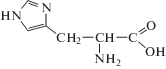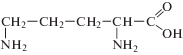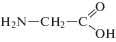Журнал неорганической химии, 2021, T. 66, № 10, стр. 1482-1490
Термодинамика смешаннолигандного комплексообразования никеля(II) с орнитином и гистидином в водном растворе
М. Г. Никитина a, Д. Ф. Пырэу a, *
a Ивановский государственный университет
153025 Иваново, ул. Ермака, 39, Россия
* E-mail: pyreu@mail.ru
Поступила в редакцию 02.03.2021
После доработки 07.06.2021
Принята к публикации 07.06.2021
Аннотация
Методами pH-метрии, калориметрии и спектрофотометрии изучено образование смешаннолигандных комплексов различного состава в системе Ni(II)–L-гистидин (His)–L-орнитин (Orn). Определены термодинамические параметры (lgK, ΔrG0, ΔrH, ΔrS) реакций их образования при 298.15 K и ионной силе I = 0.5 (KNO3). На основании сравнительного анализа термодинамических параметров предложен наиболее вероятный способ координации аминокислотных остатков в составе смешанных комплексов.
ВВЕДЕНИЕ
Тройные системы, включающие катион 3d-металла и аминокислоты с дополнительными донорными группами, такие как гистидин, лизин, орнитин, аргинин или аспарагиновая кислота, являются модельными объектами при объяснении связывания ионов металлов в ферментах. Не менее важным вопросом является характер межлигандного взаимодействия, часто способствующий росту устойчивости таких комплексов [1]. Внимание к смешанному комплексообразованию 3d-металлов с биологически активными молекулами постоянно растет. В частности, в работах [2, 3] показана биохимическая значимость образования устойчивых смешанных комплексов Cu(II) и Ni с L-гистидином и нуклеозидмонофосфатами. Смешанные комплексы в тройных системах M–His–производные имидазола служат моделями связывания катиона металла с олигогистидиновыми фрагментами, активно используемыми при модификации белковых молекул с целью их разделения посредством аффинной (immobilized metal ion-affinity chromatography, IMAC) хроматографии, а также таргетирования [4, 5]. Смешанное комплексообразование платины(IV) с аминокислотами и азотистыми основаниями, изученное в работах [6, 7], способствует лучшему пониманию противоопухолевой активности соединений платины.
Выявление состава смешанных комплексов и способов координации в них аминокислотных остатков является трудоемкой задачей, поскольку, с одной стороны, одному составу могут отвечать комплексы (изомеры) с различным типом связывания лиганда, а с другой – доля накопления той или иной ионной формы может быть недостаточной для надежного определения ее физико-химических характеристик. Более того, информативность данных того или иного метода в зависимости от объекта исследования может быть совершенно различной. В отличие от различных видов спектроскопии и специфики их использования, анализ термодинамических характеристик равновесий комплексообразования является универсальным. При этом предпочтение отдается калориметрии как наиболее надежному способу определения энтальпийной характеристики процесса. Изучение систем, включающих наряду с катионом металла два остатка аминокислот основного типа (His, Lys, Orn) или с полярными боковыми группами (Ser, Thr, Cys), сталкивается с проблемой определения типа координации аминокислотного остатка в составе цвиттер-ионной формы. Результаты только pH-потенциометрии здесь не дают нужной информации, поэтому необходимо привлечение данных других методов, чаще всего спектральных.
Поскольку ранее тройную систему Ni(II)–His–Orn изучали в основном с помощью потенциометрического метода [8] и структурный аспект в этой работе ограничивался только анализом констант равновесия, представляло интерес уточнить ионный состав растворов и выявить особенности координации лигандов в смешанных комплексах на основе сравнительного анализа термодинамических данных.
В настоящей работе исследованы лиганды гистидин, орнитин и глицин, структурные формулы которых приведены ниже:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Концентрацию рабочего раствора нитрата никеля(II) марки “ч. д. а.” устанавливали комплексонометрически. Солянокислые L-гистидин (Reanal), L-орнитин (Acros) марки “ч. д. а.” использовали без дополнительной очистки. Бескарбонатный раствор гидроксида натрия готовили по обычной методике на дистиллированной воде, свободной от CO2. Используемый для создания ионной силы нитрат калия марки “ч. д. а.” дважды перекристаллизовывали из водного раствора.
В ходе работы была проведена серия pH-потенциометрических титрований растворов (Ni(NO3)2 + HHis · HCl + HOrn · HCl + KNO3) 0.2 M раствором NaOH при 25°С и ионной силе 0.5 (KNO3) при соотношениях Ni : His : Orn = 1 : 1 : 1, 1 : 2 : 1 и 1 : 1 : 2. В ячейку для титрования помещали 20 мл титруемого раствора и добавляли титрант (3–5 мл). При этом величина pH менялась в диапазонах 4–10.5 (Ni : His : Orn = 1 : 1 : 1) и 4–11.5 (Ni : His : Orn = 1 : 2 : 1, 1 : 1 : 2). Концентрация ионов никеля во всех опытах составляла 0.01 моль/л. Для каждого соотношения было проведено три титрования. Каждая кривая насчитывала в среднем 50–60 точек (порций титранта). ЭДС цепи с переносом, включающей стеклянный и хлорсеребряный электроды, измеряли компенсационным методом. Соответствие экспериментально найденного наклона водородной функции стеклянного электрода (η) теоретическому проверяли по трем стандартным буферным растворам в области pH 2–9. Обработку экспериментальных данных рН-метрических измерений проводили по программе PHMETR [9], основанной на минимизации функции правдоподобия F = = Σ(рсНэксп – рсНрасч)2, где рсН = –lg[H+] – экспериментальные и рассчитанные по модели величины соответственно, с учетом протекания реакций:
(1)
${{{\text{H}}}_{{\text{2}}}}{\text{O}} = {{{\text{H}}}^{{\text{ + }}}}{\text{ + O}}{{{\text{H}}}^{{\text{--}}}}{\text{,}}$(2)
${\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + }}{{{\text{H}}}_{{\text{2}}}}{\text{O}} = {\text{NiO}}{{{\text{H}}}^{{\text{ + }}}}{\text{ + }}{{{\text{H}}}^{{\text{ + }}}}{\text{,}}$(3)
${{{\text{L}}}^{{\text{--}}}} + i{{{\text{H}}}^{{\text{ + }}}} = {\text{H}}{{{\text{L}}}^{{\text{0}}}}{\text{ }}\left( {{\text{L = His,Orn}}} \right){\text{,}}$(4)
${{{\text{L}}}^{{\text{--}}}} + i{{{\text{H}}}^{{\text{ + }}}} = {{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{{\text{ + }}}}{\text{ }}\left( {{\text{L = His,Orn}}} \right){\text{,}}$(5)
${{{\text{L}}}^{{\text{--}}}} + i{{{\text{H}}}^{{\text{ + }}}} = {{{\text{H}}}_{{\text{3}}}}{{{\text{L}}}^{{{\text{2 + }}}}}{\text{ }}\left( {{\text{L = His,Orn}}} \right){\text{,}}$(6)
${\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + Hi}}{{{\text{s}}}^{{\text{--}}}} = {\text{NiHi}}{{{\text{s}}}^{{\text{ + }}}}{\text{,}}$(7)
${\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + 2Hi}}{{{\text{s}}}^{{\text{--}}}} = {\text{NiHis}}_{2}^{0}$(8)
${\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + HHis}} = {\text{NiHHi}}{{{\text{s}}}^{{{\text{2 + }}}}}{\text{,}}$(9)
${\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + HHis + Hi}}{{{\text{s}}}^{{\text{--}}}} = {\text{NiHHis}}_{2}^{ + }{\text{,}}$(10)
${\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + Or}}{{{\text{n}}}^{{\text{--}}}} = {\text{NiOr}}{{{\text{n}}}^{{\text{ + }}}},$(11)
${\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + 2Or}}{{{\text{n}}}^{{\text{--}}}} = {\text{NiOrn}}_{2}^{0}{\text{,}}$(12)
${\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + HOrn}} = {\text{Ni}}{{\left( {{\text{HOrn}}} \right)}^{{{\text{2 + }}}}}{\text{,}}$(13)
${\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + 2HOrn}} = {\text{Ni}}\left( {{\text{HOrn}}} \right)_{2}^{{2 + }}{\text{,}}$(14)
${\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + 3HOrn}} = {\text{Ni}}\left( {{\text{HOrn}}} \right)_{3}^{{2 + }}$(15)
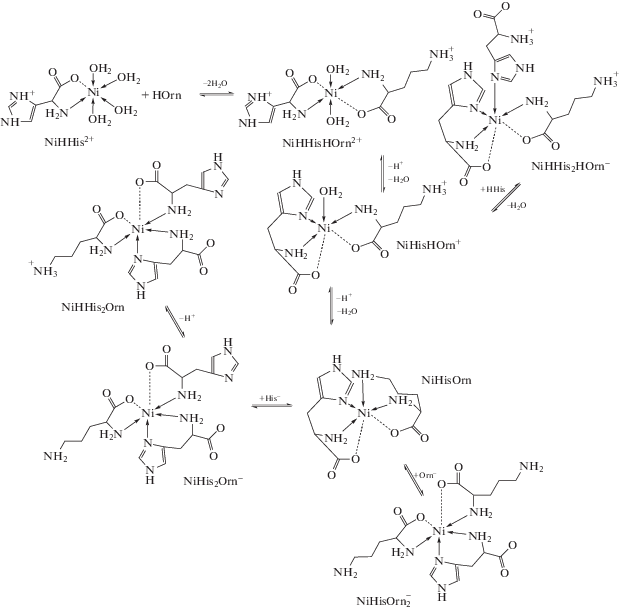
${\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + Or}}{{{\text{n}}}^{{\text{--}}}}{\text{ + Hi}}{{{\text{s}}}^{{\text{--}}}} = {\text{Ni}}\left( {{\text{Orn}}} \right)\left( {{\text{His}}} \right){\text{.}}$В случае соотношения Ni : His : Orn = 1 : 1 : 1 согласие между рассчитанной кривой и экспериментом достигалось при учете образования смешанных комплексов состава Ni(Orn)(His), Ni(HOrn)(His)+, NiH2(Orn)(His)2+, Ni(Orn)(His–1)–. Результаты титрования при соотношении Ni : : His : Orn = 1 : 1: 2 были обработаны с помощью модели комплексообразования, которая учитывала смешанный комплекс состава ${\text{Ni}}\left( {{\text{His}}} \right)({\text{Orn}})_{2}^{ - }.$ Образование протонированных комплексов состава NiHi(His)(Orn)2 (i = 1, 2) не было выявлено по данным потенциометрии. При этом учитывалось образование указанных выше смешанных комплексов, а значения констант их образования фиксировали по данным титрования при соотношении Ni : His : Orn = 1 : 1 : 1. В случае соотношения Ni : His : Orn = 1 : 2 : 1 лучшее соответствие расчетных и экспериментальных кривых титрования достигалось при учете комплексов состава Ni(His)2(Orn)–, NiH(His)2(Orn), NiH2(His)2(Orn)+ и ${\text{Ni}}{{\left( {{\text{His}}} \right)}_{{\text{2}}}}({\text{Orn}}){\text{H}}_{{--{\text{1}}}}^{{{\text{2}}--}}.$ Образование указанных трис-комплексов оказалось довольно неожиданным, поскольку комплекс NiHis2 координационно насыщенный и координация остатка орнитина возможна только за счет понижения дентатности остатков гистидина.
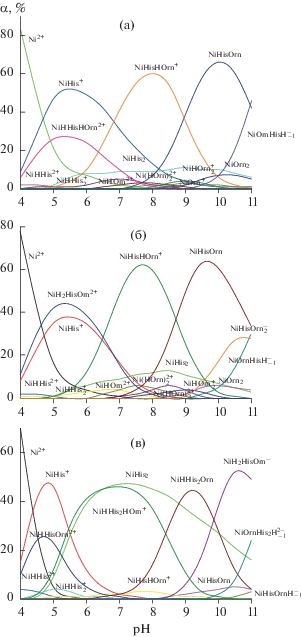
Значения lgK реакций (3)–(5) для гистидина (9.02 и 15.07 соответственно) и орнитина (10.52 и 19.35 соответственно) были взяты из критических обзоров [10] и [11]. Рекомендованные значения констант устойчивости однороднолигандных комплексов Ni с гистидином также были взяты из обзора [10], а значения констант устойчивости однороднолигандных комплексов Ni с орнитином – из работы [12]. Рассчитанные константы устойчивости смешанных комплексов приведены в табл. 1. Диаграммы долевого распределения в изучаемой системе при разных соотношениях Ni : His : Orn представлены на рис. 1.
Таблица 1.
Термодинамические параметры реакций образования смешаннолигандных комплексов в системе Ni2+–His––Orn––H+ при 298.15 K и I = 0.5 (KNO3)
| Равновесие | lgK | –ΔrG0, кДж/моль | ΔrH, кДж/моль |
ΔrS, Дж/моль K |
|---|---|---|---|---|
| Ni2+ + His– + Orn– = NiHisOrn | 14.49 ± 0.10 | 82.71 ± 0.57 | –63.37 ± 0.42 | 64.9 ± 2.4 |
| Ni2+ + Orn– + His– + H+ ↔ NiHOrnHis+ | 23.45 ± 0.08 | 133.85 ± 0.56 | –107.90 ± 0.59 | 87.04 ± 2.7 |
| Ni2+ + Orn– + His– + 2H+ = NiHHisHOrn2+ | 29.82 ± 0.13 | 170.21 ± 0.74 | –142.49 ±1.44 | 92.97 ± 5.4 |
| Ni2+ + His– + 2Orn– = NiHisOrn$_{2}^{ - }$ | 16.77 ± 0.12 | 95.72± 0.68 | –67.26 ± 1.81 | 95.46 ± 6.5 |
| Ni2+ + 2His– + Orn– = NiHis2Orn– | 18.86 ± 0.05 | 107.65 ± 0.29 | –72.78 ± 1.03 | 116.9 ± 3.9 |
| Ni2+ + 2His– + Orn– + H+↔ NiHHis2Orn | 28.73 ± 0.05 | 163.99 ± 0.29 | –126.61 ± 1.12 | 125.4 ± 3.9 |
| Ni2+ + 2His– + Orn– + 2H+↔ NiHHis2HOrn+ | 37.14 ± 0.06 | 211.99 ± 0.34 | –165.30 ± 1.57 | 156.6 ± 5.4 |
| NiHis+ + Orn– = NiHisOrn | 5.91 ± 0.10 | 33.73 ± 0.57 | –29.97 ± 0.42 | 12.6 ± 2.4 |
| NiHis+ + HOrn = NiHisHOrn+ | 4.35 ± 0.08* | 24.83 ± 0.46 | –22.58 ± 0.59* | 7.5 ± 2.6 |
| 6.04 ± 0.08** | 34.48 ± 0.46 | –27.42 ± 0.59** | 23.7 ± 2.6 | |
| Ni2+ + HOrn + HHis = NiHHisHOrn2+ | 10.10 ± 0.13* | 57.65 ± 0.74 | –45.42 ± 1.44* | 41.0 ± 5.4 |
| 13.03 ± 0.13** | 74.37 ± 0.74 | –60.07 ± 1.44** | 47.9 ± 5.4 | |
| NiHisOrn + Orn– = NiOrn2His– | 2.28 ± 0.15 | 13.01 ± 0.86 | –3.89 ± 1.86 | 30.6 ± 6.9 |
| NiHisOrn + His– = NiHis2Orn– | 4.37 ± 0.12 | 24.94 ± 0.68 | –9.41 ± 1.12 | 52.1 ± 4.4 |
| NiHis2 + Orn– = NiHis2Orn– | 3.38 ± 0.10 | 19.29 ± 0.68 | –2.68 ± 1.03 | 55.7 ± 4.1 |
| NiHis2 + HOrn = NiHHis2Orn | 2.73 ± 0.05* | 15.58 ± 0.28 | –4.51 ± 1.12* | 37.1 ± 3.9 |
| 4.42 ± 0.05** | 25.23 ± 0.28 | –9.43 ± 1.12** | 53.1 ± 3.9 | |
| NiHis+ + HHis + HOrn = NiHOrnHHis$_{2}^{ + }$ | 8.84 ± 0.06* | 50.46 ± 0.34 | –34.83 ± 1.12* | 52.4 ± 3.9 |
| 11.77 ± 0.06** | 67.18 ± 0.34 | –49.48 ± 1.12** | 68.5 ± 3.9 | |
| 10.53 ± 0.06*** | 60.10 ± 0.34 | –39.67 ± 1.12*** | 68.5 ± 3.9 | |
| Ni2+ + His– + HHis + HOrn = NiHOrnHHis$_{2}^{ + }$ | 20.35 ± 0.06** | 116.16 ± 0.34 | –82.88 ± 1.12** | 111.6 ± 3.9 |
| NiHisOrn + HHis = NiHHis2Orn | 5.0* | 28.8 | –18.1* | 35.8 |
| 8.0** | 45.5 | –32.7** | 42.8 |
Рис. 1.
Диаграмма долевого распределения частиц в системе Ni2+–His––Orn––H+ при соотношениях Ni : : His : Orn = 1 : 1 : 1 (а), 1 : 1 : 2 (б), 1 : 2 : 1 (в). СNi = = 0.01 моль/л.
Тепловые эффекты определяли на ампульном калориметре смешения с изотермической оболочкой и термисторным датчиком температуры. Надежность работы калориметра проверяли по теплоте растворения KCl в воде при 298.15 K. Были измерены тепловые эффекты смешения ΔmixH раствора нитрата Ni(II) с щелочными растворами аминокислот, содержащими фоновый электролит (KNO3). Концентрация никеля(II) после смешения составляла 0.005 моль/л. Компьютерное моделирование равновесий по программе RRSU [9] позволяло подобрать оптимальные условия проведения термохимического эксперимента. Обработку данных калориметрических измерений проводили по программе HEAT [9] с учетом вкладов процессов ионизации воды (ΔrH(1) = –56.90 кДж/моль [13]), протонирования аминокислот (ΔrH(3) = = –45.15 кДж/моль, ΔrH(4) = –75.65 кДж/моль [14] для гистидина и ΔrH(3) = –51.92 кДж/моль, ΔrH(4) = = –99.00 кДж/моль [15] для орнитина), образования однороднолигандных комплексов Ni с гистидином (ΔrH(6) = –33.4 кДж/моль и ΔrH(7) = = –70.1 кДж/моль [16]) и смешанных комплексов указанных выше составов в суммарный тепловой эффект. Вклад комплексов Ni с орнитином в суммарный тепловой эффект в данных условиях оказался совсем небольшим.
Была приготовлена серия растворов, содержащих ионы никеля и аминокислоты, с различной величиной pH и сняты их электронные спектры поглощения (рис. 2, 3). Измерение оптической плотности проводили на спектрофотометре КФК-3 в кюветах длиной 5 см. Раствором сравнения служил 0.5 М раствор KNO3.
Рис. 2.
Электронные спектры поглощения растворов в системе Ni–His–Orn при соотношениях: 1 : 1 : 1 и pH 5.72 (1), 8.35 (2), 9.27 (3), 10.42 (4), 11.71 (5) (а); 1 : 1 : 2 и pH 7.56 (1), 8.99 (2), 9.93 (3), 10.80 (4), 11.02 (5) (б); 1 : 2 : 1 и pH 10.61 (1), 9.53 (2), 7.25 (3) (в); CNi = = 0.01 моль/л; l = 5 см, 200°С, I = 0.5 (KNO3).
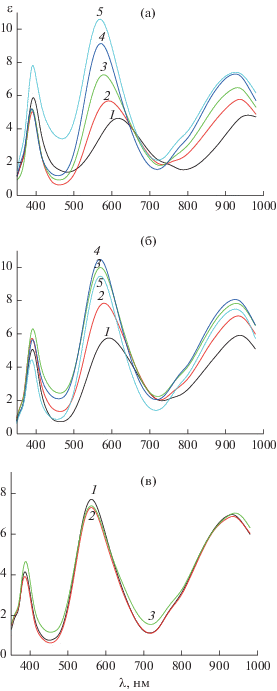
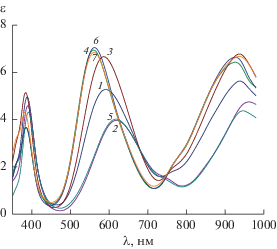
Рис. 3.
Электронные спектры поглощения растворов в системе Ni–Gly–His при соотношениях 1 : 0 : 1 и pH 7.21 (5); 1 : 0 : 2 и pH 7.90 (4); 1 : 1 : 1 и pH 9.11 (1) и 6.01(2); 1 : 2 : 1 и pH 10.27 (3); д) 1 : 2 : 2 и pH 9.80 (6) и 7.44 (7); CNi = 0.005 моль/л; l = 5 см, 200°С , I = 0.5 (KNO3) по данным [19].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В недавних работах [17, 18] подробно рассмотрены возможные способы координации остатков гистидина, лизина и орнитина в составе смешаннолигандных нитрилотриацетатов и иминодиацетатов Cu(II) и Ni и проведен сравнительный анализ термодинамических параметров реакций их образования. Отмечено сходное усиление интенсивности полосы поглощения при 600 нм в спектрах растворов, содержащих Ni(Ida)(His)–, Ni(Ida)(En) и Ni(Ida)(Orn)–, что указывает на участие двух аминогрупп в координации остатка орнитина и тем самым на тридентатный (N, N, O) тип координации орнитина в составе Ni(Ida)(Orn)–. По-видимому, равновесие между формами указанного смешанного комплекса с би- и тридентатным типом координации орнитина смещено в сторону последнего, т.е. средняя дентатность орнитина в этом случае >2. В комплексах Ni(Ida)(Lys)– и Ni(Ida)(HLys) остаток лизина, по всей видимости, координирован по глицинатному типу, что связано с меньшей устойчивостью большего по размерам хелатного цикла. Из этого следует, что при переходе от Ni(Ida)(Lys)– к Ni(Ida)(HLys) протонированию подвергается не участвующая в координации ε-аминогруппа. Это подтвердили термохимические данные: присоединение анионной формы орнитина к иминодиацетату Ni оказывается существенно более экзотермичным по сравнению с цвиттер-ионной формой, в то время как для лизина эти величины практически равны.
В литературе имеются данные лишь одной работы [8], в которой методами рН-метрии и спектрофотометрии были изучены тройные системы Ni(II)–гистидин, гистамин–диаминокарбоновая кислота. К сожалению, в данных работах отсутствует критический выбор адекватной эксперименту модели комплексообразования, а указание на наиболее вероятный способ координации аминокислотных остатков основан лишь на анализе величин констант устойчивости комплексов. Тем не менее значения констант устойчивости комплексов состава NiHi(His)(Orn), где i = 0, 1, 2 (заряд опущен), полученные в настоящей работе и в работе [8], достаточно хорошо согласуются с учетом разницы в условиях эксперимента. Представляло интерес не только уточнить ионный состав растворов в системе Ni–His–Orn в широком интервале концентрационных соотношений и pH, но и использовать термодинамический подход к оценке строения образующихся смешанных комплексов.
Рассчитанные термодинамические параметры изученных реакций приведены в табл. 1, из которой видно, что суммарные процессы присоединения аминокислотных остатков к катиону никеля сопровождаются большими отрицательными изменениями энтальпии и положительными изменениями энтропии. Это обусловлено прежде всего вытеснением значительного числа или даже всех молекул воды из внутренней координационной сферы. Экзотермичность этих реакций указывает на то, что образование связей между катионом никеля и донорными атомами азота является энтальпийно выгодным процессом: затраты тепла, связанные с дегидратацией центрального иона и лигандов, в значительной мере компенсируются теплотой образования связей N → Ni. Поскольку суммарные процессы (табл. 1) оказываются малоинформативными при оценке возможного типа координации лигандов, были рассчитаны термодинамические параметры присоединения анионной или цвиттер-ионной формы орнитина к моно- и бис-комплексам Ni(II) с гистидином. В этих процессах величина и знак изменения как энтальпии, так и энтропии в большей мере служат указанием на возможный тип координации лиганда. В качестве модельных процессов нами рассматривались процессы смешаннолигандного комплексообразования Ni(II) с гистидином и глицином [19], поскольку анионная и особенно цвиттер-ионная формы орнитина часто координируются по глицинатному типу.
Прежде всего реакции присоединения анионной и цвиттер-ионной форм орнитина к NiHis+ имеют сильно различающиеся значения констант равновесия и тепловых эффектов. При этом параметры присоединения HOrn± к NiHis+ близки к параметрам как аналогичной реакции с участием глицина, так и второй ступени образования глицинатных комплексов Ni(II). На основании этого можно с уверенностью говорить о преобладании тридентатного (N, N, O) типа координации орнитина в составе комплекса Ni(His)(Orn). Оправданным является предположение о том, что равновесие между формами смешанного комплекса с би- и тридентатным типом координации орнитина смещено в сторону последнего. На это указывают также изменения, происходящие в спектрах растворов (рис. 2) при pH > 8. Дальнейшее усиление интенсивности и коротковолновый сдвиг полосы поглощения при 600 нм вызваны вовлечением в координацию ε-аминогруппы орнитина. Ее протонирование приводит к образованию комплекса Ni(His)(HOrn)+, в котором цвиттер-ионная форма орнитина координирована по глицинатному N,O-типу. Термодинамические параметры присоединения HOrn± к NiHis+, рассчитанные с учетом протонирования α-аминогруппы и предполагающие, таким образом, координацию цвиттер-ионной формы орнитина посредством ε-аминогруппы и ее монодентатный характер, оказываются явно завышенными.
В комплексе состава Ni(HHis)(HOrn)2+ протонированными оказываются оба аминокислотных остатка. Термодинамические параметры присоединения цвиттер-ионных форм орнитина и гистидина к катиону никеля рассчитаны нами с учетом протонирования остатка гистидина как по α-аминогруппе, так и по имидазольному кольцу. Использование в расчетах pK2 (протонирование остатка гистидина по имидазольному фрагменту) дает явно завышенные значения lgK и экзоэффекта рассматриваемой реакции, хотя это предполагает участие в координации именно глицинатного фрагмента. В то же время учет протонирования остатка гистидина по α-аминогруппе (pK1) и тем самым координации HHis± посредством гетероатома азота пиридинового типа дает значения lgK и ΔrH, близкие к таковым для процесса образования комплекса NiGly2. Это предполагает глицинатный тип координации цвиттер-ионных форм орнитина и гистидина в комплексе состава Ni(HHis)(HOrn)2+ (рис. 4). Очевидно, поведение глицинатного и имидазольного фрагментов гистидина при их протонировании и последующей координации нельзя полностью рассматривать как независимое. На глицинатный тип координации цвиттер-ионных форм орнитина и гистидина в комплексе Ni(HHis)(HOrn)2+ указывают спектральные данные (рис. 3). Спектры растворов, в которых доминируют комплексные частицы Ni(HHis)(HOrn)2+ и Ni(HHis)(Gly)+, имеют близкие параметры.
Термодинамические параметры образования смешанных комплексов, включающих три аминокислотных остатка, свидетельствуют о конкуренции между донорными атомами лигандов в условиях образования координационно-насыщенных комплексов. Так, реакции присоединения анионных форм His– или Orn– к комплексу Ni(His)(Orn) характеризуются совершенно другими значениями констант равновесия и тепловых эффектов. В этом случае присоединение остатка гистидина или орнитина возможно только за счет понижения дентатности уже координированных остатков аминокислот. Эти процессы, как и присоединение Orn– к NiHis2, характеризуются слабым экзоэффектом. Очевидно, присоединение третьего аминокислотного остатка приводит к перестройке комплекса, не сопровождаемой увеличением числа координированных атомов азота аминного типа. Среди рассматриваемых реакций присоединение His– к комплексу Ni(His)(Orn) характеризуется существенно большими экзоэффектом и константой равновесия. Это может быть следствием того, что устранение от координации ε-аминогруппы орнитина и координация третьего остатка гистидина посредством глицинатного фрагмента оказываются термодинамически более выгодными. Термодинамические параметры присоединения цвиттер-ионной формы орнитина к NiHis2 с образованием NiH(His)2(Orn), рассчитанные при учете протонирования остатка орнитина по ε-аминогруппе, очень близки к таковым для процесса образования комплекса Ni(Orn)2(His)–. Это косвенно подтверждает координацию остатка орнитина по глицинатному типу. Учет протонирования остатка орнитина по α-аминогруппе, предполагающий монодентатный характер HOrn±, приводит к более высоким значениям константы равновесия и экзоэффекта, что кажется маловероятным. Однако такой способ координации вполне возможен, и исключать его полностью из рассмотрения только по данным термодинамики нельзя. Вероятность того, что в структуре NiH(His)2(Orn) протонированным оказывается один из остатков гистидина, существенно меньше: основные свойства ε-аминогруппы орнитина значительно выше, чем у имидазольного фрагмента остатка гистидина, координированного по глицинатному типу (рис. 4).
Наибольшие трудности возникают при оценке вероятного строения смешанного комплекса состава ${\text{Ni}}({\text{HOrn}}){\text{H}}({\text{His}})_{2}^{ + }.$ Термодинамические характеристики присоединения HHis± и HOrn± к комплексу NiHis+ рассчитаны нами исходя из трех возможных способов протонирования остатков гистидина и орнитина одновременно: 1) по α-аминогруппе гистидина и ε-аминогруппе орнитина, 2) по имидазольному кольцу гистидина и ε-аминогруппе орнитина и 3) α-аминогруппам гистидина и орнитина. Это позволило указать на наиболее вероятный тип координации цвиттер-ионных форм аминокислот. Наиболее правдоподобные значения lgK и ΔrH для реакции вида
(17)
$\begin{gathered} {\text{N}}{{{\text{i}}}^{{{\text{2 + }}}}}{\text{ + Hi}}{{{\text{s}}}^{{\text{--}}}}{\text{ + HHis + HOrn = }} \\ {\text{ = }}\,\,{\text{Ni}}\left( {{\text{HOrn}}} \right){\text{H}}\left( {{\text{His}}} \right)_{2}^{ + }{\text{.}} \\ \end{gathered} $Таблица 2.
Термодинамические параметры реакций образования смешаннолигандных комплексов в системе Ni2+–His––Gly––H+ при 298.15 K и I = 0.5 (KNO3) по данным [13]
| Равновесие | lgK | –ΔrG0, кДж/моль | ΔrH, кДж/моль |
ΔrS, Дж/моль K |
|---|---|---|---|---|
| NiHis+ + Gly – = NiHisGly | 5.47 ± 0.12 | 31.22 ± 0.68 | –15.28 ± 0.42 | 53.5 ± 2.7 |
| NiHis+ + 2Gly – ↔ NiGly2His– | 8.21 ± 0.12 | 46.86 ± 0.68 | –38.86 ± 0.85 | 26.8 ± 3.7 |
| NiHis2 + Gly – = NiHis2Gly– | 2.84 ± 0.03 | 16.21 ± 0.17 | 0.72 ± 1.14 | 56.8 ± 3.9 |
| NiHis+ + Gly – + HHis ↔ NiGlyHHis2 | 9.74 ± 0.03* | 55.59 ± 0.17 | –33.54 ± 0.68* | 74.0 ± 2.4 |
| 12.67 ± 0.03** | 72.32 ± 0.17 | –48.19 ± 0.68** | 80.9 ± 2.4 | |
| NiGlyHis + HHis ↔ NiGlyHHis2 | 4.3* | 24.4 | –18.3* | 20.6 |
| 7.2** | 41.1 | –32.9** | 27.5 |
Однако значения lgK и ΔrH для реакции (17) значительно выше аналогичных величин для реакции образования ${\text{NiGly}}_{3}^{ - }$ (13.90 и –61.8 кДж/моль соответственно). Это не позволяет всерьез рассматривать указанную модель строения комплекса, тем более как доминирующую.
Как уже отмечалось выше, из спектральных данных, представленных на рис. 2, хорошо заметны рост и коротковолновое смещение полосы при 600 нм, обусловленные увеличением числа координированных атомов азота. Особенно хорошо это прослеживается в спектрах растворов при соотношении Ni : His : Orn = 1 : 1 : 1 и депротонировании комплекса Ni(HHis)(HOrn)2+ с образованием комплекса Ni(His)(Orn). При этом в координацию оказываются вовлеченными все донорные атомы азота двух аминокислотных остатков. В спектрах растворов при соотношении Ni : His : : Orn = 1 : 2 : 1 в диапазоне pH от 7.3 до 10.6 (рис. 2) изменения оказываются минимальными. Аналогичная картина отмечается и в спектрах растворов с соотношением Ni : His : Gly = 1 : 2 : 1 (рис. 3). Это согласуется с данными термодинамики, свидетельствующими о насыщении координационной сферы никеля и координации третьего аминокислотного остатка, приводящей не к увеличению числа координированных атомов азота, а лишь к перераспределению дентатности лигандов.
Список литературы
Yamauchi O., Odani A. // J. Chem. Soc., Dalton Trans. 2002. P. 3411. https://doi.org/10.1039/B202385G
Jeżowska-Bojczuk M., Kaczmarek P., Bal W. et al. // J. Inorg. Biochem. 2004. V. 98. P. 1770. https://doi.org/10.1016/j.jinorgbio.2004.08.002
Bregier-Jarzebowska R., Gasowska A., Lomozik L. // J. Coord. Chem. 2014. V. 67. P. 45. https://doi.org/10.1080/00958972.2013.878457
Valenti L.E., De Pauli C.P., Giacomelli C.E. // J. Inorg. Biochem. 2006. V. 100. P. 192. https://doi.org/10.1016/j.jinorgbio.2005.11.003
Mehlenbacher M.R., Bou-Abdallah F., Liu X.X., Melman A. // Inorg. Chim. Acta. 2015. V. 437. P. 152. https://doi.org/10.1016/j.ica.2015.08.009
Molodkin A.K., Esina N.Ya., Andreeva O.I. // Russ. J. Inorg. Chem. 2008. V. 53. P. 1741. https://doi.org/10.1134/S0036023608110120
Molodkin A.K., Esina N.Ya., Andreeva O.I. et al. // Russ. J. Inorg. Chem. 2008. V. 53. P. 1203. https://doi.org/10.1134/S0036023608080093
Nair M.S., Arasu P.T., Sutha S.G. et al. // J. Indian Chem. Soc. 1998. V. 37A. P. 1084. http://nopr.niscair.res.in/handle/123456789/40379
Бородин В.А., Васильев В.П., Козловский Е.В. Математические задачи химической термодинамики. Новосибирск: Наука, 1985. 219 с.
Pettit L.D. // Pure Appl. Chem. 1984. V. 56. P. 247. https://doi.org/10.1351/pac198456020247
Yamauchi O., Odani A. // Pure Appl. Chem. 1996. V. 68. P. 469. https://doi.org/10.1351/pac199668020469
Farkas E., Gergely A., Kas E. // J. Inorg. Nucl. Chem. 1981. V. 43. P. 1591. https://doi.org/10.1016/0022-1902(81)80343-0
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высш. школа, 1982. 201 с.
Гаравин В.А. Дис. … канд. хим. наук. Иваново, 1983. 124 с.
Gergely A., Farkas E., Nagypál I. et al. // J. Inorg. Nucl. Chem. 1978. V. 40. P. 1709. https://doi.org/10.1016/0022-1902(78)80366-2
Amico P., Arena G., Daniele P. et al. // Inorg. Chem. 1981. V. 20. P. 772. https://doi.org/10.1021/ic50217a027
Kiseleva I., Pyreu D., Krivonogikh T. et al. // Polyhedron. 2013. V. 51. P. 10. https://doi.org/10.1016/j.poly.2012.12.010
Pyreu D.F., Bazanova M.A., Gridchin S.N. et al. // Russ. J. Inorg. Chem. 2016. V. 61. P. 909. https://doi.org/10.1134/S0036023616070159
Pyreu D., Gridchin S. // J. Solution Chem. 2020. V. 49. P. 239. https://doi.org/10.1007/s10953-020-00957-5
Дополнительные материалы
- скачать ESM_1.doc
- Дополнительный файл с расчетами N1.
- скачать ESM_2.doc
- Дополнительный файл с расчетами N2.
- скачать ESM_3.doc
- Дополнительный файл с расчетами N3.
Инструменты
Журнал неорганической химии