Журнал неорганической химии, 2021, T. 66, № 10, стр. 1474-1481
Образование комплексов La3+, Ce3+, Eu3+, Gd3+ с гидразонами пиридоксаль-5-фосфата в нейтральном буфере Трис-HCl
Г. А. Гамов a, *, М. Н. Завалишин a
a Ивановский государственный химико-технологический университет
153000 Иваново, пр-т Шереметевский, 7, Россия
* E-mail: ggamov@isuct.ru
Поступила в редакцию 10.03.2021
После доработки 08.06.2021
Принята к публикации 09.06.2021
Аннотация
Синтезированы гидразоны пиридоксаль-5-фосфата и гидразидов 4-гидроксибензойной, 3-гидроксинафталин-2-карбоновой кислот и L-тирозина. Исследовано комплексообразование ионов La3+, Ce3+, Eu3+, Gd3+ с этими гидразонами в нейтральном водном растворе (0.05 М буфер ТРИС-HCl, рН 7.2). Определен наиболее вероятный стехиометрический состав комплексов и условные константы их устойчивости при фиксированном значении рН. Рассмотрена возможность использования гидразонов пиридоксаль-5-фосфата для создания флуоресцентных сенсоров для биологических исследований или контрастных веществ для МРТ.
ВВЕДЕНИЕ
Ионы лантанидов(III) благодаря своему электронному строению и люминесцентным свойствам находят широкое применение при создании биологических флуоресцентных проб и контрастных агентов для магнитно-резонансной томографии. Выбор иона позволяет регулировать область испускания флуоресцентной пробы: так, соединения Eu3+ дают красный свет, Tb3+ – зеленый, Sm3+ – оранжевый [1], Ce3+ – от фиолетово-синего до голубовато-зеленого [2, 3], в то время как соединения Yb, Nd, Er эмитируют в ближней ИК-области [1]. Для МРТ-диагностики оптимальным является использование соединений Gd3+ из-за наибольшего числа неспаренных электронов (конфигурация f7) [4]. Для синтеза комплексов лантанидов(III) обычно используются полидентатные хелатирующие либо макроциклические N,O-донорные лиганды [5, 6]. При этом необходимо учитывать, что молекулы воды, остающиеся в координационной сфере металла, ухудшают люминесцентные свойства комплекса, но необходимы для использования его в качестве контрастного агента в МРТ [5]. Образующиеся комплексы должны иметь высокую устойчивость во избежание токсического действия катионов лантанидов [7].
Представляет интерес исследовать устойчивость комплексов некоторых лантанидов, а именно La3+, Ce3+, Eu3+ и Gd3+, с таким классом хелатирующих N,O-донорных лигандов, как гидразоны, производные пиридоксаль-5-фосфата, в нейтральном водном растворе. Ранее было показано, что такие гидразоны способны связывать ионы d-металлов в прочные координационные соединения [8–11] даже в фосфатном буфере, причем они могут конкурировать за ион металла даже с некоторыми белками-металлошаперонами [8]. Однако хелатирование ионов f-металлов может оказаться не таким эффективным, и тогда гидразоны пиридоксаль-5-фосфата не следует использовать для создания новых флуоресцентных проб либо контрастирующих агентов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
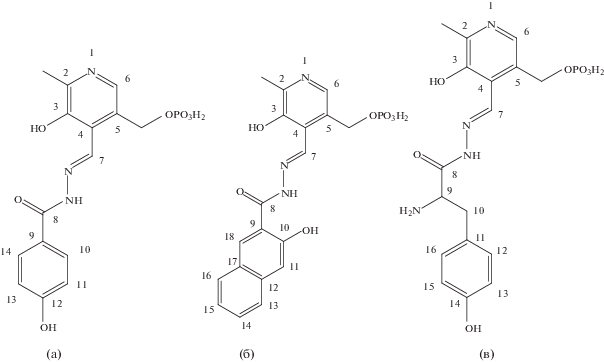
Гидразоны, образованные пиридоксаль-5-фосфатом (PLP) и гидразидами 4-гидроксибензойной (4HBH), 3-гидроксинафталин-2-карбоновой (3HNH) кислот и L-тирозина (TYR) (рис. 1), синтезировали аналогично [11] из реагентов, приобретенных в Sigma.
Рис. 1.
Структурные формулы гидразонов PLP-4HBH (а), PLP-3HNH (б), PLP-TYR (в) с нумерацией атомов, использованной для отнесения сигналов в спектрах ЯМР.
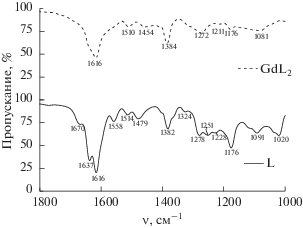
Водный раствор 1 ммоль пиридоксаль-5-фосфата объемом 25 мл, нагретый до 90°С, приливали к 25 мл водно-этанольного (1 : 1 об. %) раствора гидразида соответствующей кислоты, нагретого также до 90°С. Наблюдали моментальное образование кристаллического продукта, который отстаивали при комнатной температуре в течение 1 ч, фильтровали, промывали ледяной водой и ацетоном и высушивали на воздухе до постоянной массы. Выход продуктов составил 80–85%, их структура подтверждена методами 1Н, 13С ЯМР- и ИК-спектроскопии. Отнесение сигналов в спектре ЯМР выполнено на основании двумерных 1Н, 13С HSQC-экспериментов. Использовали следующие обозначения мультиплетности: s – синглет, d – дублет, t – триплет, ddd – дублет дублетов дублетов. В ИК-спектрах применяли следующие обозначения: ос – очень сильная, с – сильная, ср – средняя, сл – слабая.
Пиридоксаль-5-фосфат 4-гидроксибензокарбогидразон (PLP-4HBH). Бледно-желтые кристаллы. 1H ЯМР (D2O, pD ~ 13), δ, млн. д.: 8.32s (1H, H7), 7.44s (1H, H6), 7.28d (3J = 8.7 Гц, 2H, H10,14), 6.30d (3J = 8.7 Гц, 2H, H11,13), 4.60d (3J = 4.0 Гц, 2H, H5'), 2.05s (3H, H2'). 13C ЯМР (D2O, pD ~ 13), δ, млн. д.: 170.7 (C8), 166.2 (C3), 154.6 (C2), 149.0 (C12), 145.0 (C7), 134.7 (C6), 130.4 (C5), 129.9 (C10,14), 122.3 (C9), 118.3 (C11,13), 116.0 (C4), 61.7 (C5'), 17.8 (C2'). ИК-спектр, см–1: 3552 ос, 3477 ос, 3415 ос, 3236 ср ν(NH, OH), 2961 сл νas(CH), 1637 с амид-I, 1616 с, 1558 сл, 1479 сл, 1382 ср, 1278 ср, 1176 с, 1091 ср, 1020 ср. M [гидразон + H] 381.92 (расч. 382.07).
Пиридоксаль-5-фосфат 3-гидроксинафтоил-2-гидразон (PLP-3HNH). Ярко-желтые кристаллы. 1H ЯМР (D2O, pD ~ 13), δ, млн д.: 8.05s (1H, H7), 7.93s (1H, H6), 7.27d (3J = 7.9 Гц, 1H, H16), 7.17s (1H, H18), 7.05d (3J = 7.9 Гц, 1H, H13), 6.89t (3J = 7.3 Гц, 1H, H15), 6.71t (3J = 7.3 Гц, 1H, H14), 6.62s (1H, H11), 4.59d (3J = 5.0 Гц, 2H, H5'), 1.93s (3H, H2'). 13C ЯМР (D2O, pD ~ 13), δ, млн. д.: 162.8 (C8), 157.8 (C10), 149.12 (C3), 147.6 (C7), 137.3 (C2), 137.2 (C18), 132.0 (C12), 130.5 (C13), 130.7 (C17), 128.4 (C16), 127.5 (C15), 120.6 (C14), 112.3 (C11), 121.3 (C9), 124.2 (C4), 124.4 (C5), 130.4 (C6). ИК, см–1: 3550 ос, 3477 ос, 3411 ос ν(NH, OH), 2924 сл νas(CH), 1637 с амид-I, 1616 ос, 1530 сл, 1458 сл, 1383 ср, 1189 сл, 1093 сл, 1052 сл. M [гидразон-H] 430.03 (расч. 430.09).
Пиридоксаль-5-фосфат L-тирозиноилгидразон (PLP-TYR). Бледно-желтые кристаллы. 1H NMR (D2O, pD ~ 13), δ, млн д.: 8.30s (1H, H7), 7.50s (1H, H6), 6.90d (3J = 8.5 Гц, 2H, H12,16), 6.53d (3J = 8.5 Гц, 2H, H13,15), 4.09t (3J = 7.1 Гц, 1H, H9), 2.75ddd (3J = = 21.8, 4J = 13.9, 7.1 Гц, 2H, H10), 2.17s (3H, H2'). 13C NMR (D2O, pD ~ 13), δ, млн. д.: 172.9 (C8), 163.4 (C14), 160.5 (C3), 159.9 (C2), 149.1 (C7), 151.3, 130.9 (C6), 130.5 (C12,16), 131.4 (C11), 131.3 (C4), 117.2 (C13, 15), 125.2 (C5), 62.3 (C5'), 56.7 (C9), 37.2 (C10), 18.7 (C2'). ИК, см–1: 3550 ос, 3474 ос, 3412 ос ν(NH, OH), 2929 сл νas(CH), 1638 с амид-I, 1515 ср, 1382 ср, 1263 ср, 1069 сл. M [гидразон + H] 424.85 (расч. 425.11).
Кроме того, синтезирован комплекс Gd3+ с гидразоном PLP-4HBH. К этанольно-диметилсульфоксидному раствору (1 : 1 об.) гидразона PLP-4HBH (0.3 ммоль, 0.1144 г) объемом 25 мл добавляли 5 мл раствора GdCl3 · 6H2O в ДМСО (0.15 ммоль, 0.0558 г) при комнатной температуре. Полученный раствор перемешивали в течение 3 ч, затем реакционную массу выливали в стакан с холодной дистиллированной водой. Выпавший желто-оранжевый осадок отфильтровывали, промывали дистиллированной водой, этанолом, ацетоном и высушивали до постоянной массы при 50°C. Продукт исследовали методом ИК-спектроскопии, см–1: 3415 ос, 3236 ср ν(OH), 2919 с νas(CH), 2851 с νs(CH), 1616 с, 1510 сл, 1454 сл, 1384 ср, 1272 ср, 1177 сл, 1081 сл.
По сравнению со свободным лигандом заметно уменьшение числа полос поглощения, особенно в области валентных колебаний OH и NH и первой амидной полосы, а также смещение пиков, связанных с колебаниями связей C=C и C=N ароматических колец и мостикового фрагмента молекулы гидразона. Кроме того, уменьшается количество пиков, соответствующих валентным колебаниям связей P=O и P–O–C (P–O–H) при 1250–1280 и 1000–1100 см–1 соответственно. В электронном спектре поглощения комплекса, растворенного в буфере 0.05 M ТРИС-HCl (pH 7.2), появляется новая полоса при 395 нм. Основное светопоглощение свободного лиганда приходится на область 300–310 нм, в которой происходят переходы в единой π–π–p–π-электронной системе. В масс-спектре не обнаруживается пиков, соответствующих комплексу стехиометрии 1 : 1 либо 1 : 2, но присутствует набор пиков 719–725 ед., интенсивность которых пропорциональна природному содержанию стабильных изотопов гадолиния (154Gd, 155Gd, 156Gd, 157Gd, 158Gd и 160Gd). Вероятно, это набор линий соответствует продукту частичного разрушения комплекса Gd(PLP-4HBH)2.
Соединения LaCl3 · 7H2O, Ce(NO3)3 · 6H2O, Eu(NO3)3 · 6H2O и GdCl3 · 6H2O марки “х. ч.” (Редкийметалл.рф, Россия) использовали без предварительной очистки. Массовая доля кристаллогидрата лантанида варьировалась в пределах 99.0–99.4 мас. %. Буферные растворы с pH 7.2 были приготовлены на основе трис(гидроксиметил)аминометана (ТРИС, Sigma-Aldrich, США). Буфер доводили до нужного значения кислотности среды, контролируемого потенциометрически, стандартизованной 1 М HCl.
Все растворы были приготовлены на бидистиллированной воде (κ = 1.7 мкСм/см, pH 6.6).
Отметим, что реакция между альдегидом и гидразидом обратима, хотя и смещена в сторону образования гидразона, а пиридоксаль-5-фосфат образует устойчивые основания Шиффа и с буферным агентом (ТРИС) [12]. Спустя сутки в спектрах буферных растворов гидразонов наблюдались изменения, свидетельствующие об их распаде и образовании продуктов с ТРИС. По этой причине использовали только свежеприготовленные растворы.
Электронные спектры поглощения растворов гидразонов PLP-4HBH, PLP-3HNH и PLP-TYR, а также смесей гидразонов и катионов металлов (Chydr = (4.0 ± 0.7) × 10–5 моль/л, ${{C}_{{{\text{L}}{{{\text{n}}}^{{3 + }}}}}}$ = (1–27) × × 10–6 моль/л) в буферных растворах ТРИС-HCl (pH 7.2) были зарегистрированы на спектрофотометре Shimadzu UV 1800 в диапазоне длин волн 210–500 нм и оптических плотностей 0–1. Использовали кварцевые кюветы с толщиной поглощающего слоя 1 см. Погрешность определения длины волны не превышала 0.5 нм, точность измерения оптической плотности была равна ±0.003 ед. Температуру поддерживали на уровне 298.2 ± 0.1 K при помощи внешнего термостатирования.
Наиболее вероятный стехиометрический состав комплексов лантанидов(III) с гидразонами и условные константы устойчивости были рассчитаны по данным спектрофотометрического титрования при помощи программного обеспечения KEV [13].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При титровании растворов гидразонов PLP-4HBH, PLP-3HNH и PLP-TYR растворами солей лантанидов(III) в среде ТРИС-HCl в электронных спектрах поглощения наблюдаются типичные изменения. Интенсивность коротковолновой полосы поглощения, обусловленной переходом в электронной π–π–p–π-системе, объединяющей молекулу гидразона, ослабевает, а в длинноволновой части спектра появляется новая полоса (рис. 2). Поскольку перенос заряда как от металла к лиганду, так и от лиганда к металлу в случае f-элементов является высокоэнергетическим [14], едва ли возникающий длинноволновый максимум поглощения обусловлен им. Более вероятно, что наблюдаемые спектральные изменения связаны с принятием определенной конформации, в которой гидразоны способны к хелатированию, а также с появлением вблизи молекул лиганда иона с высоким зарядом.
Рис. 2.
Примеры спектрофотометрического титрования растворов: а – PLP-4HBH (3.39 × 10–5 моль/л)–La3+ ((0–2.63) × × 10–5 моль/л); б – PLP-3HNH (4.02 × 10–5 моль/л)–Ce3+ ((0–1.09) × 10–5 моль/л); в – PLP-TYR (3.77 × 10–5 моль/л)–Eu3+ ((0–9.95) × 10–6 моль/л); г – PLP-4HBH (3.93 × 10–5 моль/л)–Gd3+ ((0–1.02) × 10–5 моль/л) в 0.05 М буфере ТРИС-HCl (pH 7.2).
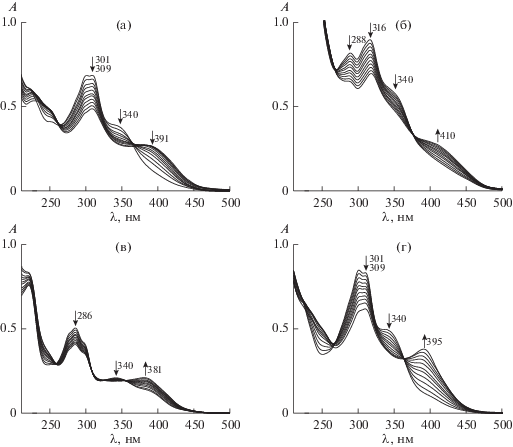
Аналогичные спектральные изменения отмечены при комплексообразовании ионов d-металлов с гидразонами, производными пиридоксаль-5-фосфата [8–11].
Первой задачей является определение стехиометрического соотношения, в котором взаимодействуют катионы и лиганды. Для этого необходимо знать, как именно происходит координация металла.
Известно, что в гидратную оболочку ионов лантанидов(III) начала ряда входят девять молекул воды, в то время как для тяжелых представителей семейства характерно гидратное число 8 (ионы промежуточных элементов существуют в водном растворе в виде смеси нона- и октагидратов) [15]. В комплексах с ионами d-элементов исследуемые гидразоны являются тридентатными лигандами, как следует из результатов рентгеноструктурного анализа комплексов с аналогичными лигандами [16–18]. Они координируют катион переходного металла через атом кислорода в положении 3 остатка пиридоксаль-5-фосфата, иминный атом азота и атом кислорода карбонильной группы. Для комплексов лантанидов с гидразонами либо основаниями Шиффа аналогичной структуры также характерна координация металла через карбонильную (карбоксильную) группу [19–22], иминный атом азота [19–24] и боковую гидроксогруппу [19, 21–23] либо гетероатом азота [23, 24]. Однако в исследуемых в настоящей работе лигандах, в отличие от описанных в литературе [19–24], есть еще и фосфатная группа, также способная к комплексообразованию с лантанидами. Об ее участии в образовании координационных соединений можно косвенно судить по изменениям в области 1000–1400 см–1 ИК-спектра свободного лиганда и комплекса с Gd3+ (рис. 3).
Так, для свободного лиганда валентные колебания связи P=O [25] проявляются в виде двух полос при 1251 и 1278 см–1, в то время как для комплекса Gd3+ в спектре обнаруживается один пик при 1272 см–1. Полосы при 1020 и 1091 см–1, которые могут быть отнесены к валентным колебаниям P–O–C (P–O–H) свободного лиганда [25], при комплексообразовании также сливаются в один пик при 1081 см–1. Кроме того, в спектрах 31P ЯМР гидразона PLP-4HBH отмечено смещение резонанса в сильное поле при комплексообразовании c La3+ (от 3.35 до –2.54 млн. д.). Для сравнения в цинковом комплексе PLP-4HBH сигнал фосфора смещен незначительно (3.17 млн. д.).
Следовательно, учитывая высокое координационное число катионов f-элементов и дентатность лигандов, теоретически можно допустить образование комплексов состава LnL', ${\text{LnL}}_{2}^{'}$ и ${\text{LnL}}_{3}^{'}.$
Вследствие сильного гидролиза ионов лантанидов(III) даже в нейтральной среде (за исключением La3+) и образования малорастворимого соединения церия(III) с ТРИС, обнаруженного нами ранее [26], приходилось поддерживать трех-четырехкратный избыток лиганда по сравнению с ионами металлов. Это означает, что графический метод неприменим для определения стехиометрии комплекса [27]. Кроме того, в ряде случаев [28, 29] такие способы могут давать неверные результаты. По этой причине для определения наиболее вероятного стехиометрического состава комплекса при помощи программного обеспечения KEV [13] экспериментальные спектральные данные описывали при помощи трех моделей, предполагающих образование частиц LnL', ${\text{LnL}}_{2}^{'}$ и ${\text{LnL}}_{3}^{'}.$ Из этих моделей наиболее правдоподобной признана имеющая физический смысл и обеспечивающая удовлетворительные статистические критерии. Например, при описании данных эксперимента рис. 2а предположение об образовании комплекса состава LaL' приводило к ${\text{lg}}\beta _{1}^{'}$ = 5.41 со стандартной погрешностью 5.70 лог. ед., что явно неудовлетворительно. Предположение об образовании комплекса ${\text{LaL}}_{2}^{'}$ c ${\text{lg}}\beta _{2}^{'}$ = 10.58 ± ± 0.32 дает намного лучший результат. Модель, согласно которой образуется LaL3, возвращает еще меньшую величину стандартного отклонения (${\text{lg}}\beta _{3}^{'}$ = 13.39 ± 0.15), однако для обеспечения хорошего описания экспериментальных оптических плотностей расчетными молярные коэффициенты светопоглощения комплексной частицы в диапазонах длин волн 280–316 и 338–354 нм должны быть отрицательными, что не имеет физического смысла. Следовательно, наиболее адекватной является модель образования бис-лигандного комплекса лантанта(III). Аналогичные расчеты были проведены для всех сочетаний металл-лиганд. Отметим, что также были протестированы стехиометрические модели, предполагавшие одновременное образование комплексов состава ML и ML2, а также ML2 и ML3. При этом расчет возвращал значение ${\text{lg}}\beta _{2}^{'},$ близкое к тому, что было рассчитано в модели, учитывающей образование только ML2, а выход другого комплекса был пренебрежимо мал (${\text{lg}}\beta _{1}^{'}$ либо ${\text{lg}}\beta _{3}^{'}$ были также малы). Таким образом, предположение об образовании единственного комплекса состава ${\text{LaL}}_{2}^{'}$ является оптимальным способом описания экспериментальных данных в выбранных концентрационных условиях. Оставшиеся места в координационной сфере катионов занимают молекулы воды, что негативно сказывается на флуоресцентных свойствах комплексов, однако положительно влияет на возможность использования комплекса Gd3+ в качестве контрастного вещества для МРТ [5]. Вероятно, образование комплекса с тремя молекулами гидразона затруднено из-за стерического фактора, связанного с необходимостью разместить вокруг центрального иона три объемные молекулы.
Как и в предыдущих работах [8–11], определяли условные константы устойчивости комплексов ионов f-металлов с гидразонами при постоянной величине рН, обеспечиваемой применением буферного раствора. При этом можно пренебречь протолитическими равновесиями лиганда и металлокомплекса. Помимо целевого процесса образования ${\text{LnL}}_{2}^{'}$ (LnL', ${\text{LnL}}_{3}^{'}$ при тестировании иных моделей) в стехиометрическую схему закладывались процессы, представленные в табл. 1.
Таблица 1.
Побочные процессы, протекающие в системе, содержащей 0.05 М буфер ТРИС-HCl, ионы La3+, Ce3+, Eu3+, Gd3+ и гидразоны PLP-4HBH, PLP-3HNH и PLP-TYR
| Процесс | lgK | Литература |
|---|---|---|
| H+ + ТРИС ↔ HТРИС+ | 8.09 | [26] |
| Ln3+ + nH2O ↔ ${\text{Ln(OH}})_{n}^{{3 - n}}$ + nH+ | –9.06 (Ln = La, n = 1), –17.86 (Ln = La, n = 2), –27.23 (Ln = La, n = 3), –8.34 (Ln = Ce, n = 1), –7.79 (Ln = Eu, n = 1), –8.20 (Ln = Gd, n =1) |
[30 с. 257, 259, 262, 282, 286] |
| Ln3+ + ТРИС ↔ LnТРИС3+ | 2.53 (Ln = La), 2.59 (Ln = Ce), 2.61 (Ln = Eu), 2.67 (Ln = Gd) |
[26] |
Константы гидролиза (Kh) второй и третьей ступени приведены в литературе только для La3+, поэтому для Ce3+, Eu3+, Gd3+ принимали Kh1 = Kh2 = = Kh3 по аналогии с [26]. При этом в конце титрования выход гидролизованных форм катионов европия, наиболее подверженного гидролизу, составлял ~4% (в том числе 0.5% Eu(OH)3), а при попытках продолжить титрование лиганда раствором соли металла помутнение смеси становилось заметно невооруженным глазом через 1–2 добавки. Помутнение раствора ограничивало максимальную общую концентрацию металла и при титровании раствором церия(III), но уже по причине образования малорастворимого комплекса с ТРИС, выход которого не превышал 20%. Выход комплекса с ТРИС для Gd3+, который наиболее сильно реагирует с компонентом буферного раствора, составлял ~26% в конце титрования. Выход металлокомплексов гидразонов составлял 40–70% от общей концентрации катиона в конце титрования.
Помимо процессов, указанных в табл. 1, принимали во внимание возможность образования хлоридных либо нитратных комплексов лантанидов(III). Однако константы устойчивости этих координационных соединений малы [31–33], выход в условиях эксперимента был исчезающе мал, поэтому процессы образования LnCl2+ и ${\text{LnNO}}_{3}^{{2 + }}$ были исключены из расчетной схемы.
Рассчитанные условные константы устойчивости комплексов ${\text{LnL}}_{2}^{'}$ приведены в табл. 2. Погрешности в табл. 2 представляют собой полуширину доверительного интервала при доверительной вероятности 0.95 и размере выборки в 3–4 эксперимента.
Таблица 2.
Условные константы устойчивости комплексов ${\text{lg}}\beta _{2}^{'}$ La3+, Ce3+, Eu3+, Gd3+ с гидразонами PLP-4HBH, PLP-3HNH и PLP-TYR в водном растворе при T = 298.2 K и рН 7.2 (0.05 М ТРИС-HCl)
| Катион | PLP-4HBH | PLP-3HNH | PLP-TYR |
|---|---|---|---|
| La3+ | 10.48 ± 0.13 | 10.55 ± 0.25 | 10.56 ± 0.14 |
| Ce3+ | 10.05 ± 0.04 | 9.88 ± 0.29 | 9.87 ± 0.06 |
| Eu3+ | 10.39 ± 0.05 | 10.29 ± 0.07 | 10.77 ± 0.21 |
| Gd3+ | 10.44 ± 0.11 | 10.37 ± 0.11 | 10.41 ± 0.09 |
Как следует из данных табл. 2, природа лиганда практически не сказывается на устойчивости комплекса, за исключением соединения Eu3+ c PLP-TYR, которое на ~0.5 лог. ед. более устойчиво, чем комплексы с другими гидразонами. Ион церия(III) образует наименее устойчивые комплексы со всеми хелатирующими гидразонами.
Из зависимости условных констант устойчивости от радиуса иона лантанида (рис. 4) видно, что комплексы Ln3+ с PLP-4HBH и PLP-3HNH подчиняются закономерности, обратной той, что была отмечена авторами [34] в ряду La3+–Ce3+–Eu3+–Gd3+ при комплексообразовании с циклическим триамином в среде ДМСО. В этом случае комплекс церия наиболее устойчив, и при переходе к европию и гадолинию константа равновесия уменьшается.
Рис. 4.
Зависимость условной константы устойчивости бис-комплексов La3+, Ce3+, Eu3+, Gd3+ с гидразонами PLP-4HBH, PLP-3HNH, PLP-TYR от радиуса катиона.
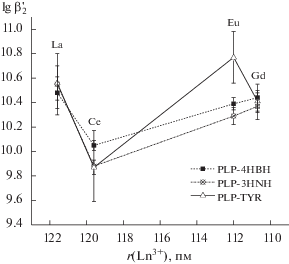
Аномально высокое значение константы устойчивости комплекса Eu3+–PLP-TYR нарушает данную закономерность.
Значения условных констант устойчивости относительно невысоки, что существенно ограничивает возможности применения комплексов лантанидов(III) с гидразонами в живых тканях в качестве флуоресцентных сенсоров или контрастирующих агентов для МРТ. Причина заключается в содержащихся в плазме крови фосфат-ионах (при физиологическом значении рН 7.4 они находятся преимущественно в виде ${\text{HPO}}_{4}^{{2 - }}$ и ${{{\text{H}}}_{2}}{\text{PO}}_{4}^{ - },$ общая концентрация у здорового человека составляет 0.8–1.4 ммоль/л [35]). Лантаниды образуют не только комплексы с гидрофосфат- и дигидрофосфат-ионами [36], но и малорастворимое соединение состава LnPO4 с ПР порядка 10–25–10–26 [36]. На этом, в частности, основано медицинское применение карбоната лантана(III) для понижения уровня фосфатов в крови при нарушении деятельности почек [4].
Расчеты показывают, что при физиологической концентрации фосфат-ионов 1 ммоль/л и рН 7.4 неизбежно разрушение исследованных комплексов лантанидов с гидразонами с концентрацией 0.05 ммоль/л и образование LnPO4. Для сохранения хотя бы 10%-ного выхода комплексной частицы необходима константа устойчивости порядка ${\text{lg}}\beta _{2}^{'}$ ~ 24.5, величина ${\text{lg}}\beta _{2}^{'}$ ~ 26 гарантирует сохранение половины комплексных частиц, а ${\text{lg}}\beta _{2}^{'}$ ~ 28.5 соответствует связыванию 90% ионов лантанидов(III) в комплекс. Таким образом, можно заключить, что гидразоны пиридоксаль-5-фосфата являются неудачными лигандами для ионов Ln3+ с точки зрения применения в биологии или медицине.
Результаты расчетов согласуются с экспериментальными данными. Добавление к раствору комплекса Gd(III)–PLP-4HBH в 0.05 М ТРИС-HCl (pH 7.2) небольшого количества фосфатного буфера (0.09 М, рН 7.4) приводит к немедленному выпадению желтовато-белого осадка, а спектр отфильтрованного раствора совпадает со спектром свободного лиганда, записанным в среде 0.05 М ТРИС-HCl (pH 7.2) (рис. 5).
ЗАКЛЮЧЕНИЕ
Исследовано комплексообразование ионов La3+, Ce3+, Eu3+, Gd3+ с гидразонами, производными пиридоксаль-5-фосфата и гидразидов 4-гидроксибензойной, 3-гидроксинафталин-2-карбоновой кислот и L-тирозина, в водном растворе при рН 7.2 (0.05 М ТРИС-HCl) и T = 298.2 K. Установлено, что все координационные соединения имеют стехиометрию 1 : 2. По данным спектрофотометрического титрования определены условные константы устойчивости комплексов при фиксированном значении рН среды. Природа гидразона не оказывает существенного влияния на устойчивость комплексов, за исключением соединения Eu3+–PLP-TYR, устойчивость которого выше, чем комплексов европия(III) с другими лигандами, на 0.5 лог. ед. Среди исследованных катионов наименее устойчивые комплексы образует Ce3+. Координационные соединения лантанидов(III) с гидразонами пиридоксаль-5-фосфата непригодны для использования в качестве флуоресцентных сенсоров для исследования живых тканей, так как содержат в своем составе молекулы воды, что ухудшает люминесцентные свойства. Кроме того, относительно низкая устойчивость комплексов приводит к их разрушению в присутствии фосфат-ионов в физиологической концентрации.
Список литературы
Abbas Z., Singh P., Dasari S. et al. // New J. Chem. 2020. V. 44. P. 15685. https://doi.org/10.1039/d0nj03261a
Harada T., Takamoku K., Nishiyama K. // J. Mol. Liq. 2017. V. 226. P. 35. https://doi.org/10.1016/j.molliq.2016.07.072
Iimori T., Sugawa H., Uchida N. // J. Phys. Chem. B. 2020. V. 124. P. 8317. https://doi.org/10.1021/acs.jpcb.0c04958
Bucker P., Richter H., Radbruch A. et al. // J. Trace Elem. Med. Biol. 2021. V. 63. Art. 126665. https://doi.org/10.1016/j.jtemb.2020.126665
Heffern M.C., Matosziuk L.M., Meade T.J. // Chem. Rev. 2014. V. 114. P. 4496. https://doi.org/10.1021/cr400477t
Aulsebrook M.L., Graham B., Grace M.R. et al. // Coord. Chem. Rev. 2018. V. 375. P. 191. https://doi.org/10.1016/j.ccr.2017.11.018
Rogosnitzky M., Branch S. // BioMetals. 2016. V. 29. P. 365. https://doi.org/10.1007/s10534-016-9931-7
Gamov G.A., Zavalishin M.N., Khokhlova A.Y. et al. // J. Coord. Chem. 2018. V. 20. P. 3304. https://doi.org/10.1080/00958972.2018.1512708
Zavalishin M.N., Gamov G.A., Khokhlova A.Yu. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 1. P. 119. https://doi.org/10.1134/S0036023620010209 [Завалишин М.Н., Гамов Г.А., Хохлова А.Ю. и др. // Журн. неорган. химии. 2020. Т. 65. № 1. С. 117. https://doi.org/10.31857/S0044457X20010201]
Gamov G.A., Zavalishin M.N., Khokhlova A.Yu. et al. // Russ. J. Gen. Chem. 2018. V. 88. № 7. P. 1436. [Гамов Г.А., Завалишин М.Н., Хохлова А.Ю. и др. // Журн. общей химии. 2018. Т. 88. № 7. С. 1144. https://doi.org/10.1134/S0044460X18070144]https://doi.org/10.1134/S1070363218070149
Gamov G.A., Zavalishin M.N., Aleksandriyskii V.V. et al. // Russ. J. Gen. Chem. A. 2019. V. 89. № 2. P. 230. [Гамов Г.А., Завалишин М.Н., Александрийский В.В. и др. // Журн. общей химии. 2019. Т. 89. № 2. С. 230. https://doi.org/10.1134/S0044460X19020100]https://doi.org/10.1134/S1070363219020105
Davis M.D., Edmondson D.E., McCormick D.B. // Monatsh. Chem. 1982. V. 113. P. 999. https://doi.org/10.1007/BF00799241
Meshkov A.N., Gamov G.A. // Talanta. 2019. V. 198. P. 200. https://doi.org/10.1016/j.talanta.2019.01.107
Bunzli J.G., Eliseeva S.V. // Lanthanide Luminescence. Photophysical, Analytical and Biological Aspects. Heidelberg: Springer, 2011. P. 15. https://doi.org/10.1007/4243_2010_3
Rudolph W.W., Irmer G. // J. Solut. Chem. 2020. V. 49. P. 316. https://doi.org/10.1007/s10953-020-00960-w
Muraskova V., Szabo N., Pizla M. et al. // Inorg. Chim. Acta. 2017. V. 461. P. 111. https://doi.org/10.1016/j.ica.2017.02.014
Back F., Oliveira G., Roman D. et al. // Inorg. Chim. Acta. 2014. V. 412. P. 6. https://doi.org/10.1016/j.ica.2013.12.008
Murphy T.B., Johnson D.K., Rose N.J. et al. // Inorg. Chim. Acta. 1982. V. 66. P. 67. https://doi.org/10.1016/S0020-1693(00)85778-3
Puntus L., Zhuravlev K., Lyssenko K. et al. // Dalton Trans. 2007. P. 4079. https://doi.org/10.1039/b706020c
Di Y., Cui X., Liu Y. et al. // Polyhedron. 2019. V. 171. P. 571. https://doi.org/10.1016/j.poly.2019.07.036
Madanhire T., Davids H., Pereira M.C. et al. // Polyhedron. 2020. V. 184. Art. 114560. https://doi.org/10.1016/j.poly.2020.114560
Ayers K.M., Schley N.D., Ung G. // Chem Commun. 2019. V. 55. P. 8446. https://doi.org/10.1039/c9cc03934a
Huang W., Zheng Z., Wu D. // Inorg. Chem. Commun. 2017. V. 84. P. 40. https://doi.org/10.1016/j.inoche.2017.07.011
Xie J., Shen S., Chen R. et al. // Oncol. Lett. 2017. V. 13. P. 4413. https://doi.org/10.3892/ol.2017.6018
Jin Y., Ma Y., Weng Y. et al. // J. Ind. Eng. Chem. 2014. V. 20. P. 3446. http://doi.org/10.1016/j.jiec.2013.12.033
Gamov G.A., Zavalishin M.N., Pimenov O.A. et al. // Inorg. Chem. 2020. V. 59. Iss. 23. P. 17783. https://doi.org/10.1021/acs.inorgchem.0c03082
Filipsky T., Riha M., Hrdina R. et al. // Bioorg. Chem. 2013. V. 49. P. 1. https://doi.org/10.1016/j.bioorg.2013.06.002
Ulatowski F., Dabrowa K., Balakier T. et al. // J. Org. Chem. 2016. V. 81. P. 1746. https://doi.org/10.1021/acs.joc.5b02909
Hibbert D.B., Thordarson P. // Chem. Commun. 2016. V. 52. P. 12792. https://doi.org/10.1039/C6CC03888C
Brown P.L., Ekberg C. Hydrolysis of Metal Ions. Wiley-VCH Verlag GmbH & Co., 2016. P. 952.
Arisaka M., Takuwa N., Suganuma H. // Bull. Chem. Soc. Jpn. 1999. V. 72. № 10. P. 2235. https://doi.org/10.1246/bcsj.72.2235
Hasegawa Y., Takashima K., Watanabe F. // Bull. Chem. Soc. Jpn. 1997. V. 70. № 5. P. 1047. https://doi.org/10.1246/bcsj.70.1047
Andersson S., Eberhardt K., Ekberg C. et al. // Radiochim. Acta. 2006. V. 94. P. 469. https://doi.org/10.1524/ract.2006.94.8.469
Zanonato P.L., Di Bernardo P., Melchior A. et al. // Inorg. Chim. Acta. 2020. V. 503. Art. 119392. https://doi.org/10.1016/j.ica.2019.119392
Cundy T., Reid I.R., Grey A. // Clinical Biochemistry: Metabolic and Clinical Aspects. 2014. P. 604. https://doi.org/10.1016/B978-0-7020-5140-1.00031-6
Liu X., Byrne R.H. // Geochim. Cosmochim. Acta. 1997. V. 61. № 8. P. 1625. https://doi.org/10.1016/S0016-7037(97)00037-9
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии