Журнал неорганической химии, 2022, T. 67, № 8, стр. 1127-1133
Синтез и термодинамические свойства индата магния
О. Н. Кондратьева a, *, М. Н. Смирнова a, Г. Е. Никифорова a, А. В. Хорошилов a, А. А. Архипенко a, В. М. Гуревич b
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: olga.kondratieva@igic.ras.ru
Поступила в редакцию 08.02.2022
После доработки 16.02.2022
Принята к публикации 24.02.2022
- EDN: IXCLVL
- DOI: 10.31857/S0044457X22080190
Аннотация
Предложен способ получения индата магния и проведено экспериментальное исследование его термодинамических свойств. Порошок MgIn2O4 синтезирован путем высокотемпературного отжига смеси нанокристаллических оксидов индия и магния. Смесь получена в результате термического разложения гелеобразного прекурсора на основе глицина и нитратов магния и индия. Микроструктура, фазовый и химический состав порошка, полученного в результате высокотемпературного отжига, изучены методами сканирующей электронной микроскопии, рентгенофазового анализа и рентгенофлуоресцентной спектрометрии. Зависимость теплоемкости MgIn2O4 от температуры измерена с помощью релаксационной, адиабатической и дифференциальной сканирующей калориметрии в диапазоне от 4.2 до 1346 K. Установлено, что экспериментальная кривая теплоемкости в изученном температурном диапазоне не имеет аномалий. С использованием измеренных значений теплоемкости рассчитаны температурные зависимости стандартных термодинамических функций MgIn2O4 в диапазоне от 0 до1346 K.
ВВЕДЕНИЕ
Двойные оксиды с общей формулой ${{{\text{A}}}^{{{\text{II}}}}}{\text{B}}_{{\text{2}}}^{{{\text{III}}}}{{{\text{O}}}_{{\text{4}}}}$ (AII = Mg, Zn; BIII = Al, Ga, In), обладающие кубической кристаллической структурой типа шпинели, получили широкую известность благодаря высоким физико-механическим [1–3], теплофизическим [3–7], электрическим и оптическим свойствам [7–10]. Широкий спектр функциональных свойств в сочетании с тугоплавкостью [7], химической инертностью и устойчивостью по отношению к ионизирующему излучению [11–14] делает эти материалы перспективными для применения в фотонике и силовой электронике [10], в качестве защитных жаростойких покрытий [15, 16] и матриц для хранения радиоактивных материалов и отходов [13]. По сравнению с другими оксидными шпинелями физико-химические свойства MgIn2O4 остаются малоизученными. Исследование кристаллического строения и катионного распределения показало, что MgIn2O4 имеет кристаллическую решетку полностью обращенной шпинели [17], в которой катионы магния преимущественно занимают октаэдрические позиции. Тепловое расширение его кристаллической решетки было изучено методом высокотемпературной рентгенографии [18]. Авторами этой работы было установлено, что MgIn2O4 обладает КТР, равным 11 × 10–6 K–1. По данным измерений оптических и электрических характеристик, проведенных как на массивной керамике [19–24], так и на тонких пленках [25–27], индат магния относится к широкозонным полупроводникам (Eg ~3.5 эВ) и обладает электропроводностью ~100 См/см (300 K) [23]. Такие свойства позволяют рассматривать его как перспективный материал для прозрачных проводящих электродов, а также компонентов фотоэлектрохимических солнечных элементов.
Традиционно индат магния получают твердофазным способом [14, 19, 22, 23, 28], однако существует ряд работ, в которых были использованы методы растворной химии: совместного осаждения [17], золь-гель [18, 29] и др. [20, 21]. Следует отметить, что литературные данные о возможности получения беспримесного индата магния достаточно противоречивы. Так, в ряде работ [22, 28, 29] показано, что даже длительный (>120 ч) высокотемпературный (>1200°C) отжиг смеси, состоящей из оксида (или карбоната) магния и оксида индия, не приводит к получению однофазного порошка MgIn2O4. По-видимому, это связано с очень узкой областью гомогенности индата магния. По мнению авторов работы [17], данная шпинель существует в присутствии небольшого избыточного количества ионов магния. Авторы [29], в свою очередь, показали, что на фазовый состав примеси и ее количество в MgIn2O4, образующемся в результате отжига продуктов термолиза геля на основе нитратов магния и индия, существенно влияет тип и количество используемого органического “топлива”.
В последние годы были опубликованы расчетно-теоретические работы по изучению фазовых переходов в MgIn2O4 [30], а также его механических [31] и термоэлектрических [32] свойств. С помощью метода Монте-Карло было предсказано [30], что на кривой теплоемкости шпинели должны существовать максимумы (при 310 и 1100 K), отвечающие перераспределению катионов Mg2+ и In3+ внутри октаэдрической и между тетраэдрической и октаэдрической подрешетками. Экспериментальная проверка существования этих переходов путем измерения теплоемкости MgIn2O4 и сравнение полученных результатов с предсказанными представляют интересную научную задачу. В настоящей работе предложен способ получения шпинели MgIn2O4 и впервые представлены результаты измерения ее теплоемкости, а также результаты расчета термодинамических свойств в широком диапазоне температур.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез индата магния осуществляли в два этапа. Первый из них заключался в термическом разложении гелеобразного прекурсора, получаемого в результате выпаривания смеси водных растворов нитратов магния и индия с добавлением глицина и нитрата аммония, второй – в высокотемпературном отжиге полученного порошка.
В качестве исходных реактивов для получения растворов Mg(NO3)2 и In(NO3)3 использовали вчетверо разбавленную дистиллированной водой азотную кислоту (ГОСТ 11125-84, ос. ч. 18-4, ω(HNO3) = 70%) и металлические магний (ГОСТ 804-93, марка “Мг 90”, ω(Mg) = 99.90%) и индий (ГОСТ 10297-94, марка “Ин-0”, ω(In) = 99.998%). К водному раствору Mg(NO3)2 и In(NO3)3 добавляли смесь глицина (ГОСТ 5860-75, х. ч., ω(NH2CH2COOH) = 99.8%) и нитрата аммония (ГОСТ 22867-77, х. ч., ω(NH4NO3) = 99.9%), а затем при температуре около 80–90°C выпаривали до гелеобразного состояния. Дальнейшее нагревание реакционной смеси приводило к ее воспламенению и разложению, в результате которого образовывался серо-коричневый порошок. Уравнение протекающей реакции можно записать следующим образом:
После охлаждения порошок-прекурсор в течение 0.5 ч размалывали в вибромельнице, а затем нагревали при температуре 1400°C в течение 8 ч. Полученный образец представлял собой белый тонкозернистый порошок.
Керамику для измерений получали методом холодного одноосного прессования. Предварительно перетертый под ацетоном и спрессованный под давлением ~200 МПа порошок MgIn2O4 спекали в платиновых тиглях при 1400°C в течение 8 ч. Плотность (ρobs) спеченных таблеток была определена геометрическим методом и выражена в процентах от теоретической (ρXRD) плотности.
Рентгенофазовый анализ (РФА) полученных порошков проводили на дифрактометре Bruker D8 Advance в геометрии Брэгга–Брентано в CuKα-излучении (λ = 1.5418 Å) с применением никелевого фильтра. Рентгенограммы регистрировали при комнатной температуре в диапазоне углов 2θ от 10° до 60° с шагом 0.0133° (время накопления 0.5 с/шаг). Полученные результаты обрабатывали с использованием программного обеспечения Bruker TOPAS.
Микроструктуру порошка индата магния исследовали с помощью сканирующей электронной микроскопии (СЭМ) на установке Carl Zeiss NVision 40 CrossBeam. Содержание магния и индия в порошке определяли методом рентгенофлуоресцентной спектрометрии (РФС) на приборе Спектроскан МАКС-GVM.
Температурную зависимость теплоемкости Cp, m(T) MgIn2O4 исследовали в интервале температур 4.21–1346 K. Измерение теплоемкости методом релаксационной калориметрии (РК) проводили на автоматизированной установке Quantum Design PPMS-9. Образцами для исследований служила керамика в форме таблеток (~2 × 2 × 1 мм), имеющих плотность ~90% от теоретической. Измерения теплоемкости в интервале 4.21–70.7 K проводили с использованием криогенной смазки Apiezon N. По данным производителя, точность измерений теплоемкости в диапазоне от 2 до 300 K составляет ±5%.
Для измерения теплоемкости индата магния методом адиабатической калориметрии (АК) использовали автоматизированную теплофизическую установку БКТ-3 (Россия). Предварительно установку калибровали путем измерения теплоемкости бензойной кислоты марки К-2. Сравнение со справочными данными [33, 34] показало, что в интервале температур 79.3 ≤ T ≤ 351 K относительные отклонения измеренных величин теплоемкости стандарта не превышали ±0.5%.
Теплоемкость MgIn2O4 при высоких температурах (316–1346 K) изучали методом дифференциальной сканирующей калориметрии (ДСК). Измерения проводили на синхронном термическом анализаторе Netzsch STA 449 F1 Jupiter в платиновом тигле в потоке аргона высокой чистоты (марка 5.5, ϕ(Ar) = 99.9995%). Перед измерением кривой теплоемкости образца проводили измерение теплоемкости стандарта (ω(α-Al2O3) = = 99.95%). Сравнение с литературными данными [35] показало, что в интервале 316–1346 K относительное отклонение измеренных величин теплоемкости для α-Al2O3 не превышает ±2%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
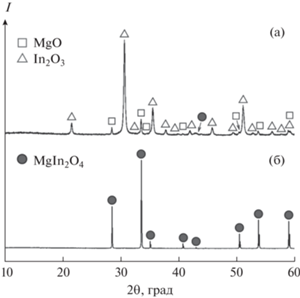
Результаты РФА синтезированных порошков приведены на рис. 1а, 1б. Анализ рентгенограммы порошка, полученного в результате термического разложения гелеобразного прекурсора (рис. 1а), показал, что он состоит из смеси двух кубических нанокристаллических фаз: In2O3 со структурой биксбиита (PDF № 01-071-2194) и MgO со структурой галита (PDF № 00-045-0946). Кроме того, на рентгенограмме наблюдаются слабые широкие рефлексы, принадлежащие шпинели MgIn2O4 (PDF № 00-040-1402). Высокотемпературный отжиг полученного порошка привел к исчезновению рефлексов примесных фаз MgO и In2O3, а также к появлению рефлексов MgIn2O4 и росту их интенсивности (рис. 1б). Таким образом, можно утверждать, что в пределах точности рентгенофазового анализа порошок индата магния является однофазным. Синтезированный MgIn2O4 (пр. гр. $Fd\bar {3}m$) имеет следующие параметры элементарной ячейки: a = = 0.88646 нм, V = 0.69660 нм3, ρXRD = 6063 кг/м3.
Рис. 1.
Рентгенограммы порошков, полученных в результате разложения гелеобразного прекурсора (а); отжига порошка-прекурсора при температуре 1400°C в течение 8 ч (б).
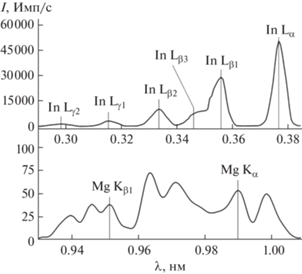
Результаты РФС (рис. 2) показали, что фактическое содержание металлов в полученном образце MgIn2O4 (9.19 мас. % Mg; 90.81 мас. % In) близко к теоретическому (9.57 мас. % Mg; 90.43 мас. % In).
Микрофотографии порошка индата магния, полученного после высокотемпературного отжига, показаны на рис. 3а, 3б. Можно отметить, что порошок обладает неоднородной микроструктурой. На микрофотографиях видны зерна MgIn2O4 с несовершенной октаэдрической огранкой, а также характерные для шпинелей скелетные формы роста. При этом на поверхности отдельных зерен MgIn2O4 размером ~2–3 мкм видны четкие треугольные ступени роста (рис. 3б).
Рис. 3.
Микроструктура порошка MgIn2O4: а – общий вид; б – увеличенный фрагмент, иллюстрирующий зерна порошка со ступенями роста.

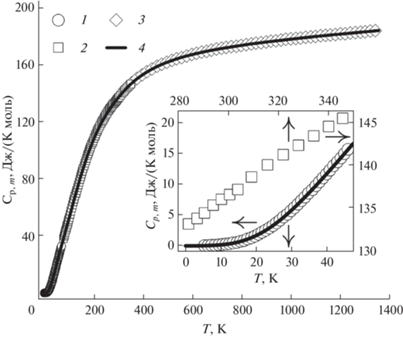
Экспериментальная кривая теплоемкости Cp,m(T) MgIn2O4, полученная в результате объединения данных РК (4.21–70.7 K), АК (79.3–351 K) и ДСК (316–1346 K), приведена на рис. 4. Как и в случае MgGa2O4 [5], явных аномалий, наличие которых характерно для фазовых превращений, на температурной кривой теплоемкости индата магния не наблюдается. Можно отметить, что на участке 300–315 K наблюдается едва заметное изменение наклона кривой Cp,m = f(T) (вставка на рис. 4). Однако эта особенность, на наш взгляд, обусловлена разбросом экспериментальных точек и не может быть отнесена к фазовому переходу, предсказанному в [30].
Рис. 4.
Теплоемкость MgIn2O4 в интервале от 0 до 1346 K: 1, 2, 3 – экспериментальная зависимость, полученная методами РК, АК, ДСК; 4 – кривая Cp,m(Т), полученная с помощью аппроксимирующих полиномов (1)–(3). На вставке показаны участки кривой теплоемкости в интервалах от 0 до 47 K и от 280 до 350 K.
Результаты измерений теплоемкости на участке 4.21–1346 K были аппроксимированы с помощью полиномов (1), (3) [36, 37] и двух линейных комбинаций ортонормированных полиномов (2) [38]:
(2)
${{C}_{{p{\text{,}}\,\,m}}}(T) = \sum\limits_{j = 0}^r {{{A}_{j}}{{U}^{j}}} ,\,\,\,\,U = \ln \frac{T}{{400}},\,\,\,\,j = 0,1,2,...,r,$(3)
${{C}_{{p{\text{,}}\,\,m}}}(T) = {{k}_{0}} + {{k}_{{{\text{ln}}}}}{\text{ln}}(T) + {{k}_{1}}{{T}^{{ - 1}}} + {{k}_{2}}{{T}^{{ - 2}}} + {{k}_{3}}{{T}^{{ - 3}}},$Таблица 1.
Коэффициенты полиномов (1)–(3)
| Параметр | Величина параметра |
|---|---|
| Полином (1) 0–17 K | |
| a, Дж/(K4 моль) | 1.59157 × 10–4 |
| b, Дж/(K2 моль) | 2.18393 × 10–4 |
| c, Дж/(K6 моль) | 2.31205 × 10–8 |
| d, Дж/(K8 моль) | 8.99083 × 10–10 |
| e, Дж/(K10 моль) | –1.59671 × 10–12 |
| Полином (2.1) 17–55 K | |
| A0, Дж/(K моль) | –2.65497 × 104 |
| A1, Дж/(K моль) | –8.21678 × 104 |
| A2, Дж/(K моль) | –1.10127 × 105 |
| A3, Дж/(K моль) | –8.37219 × 104 |
| A4, Дж/(K моль) | –3.95192 × 104 |
| A5, Дж/(K моль) | –1.18622 × 104 |
| A6, Дж/(K моль) | –2.21103 × 103 |
| A7, Дж/(K моль) | –233.979 |
| A8, Дж/(K моль) | –10.7635 |
| Полином (2.2) 55–325 K | |
| A0, Дж/(K моль) | 153.407 |
| A1, Дж/(K моль) | 50.0867 |
| A2, Дж/(K моль) | –38.4311 |
| A3, Дж/(K моль) | –87.1444 |
| A4, Дж/(K моль) | –187.238 |
| A5, Дж/(K моль) | –178.058 |
| A6, Дж/(K моль) | –73.1626 |
| A7, Дж/(K моль) | –10.9788 |
| Полином (3) 325–1346 K | |
| k0, Дж/(K моль) | –155.375 |
| kln, Дж/(K моль) | 42.9802 |
| k1, Дж/моль | 5.06656 × 104 |
| k2, (Дж K)/моль | –1.54881 × 107 |
| k3, (Дж K2)/моль | 1.35506 × 109 |
Поскольку экспериментальные значения Cp,m в области очень низких температур не подчиняются кубическому закону, для экстраполяция температурной кривой теплоемкости к абсолютному нулю был выбран полином (1). Результаты аппроксимации теплоемкости MgIn2O4 в интервале температур 0–1346 K представлены в табл. 2 и в виде графика приведены на рис. 4. Относительное отклонение рассчитанных значений теплоемкости от экспериментальных (δCp,m, %) не превышает погрешности измерений теплоемкости. Максимальное значение δCp,m в изученном интервале температур составило 1.02% (при 4.21 K) при среднем отклонении 0.10%.
Таблица 2.
Стандартные термодинамические функции MgIn2O4
| T, K | Cp, m, Дж/(K моль) | $\Delta _{0}^{T}H_{m}^{^\circ }$(T), Дж/моль | $\Delta _{0}^{T}S_{m}^{^\circ }$(T), Дж/(K моль) | $\Phi _{m}^{^\circ }$, Дж/(K моль) |
|---|---|---|---|---|
| 1 | 0.00037757 | 0.00014899 | 0.00027145 | 0.00012246 |
| 5 | 0.021126 | 0.027701 | 0.0077476 | 0.0022075 |
| 10 | 0.17105 | 0.42231 | 0.056806 | 0.014575 |
| 15 | 0.65022 | 2.2787 | 0.20096 | 0.049047 |
| 20 | 1.7319 | 7.9471 | 0.51969 | 0.12233 |
| 30 | 5.9458 | 44.136 | 1.9297 | 0.45849 |
| 40 | 11.987 | 132.94 | 4.4427 | 1.1192 |
| 50 | 18.695 | 286.01 | 7.8306 | 2.1104 |
| 60 | 25.487 | 507.04 | 11.842 | 3.3910 |
| 70 | 32.213 | 795.85 | 16.280 | 4.9111 |
| 80 | 38.583 | 1150.0 | 21.001 | 6.6250 |
| 90 | 44.835 | 1567.1 | 25.906 | 8.4933 |
| 100 | 51.142 | 2046.9 | 30.955 | 10.486 |
| 120 | 63.927 | 3197.5 | 41.409 | 14.763 |
| 140 | 76.407 | 4602.0 | 52.209 | 19.338 |
| 160 | 87.963 | 6247.6 | 63.179 | 24.131 |
| 180 | 98.265 | 8112.1 | 74.147 | 29.080 |
| 200 | 107.24 | 10169 | 84.977 | 34.130 |
| 220 | 114.99 | 12394 | 95.571 | 39.236 |
| 240 | 121.65 | 14762 | 105.87 | 44.362 |
| 260 | 127.42 | 17254 | 115.84 | 49.479 |
| 280 | 132.46 | 19854 | 125.47 | 54.565 |
| 300 | 136.92 | 22548 | 134.76 | 59.603 |
| 350 | 146.33 | 29639 | 156.61 | 71.924 |
| 400 | 153.18 | 37136 | 176.62 | 83.778 |
| 500 | 161.95 | 52934 | 211.83 | 105.97 |
| 600 | 167.26 | 69413 | 241.86 | 126.18 |
| 700 | 170.91 | 86331 | 267.94 | 144.61 |
| 800 | 173.71 | 103568 | 290.95 | 161.49 |
| 900 | 176.03 | 121057 | 311.55 | 177.04 |
| 1000 | 178.05 | 138763 | 330.20 | 191.44 |
| 1100 | 179.90 | 156662 | 347.26 | 204.84 |
| 1200 | 181.61 | 174738 | 362.98 | 217.37 |
| 1300 | 183.22 | 192980 | 377.58 | 229.14 |
| 1346 | 183.94 | 201425 | 383.97 | 234.32 |
С использованием зависимостей Cp,m = f(T) и Cp,m/T = f(T) были рассчитаны температурные зависимости следующих термодинамических функций: приращения энтальпии $\Delta _{0}^{T}H_{m}^{^\circ }(T)$ и энтропии $\Delta _{0}^{T}S_{m}^{^\circ }(T).$ Функция ${\text{Ф}}_{m}^{^\circ }(T)$ была рассчитана по формуле: ${\text{Ф}}_{m}^{^\circ }(T)$ = ${{ - \Delta _{0}^{T}H_{m}^{^\circ }(T)} \mathord{\left/ {\vphantom {{ - \Delta _{0}^{T}H_{m}^{^\circ }(T)} T}} \right. \kern-0em} T}$ + $\Delta _{0}^{T}S_{m}^{^\circ }(T).$ Результаты этих вычислений приведены в табл. 2. Значения стандартных термодинамических функций при 298.15 K составляют: $C_{{p,\,\,m}}^{^\circ }$ (298.15 K) = = 136.53 ± 0.68 Дж/(K моль); $S_{m}^{^\circ }$ (298.15 K) = 133.92 ± ± 0.67 Дж/(K моль); $H_{m}^{^\circ }$(298.15 K)–$H_{m}^{^\circ }$(0) = 22295 ± ± 110 Дж/моль; ${\text{Ф}}_{m}^{^\circ }$ (298.15 K) = = 59.14 ± ± 0.30 Дж/(K моль).
ЗАКЛЮЧЕНИЕ
Микрокристаллический индат магния получен комбинированием метода глицин-нитратного горения геля с высокотемпературным отжигом. Установлено, что в пределах точности РФА примесные фазы в порошке шпинели отсутствуют, а соотношение металлов близко к стехиометрическому. Впервые с помощью комплекса калориметрических методов исследована зависимость теплоемкости индата магния от температуры. Экспериментально показано, что аномалии, характерные для фазовых переходов, на кривой теплоемкости отсутствуют. Рассчитаны температурные зависимости термодинамических функций MgIn2O4 и определено значение его абсолютной энтропии при T = 298.15 K.
Список литературы
Hirschle C., Schreuer J., Galazka Z. // J. Appl. Phys. 2018. V. 124. P. 065111. https://doi.org/10.1063/1.5037786
Hirschle C., Schreuer J., Galazka Z. et al. // J. Alloys Compd. 2021. V. 886. 161214. https://doi.org/10.1016/j.jallcom.2021.161214
van der Laag N.J., Snel M.D., Magusin P.C.M.M. et al. // J. Eur. Ceram. Soc. 2004. V. 4. P. 2417. https://doi.org/10.1016/j.jeurceramsoc.2003.06.001
Wilkerson K.R., Smith J.D., Sander T.P. et al. // J. Am. Ceram. Soc. 2013. V. 96. P. 859. https://doi.org/10.1111/jace.12125
Kondrat'eva O.N., Tyurin A.V., Nikiforova G.E. et al. // Thermochim. Acta. 2016. V. 641. P. 49. https://doi.org/10.1016/j.tca.2016.08.015
Кондратьева О.Н., Никифорова Г.Е., Смирнова М.Н. и др. // Журн. неорган. химии. 2021. Т. 66. № 7. С. 851. [Kondrat’eva O.N., Nikiforova G.E., Smirnova M.N. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 7. P. 957.] https://doi.org/10.1134/S0036023621070068
Galazka Z. Transparent Semiconducting Oxides: Bulk Crystal Growth and Fundamental Properties. N.Y.: Jenny Stanford Publishing Pte. Ltd., 2020.
Galazka Z., Klimm D., Irmscher K. et al. // Phys. Status Solidi A. 2015. V. 212. P. 1455. https://doi.org/10.1002/pssa.201431835
Galazka Z., Ganschow S., Schewski R. et al. // APL Mater. 2019. V. 7. P. 022512. https://doi.org/10.1063/1.5053867
Glazunov I.V., Malyarevich A.M., Yumashev K.V. et al. // J. Non-Cryst. Solids. 2021. V. 557. P. 120627. https://doi.org/10.1016/j.jnoncrysol.2020.120627
Wang L., Gong W., Wang S. et al. // J. Am. Ceram. Soc. 1999. V. 82. P. 3321. https://doi.org/10.1111/j.1151-2916.1999.tb02246.x
Shen T.D., Feng S., Tang M. et al. // Appl. Phys. Lett. 2007. V. 90. P. 263115. https://doi.org/10.1063/1.2753098
Uberuaga B.P., Tang M., Jiang C. et al. // Nat. Commun. 2015. V. 6. P. 8750. https://doi.org/10.1038/ncomms9750
Tang M., Valdez J.A., Wang Y. et al. // Scripta Mater. 2016. V. 125. P. 10. https://doi.org/10.1016/j.scriptamat.2016.07.009
Schlegel N., Ebert S., Mauer G. et al. // J. Therm. Spray Tech. 2015. V. 24. P. 144. https://doi.org/10.1007/s11666-014-0138-6
Ebert S., Mücke R., Mack D. et al. // J. Eur. Ceram. Soc. 2013. V. 33. P. 3335. https://doi.org/10.1016/j.jeurceramsoc.2013.06.021
Покровский Б.И., Гапеев А.К., Горяга А.Н. и др. // Ферримагнетизм. М.: Изд-во Моск. ун-та, 1975. С. 137.
Surble S., Baldinozzi G., Simeone D. et al. // Nucl. Instrum. Methods Phys. Res., Sect. B. 2008. V. 266. P. 3002. https://doi.org/10.1016/j.nimb.2008.03.153
Moriga T., Sakamoto T., Sato Y. et al. // J. Solid State Chem. 1999. V. 142. P. 206. https://doi.org/10.1006/jssc.1998.8036
Dali S.E., Chockalingam M.J. // Mater. Chem. Phys. 2002. V. 70. P. 73. https://doi.org/10.1016/S0254-0584(00)00466-1
Dali S.E., Jayachandran M.J., Chockalingam M.J. // J. Mater. Sci. Lett. 1999. V. 18. P. 915. https://doi.org/10.1023/A:1006625000253
Biswas K., Varadaraju U.V. // Mater. Res. Bull. 2010. V. 45. P. 659. https://doi.org/10.1016/j.materresbull.2009.11.003
Ueda N., Omata T., Hikuma N. et al. // Appl. Phys. Lett. 1992. V. 61. 1954. https://doi.org/10.1063/1.108374
Tanji H., Kurihara N., Yoshida M. // J. Mater. Sci. Lett. 1994. V. 13. P. 1673. https://doi.org/10.1007/BF00451735
Miyakawa M., Noshiro R., Ogawa T. et al. // J. Appl. Phys. 2002. V. 91. P. 2112. https://doi.org/10.1063/1.1418425
Muranaka S., Shigematu T. // J. Jpn. Soc. Powder Metall. 2002. V. 47. P. 375. https://doi.org/10.2497/jjspm.47.375
Moses Ezhil Raj A., Subramanian B., Senthilkumar V. et al. // Physica E. 2008. V. 40. P. 467. https://doi.org/10.1016/j.physe.2007.07.004
Kimizuka N., Brown F., Flores M.J.R. // J. Solid State Chem. 2000. V. 150. P. 276. https://doi.org/10.1006/jssc.1999.8591
Surble S., Gosset D., Dolle M. et al. // Solid State Sci. 2011. V. 13. P. 42. https://doi.org/10.1016/j.solidstatesciences.2010.10.004
Seko A., Yuge K., Oba F. et al. // Phys. Rev. B. 2006. V. 73. P. 184117. https://doi.org/10.1103/PhysRevB.73.184117
Bouhemadou A., Khenata R., Zerarga F. // Eur. Phys. J. B. 2007. V. 56. P. 1. https://doi.org/10.1140/epjb/e2007-00003-1
Mahmood Q., Hassan M., Algrafy E. et al. // J. Phys. Chem. Solids. 2020. V. 144. P. 109481. https://doi.org/10.1016/j.jpcs.2020.109481
Bissengaliyeva M.R., Gogol D.B., Taymasova S.T. et al. // J. Chem. Eng. Data. 2011. V. 56. P. 195. https://doi.org/10.1021/je100658y
Стрелков П.Г., Склянкин А.А. // Прикл. мех. и техн. физика. 1960. № 2. С. 100.
Archer D.G. // J. Phys. Chem. Ref. Data. 1993. V. 22. P. 1441. https://doi.org/10.1063/1.555931
Majzlan J., Navrotsky A., Woodfield B.F. et al. // J. Low Temp. Phys. 2003. V. 130. P. 69. https://doi.org/10.1023/a:1021897402158
Richet P., Fiquet G. // J. Geophys. Res. 1991. V. 96. P. 445. https://doi.org/10.1029/90JB02172
Гуревич В.М., Хлюстов В.Г. // Геохимия. 1979. № 6. С. 829.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии