Журнал неорганической химии, 2022, T. 67, № 8, стр. 1116-1126
Взаимодействие карбонатов кальция и стронция с раствором KF
П. П. Федоров a, *, А. А. Лугинина a, Н. Ю. Табачкова a, А. А. Александров a, Л. В. Бадьянова a, С. В. Кузнецов a
a Институт общей физики им. А.М. Прохорова РАН
119991 Москва, ул. Вавилова, 38, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 16.12.2021
После доработки 25.01.2022
Принята к публикации 27.01.2022
- EDN: TWEBKM
- DOI: 10.31857/S0044457X22080104
Аннотация
Исследованы реакции превращения порошкообразных MCO3 (M = Ca, Sr) в соответствующие фториды при взаимодействии с раствором фторида калия. По данным рентгенофазового анализа, растровой и просвечивающей электронной микроскопии, рентгеноспектрального микроанализа, предложенные условия позволяют синтезировать однофазные наноразмерные порошки фторидов кальция и стронция, содержащие 1.7 и 4.4 мол. % KF соответственно. Соединение KCaF3 в результате протекания этой реакции не образуется. Установлено, что KCaF3 является высокотемпературной фазой с температурой образования 626оС.
ВВЕДЕНИЕ
Фториды кальция (CaF2) и стронция (SrF2) в течение многих десятилетий привлекают внимание исследователей, так как обладают прозрачностью в широкой спектральной области от вакуумного ультрафиолета до среднего ИК-диапазона, низким показателем преломления в сочетании с удовлетворительными химическими, термическими и механическими характеристиками [1–4], а также являются хорошими матрицами для ионов редкоземельных элементов [5, 6]. Благодаря сочетанию уникальных физико-химических и оптических свойств, они находят применение в различных областях фотоники [7–21].
Существует большое количество методик синтеза CaF и SrF2, в том числе осаждением из водных растворов в результате обменных реакций с использованием различных фторирующих агентов: фтороводородной кислоты [21–24], фторидов натрия [25], калия [16–19, 26], аммония [27–30]. Твердофазным синтезом путем нагревания гомогенизированной смеси карбонатов кальция или стронция с фторидом аммония получены фториды высокого качества, пригодные для выращивания монокристаллов, однако вследствие высоких температур наблюдается спекание частиц продукта [31]. Фториды с микронными размерами частиц получены синтезом из растворов в расплаве [32–34]. В последнее время большое внимание уделяется разработке методик получения нанокристаллических порошков CaF2 и SrF2 методами гидротермального синтеза [35, 36], золь-гель синтеза [37–39], термическим разложением прекурсоров [40], осаждением из неводных органических растворителей [10, 41–43] и в микрореакторах [44].
Карбонаты кальция и стронция, имеющие строгую стехиометрию, являются удобным сырьем для получения фторидов [45–48]. Применение высококонцентрированных растворов HF приводит к получению хорошо отстаивающихся осадков гидрофторидов щелочноземельных металлов с крупнокристаллической структурой, которые при термообработке (145–200°С) не подвергаются гидролизу и образуют соответствующие фториды высокой чистоты [46–49]. KF, в отличие от фтороводородной кислоты, является менее агрессивным фторирующим агентом.
Карбонаты кальция и стронция, фториды кальция и стронция плохо растворимы в воде. Произведение растворимости (ПР) CaF2 (4.0 × × 10–11) почти на два порядка меньше ПР СаСО3 (3.8 × 10–9), а ПР SrF2 (2.5 × 10–9), наоборот, в 23 раза превышает ПР SrCO3 (1.1 × 10–10) [50, 51]. Полное превращение MCO3 в MF2 (М = Ca, Sr) по реакции
(1)
${\text{МC}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{тв}}} \right){\text{ + 2KF(aq) }} \to {\text{М}}{{{\text{F}}}_{{\text{2}}}}\left( {{\text{тв}}} \right) + {{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}}$(2)
$\frac{{{{{\left( {{{a}_{{{{{\text{F}}}^{ - }}}}}{{{{\gamma }}}_{{{{{\text{F}}}^{ - }}}}}} \right)}}^{2}}}}{{{{a}_{{{\text{CO}}_{3}^{{2 - }}}}}{{{{\gamma }}}_{{{\text{CO}}_{3}^{{2 - }}}}}}} > \frac{{{\text{П}}{{{\text{Р}}}_{{{\text{M}}{{{\text{F}}}_{2}}}}}}}{{{\text{П}}{{{\text{Р}}}_{{{\text{MC}}{{{\text{O}}}_{3}}}}}}},$(3)
${\text{для}}\,\,{\text{Ca}}{{{\text{F}}}_{2}}\frac{{{{{\left( {{{a}_{{{{{\text{F}}}^{ - }}}}}{{{{\gamma }}}_{{{{{\text{F}}}^{ - }}}}}} \right)}}^{2}}}}{{{{a}_{{{\text{CO}}_{3}^{{2 - }}}}}{{{{\gamma }}}_{{{\text{CO}}_{3}^{{2 - }}}}}}} > 0.01,$(4)
${\text{для}}\,\,{\text{Sr}}{{{\text{F}}}_{2}}\frac{{{{{\left( {{{a}_{{{{{\text{F}}}^{ - }}}}}{{{{\gamma }}}_{{{{{\text{F}}}^{ - }}}}}} \right)}}^{2}}}}{{{{a}_{{{\text{CO}}_{3}^{{2 - }}}}}{{{{\gamma }}}_{{{\text{CO}}_{3}^{{2 - }}}}}}} > 23.0,$При исследовании взаимодействия карбоната кальция с раствором фтористого калия не наблюдалось образования хорошо известного соединения KCaF3 [54].
Целью настоящей работы является исследование взаимодействия СаСО3 с водным раствором KF для уточнения области образовании твердого раствора Ca1 –xKxF2 –x в зависимости от избытка KF, установление температурных границ существования соединения KCaF3 и экспериментальная проверка взаимодействия карбоната стронция с водным раствором фторида калия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных веществ использовали SrCO3 (ос. ч. 7-2, Унихим, Россия) и СаCO3 (ос. ч. 7-3, Унихим, Россия), КF · 2H2O (ч., Химзавод фторсолей, Россия), бидистиллированную воду.
Синтез МF2 проводили по методике, описанной ранее в [54], с небольшими изменениями. Раствор КF медленно добавляли к суспензии карбоната при постоянном перемешивании на магнитной мешалке. После отстоя маточный раствор с рН 10.5–11.0 декантировали, осадок промывали Н2О семикратной декантацией по 120 мл. Величину рН контролировали pH-метром типа рН-150 МА с электродом ЭСКЛ-08М. Помимо указанной методики, синтез SrF2 проводили в две стадии: после декантации маточного раствора к осадку добавляли свежий раствор КF · 2H2O. Отмытый и отфильтрованный осадок сушили под ИК-лампой. Условия синтеза порошков MF2 приведены в табл. 1, из которой видно, что рН фильтрата после отмывки образцов с примесью MCO3 оставался щелочным, а для образцов MF2 рН ≤ 7. Образец, выдержанный под маточным раствором в течение 30 сут, обозначен как 3м. При синтезе СаF2 осадок хорошо отстаивался, его фильтровали и получали сыпучий порошок. При синтезе SrF2 осадок гораздо хуже отстаивался, фильтровался и после сушки требовал перетирания. Образцы 3с и 10с подвергали термообработке на воздухе в платиновом тигле в муфельной печи СНОЛ при 600°C в течение 1 ч.
Таблица 1.
Условия синтеза порошков MF2
| Номер образца | Суспензия МCO3, т : ж = 1 : 3 | Раствор КF, 14.0 мас. % | Избыток КF от стехиометрии, % | Время перемешивания, ч | рН фильтрата после отмывки |
|---|---|---|---|---|---|
| навеска МCO3, г | навеска КF · 2H2O, г | ||||
| Синтез СaF2 | |||||
| 1а | 5.0322 | 10.5965 | 12 | 9 | 8.5 |
| 2а | 5.0543 | 11.4146 | 20 | 9 | 7.0 |
| 3а | 5.0160 | 12.2599 | 30 | 9 | 6.8 |
| 4а | 5.0014 | 13.1645 | 40 | 9 | 6.8 |
| 5а | 5.0010 | 14.1037 | 50* | 9 | 6.7 |
| Синтез SrF2 | |||||
| 6а | 5.0062 | 7.6599 | 20 | 11 | 8.1 |
| 7а | 5.0002 | 8.2912 | 30 | 11 | 8.0 |
| 8а | 5.0012 | 9.5654 | 50 | 11 | 8.0 |
| 9а | 5.0018 | 10.8420 | 70 | 11 | 7.9 |
| 10а | 5.0053 | 8.2967 | 30 | 9 | – |
| Вторая стадия | 8.2967 | 30 | 11 | 6.7 | |
| 11а | 5.0074 | 8.9387 | 40 | 9 | – |
| Вторая стадия | 8.9387 | 40 | 11 | 6.7 | |
Полученные порошки исследовали методом рентгенофазового анализа (РФА) на дифрактометре D8 Bruker Advance (CuKα-излучение, диапазон углов 2θ 10°–80°, шаг 0.02°). Параметры элементарной ячейки, размеры областей когерентного рассеяния (ОКР, D) и значения микродеформаций (e) рассчитывали с помощью программного пакета TOPAS.
Термогравиметрический анализ (ТГА) проводили на дериватографе MOM Q1500 D в платиновых тиглях на воздухе при скорости нагрева 10 град/мин. Смесь CaCO3/КF · 2H2O = 1/3 для ТГА готовили встряхиванием в вортексе Multi Speed Vortex MSV-3500 при скорости вращения 1600 об/мин в течение 15 мин (образец 12).
Размер частиц и морфологию порошков изучали методами просвечивающей (ПЭМ) и растровой электронной микроскопии (РЭМ). ПЭМ проводили на просвечивающем электронном микроскопе JEM 2100 (JEOL, Япония) при ускоряющем напряжении 200 кВ, РЭМ – на электронном микроскопе Carl Zeiss NVision 40 (Германия). Средний размер частиц определяли по 25 измерениям с использованием программы ImageJ. Мольную долю KF (х) в твердом растворе M1 –xKxF2 –x рассчитывали по результатам рентгеноспектрального микроанализа (РСМА). Для РСМА образцов использовали электронный микроскоп EVO 10 Carl Zeiss GmbH (Германия), оснащенный детектором SmartEDX (AMETEK, США) при токе пучка 626 пА и ускоряющем напряжении 20 кВ с рабочим расстоянием 8.9–9.0 мм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
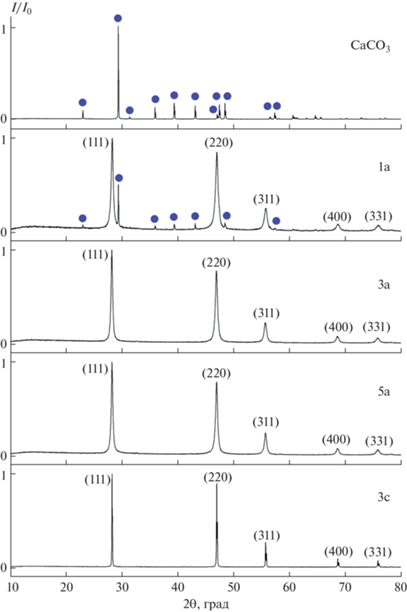
Данные РФА синтезированных порошков CaF2 однозначно указывают на быстрое протекание реакции (1). В опыте 1 превращение происходит не полностью, образец двухфазный, наряду с полученным CaF2 остается небольшая доля исходной фазы карбоната (рис. 1). Увеличение избытка KF до ≥20% приводит к полному превращению карбоната кальция во фторид. Результаты РФА и данные РСМА приведены в табл. 2.
Таблица 2.
Результаты РФА порошков, синтезированных из CaCO3 и КF
| Образец | Параметр a фазы CaF2, Å | Размер ОКР (D), нм | e, микро-деформации | Параметры решетки фазы CaCO3, Å | Мольная доля KF (х) по данным РСМА* | |
|---|---|---|---|---|---|---|
| a | c | |||||
| CaCO3 | – | >100 | – | 4.9888(1) | 17.061(1) | – |
| 1а | 5.4683(3) | 21 | 0.127(6) | 4.9941(3) | 17.086(2) | 0.015 |
| 2а | 5.4679(2) | 23 | 0.085(4) | – | – | 0.018 |
| 3а | 5.4696(2) | 29 | 0.114(3) | – | – | 0.017 |
| 3м | 5.4702(2) | 30 | 0.141(3) | – | – | 0.019 |
| 4а | 5.4713(2) | 27 | 0.118(4) | – | – | Н. а.** |
| 5а | 5.4707(2) | 24 | 0.094(4) | – | – | 0.016 |
| 3с | 5.4641(1) | 440 | 0.006(1) | – | – | 0.017 |
Исходный порошок CaCO3 представляет собой агломераты частиц (друзы) микронных (1–7 мкм) размеров (рис. 2а, 2б). Габитус кристалликов – ромбоэдры. При протекании реакции (1) исходный ромбоэдрический габитус частиц сохраняется, хотя они наполняются округлыми частицами CaF2 размером 22 ± 6 нм (рис. 2в, 2г). Определенные по микрофотографиям РЭМ размеры частиц достаточно хорошо согласуются с рассчитанными значениями ОКР (табл. 2). Следует отметить, что сохранение исходной формы ромбоэдрических микрочастиц имеет место даже при полном протекании реакции (образец 2а, рис. 2д, 2е). Эти явления могут быть описаны в терминах топотаксии [55] и/или метасоматоза [56]. Реакция сопровождается заметным изменением объема, ромбоэдрические микрочастицы имеют пористый характер – степень заполнения объема в них всего ~2/3 [54]. Такая ажурная матрица выступает в роли микрореактора, предоставляя возможность пространственного обособления наночастиц CaF2, которые слабо взаимодействуют друг с другом. Это подтверждается малыми величинами микродеформаций (табл. 2). При увеличении избытка KF (образец 3а) наблюдается формирование агрегатов наночастиц сферической формы размером 79 ± 21 нм (рис. 2ж). Эти агрегаты образованы наночастицами размером 28 ± 8 нм, которые имеют случайную ориентацию. Образование агрегатов вызывает частичное обрушение исходной формы ромбоэдрических микрочастиц (рис. 2з). Выдержка наночастиц под маточным раствором (образец 3м) практически не влияет на их размеры и также вызывает агрегацию в неограненные наночастицы (рис. 2и). Увеличение величины микродеформаций (табл. 2) свидетельствует о взаимодействии между наночастицами CaF2. Однако ориентированное сращивание наночастиц [34, 44, 57] не происходит из-за их неподходящих кристаллографических ориентаций (рис. 2и).
Рис. 2.
Микрофотографии РЭМ: исходного CaCO3 (а, б), образца 1а (в, г), образца 2а (д, е), образца 3а (ж, з). Микрофотография ПЭМ образца 3м (и).

При данном синтезе получен сыпучий порошок CaF2, в отличие от гелеобразных осадков и высушенных порошков, требующих перетирания при соосаждении из водных растворов нитрата кальция и KF [16, 17, 26]. Нагрев до 600°C (образец 5с) приводит к значительному увеличению размеров частиц (ОКР = 441 ± 23 нм). Наночастицы фторида кальция активно взаимодействуют друг с другом во время спекания, химический состав при этом не меняется (рис. 1, табл. 2).
Данные РСМА свидетельствуют об образовании твердого раствора Ca1 –xKxF2 –x (х = 0.017), состав которого не зависит от используемого избытка KF (табл. 2).
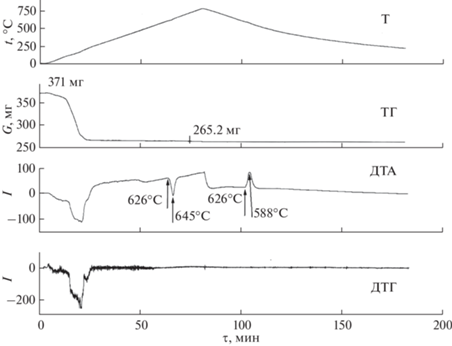
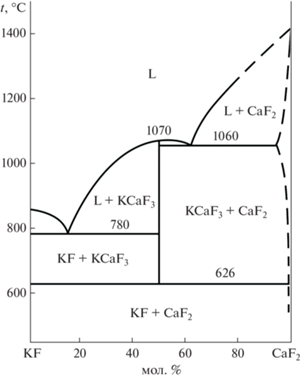
Интересно отметить, что даже при стехиометрическом соотношении исходных реагентов (образец 5а, табл. 2) не образуется известное по многочисленным работам соединение KCaF3 [58–65]. Соединение KCaF3 со структурой перовскита образуется при кристаллизации расплава [58], а также в результате твердофазного взаимодействия фторидов калия и кальция при повышенных температурах (700–800°C) [62]. Заметим, что это соединение не зафиксировано в многочисленных работах [16, 17, 21, 26, 66–75] по синтезу прекурсоров оптической керамики на основе фторида кальция в результате взаимодействия растворов нитратов и фторида калия. Не известен также природный минерал такого состава. По-видимому, KCaF3 представляет собой высокотемпературную фазу. Для проверки этого предположения выполнен ТГА образца 12 (смеси CaCO3/КF · ⋅ 2H2O = 1/3, подготовленной описанным выше способом). Кривые ТГА представлены на рис. 3. Результаты РФА образца после проведения ТГА подтверждают образование соединения KCaF3. На основании полученных данных установлена температура образования соединения KCaF3, (626°С) и построена схема фазовых равновесий в системе KF–CaF2 с учетом данных [58] (рис. 4).
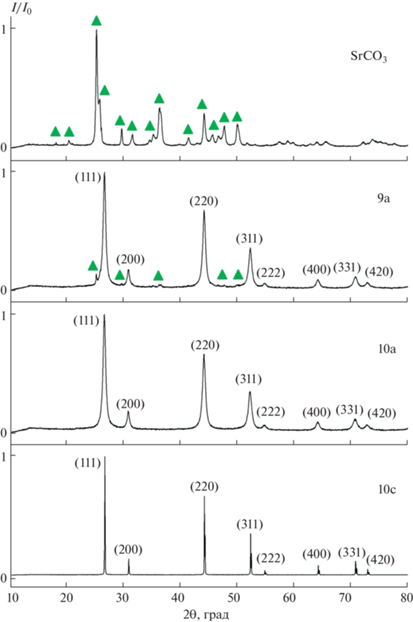
При синтезе фторида стронция исходный SrCO3 состоял из округлых наночастиц размером 50 ± 8 нм, габитус которых определялся ромбической структурой арагонита (рис. 5а, табл. 3). Результаты РФА подтвердили предположение, что только декантацией и повторной обработкой свежим раствором KF можно получить фторид стронция (образцы 10а и 11а, табл. 3). При проведении синтеза в одну стадию даже при значительном избытке КF (70%) присутствует фаза SrCO3 (рис. 6, табл. 3). В процессе синтеза фторида стронция получены ограненные кубические наночастицы, более мелкие, чем наночастицы исходного SrCO3. На рис. 5б (образец 6а) кроме ограненных наночастиц SrF2 видны более крупные округлые частицы SrCO3. На рис. 5в и 5г видны только хорошо ограненные наночастицы, что подтверждает образование SrF2. Размеры частиц, определенные по данным ПЭМ, составляют от 12 до 53 нм. Несовпадение размеров с рассчитанными значениями ОКР (табл. 3) может указывать на реализацию неклассического механизма образования кристаллов путем ориентированного сращивания наночастиц. Увеличение величины микродеформаций для образцов 10а и 11а также свидетельствует о взаимодействии между наночастицами SrF2. Прокаливание фторида стронция на воздухе при 600°C (образец 10с) не вызывает пирогидролиза фторида, однако приводит к существенному увеличению размеров частиц (ОКР = = 611 ± 9 нм). Данные РСМА свидетельствуют об образовании твердого раствора Sr1 –xKxF2 –x, где х = = 0.044 (табл. 3).
Таблица 3.
Результаты РФА порошков, синтезированных из SrCO3 и КF
| Образец | Параметр a фазы SrF2, Å | Размер ОКР (D), нм | e, микро-деформации | Параметры решетки фазы SrCO3, Å | Мольная доля KF (х) по данным РСМА* | ||
|---|---|---|---|---|---|---|---|
| a | b | c | |||||
| SrCO3 | – | 43 | 0.197(3) | 5.093(1) | 8.453(1) | 6.033(1) | – |
| 6а | 5.8008(6) | 13 | – | 5.084(1) | 8.430(1) | 6.026(1) | 0.037 |
| 7а | 5.8079(2) | 16 | 0.028(5) | 5.088(1) | 8.451(2) | 6.029(1) | 0.039 |
| 8а | 5.8053(2) | 11 | 0.041(6) | 5.103(1) | 8.422(2) | 6.031(1) | 0.050 |
| 9а | 5.8046(3) | 10 | – | 5.095(1) | 8.428(3) | 6.039(2) | Н. а. |
| 10а | 5.8091(4) | 12 | 0.063(4) | – | – | – | 0.045 |
| 11а | 5.8097(4) | 13 | 0.060(1) | – | – | – | 0.046 |
| 10с | 5.8003(1) | 610 | – | – | – | – | 0.040 |
Твердые растворы фторидов одновалентных металлов во фторидах со структурой флюорита MF2, где M = Ca, Sr, Ba, Cd, Pb, известны [4, 76–80]. Замещение происходит с образованием вакансий в анионной подрешетке по следующему механизму: M2+ + F– → Me+ + VF. Общая формула записывается как M1 –xMexF2 –x. Такие твердые растворы характеризуются высокой анионной проводимостью [76, 78]. Наибольшая ширина твердых растворов (~10 мол. %, х = 0.1) зафиксирована в системах CdF2–NaF [77] и PbF2–MeF (Me = K, Rb) [76]. В случае совместного вхождения фторидов одно- и трехвалентных элементов в решетку флюорита наблюдаются существенно более широкие области гомогенности твердых растворов на основе соединений флюоритовой структуры [6]. В частности, наблюдалось совместное вхождение фторидов РЗЭ и аммония во фторид стронция [30].
В системе KF–SrF2 ранее [79] зафиксировано образование твердого раствора c максимальной концентрацией 1.2 мол. % KF (х = 0.012). Именно такая величина получена при соосаждении фторида стронция из нитратного раствора действием фторида калия в качестве фторирующего агента. В данной работе зафиксировано значительно большее вхождение калия в состав твердого раствора. Причина этого расхождения неясна. Определенные параметры решетки твердого раствора Sr1 –xKxF2 –x свидетельствуют о том, что параметр решетки с концентрацией меняется незначительно (табл. 3, параметр решетки SrF2a = 5.800 Å, JCPDS card # 06-0262). Это объясняется существенно бóльшим ионным радиусом калия по сравнению со стронцием (“кристаллические” ионные радиусы по системе Шеннона для КЧ = 8 составляют 1.61 и 1.40 Å соответственно [81]), что компенсирует образование анионных вакансий при гетеровалентном изоморфном замещении.
Заметим, что в многочисленных работах по синтезу прекурсоров оптической керамики c использованием KF в качестве фторирующего агента [66] не учитывалась возможность вхождения калия в состав твердого раствора.
ЗАКЛЮЧЕНИЕ
Проведенные исследования подтвердили полноту протекания реакции SrCO3 с раствором фторида калия при условии удаления из раствора ионов ${\text{CO}}_{3}^{{2 - }}$ декантацией маточного раствора и использовании свежего раствора KF на второй стадии. Получение при синтезе частиц размером от 12 до 53 нм объясняет образование плохо отстаивающегося осадка. Показан эффект наследования ромбоэдрического габитуса исходных микрокристаллов CaCO3, наполненных ансамблями округлых наночастиц CaF2, что способствует образованию хорошо отстаивающегося осадка и получению сыпучего порошка. Установлено образование твердых растворов Ca0.983K0.017F1.983 и Sr0.956K0.044F1.956, состав которых не зависит от используемого избытка KF. Показано, что прокалка синтезированных фторидов кальция и стронция на воздухе при 600°C не вызывает их пирогидролиза и приводит к значительному увеличению размера частиц. Обнаружено, что соединение KCaF3 нестабильно при низких температурах и нормальном давлении. Уточнена фазовая диаграмма системы KF–CaF2 с указанием температуры образования соединения KCaF3 (626°С).
Список литературы
Воронкова Е.М., Гречушников Б.Н., Диблер Г.И., Петров И.П. // Оптические материалы для инфракрасной техники. М.: Наука, 1965. 335 с.
Юшкин Н.П., Волкова Н.В., Маркова Г.А. // Оптический флюорит. М.: Наука, 1983. 134 с.
Зверев В.А., Кривопустова Е.В., Точилина Т.В. // Оптические материалы. Ч. 2. Учебное пособие для конструкторов оптических систем и приборов. CПб.: НИУ ИТМО, 2013. 248 с.
Crystals with the fluorite structure: electronic, vibrational, and defect properties / Ed. Hayes W., Oxford: Clarendon Press, 1974. 448 p.
Kuznetsov S.V., Fedorov P.P. // Inorg. Mater. 2008. V. 44. № 13. P. 1434. (Suppl.). https://doi.org/10.1134/S0020168508130037
Sobolev B.P. // The Rare Earth Trifluorides. P. 2. Introduction to Materials Science of Multiconoinent Metal Fluoride Crystals. Barcelona, 2001. 459 p.
Fedorov P.P., Kuznetsov S.V., Osiko V.V. //Elaboration of Nanofluorides and Ceramics for Optical and Laser Applications . Amsterdam: Elsevier, 2016. P. 7. http://dx.doi.org/10.1016/B978-0-12-801639-8.00002-7
Moncorge R., Camy P., Doualan J.L. et al. // J. Lumin. 2013. V. 133. P. 276. https://doi.org/10.1016/j.jlumin.2011.09.038
Kaminskii A.A. // Laser Crystals. Their Physics and Properties. Berlin: Springer, 1990. https://doi.org/10.1007/978-3-540-70749-3
Feldmann C., Roming M., Trampert K. // Small. 2006. V. 2. P. 1248. https://doi.org/10.1002/smll.200600140
Wang G., Peng Q., Li Y. // J. Am. Chem. Soc. 2009. V. 131. P. 14200. https://doi.org/10.1021/ja906732y
Zhang C., Li C., Peng C. et al. // Chem. Eur. J. 2010. V. 16. № 19. P. 5672. https://doi.org/10.1002/chem.200903137
Basiev T.T., Doroshenko M.E., Konyushkin V.A., Osiko V.V. // Opt. Lett. 2010. V. 35. № 23. P. 4009. https://doi.org/10.1364/OL.35.004009
Sarthou J., Duquesne J.-Y., Becerra L. et al. // J. Appl. Phys. 2017. V. 121. P. 245108. https://doi.org/10.1063/1.4990282
Liu Z., Jia M., Yi G. et al. // J. Alloys Compd. 2015. V. 646. P. 760. https://doi.org/10.1016/j.jallcom.2015.05.272
Li W., Huang H., Mei B. et al. // Ceram. Int. 2020. V. 46. № 11. P. 19530. https://doi.org/10.1016/j.ceramint.2020.05.003
Wan Z., Li W., Mei B. et al. // J. Lumin. 2020. V. 223. P. 117188. https://doi.org/10.1016/j.jlumin.2020.117188
Yang Yu, Li W., Mei B. et al. // J. Lumin. 2019. V. 213. P. 504. https://doi.org/10.1016/j.jlumin.2019.05.010
Zhou Z., Li W., Song J. et al. // J. Eur. Ceram. Soc. 2019. V. 39. P. 2446. https://doi.org/10.1016/j.jeurceramsoc.2019.02.033
Fedorov P.P., Luginina A.A., Kuznetsov S.V., Osiko V.V. // J. Fluor. Chem. 2011. V. 132. № 12. P. 1012. https://doi.org/10.1016/j.jfluchem.2011.06.025
Lyberis A., Patriarche G., Gredin P. et al. // J. Eur. Ceram. Soc. 2011. V. 31. № 9. P. 1619. https://doi.org/10.1016/j.jeurceramsoc.2011.02.03
Mayakova M.N., Luginina A.A., Kuznetsov S.V. et al. // Mendeleev Commun. 2014. V. 24. P. 360. https://doi.org/10.1016/j.mencom.2014.11.017
Kuznetsov S.V., Nizamutdinov A.S., Mayakova M.N. et al. // J. Fluor. Chem. 2019. V. 222–223. P. 46. https://doi.org/10.1016/j.jfluchem.2019.04.010
Sarthou J., Aballea P., Patriarche G. et al. // J. Am. Ceram. Soc. 2016. V. 99. № 6. P. 1992. https://doi.org/10.1111/jace.14216
Malviya D., Pawade V.B., Bhanvase B.A. // Luminescence. 2019. V. 34. № 4. P. 426. https://doi.org/10.1002/bio.3630
Li W., Huang H., Mei B., Song J. // Ceram. Int. 2017. V. 43. P. 10403. https://doi.org/10.1016/j.ceramint.2017.05.075
Fedorov P.P., Luginina A.A., Ermakova J.A. et al. // J. Fluor. Chem. 2017. V. 194. P. 8. https://doi.org/10.1016/j.jfluchem.2016.12.003
Лугинина А.А., Федоров П.П., Кузнецов С.В. и др. // Неорган. материалы. 2012. Т. 48, № 5. С. 617. [Luginina A.A., Fedorov P.P., Kuznetsov S.V. et al. // Inorg. Mater. 2012. V. 48. № 5. P. 530.] https://doi.org/10.1134/S002016851205010X
Singh S.G., Sen S., Patra G.D., Gadkari S.C. // J. Lumin. 2015. V. 166. P. 222. https://doi.org/10.1016/j.jlumin.2015.05.014
Rozhnova Yu.A., Kuznetsov S.V., Luginina A.A. et al. // Mater. Chem. Phys. 2016. V. 172. P. 150. https://doi.org/10.1016/j.matchemphys.2016.01.055
Лугинина А.А., Ольховая Л.А., Икрами Д.Д. и др. // Журн. неорган. химии. 1981. Т. 26. С. 332.
Волынец Ф.К., Черневская Э.Г., Иванова И.А. и др. // Журн. прикл. химии. 1979. Т. 52. № 2. С. 458.
Fedorov P.P., Alexandrov A.A. // J. Fluor. Chem. 2019. V. 227. P. 109374. https://doi.org/10.1016/j.jfluchem.2019.109374
Пройдакова В.Ю., Александров А.А., Воронов В.В., Федоров П.П. // Журн. неорган. химии. 2020. Т. 65. № 6. С. 764. [Proydakova V.Yu., Alexandrov A.A., Voronov V.V., Fedorov P.P. // Russ. J. Inorg. Chem. 2020. V. 65. № 6. P. 834.] https://doi.org/10.1134/S0036023620060169
Pandurangappa C., Lakshminarappa B.N., Nagabhushana B.M. // J. Alloys Compd. 2010. V. 489. № 3. P. 592. https://doi.org/10.1016/j.jallcom.2009.09.118
Hou S., Zou Y., Yu X. et al. // CrystEngComm. 2011. V. 13. P. 835. https://doi.org/10.1039/C0CE00396D
Rehmer A., Scheurell K., Kemnitz E. // J. Mater. Chem. C. 2015. V. 3. P. 1716. https://doi.org/10.1039/C4TC02510E
Scheurell K., Kemnitz E. // Inorganics. 2018. V. 6. P. 128. https://doi.org/10.3390/inorganics6040128
Müller A., Krahl T., Radnik J. et al. // Surf. Interface Anal. 2021. V. 53. P. 494. https://doi.org/10.1002/sia.6937
Du Y.-P., Sun X., Zhang Y.-W. et al. // Cryst. Growth Des. 2009. V. 9. № 4. P. 2013. https://doi.org/10.1021/cg801371r
Labeguerie J., Gredin P., Mortier M.A. et al. // Z. Anorg. Allg. Chem. 2006. V. 632. P. 1538. https://doi.org/10.1002/zaac.200600074
Safronikhin A., Ehrlich H., Lisichkin G. // J. Alloys Compd. 2017. V. 694. P. 1182. https://doi.org/10.1016/j.jallcom.2016.10.128
Back M., Marin R., Franceschin M. et al. // J. Mater. Chem. C. 2016. V. 4. № 9. P. 1906. https://doi.org/10.1039/C5TC03355A
Абиев Р.Ш., Здравков А.В., Кудряшова С.Ю. и др. // Журн. неорган. химии. 2021. Т. 66. № 7. С. 929. [Abiev R.Sh., Zdravkov A.V., Kudryashova Yu.S. et al. // Russ. J. Inorg. Chem. 2021. V. 66. 7. P. 1047. https://doi.org/10.1134/S0036023621070020]
Рысс И.Г. // Химия фтора и его неорганических соединений. М.: Госхимиздат, 1956. 720 с.
Икрами Д.Д., Парамзин А.С. // Изв. АН Тадж. ССР, отд. физ.-мат. и геол.-хим. наук. 1970. № 2. С. 66.
Икрами Д.Д., Парамзин А.С. // Журн. неорган. химии. 1971. Т. 16. № 11. С. 3121.
Икрами Д.Д., Парамзин А.С., Пирматова А.Н. и др. // Журн. неорган. химии. 1971. Т. 16. № 10. С. 2775.
Опаловский А.А., Федотова Т.Д. // Гидрофториды. Новосибирск: Наука, 1973. 147 с.
Лурье Ю.Ю. // Справочник по аналитической химии. М.: Химия, 1989. 448 с.
Новый справочник химика и технолога. Химическое равновесие. Свойства растворов / Под ред. Симановой С.А. СПб.: НПО “Профессионал”, 2004. 998 с.
Крешков А.П. // Основы аналитической химии. Теоретические основы. Количественный анализ. М.: Химия, 1970. 456 с.
Гаррелс Р.М., Крайст Ч.Л. Растворы, минералы, равновесия / Пер. с англ. под ред. Рябчикова И.Д., Щербины В.В. М.: Мир, 1968. 371 с.
Fedorov P.P., Luginina A.A., Alexandrov A.A. et al. // J. Fluor. Chem. 2021. V. 251. P. 109898. https://doi.org/10.1016/j.jfluchem.2021.109898
Shannon R., Rossi R. // Nature. 1964. V. 202. P. 1000. https://doi.org/10.1038/2021000a0
Гликин А.Э. Полиминерально-метасоматический кристаллогенез. СПб.: Нева, 2004. 231 с.
Федоров П.П., Осико В.В. // Докл. РАН. 2019. Т. 488. № 3. С. 253. [Fedorov P.P., Osiko V.V. // Dokl. Phys. 2019. V. 64. P. 353.] https://doi.org/10.1134/S1028335819090076
Thoma R.E. // Advances in molten salt chemistry. N.Y.–London: Plenum Press, 1975. V. 3. P. 275.
Ludekens W.L.W., Welch A.J.E. // Acta Crystallogr. 1952. V. 5. P. 841. https://doi.org/10.1107/S0365110X52002240
Bulou A., Nouet J., Hewat A.W., Schafer F.J. // Ferroelectrics. 1980. V. 25. P. 375.
Ratuszna A., Rousseau M., Daniel P. // Powder Diffr. 1997. V. 12. № 2. P. 70. https://doi.org/10.1017/S0885715600009453
Knight K.S., Darlington C.N.W., Wood I.G. // Powder Diffr. 2005. V. 20. № 1. P. 7. https://doi.org/10.1154/1.1835959
Knight K.S. // Can. Mineral. 2011. V. 49. P. 793. https://doi.org/10.3749/canmin.49.3.793
Jakymiw C., Vočadlo L., Dobson D.P. et al. // Phys. Chem. Minerals. 2018. V. 45. P. 311. https://doi.org/10.1007/s00269-017-0920-3
Ali A., Rahman A.U., Rahman G. // Phys. B. 2019. V. 565. P. 18. https://doi.org/10.1016/j.physb.2019.04.019
Кузнецов С.В., Александров А.А., Федоров П.П. // Неорган. материалы. 2021. Т. 57. № 6. С. 583. [Kuznetsov S.V., Alexandrov A.A., Fedorov P.P. // Inorg. Mater. 2021. V. 57. P. 555. https://doi.org/10.1134/S0020168521060078].
Li W., Liu Z., Zhou Z. et al. // J. Eur. Ceram. Soc. 2016. V. 36. № 14. P. 3481.
Liu X., Mei B., Li W. et al. // Ceram. Int. 2016. V. 42. № 11. P. 13285.
Liu L., Song J., Li W. et al. // Mater. Chem. Phys. 2018. V. 204. P. 345.
Liu Z., Jia M., Liu X. et al. // Mater. Lett. 2018. V. 227. P. 223.
Xie X., Mei B., Song J. et al. // Opt. Mater. 2018. V. 76. P. 111.
Li W., Huang H., Mei B., Song J. // Opt. Mater. 2018. V. 75. P. 7.
Yi G., Li W., Song J. et al. // Mater. Res. Bull. 2018. V. 102. P. 304.
Aballea P., Suganuma A., Druon F. et al. // Optica. 2015. V. 2. № 4. P. 288. https://doi.org/10.1364/OPTICA.2.000288
Sun Z., Mei B., Li W. et al. // J. Am. Ceram. Soc. 2016. V. 99. № 12. P. 4039.
Бучинская И.И., Федоров П.П. // Успехи химии. 2004. Т. 73. № 4. С. 404. [Buchinskaya I.I., Fedorov P.P. // Russ. Chem. Rev. 2004. V. 73. P. 371. https://doi.org/10.1070/RC2004v073n04ABEH000811]
Федоров П.П. // Журн. неорган. химии. 2021. Т. 66. № 10. С. 1371. [Fedorov P.P. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1455.] https://doi.org/10.1134/S0036023621100041
Федоров П.П., Маякова М.Н., Кузнецов С.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 11. С. 1529. [Fedorov P.P., Maykova M.N., Kuznetsov S.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 11. P. 1472.] https://doi.org/10.1134/S003602361611005X
Fedorov P.P., Mayakova M.N., Maslov V.A. et al. // Nanosystems: Physics, Chemistry, Mathematics. 2017. V. 8. № 6. P. 830. https://doi.org/10.17586/2220-8054-2017-8-6-830
Fedorov P.P. // Russ. J. Inorg. Chem. 2000. V. 45. Suppl. 3. P. S268.
Shannon R.D. // Acta Crystallogr., Sect. A. 1976. V. 32. № 5. P. 751.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии