Журнал неорганической химии, 2022, T. 67, № 3, стр. 373-383
Особенности строения одноядерных комплексов монодепротонированного гемигексафиразина с Y, La и Lu по данным квантово-химических расчетов
Ю. А. Жабанов a, *, Н. И. Гиричева b, М. К. Исляйкин a, c
a Ивановский государственный химико-технологический университет
153000 Иваново,
Шереметевский пр-т, 7, Россия
b Ивановский государственный университет
153025 Иваново, ул. Ермака, 39, Россия
c Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, ул. Академическая, 1, Россия
* E-mail: zhabanov@isuct.ru
Поступила в редакцию 08.09.2021
После доработки 27.09.2021
Принята к публикации 30.09.2021
- EDN: OEULKM
- DOI: 10.31857/S0044457X22030187
Аннотация
Молекулярная структура одноядерных нецентросимметричных комплексов Y, La и Lu с шестизвенным порфириноидом АВАВАВ-типа (гемигексафиразином, Н3Нhр) состава MН2Нhр изучена методом DFT. Обнаружено, что макроциклический лиганд в этих комплексах имеет плоское строение. Выполнен анализ распределения электронной плотности в молекулах MH2Hhp методами QTAIM и NBO. Показано, что в каждом комплексе образуются три координационные связи между атомом M и атомом азота пиррольного фрагмента и двумя атомами азота соседних тиадиазольных фрагментов. Лиганд H2Hhp является квазитридентатным несмотря на то, что комплексы MH2Hhp образованы замещением лишь одного атома водорода. Показано, что электронное строение комплексов МH2Hhp не соответствует общепринятым представлениям МI+H2HhpI– о степени окисления металла и лиганда в подобных структурах. На основании данных расчетов методом TDDFT установлено, что электронные спектры поглощения комплексов MH2Hhp содержат полосы поглощения в ИК-области, а комплексы могут обладать ярко выраженными донорными свойствами.
ВВЕДЕНИЕ
В последнее десятилетие повышенный интерес вызывают порфириноиды [1] с увеличенной координационной полостью [2].
Шестизвенные макрогетероциклические соединения АВАВАВ-типа, состоящие из последовательно чередующихся тиадиазольных (А) и пирролсодержащих (В) фрагментов, связанных мезо-атомами азота, – гемигексафиразины – обладают увеличенной координационной полостью и проявляют необычные по сравнению с порфиринами и фталоцианинами координационные свойства [3–7].
Впервые результаты прямого исследования структуры этого класса порфириноидов были получены для трет-бутилзамещенного макроцикла (C42H39N15S3) с помощью синхронного электронографического и масс-спектрометрического эксперимента и квантово-химических расчетов методом теории функционала электронной плотности (DFT) в 2008 г. [8]. Установлено, что молекула обладает симметрией C3h, а макроциклический остов имеет плоское строение. Тиадиазольные кольца ориентированы таким образом, что атомы серы направлены наружу макроциклической полости [8, 9]. Позднее плоское строение макроциклического остова было подтверждено результатами исследования незамещенного H3Hhp методом газовой электронографии [10]. В 2010 году основные структурные параметры этих соединений (плоский макроцикл и ориентация атомов серы наружу) были подтверждены методом рентгеноструктурного анализа кристалла гексапентаоксизамещенного макроцикла [3]. Сформированная таким образом внутренняя макроциклическая полость имеет увеличенные по сравнению с порфиринами и фталоцианинами размеры и может быть разделена на три самостоятельных хелатоподобных координационных “кармана”. Таким образом, гемигексафиразины (Hhps) способны координировать три атома переходных металлов или один атом большого радиуса. В последнем случае координация может проходить с образованием как центросимметричного, так и нецентросимметричного комплекса.
Таким образом, показано, что присутствие заместителей практически не оказывает влияния на строение макроциклического остова Hhps, поэтому теоретические исследования таутомерных превращений с участием внутрициклических атомов водорода можно проводить с использованием незамещенного макроцикла в качестве модельного соединения [10, 11].
Гемигексафиразины можно считать структурными аналогами гексафирина [12] с увеличенной внутренней полостью, которая может вмещать атомы переходных металлов (например, Ni2+, Cu2+, Co2+ [12–14] или La3+ [15]). Их свойства представляют большой интерес в связи с необычной структурой образующихся координационных соединений.
Впервые формирование нецентросимметричного комплекса H2Hhp– с Dy на поверхности Au(111) обнаружено методом сканирующей туннельной микроскопии (СТМ) в работе [4]. Структура замещенных металлокомплексов M3Hhp (M = Cu, Co, Ni) была изучена методом СТМ в работе [6], а восстановленных форм Ni3OHhp и Cu3OHhp – методом рентгеноструктурного анализа в работе [7]. Особенности строения комплексов гемигексафиразина с МHhp (M = Y, La, Lu) были изучены с помощью квантово-химических расчетов [16].
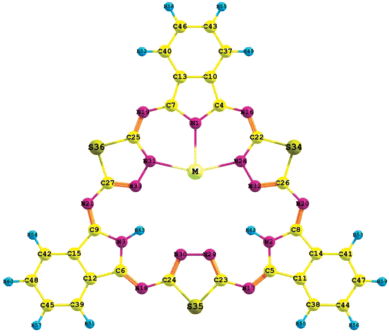
В настоящей работе объектами исследования являлись нецентросимметричные комплексы МH2Hhp (M = Y, La, Lu), в которых лишь один атом водорода во внутренней полости Hhp замещен атомом металла. Подобный комплекс DyH2Hhp, обнаруженный методом СТМ в работе [4], является наиболее энергетически устойчивым, по данным DFT-расчетов, среди структур, рассмотренных в реакции металлирования (рис. 5 в работе [4]).
ДЕТАЛИ КВАНТОВО-ХИМИЧЕСКИХ РАСЧЕТОВ
Исследование структуры молекул нецентрированных металлокомплексов МH2Hhp (М = Y, La, Lu) (рис. 1) выполнено методом теории функционала плотности (DFT, гибридный функционал B3LYP) с использованием базисных наборов cc-pVTZ [17, 18] для описания электронных оболочек атомов C, N, S, H. Электронные оболочки атомов металлов описывали с помощью квазирелятивистских псевдопотенциалов в комбинации с соответствующими базисными наборами. Для атома Y использовали псевдопотенциал и базис cc-pVTZ-PP [19], для La – комбинацию псевдопотенциала и базис Def2-TZVPP [20], для атома Lu – валентно-трехэкспонентный базис [21, 22] и псевдопотенциал [23], разработанные штутгартской группой. Во всех трех случаях базисные наборы использовали для описания 11 валентных электронных оболочек. Все расчеты проводили с помощью программного пакета Firefly 8.1 [24], частично основанного на исходном коде программы GAMESS (US) [25]. Распределение электронной плотности анализировали с помощью метода QTAIM [26] (квантовая теория атомов в молекулах) с использованием пакета программ AIMAll [27] и NBO-анализа [28].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Формально степень окисления металла в комплексах МH2Hhp (M = Y, La, Lu) равна +1, а в комплексах МHhp – +3. В этой связи сравнение геометрического и электронного строения двух типов комплексов позволит проследить, насколько реализуются общепринятые представления о степени окисления металла и лиганда в подобных структурах.
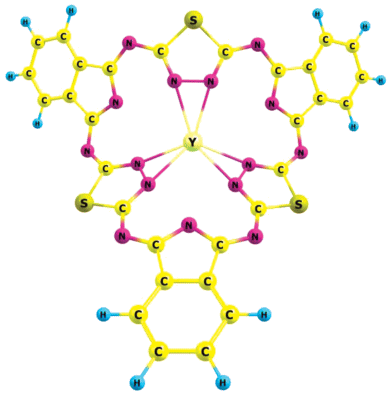
Комплексы МHhp (рис. 2) имеют неплоское строение [16], причиной которого является соотношение размеров большой координационной полости лиганда Hhp3– и относительно малого размера иона М3+. Подстройка лиганда Hhp3– к М3+ происходит путем стягивания трех донорных единиц Nt–Nt к центральному иону, сопровождающегося поворотом плоскостей гетероциклических фрагментов лиганда.
В комплексах МH2Hhp координирующая полость, определяемая пространством между атомом азота депротонированного изоиндольного и двумя атомами азота соседних тиадиазольных фрагментов, существенно меньше, чем координационная полость в комплексах МHhp.
Для инкорпорирования в ограниченное координационное пространство ион металла должен иметь возможно малый размер, который, как известно, уменьшается при увеличении на нем положительного заряда (увеличении степени окисления металла).
При рассмотрении особенностей строения комплексов МH2Hhp можно выделить два фактора: стерический, направленный на искажение геометрического строения лиганда при внедрении М+, и электронный, при котором происходит уменьшение размера иона металла за счет передачи электронной плотности с его валентных орбиталей на лиганд. Рассмотрим оба фактора.
Геометрическое строение комплексов МH2Hhp
По данным квантово-химических расчетов, комплексы YH2Hhp и LaH2Hhp имеют плоское строение (симметрия C2v и Cs соответственно), а комплекс LuH2Hhp – геометрическое строение (симметрия C2) c незначительным (до 3°) искажением макроцикла типа рафлинг.
В комплексе LaH2Hhp атом La смещен от оси C2 на 0.006 Å. Однако величина барьера между структурами симметрии Cs и C2v составляет всего 0.54 кДж/моль, при этом энергия нулевого колебания, связанного со смещением атома La в плоскости макроцикла, приводящего к понижению симметрии, составляет 0.37 кДж/моль. Энергия нулевого колебания сопоставима с величиной барьера V (Cs → C2v) (0.54 кДж/моль). Таким образом, комплекс лантана следует считать структурно нежестким.
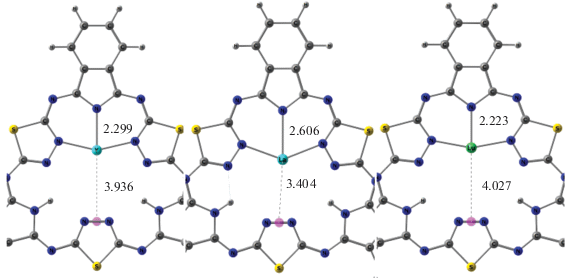
Положение металла внутри малой координирующей полости относительно изоиндольного и тиадиазольного фрагментов изменяется в зависимости от природы атома металла. Величина расстояния между металлом и точкой в центре связи Nt–Nt противоположного тиадизольного фрагмента (рис. 3) является наибольшей в случае металлокомплекса с Lu (4.027 Å) и наименьшей в случае металлокомплекса с La (3.404 Å). При этом расстояние от атома азота изоиндольного фрагмента до центра связи Nt–Nt противоположного тиадиазольного цикла изменяется от 6.25 до 6.01 Å.
Рис. 3.
Положение атома металла (Y, La, Lu) внутри координационной полости комплексов МH2Hhp (расстояния даны в Å).
Следует отметить интересный факт: периметр внутреннего контура макроцикла (рис. 4) остается постоянным и равным 36.2(2) Å (табл. 1) независимо от природы металла и симметрии металлокомплексов и таким же, как в комплексах MHhp (M = Y, La, Lu), в ионе лиганда Нhр3– и в безметальном соединении H3Hhp [16].
Плоское (или близкое к таковому – Lu) строение комплексов МH2Hhp позволяет заключить, что ион Мn+ имеет объем, соответствующий размеру координационной полости.
Природа координационных связей в комплексах МH2Hhp. Заряд на атоме М
Во всех рассмотренных комплексах атом металла смещен в сторону депротонированного изоиндольного фрагмента (рис. 1 и 3). В этом положении атом М образует три координационные связи (M–N1, M–N28 и M–N31) с атомами азота, о чем свидетельствует наличие критических точек между данными атомами по результатам анализа электронной плотности методом QTAIM (рис. 5). По величинам порядков связей M–N1, M–N28 и M–N31, оцененных по схеме Вайберга в рамках NBO-анализа, и индексов делокализации электронов, полученных методом QTAIM (табл. 2), можно судить, что эти связи наряду с ионной составляющей имеют заметную ковалентную составляющую. В то же время между металлом и атомами азота N32 и N33 координационные связи не образуются, о чем свидетельствует отсутствие критических точек (рис. 5), а также данные NBO-анализа (табл. 2).
Рис. 5.
Распределение электронной плотности в молекулах МH2Hhp (M = Y, La, Lu) в плоскости макроцикла по данным метода QTAIM. Критические точки связи – зеленые, критические точки кольца – красные.
Таблица 2.
Межъядерные расстояния (R, Å), порядки связей (B), оцененные по схеме Вайберга, сумма энергий ΣE(2) (ккал/моль) взаимодействия между неподеленными электронными парами атомов азота и акцепторными орбиталями центрального атома М по данным NBO-анализа, индексы делокализации электронов δ(A,B) по данным метода QTAIM
| Связь | R | B | δ(A,B) | ΣE(2) |
|---|---|---|---|---|
| YH2Hhp | ||||
| Y–N1 | 2.299 | 0.37 | 0.48 | 66.18 |
| Y–N28 | 2.183 | 0.34 | 0.50 | 77.24 |
| Y–N32 | 2.881 | 0.10 | 0.07 | 10.22 |
| LaH2Hhp | ||||
| La–N1 | 2.606 | 0.15 | 0.38 | 20.51 |
| La–N28 | 2.325 | 0.18 | 0.51 | 35.2 |
| La–N31 | 2.338 | 0.21 | 0.54 | 38.2 |
| La–N32 | 2.851 | 0.06 | 0.12 | 5.4 |
| La–N33 | 2.977 | 0.04 | 0.08 | 3.44 |
| LuH2Hhp | ||||
| Lu–N1 | 2.223 | 0.38 | 0.53 | 61.17 |
| Lu–N28 | 2.167 | 0.32 | 0.49 | 70.11 |
| Lu–N32 | 2.912 | 0.06 | 0.06 | 4.37 |
В комплексах МH2Hhp и MHhp (рис. 1 и 2 соответственно) атомы металлов являются трехкоординированными, однако в комплексах MHhp донорными единицами являются неподеленные пары атомов азота связи Nt–Nt трех тиадиазольных фрагментов [16], а в комплексах МH2Hhp – неподеленные пары атомов азота N1, N28, N31. В комплексах MHhp донорные единицы практически симметрично окружают центральный атом. В комплексах МH2Hhp донорные атомы расположены близко друг к другу и три координационные связи “образуют” Т-образную структуру.
Электронная конфигурация атома металла в ряду YH2Hhp, LaH2Hhp, LuH2Hhp отличается в основном заселенностью d-орбиталей (табл. 3). Электронная конфигурация донорных атомов азота почти одинаковая в комплексах МH2Hhp. Судя по суммарной энергии донорно-акцепторного взаимодействия ΣE(2) между неподеленными парами атомов азота и d-орбиталями атомов металлов (табл. 2), комплекс лантана намного менее прочный, чем комплексы Y и Lu. Это связано с положением атома La в координационной полости макроцикла. Из табл. 2 видно, что расстояние La–N1 длиннее, чем аналогичные расстояния в комплексах Y и Lu, на ~0.3 Å. Причиной таких больших различий является размер атома металла. Отметим, что ионные радиусы Y и Lu близки, что отражается в близости длин связей Y–N1 и Lu–N1.
Таблица 3.
NPA-заряды на атомах (Q) и электронные конфигурации атомов по данным NBO-анализа, заряды на атомах (q), полученные методом QTAIM в комплексах МH2Hhp (M = Y, La, Lu)
| Атом | Q (NBO) | q (AIM) | Электронная конфигурация |
|---|---|---|---|
| YH2Hhp | |||
| Y | 2.03 | 2.08 | [core]5s0.094d0.775p0.10 |
| N1 | –0.77 | –1.19 | [core]2s1.412p4.35 |
| N28 | –0.61 | –0.87 | [core]2s1.382p4.21 |
| N32 | –0.37 | –0.79 | [core]2s1.372p3.97 |
| LaH2Hhp | |||
| La | 2.45 | 2.11 | [core]6s0.064f0.075d0.43 |
| N1 | –0.82 | –1.15 | [core]2s1.432p4.36 |
| N28 | –0.65 | –0.86 | [core]2s1.382p4.22 |
| N32 | –0.45 | –0.79 | [core]2s1.382p4.03 |
| N31 | –0.71 | –0.85 | [core]2s1.412p4.26 |
| N33 | –0.42 | –0.80 | [core]2s1.372p4.01 |
| LuH2Hhp | |||
| Lu | 2.13 | 2.08 | [core]6s0.145d0.666p0.07 |
| N1 | –0.80 | –1.20 | [core]2s1.412p4.38 |
| N28 | –0.64 | –0.86 | [core]2s1.392p4.23 |
| N32 | –0.38 | –0.79 | [core]2s1.382p3.97 |
В отличие от комплексов MHhp, среди которых комплекс LaHhp является наиболее прочным и жестким [16], в ряду комплексов MH2Hhp комплекс LaH2Hhp является менее прочным и обладает наименьшей жесткостью.
В комплексах MHhp размер атома La в большей степени, чем размеры Y и Lu, соответствует размеру увеличенной координационной полости, и это приводит к меньшему структурному искажению от оптимальной структуры безметального лиганда. Напротив, в комплексах МH2Hhp размер атома La оказывается слишком большим для полости между двумя тиадиазольными и изоиндольным фрагментами.
В комплексах MHhp на атомах Y, La и Lu NPA-заряды составляют 2.24, 2.26 и 2.25 (работа [16], табл. 3). В комплексах МH2Hhp эти заряды равны 2.03, 2.45 и 2.13 (табл. 3), что также намного больше, чем +1, и это не соответствует ожидаемой степени окисления атома металла в монодепротонированном лиганде. Данные заряды в комплексах МH2Hhp близки к зарядам на атомах М в комплексах с трижды депротонированным лигандом (MHhp).
При этом в лиганде H2Hhp происходит увеличение электронной плотности на атомах N1, N28, C7, C4, S36, S34 за счет ее переноса с атома металла. Это увеличение в сумме соответствует ~1.2 электрона. Именно такое перераспределение электронной плотности приводит к большому положительному заряду на атоме М и возникновению большого дипольного момента в комплексах МH2Hhp (в случае Y, La, Lu μ = 11.4, 9.2, 11.0 D соответственно), в отличие от дипольного момента в комплексах MHhp, близкого к нулю.
Таким образом, электронное строение комплексов МH2Hhp не соответствует общепринятым представлениям о степени окисления металла и лиганда МI+H2HhpI– в подобных структурах.
Внутримолекулярные водородные связи в комплексах МH2Hhp
Во всех трех комплексах МH2Hhp (М = Y, La, Lu) существуют бифуркатные внутримолекулярные водородные связи (ВМВС) N32…H62 и N29…H62 (N33…H63 и N30…H63), причем первая связь прочнее второй (табл. 4), о чем свидетельствуют данные NBO-анализа и результаты QTAIM (рис. 5). На рис. 6 показано взаимодействие неподеленной пары атома азота с σ*-орбиталью связи N2–H62. ВМВС в комплексе La более прочные, чем в комплексах Y и Lu, из-за меньшего расстояния от атома N1 до центра связи Nt–Nt (рис. 3, табл. 4).
Таблица 4.
Характеристики внутримолекулярных ВС. Межъядерные расстояния (R, Å), порядки связей (B), оцененные по схеме Вайберга, сумма энергий ΣE(2) (ккал/моль) взаимодействия между неподеленными электронными парами атомов азота и акцепторными орбиталями σ*(N–H) по данным NBO-анализа (рис. 6), индексы делокализации электронов δ (A,B) по данным метода QTAIM
| Связь | R | B | δ(A,B) | ΣE(2) |
|---|---|---|---|---|
| YH2Hhp | ||||
| N32–H62 | 2.114 | 0.02 | 0.06 | 3.69 |
| N29–H62 | 2.236 | 0.01 | 0.05 | 2.88 |
| LaH2Hhp | ||||
| N32–H62 | 2.006 | 0.03 | 0.07 | 6.82 |
| N29–H62 | 2.355 | 0.01 | 0.04 | 2.08 |
| N33–H62 | 1.964 | 0.03 | 0.07 | 8.47 |
| N30–H62 | 2.256 | 0.01 | 0.04 | 3.19 |
| LuH2Hhp | ||||
| N32–H62 | 2.107 | 0.02 | 0.06 | 4.37 |
| N29–H62 | 2.243 | 0.01 | 0.04 | 2.98 |
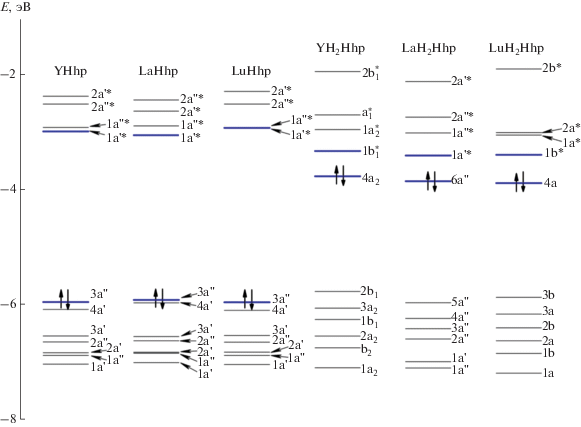
Граничные орбитали комплексов MHhp и МH2Hhp
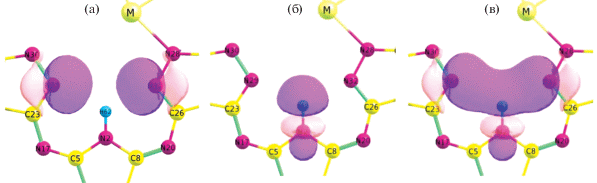
На рис. 7 представлена энергетическая диаграмма молекулярных орбиталей для комплексов MHhp и МH2Hhp. Из диаграммы видно, что при переходе от комплексов MHhp к МH2Hhp происходит снижение энергии низшей свободной молекулярной орбитали (НСМО) и существенное повышение энергии высшей занятой молекулярной орбитали (ВЗМО), что увеличивает как донорные, так и акцепторные свойства комплексов МH2Hhp. Вид ВЗМО и НСМО комплексов MHhp и МH2Hhp показан на рис. 8.
Рис. 8.
Формы высших занятых и нижних свободных молекулярных орбиталей для MHhp и МH2Hhp (М = Y, La, Lu).
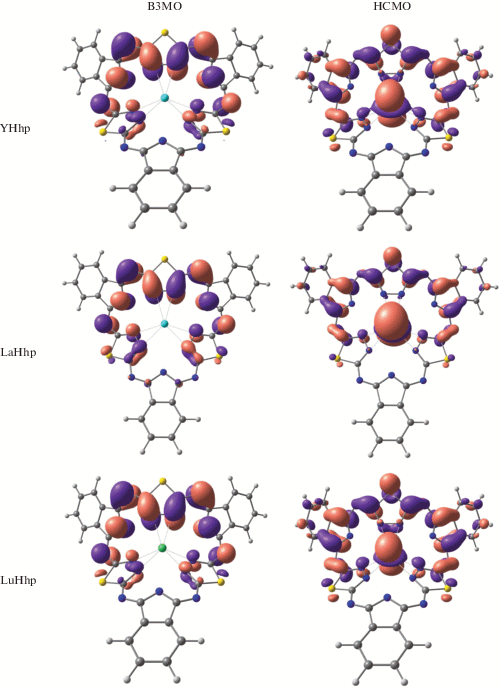
Рис. 8.
Окончание.
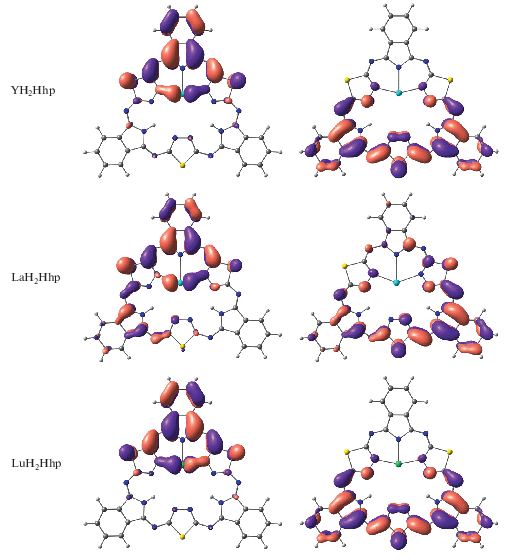
ВЗМО комплексов MHhp является линейной комбинацией атомных орбиталей лиганда. В комплексах МH2Hhp ВЗМО, кроме того, включает р-АО металла и носит связывающий характер в области М–N28. В комплексах MHhp основной вклад в НСМО вносят dz2-атомные орбитали металла, в то время как в комплексах МH2Hhp НСМО представляет линейную комбинацию атомных орбиталей тех гетероциклических фрагментов, которые не вовлечены в образование координационных связей.
В комплексах MHhp при переходе ВЗМО → → НСМО происходит перенос заряда от лиганда на центральный атом. В комплексах МH2Hhp также происходит перенос заряда: от части лиганда с координационными связями и повышенной электронной плотностью (сумма NPA-зарядов на атомах Σq = –1.47е) на ту часть лиганда, в которой такие связи отсутствуют (Σq = –0.56е). Малая ширина энергетической щели ВЗМО–НСМО комплексов МH2Hhp проявляется в наличии полос поглощения в длинноволновой области электронного спектра и указывает на возможность проявления полупроводниковых свойств этих соединений.
Электронные спектры поглощения по данным TDDFT-расчетов
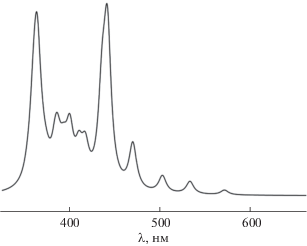
Электронные спектры поглощения комплексов MHhp (М = Y, La, Lu) можно охарактеризовать как типичные, содержащие полосы поглощения в видимой и ультрафиолетовой областях. Для примера на рис. 9 представлен рассчитанный электронный спектр металлокомплекса LaHhp.
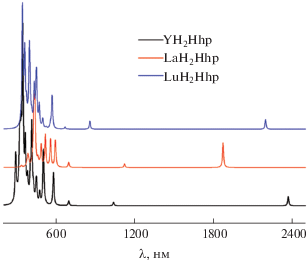
Было проведено моделирование электронных спектров комплексов МH2Hhp (М = Y, La, Lu) на основе результатов TDDFT-расчетов. Расчеты методом TDDFT были проведены для 20 возбужденных состояний в приближении B3LYP/cc-pVTZ. Смоделированные на основании TDDFT-расчетов электронные спектры поглощения для молекул МH2Hhp (М = Y, La, Lu) представлены на рис. 10. Вследствие того, что энергетическая щель НСМО–ВЗМО для данных молекул составляет всего ~0.5 эВ (рис. 7), электронный спектр этих молекул имеет полосы поглощения в диапазоне 1800–2400 нм, что соответствует 5555–4166 см–1 (рис. 10).
ЗАКЛЮЧЕНИЕ
Методами квантовой химии изучено строение асимметричных металлокомплексов однократно депротонированного гемигексафиразина с Y, La и Lu. Установлено, что металлокомплекс с Y обладает равновесной структурой симметрии C2v, а комплексы с лантаном и лютецием имеют геометрическое строение симметрии Cs и C2 соответственно с плоским или близким к плоскому лигандом. На основании анализа распределения электронной плотности методами NBO и QTAIM было установлено, что в рассмотренных комплексах металл образует с лигандом три координационные связи несмотря на то, что комплексы сформированы в результате замещения лишь одного атома водорода.
Показано, что электронное строение комплексов МH2Hhp не соответствует общепринятым представлениям о степени окисления металла и лиганда МI+H2HhpI– в подобных структурах. Отмечено, что при переходе от комплексов MHhp к МH2Hhp происходит снижение энергии НСМО и существенное повышение энергии ВЗМО, что увеличивает как донорные, так и акцепторные свойства комплексов МH2Hhp. По данным TDDFT-расчетов, в электронных спектрах этих металлокомплексов следует ожидать появления полос поглощения в ближнем ИК-диапазоне.
Список литературы
Bottari G., de la Torre G., Guldi D.M. et al. // Coord. Chem. Rev. 2021. V. 428. P. 213605. https://doi.org/10.1016/J.CCR.2020.213605
Saito S., Osuka A. // Angew. Chem. Int. Ed. 2011. V. 50. № 19. P. 4342. https://doi.org/10.1002/anie.201003909
Trukhina O.N., Rodríguez-Morgade M.S., Wolfrum S. et al. // J. Am. Chem. Soc. 2010. V. 132. № 37. P. 12991.
Cirera B., Trukhina O., Björk J. et al. // J. Am. Chem. Soc. 2017. V. 139. № 40. P. 14129. https://doi.org/10.1021/jacs.7b06406
Konarev D.V., Khasanov S.S., Islyaikin M.K. et al. // Chem. - An Asian J. 2020. V. 15. № 1. P. 61.https://doi.org/10.1002/asia.201901518
Bacilla A.C.C., Okada Y., Yoshimoto S. et al. // Bull. Chem. Soc. Jpn. 2020. V. 94. P. 34. https://doi.org/10.1246/bcsj.20200188
Nazarov D.I., Islyaikin M.K., Ivanov E.N. et al. // Inorg. Chem. 2021. V. 7. P. 35. https://doi.org/10.1021/acs.inorgchem.1C01132
Zakharov A.V., Shlykov S.A., Bumbina N.V. et al. // Chem. Commun. 2008. P. 3573.
Zakharov A.V., Shlykov S.A., Danilova E.A. et al. // Phys. Chem. Chem. Phys. 2009. V. 11. P. 8570.
Zhabanov Y.A., Zakharov A.V., Shlykov S.A. et al. // J. Porphyr. Phthalocyanines. 2013. V. 17. № 3. P. 220. https://doi.org/doi:10.1142/S1088424613500144
Otlyotov A.A., Veretennikov V.V., Merlyan A.P. et al. // Macroheterocycles. 2019. V. 12. № 2. P. 209.https://doi.org/10.6060/mhc190443o
Islyaikin M.K., Danilova E.A., Yagodarova L.D. et al. // Org. Lett. 2001. V. 3. № 14. P. 2153.
Sessler J.L., Seidel D. // Angew. Chem. Int. Ed. 2003. V. 42. № 42. P. 5134.
Danilova E., Islyaikin M. // Maroheterocycles. 2012. V. 5. № 2. P. 157. https://doi.org/10.6060/mhc2012.120577i
Бумбина Н.В., Данилова Е.А., Исляйкин М.К. // Изв. вузов. Химия и хим. технология. 2008. V. 51. № 6. P. 15.
Zhabanov Y.A., Giricheva N.I., Zakharov A.V. et al. // J. Mol. Struct. 2017. V. 1132. https://doi.org/10.1016/j.molstruc.2016.07.033
Dunning J. // J. Chem. Phys. 1989. V. 90. № 2. P. 1007.
Woon D.E., Dunning T.H.J. // J. Chem. Phys. 1993. V. 98. № 2. P. 1358.
Figgen D., Peterson K.A., Dolg M. et al. // J. Chem. Phys. 2009. V. 130. № 16. P. 124101. https://doi.org/10.1063/1.3119665
Weigend F., Ahlrichs R. // Phys. Chem. Chem. Phys. Des. Assess. accuracy. 2005. V. 7. № 18. P. 3297.
Yang J., Dolg M. // Theor. Chem. Acc. 2005. V. 113. № 4. P. 212.
Weigand A., Cao X., Yang J. et al. // Theor. Chem. Acc. 2009. V. 126. № 3. P. 117. https://doi.org/10.1007/s00214-009-0584-2
Dolg M., Stoll H., Savin A. et al. // Theor. Chim. Acta. 1989. V. 75. № 3. P. 173.
Granovsky A.A. // Firefly, version 8. http://classic.chem.msu.su/gran/firefly/index.html, (accessed May 12, 2021)
Schmidt M.W., Baldridge K.K., Boatz J.A. et al. // J. Comput. Chem. 1993. V. 14. № 11. P. 1347.
Bader R.F.W. // Atoms in Molecules: A Quantum Theory. Oxford University Press, Clarendon Press, 1990. https://global.oup.com/academic/product/atoms-in-molecules-9780198558651?cc=in&lang=en& (accessed March 12, 2020)
Keith T.A. // AIMAll, TK Gristmill Software http://aim.tkgristmill.com/references.html (accessed March 13, 2020)
Weinhold F., Landis C.R. // Chem. Educ. Res. Pract. 2001. V. 2. № 2. P. 91. https://doi.org/10.1039/B1RP90011K
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии