Журнал неорганической химии, 2022, T. 67, № 3, стр. 416-422
Золь-гель синтез пористых углеродных материалов с использованием нанокристаллической целлюлозы в качестве темплата
М. И. Воронова a, *, О. В. Суров a, Н. В. Рублева a, А. Г. Захаров a
a Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, ул. Академическая, 1, Россия
* E-mail: miv@isc-ras.ru
Поступила в редакцию 09.09.2021
После доработки 06.10.2021
Принята к публикации 11.10.2021
- EDN: WIUENZ
- DOI: 10.31857/S0044457X22030163
Аннотация
Для получения пористых углеродных материалов (ксерогелей и аэрогелей) применен золь-гель метод с использованием нанокристаллической целлюлозы (НКЦ) в качестве темплата. Метод включает золь-гель синтез неорганической матрицы кремнезема (с использованием тетраэтоксисилана в качестве прекурсора SiO2) и карбонизацию НКЦ в инертной атмосфере с последующим удалением SiO2 кипячением в растворе щелочи. Изучены факторы, определяющие формирование пористой структуры углерода, и проведены исследования полученных пористых углеродных материалов.
ВВЕДЕНИЕ
При всем многообразии методов получения пористых углеродных материалов (ПУМ), обусловленном широчайшей областью их применения, двойной темплатный золь-гель синтез имеет неоспоримые преимущества. Он очень прост и надежен и дает хорошо воспроизводимые результаты. Данный метод включает смешивание суспензии органического темплата с совместимым прекурсором неорганической матрицы для формирования наноструктурированного композиционного материала [1–3]. Карбонизация темплата с последующим удалением неорганической матрицы дает пористый углеродный материал, свойства которого во многом определяются условиями формирования матрицы и свойствами темплата. При двойном темплатном синтезе (жестком темплатинге, нанокастинге) структурные особенности темплата и матрицы определяют свойства получаемого пористого углеродного материала, что позволяет получать материалы с регулируемыми пористостью и удельной поверхностью. При этом регулирование структуры углеродного материала осуществляется путем изменения размеров и концентрации темплата, концентрации прекурсора, а также природы растворителя, pH, ионной силы и температуры [4].
В работе в качестве темплата использовали частицы нанокристаллической целлюлозы (НКЦ), а в качестве прекурсора для получения неорганической матрицы кремнезема – тетраэтоксисилан.
Нанокристаллическая целлюлоза может быть выделена кислотным гидролизом из целлюлозосодержащего сырья. Частицы НКЦ имеют анизотропную стержнеобразную форму (диаметр 5−200 нм, длина 100−300 нм в зависимости от источника целлюлозы и условий гидролиза) [5–9], большой поверхностный заряд, высокую механическую прочность [10]. Физико-химические свойства НКЦ и возможность ее химической модификации [11, 12] привлекают внимание исследователей в связи с разработкой новых функциональных материалов [13–18]. В силу сочетания свойств (анизотропная форма частиц, поверхностный заряд, большая площадь поверхности) НКЦ в последнее время широко применяется в темплатном синтезе пористых материалов [19–23].
В литературе описаны методы получения углеродных аэрогелей с использованием нанофибриллярной и бактериальной целлюлозы [24–28]. Такие материалы обладают набором уникальных физических свойств (низкая плотность, высокая электропроводность, большие пористость и удельная поверхность), что делает их очень перспективными с точки зрения разработки материалов, используемых в качестве носителей катализаторов, электродов суперконденсаторов, адсорбентов, газовых сенсоров и т.д. Однако получению углеродных материалов с использованием НКЦ, на наш взгляд, уделяется недостаточно внимания [29, 30].
Цель настоящей работы – изучить влияние условий двойного темплатного золь-гель синтеза с использованием НКЦ в качестве темплата на свойства ПУМ (ксерогелей и аэрогелей).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Для получения водных суспензий НКЦ использовали коммерческую микрокристаллическую целлюлозу (МКЦ) (Cellulose, powder ~20 micron, Sigma-Aldrich). В качестве прекурсора кремнезема применяли тетраэтоксисилан (ТЭОС) (tetraethyl orthosilicate, C8H20O4Si, ≥99%, Merck). В работе использовали NaOH (х. ч., АО “Химреактив”), серную кислоту (х. ч., ГОСТ 4204-77, Химмед) и бидистиллированную воду.
Синтез объектов исследования
Получение НКЦ. Водные суспензии НКЦ были получены сернокислотным гидролизом МКЦ методом, описанным ранее [31]. Гидролиз МКЦ (концентрация суспензии 0.025 г/мл) проводили в растворе серной кислоты (62%) при 50°С в течение 2 ч при интенсивном перемешивании. После гидролиза суспензию отмывали водой с использованием повторяющихся циклов центрифугирования (10 мин при 8000 об/мин), т.е. надосадочную жидкость отделяли от осадка и добавляли новую порцию воды. Этап центрифугирования прекращали после 5−6 промывок, пока промывная вода не сохраняла постоянное значение рН. Далее суспензию НКЦ обрабатывали ультразвуком (Sonorex DT100 Bandelin) в течение 15–30 мин. Выход НКЦ составлял 30–35%. При необходимости концентрацию водной суспензии НКЦ изменяли добавлением или испарением воды с помощью ротационного испарителя. Концентрацию водной суспензии НКЦ определяли гравиметрическим методом. После отмывки суспензия имела значение рН ~ 2.4 вследствие наличия поверхностных групп –OSO3H.
Получение пористого углерода
Получение пористого углерода включает следующие стадии.
1. Получение композитов НКЦ/SiO2. Композиты НКЦ/SiO2 получали смешиванием водной суспензии НКЦ (рН 2.2–2.4) с ТЭОС при перемешивании на магнитной мешалке с последующим гидролизом при температуре 60°C в течение 3 ч. Сушкой геля НКЦ/SiO2 на воздухе при комнатной температуре в течение 36–48 ч были получены композитные пленки (ксерогели) НКЦ/SiO2, сублимационной сушкой геля НКЦ/SiO2 – аэрогели НКЦ/SiO2. Сублимационную сушку проводили при давлении 6–10 Па и температуре коллектора –50°С в течение 36 ч.
2. Пиролиз и получение композитов С/SiO2. Пиролиз композитов НКЦ/SiO2 проводили в муфельной печи в атмосфере азота (скорость подачи азота 20 мл/мин) по следующей программе: нагрев до 100°С со скоростью 2 град/мин, выдержка в течение 2 ч при 100°С, нагрев до 900°С со скоростью 2 град/мин, выдержка 4 ч при 900°С. Затем образцы медленно охлаждали до комнатной температуры в атмосфере азота.
3. Получение пористого углерода. Углерод получали удалением SiO2 путем кипячения композитов С/SiO2 в 2 М NaOH при 90°С в течение 4 ч. После охлаждения образцы фильтровали и промывали большим количеством воды. Удаление кремнезема контролировали по данным элементного анализа. Элементный анализ показал содержание углерода ~95–97%, кислорода ~3–5% и следы натрия и кремния.
Методы физико-химического анализа
Сканирующая электронная микроскопия (СЭМ), электронная спектроскопия для химического анализа. Морфология образцов изучена с использованием сканирующего электронного микроскопа VEGA3 TESCAN (Чехия). Исследование проводили с использованием детектора вторичных электронов при ускоряющем напряжении 5 кВ в режиме высокого вакуума. Элементный состав определяли методом рентгеновского энергодисперсионного анализа с помощью спектрометра X-Max 6 (Oxford Instruments NanoAnalysis) с использованием детектора x-ACT. Диапазон анализируемых элементов: 4Be–94Pu. Данное оборудование обеспечивает высокую точность анализа (разрешающая способность соответствует стандарту ISO156 32:2012).
Пористая структура композитов изучена методом низкотемпературной адсорбции азота (анализатор удельной поверхности и пористости NOVAtouch NT LX, Quantachrome, США). Образцы выдерживали под вакуумом в течение 3 ч при температуре 50°С. Адсорбционные и десорбционные изотермы измеряли при –196°C в интервале относительных давлений p/p0 от 0.01 до 0.95. Удельную поверхность рассчитывали по адсорбционной изотерме методом БЭТ. Распределение пор по размерам и объем пор определяли методом BJH.
Адсорбционные характеристики. Адсорбцию насыщенных паров воды и органических растворителей на образцах измеряли при температуре 25°C. Содержание адсорбата в образцах определяли гравиметрически.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Данные, приведенные в табл. 1, демонстрируют эволюцию пористой структуры композитов в процессе получения аэрогеля углерода. На рис. 1 показаны низкотемпературные изотермы адсорбции–десорбции азота и распределение пор по размерам для соответствующих образцов.
Таблица 1.
Изменение пористой структуры композитов в процессе получения аэрогеля углерода
| Образец | Sуд (BET), м2 /г | Vп (BJH), см3/г | Rп (BJH), нм |
|---|---|---|---|
| 1. НКЦ/SiO2-А, 1 стадия | 30 | 0.036 | – |
| 2. С/SiO2-А, 2 стадия | 118 | 0.094 | 2.4 |
| 3. С-А, 3 стадия | 585 | 0.456 | 1.9 |
| 4. SiO2-А | 276 | 0.302 | 2.5 |
| 5. С(НКЦ)-А | 355 | 0.015 | <2.0 |
Рис. 1.
Изотермы адсорбции (темные значки) и десорбции (светлые значки) азота (77 K) (а) и соответствующее распределение пор по размерам (б), рассчитанное по десорбционной ветви методом BJH, для исследованных образцов. Нумерация образцов соответствует приведенной в табл. 1.
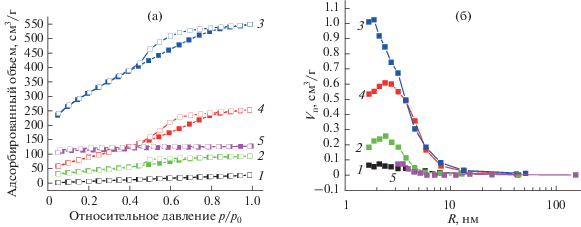
Для получения композита НКЦ/SiO2-А (аэрогель) использовали водную суспензию НКЦ с концентрацией 18 г/л и рН 1.65. Содержание НКЦ в лиофилизированном композите составляет 45%, образец имеет маленькую удельную поверхность – 30 м2/г (табл. 1, образец 1). Пиролиз в атмосфере азота приводит к образованию углерода на поверхности пористого кремнезема, вследствие чего удельная поверхность увеличивается до 118 м2/г (образец 2). Удаление кремнезема приводит к формированию развитой пористой структуры углерода с большой удельной поверхностью – 585 м2/г (образец 3). Для сравнения в табл. 1 приведены также характеристики образцов кремнезема (образец 4 получен из композита НКЦ/SiO2-А термическим удалением НКЦ в процессе прокаливания на воздухе) и углерода, полученного пиролизом аэрогеля чистой НКЦ (образец 5). Из табл. 1 видно, что углерод, полученный двойным темплатингом, имеет значительно бóльшую удельную поверхность и объем пор, чем кремнезем в составе исходного композита или углерод, полученный пиролизом аэрогеля НКЦ.
По форме низкотемпературные изотермы адсорбции–десорбции азота на образце 3 можно отнести к IV типу по классификации Брунауэра [32], характерному для мезопористых материалов (рис. 1). Удельная поверхность аэрогеля углерода значительно выше, чем кремнезема, полученного из той же исходной смеси водной суспензии НКЦ с ТЭОС. Углеродный материал, полученный из чистой НКЦ (в отсутствие кремнезема), обладает микропористой структурой (I тип изотермы адсорбции). Поэтому можно предположить, что мезопористую структуру углеродный материал приобретает за счет темплата SiO2.
В табл. 2 приведены характеристики пористой структуры углеродных материалов, полученных из композитов НКЦ/SiO2 с различным содержанием НКЦ (от 30 до 60%).
Таблица 2.
Характеристики пористой структуры углеродного материала
| № образца | Содержание НКЦ в композите НКЦ/SiO2, % | Sуд (BET), м2 /г | Vп (BJH), см3/г | Rп (BJH), нм | Smic, м2/г |
|---|---|---|---|---|---|
| Ксерогели С | |||||
| 1С | 30 | 257 | 0.015 | 4.0 | 731 |
| 2С | 35 | 358 | 0.345 | 1.9 | 1025 |
| 3С | 45 | 480 | 0.405 | 2.0 | 1990 |
| 4С | 60 | 732 | 0.730 | 1.8 | 1880 |
| Аэрогели С | |||||
| 1С-А | 30 | 261 | 0.077 | 1.8 | 635 |
| 2С-А | 38 | 426 | 0.358 | 2.1 | 1050 |
| 3С-А | 45 | 585 | 0.456 | 1.9 | 2220 |
| 4С-А | 60 | 1125 | 0.876 | 1.9 | 3229 |
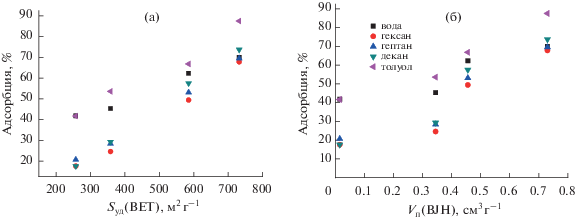
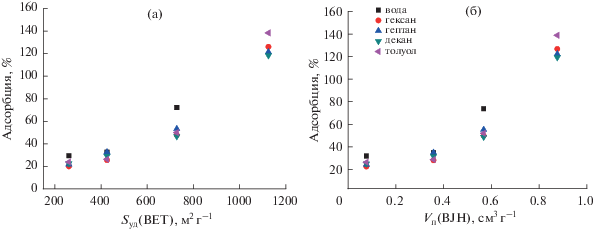
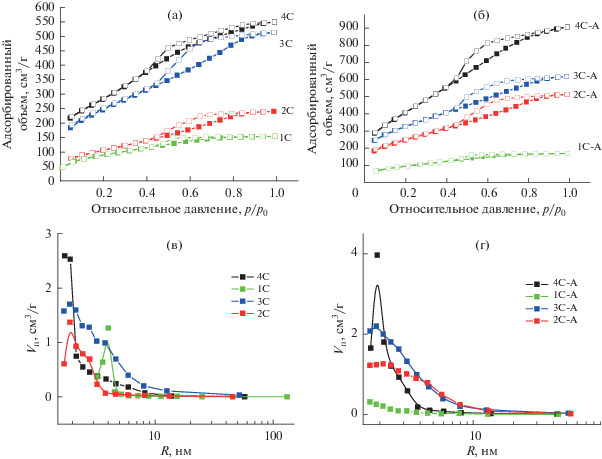
Анализ пористой структуры методом низкотемпературной адсорбции азота показывает, что удельная поверхность (по БЭТ) и объем пор углеродных материалов растут с увеличением доли НКЦ в исходном композите НКЦ/SiO2 (табл. 2, рис. 2). Удельная поверхность аэрогеля углерода (образец 4С-А) достигает значения 1125 м2/г при содержании НКЦ в исходном композите 60%. Кроме того, анализ экспериментальных изотерм с использованием t-метода Хэлси [32], который используется для определения объема микропор в присутствии мезопор, показывает резкое увеличение удельной поверхности углеродных материалов за счет значительного содержания микропор. Приблизительное отношение поверхностей микро- и мезопор в полученных углеродных материалах составляет 2.4–3.2.
Рис. 2.
Изотермы адсорбции (темные значки) и десорбции (светлые значки) азота (77 K) (а, б) и соответствующее распределение пор по размерам (в, г), рассчитанное по десорбционной ветви методом BJH, для исследованных образцов. Нумерация образцов соответствует приведенной в табл. 2.
Изучена сорбция насыщенных паров воды и органических растворителей (гексана, гептана, декана и толуола) при температуре 25°С на ксерогелях и аэрогелях полученных углеродных материалов (табл. 3).
Таблица 3.
Адсорбция насыщенных паров воды и органических растворителей на пористых углеродных материалах
| № образца | Адсорбция паров, % | ||||
|---|---|---|---|---|---|
| Н2О | гексан | гептан | декан | толуол | |
| Ксерогель С | |||||
| 1С | 41.8 | 17.6 | 20.7 | 17.6 | 41.7 |
| 2С | 45.3 | 24.56 | 28.35 | 29.3 | 53.6 |
| 3С | 62.3 | 49.4 | 53.1 | 57.5 | 66.8 |
| 4С | 70.0 | 67.8 | 69.5 | 73.7 | 87.5 |
| Аэрогель С | |||||
| 1С-А | 29.5 | 20.0 | 21.8 | 22.6 | 23.9 |
| 2С-А | 32.6 | 25.6 | 32.6 | 29.2 | 26.3 |
| 3С-А | 72.2 | 47.8 | 53.3 | 46.7 | 50 |
| 4С-А | 180.0 | 126.1 | 121.5 | 118.5 | 138.5 |
Как видно на рис. 3, 4, величина сорбции паров органических растворителей и воды линейно растет с ростом удельной площади поверхности и объема пор углеродных материалов. Величина сорбции не зависит от природы растворителя (в пределах погрешности эксперимента).
ЗАКЛЮЧЕНИЕ
Проведен двойной темплатный золь-гель синтез пористых углеродных материалов (ксерогелей и аэрогелей) с использованием нанокристаллической целлюлозы и кремнезема в качестве органического и неорганического темплатов с последующей карбонизацией НКЦ в инертной атмосфере и удалением SiO2 кипячением в растворе щелочи. Изучены условия формирования пористой структуры углерода, проведена характеристика полученных пористых углеродных материалов. Показано, что пористая структура материалов сформирована мезопорами со значительным содержанием микропор. Сделан вывод, что микропористая структура углерода формируется за счет НКЦ, тогда как мезопористая – за счет как SiO2, так и НКЦ. Изучена сорбция насыщенных паров воды и органических растворителей (гексана, гептана, декана и толуола) при температуре 25°С на углеродных ксерогелях и аэрогелях. Показано, что сорбция паров органических растворителей и воды линейно растет с ростом удельной площади поверхности и объема пор углеродных материалов и мало зависит от природы растворителя.
Список литературы
Hench L.L., West J.K. // Chem. Rev. 1990. V. 90. № 1. P. 33. https://doi.org/10.1021/cr00099a003
Ivicheva S.N., Ovsyannikov N.A., Lysenkov A.S. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 12. P. 1820. https://doi.org/10.1134/S0036023620120050
Frolova M.G., Lysenkov A.S., Titov D.D. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 8. P. 1191. https://doi.org/10.1134/S0036023621080052
Handy B., Walther K.L., Wokaun A. et al. // Stud. Surf. Sci. Catal. 1991. V. 63. P. 239. https://doi.org/10.1016/S0167-2991(08)64589-9
Jiang F., Hsieh Y.-L. // Carbohyd. Polym. 2013. V. 95. P. 32. https://doi.org/10.1039/c3ra41646a
Habibi Y., Lucia L.A., Rojas O.J. // Chem. Rev. 2010. V. 110. P. 3479. https://doi.org/10.1021/cr900339w
Lu P., Hsieh Y.-L. // Carbohyd. Polym. 2010. V. 82. P. 329. https://doi.org/10.1016/j.carbpol.2010.04.073
Jonoobi M., Oladi R., Davoudpour Y. et al. // Cellulose. 2015. V. 22. P. 935. https://doi.org/10.1007/s10570-015-0551-0
Brinchi L., Cotana F., Fortunati E. et al. // Carbohyd. Polym. 2013. V. 94. P. 154. https://doi.org/10.1016/j.carbpol.2013.01.033
Sÿturcova A., Davies G.R., Eichhorn S.J. // Biomacromolecules. 2005. V. 6. P. 1055. https://doi.org/10.1021/bm049291k
Habibi Y. // Chem. Soc. Rev. 2014. V. 43. P. 1519. https://doi.org/10.1039/C3CS60204D
Jasmani L., Eyley S., Wallbridge R. et al. // Nanoscale. 2013. V. 5. P. 10207. https://doi.org/10.1039/C3NR03456A
Holt B.L., Stoyanov S.D., Pelan E. et al. // J. Mater. Chem. 2010. V. 20. P. 10058. https://doi.org/10.1039/C0JM01022G
Giese M., Blusch L.K., Khan M.K. et al. //Angew. Chem. Int. Ed. 2015. V. 54. P. 2888. https://doi.org/10.1002/anie.201407141
Ioelovich M., Figovsky O. // Adv. Mater. Res. 2008. V. 47–50. P. 1286. https://doi.org/10.4028/www.scientific.net/AMR.47-50.1286
Lin N., Dufresne A. // Eur. Polym. J. 2014. V. 59. P. 302. https://doi.org/10.1016/j.eurpolymj.2014.07.025
Georgea J., Siddaramaiah // Carbohyd. Polym. 2012. V. 87. № 3. P. 2031. https://doi.org/10.1016/j.carbpol.2011.10.019
Denisov A.Y., Kloser E., Gray D.G. et al. // J. Biomol. NMR. 2010. V. 47. № 3. P. 195. https://doi.org/10.1007/s10858-010-9423-y
Kelly J.A., Giese M., Shopsowitz K.E. et al. // Acc. Chem. Res. 2014. V. 47. P. 1088. https://doi.org//10.1021/ar400243m
Shopsowitz K.E., Qi H., Hamad W.Y. et al. // Nature. 2010. V. 468. P. 422. https://doi.org/10.1038/nature09540
Shopsowitz K.E., Kelly J.A., Hamad W.Y. et al. // Adv. Funct. Mater. 2014. V. 24. P. 327. https://doi.org/10.1002/adfm.201301737
Nguyen T.-D., Hamad W.Y., MacLachlan M.J. // Chem. Commun. 2013. V. 49. P. 11296. https://doi.org/10.1039/c3cc47337f
Shopsowitz K.E., Stahl A., Hamad W.Y. et al. // Angew. Chem. Int. Ed. 2012. V. 51. P. 6886. https://doi.org//10.1021/ja210355v
Meng Y., Young T.M., Liu P. et al. // Cellulose. 2015. V. 22. P. 435. https://doi.org/10.1007/s10570-014-0519-5
Chen L., Huang Z., Liang H. et al. // R. Soc. Chem. 2013. V. 6. P. 3331. https://doi.org/10.1039/c3ee42366b
Wu Z.Y., Li C., Liang H.W. et al. // Chem. Int. Ed. 2013. V. 52. P. 2925. https://doi.org/10.1002/anie.201209676
Chen L.F., Huang Z.H., Liang H.W. et al. // Energy Environ. Sci. 2013. V. 6. P. 3331. https://doi.org/10.1039/c3ee42366b
Chen L.F., Liang H.W., Guan Q.F. et al. // Adv. Mater. 2013. V. 25. P. 4746. https://doi.org/10.1002/adma.201204949
Hong li Zhu H., Shen F., Luo W. et al. // Nano Energy. 2017. V. 33. P. 37. https://doi.org/10.1016/j.nanoen.2017.01.021
Wen Y., Jiang M., Kitchens C.L. et al. // Cellulose. 2017. V. 24. P. 4599. https://doi.org/10.1007/s10570-017-1464-x
Bondeson D., Mathew A., Oksman K. // Cellulose. 2006. V. 13. № 2. P. 171. https://doi.org/10.1007/s10570-006-9061-4
Адамсон А. Физическая химия поверхностей / Пер. с англ. под ред. Зорина З.М., Муллера В.М. М.: Мир, 1979.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии