Журнал неорганической химии, 2022, T. 67, № 3, стр. 423-430
Гидрогели диоксида кремния как основа новых мягких лекарственных форм и косметических композиций
Е. С. Долинина a, *, Е. В. Парфенюк a
a Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, ул. Академическая, 1, Россия
* E-mail: terrakott37@mail.ru
Поступила в редакцию 08.09.2021
После доработки 27.09.2021
Принята к публикации 28.09.2021
- EDN: WUFDOE
- DOI: 10.31857/S0044457X22030060
Аннотация
Показана перспективность применения гидрогелей коллоидного диоксида кремния в качестве платформы для разработки новых мягких лекарственных форм и косметических композиций для топической доставки лекарственных веществ. На примере гидрогелевых композитов дисульфидного антиоксиданта (липоевой кислоты) показано, что гидрогель диоксида кремния способен контролируемо высвобождать лекарственное вещество по закону нулевого порядка в течение 2 сут, способствуя пропорциональному увеличению антиоксидантного эффекта. Установлено, что гидрогели являются наноразмерными, а их плотность и скорость высвобождения антиоксиданта зависят от концентрации кислоты, использованной при приготовлении гидрогелей, и количества лекарственного вещества в гидрогелевом композите.
ВВЕДЕНИЕ
Коллоидный (аморфный) диоксид кремния является неорганическим материалом с уникальным набором физико-химических и биологических свойств. Он обладает высокой механической [1], термической и фотоустойчивостью [2, 3], может быть получен в виде частиц различной формы и размера, иметь разнообразную пористую структуру и химию поверхности [4–8]. С другой стороны, в отличие от кристаллических форм, аморфный диоксид кремния является малотоксичным, биосовместимым и биодеградируемым материалом [6, 7], устойчивым к бактериальным атакам [9]. Аморфный диоксид кремния признан в России и во всем мире безопасной пищевой добавкой [10]. Указанные свойства делают его привлекательным материалом для создания новых фармацевтических продуктов. Благодаря большой удельной поверхности аморфный диоксид кремния обладает высокой адсорбционной способностью и широко применяется в медицине в качестве энтеросорбентов [11]. Многочисленные исследования, проводимые во всем мире, свидетельствуют о том, что аморфный диоксид кремния является перспективной основой для разработки новых лекарственных форм с улучшенными физико-химическими и фармакологическими свойствами [7, 8, 12–14].
Подавляющая часть этих исследований касается твердых, порошкообразных форм диоксида кремния – ксерогелей и аэрогелей. Однако диоксид кремния может быть получен и в виде гидрогелей. Гидрогели диоксида кремния представляют собой коллоидные системы, состоящие из трехмерной сетки, образованной частицами диоксида кремния, взаимодействующими друг с другом, пустоты (поры) которой заполнены водной средой. Благодаря особым свойствам гидрогели диоксида кремния являются перспективными материалами для медицины и косметологии:
– из-за наличия трехмерной сетки из частиц диоксида кремния гидрогели обладают механическими свойствами твердых тел, такими как способность к деформации и сохранение формы; они могут легко намазываться на поверхность;
– гидрогели диоксида кремния способны удерживать очень большое количество водной фазы, поэтому обладают сильным гидратирующим эффектом и легко смываются водой;
– высокая пористость этих материалов способствует их использованию в качестве матрицы для загрузки лекарственных веществ.
Следует отметить, что, несмотря на перечисленные свойства, исследования гидрогелей диоксида кремния и разработка на их основе материалов для медицины и косметологии весьма редки. В литературе для этих целей в основном предлагаются гидрогели на основе природных и синтетических полимеров, которые в большинстве своем подвергаются быстрой деградации в биологических средах, что значительно сокращает сроки их функционирования. Гидрогели диоксида кремния часто предлагаются в качестве сшивающих агентов для укрепления структуры полимерных гидрогелей [15, 16]. В работе [17] показано, что гидрогель диоксида кремния может стать основой для новой инъекционной формы лекарственных веществ для лечения остеопороза с контролируемым высвобождением. Работы [18, 19] посвящены разработке тиксотропных гидрогелей диоксида кремния (тиксогелей) с целью их применения в качестве систем доставки лекарственных веществ. Они показали, что тиксогели стабильны при физиологических условиях и скорость высвобождения из них модельных гидрофобных лекарственных веществ не зависит от плотности гидрогелей и размера их частиц. Таким образом, гидрогели диоксида кремния с загруженным в них лекарственным веществом могут стать основой для разработки новых мягких лекарственных форм.
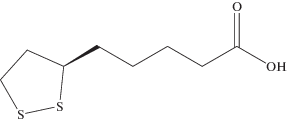
Цель настоящей работы – оценка возможности создания на основе гидрогеля диоксида кремния мягких лекарственных форм с контролируемым высвобождением хорошо известного дисульфидного антиоксиданта – α-липоевой кислоты (ЛК) (рис. 1). Такие гидрогели могут найти применение в качестве основы для топической доставки антиоксидантов в виде мазей, гелей, а также кремов и филлеров в косметологии. Наши исследования показали, что, варьируя условия золь-гель синтеза, можно изменять плотность, пористость гидрогелей диоксида кремния, увеличивать или уменьшать их отклик на механические воздействия в несколько раз [20], что очень важно для разработки указанных продуктов.
ЛК обладает очень высокой антиоксидантной активностью, но подвержена интенсивному предсистемному метаболизму и имеет очень низкое время полужизни в организме (только 0.5–1.5 ч) [21]. Это приводит к необходимости многократного введения больших доз препарата. Поэтому очень важно, чтобы лекарственные гидрогели обладали длительным контролируемым высвобождением антиоксидантов и могли поддерживать их антиоксидантный эффект на терапевтическом уровне в течение длительного периода времени.
Лекарственные гидрогели были получены золь-гель методом. Учитывая указанное потенциальное применение гидрогелей и способ их введения (трансдермальное, инъекционное), они имели рН 6.6–7.4. В настоящей работе исследованы некоторые свойства чистых гидрогелей (без лекарственного вещества) и гидрогелевых композитов с ЛК (внешний вид, морфология, плотность, размер частиц), а также влияние условий синтеза гидрогелевых композитов (концентрация катализатора, количество лекарственного вещества) на кинетические параметры высвобождения ЛК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. Тетраэтоксисилан (ос. ч., ЭКОС, Москва), DL-α-липоевую кислоту (>99.0%, CAS 1077-28-7, Tokyo Chemical Industry Co., LTD, Япония) использовали без дополнительной очистки. Растворы соляной кислоты (37%, CAS 7647-01-0, Acros Organics, Бельгия) применяли в качестве катализатора для образования золя диоксида кремния. В работе использовали гидроксид натрия (ч. д. а.), натрий фосфорнокислый однозамещенный (NaH2PO4 · 2H2O) и двузамещенный (Na2HPO4 · 12H2O, ч. д. а.) производства Химмед (Москва), 2,2-дифенил-1-пикрилгидразил (ДФПГ, CAS 1898-66-4) производства Tokyo Chemical Industry Co., LTD (Япония).
Синтез чистых гидрогелей и гидрогелевых композитов диоксида кремния с ЛК. Для приготовления гидрогелевых композитов была использована методика двухступенчатого золь-гель синтеза, разработанная нами ранее [20]. На первой ступени получали золь диоксида кремния (процесс катализировали растворами HCl различной концентрации (0.125, 0.25 и 0.50 моль/л)), затем в реакционную смесь при быстром перемешивании вводили раствор антиоксиданта, рН смеси быстро доводили до значения 6–7 добавлением фосфатного буфера (рН 7.4). Для увеличения растворимости липоевую кислоту вводили в реакционную смесь в виде раствора в водном NaOH. Далее осуществляли контроль конечного значения рН и интенсивно перемешивали смесь до образования геля. Старение гелей в плотно закрытых емкостях происходило в течение 10 сут. Были получены гидрогелевые композиты с малой (3.9–4.6 мг/г композита) и большой (8.5–9.6 мг/г композита) загрузкой лекарственного вещества.
Синтез чистых гидрогелей проводили по описанной выше методике, но без введения ЛК.
В табл. 1 приведены обозначения и условия синтеза полученных гидрогелей. Поскольку антиоксидант быстро деградирует на свету, процессы получения, хранения и исследования гидрогелей проводили в темноте.
Таблица 1.
Условия синтеза гидрогелей диоксида кремния и гидрогелевых композитов, размер их частиц
| Гидрогель | СHCl, моль/л | Раствор антиоксиданта | Загрузка, мг/г |
рН гидрогеля | Размер частиц, нм |
Плотность, г/см3 |
|
|---|---|---|---|---|---|---|---|
| m, мг* | 1 М NaOH + H2O, мл | ||||||
| ГГ1 | 0.125 | – | 3.0 + 3.3 | – | 7.33 | 222 ± 20 | 1.0228 |
| ГГ2 | 0.25 | – | 5.7 +7.3 | – | 7.14 | 234 ± 32 | 1.0219 |
| ГГ3 | 0.50 | – | 10.5 + 12.3 | – | 7.44 | 209 ± 18 | 1.0110 |
| ЛК-ГГ1(М) | 0.125 | 150.91 | 3.0 + 3.3 | 3.9 | 6.81 | 198 ± 24 | 0.9820 |
| ЛК-ГГ1(Б) | 0.125 | 305.88 | 3.0 + 3.3 | 8.5 | 6.62 | 215 ± 20 | 0.9896 |
| ЛК-ГГ2(М) | 0.25 | 278.46 | 5.7 + 7.3 | 4.6 | 7.26 | 218 ± 22 | 0.9895 |
| ЛК-ГГ2(Б) | 0.25 | 564.60 | 5.7 +7.3 | 9.6 | 7.31 | 235 ± 35 | 0.9915 |
| ЛК-ГГ3(М) | 0.50 | 473.01 | 10.5 + 12.3 | 4.4 | 7.05 | 225 ± 42 | 0.9957 |
| ЛК-ГГ3(Б) | 0.50 | 946.11 | 10.5 + 12.3 | 9.0 | 7.26 | 243 ± 20 | 0.9984 |
Анализ размера частиц синтезированных гидрогелей. Размеры частиц гидрогелей измеряли методом динамического рассеяния света на анализаторе Zetasizer Nano ZS (Malvern Instruments LTD, UK). Перед измерением образцы помещали в фосфатный буферный раствор (рН 7.4) и обрабатывали ультразвуком в течение 10 мин для разрушения агрегатов.
Оптическая микроскопия позволяет увидеть морфологию гидрогелей в реальном виде, без сушки или замораживания. Снимки были получены на оптическом микроскопе XSP-104, оборудованном камерой PCE-ME 100 (Апекслаб, Россия). Образцы массой ~2.5 мг были однородно распределены в виде тонкого слоя на стеклянной пластине и накрыты другой стеклянной пластиной.
Определение плотности гидрогелей. Плотность гидрогелей определяли методом гидростатического взвешивания на весах DEMCOM серии DA с использованием грузика с известным объемом и массой. Плотность гидрогеля рассчитывали по формуле:
где А – вес грузика в воздухе, В – вес грузика в гидрогеле, V – объем грузика, ρВ – плотность воздуха (0.0012 г/см3). Оцененная погрешность в определении плотности составила 0.03%.Измерение кинетики высвобождения ЛК in vitro. Профили высвобождения антиоксидантов из синтезированных гидрогелевых композитов были получены путем инкубирования 0.25 г композита в 100 мл раствора фосфатного буфера с рН 5.5 при 32°С (условия, имитирующие рН и температуру поверхности кожи) и рН 7.4 при 37°С (условия, имитирующие плазму крови). Через определенные промежутки времени отбирали пробы (5 мл), которые замещали тем же объемом соответствующего буферного раствора. Образцы центрифугировали при 10 000 об/мин в течение 5 мин. Количество высвободившегося антиоксиданта в надосадочной фракции определяли спектрофометрически (спектрометр Cary 100, Varian, Australia), используя соответствующие калибровочные графики.
Анализ полученных кинетических профилей высвобождения. Профили высвобождения обрабатывали с помощью наиболее часто применяемых кинетических моделей: нулевого (2) и первого порядка (3), Корсмейера–Пеппаса (4), Хиксона–Кроувелла (5) [22]. Модель нулевого порядка
показывает, что высвобождение происходит при постоянной скорости, независимой от содержания лекарственного вещества в композите. Это идеальный закон для высвобождения большинства лекарственных веществ. Модель первого порядка описывает высвобождение, скорость которого зависит от количества вещества в композите. Линейная зависимость в модели Хиксона–Кроувелла указывает на то, что процесс высвобождения сопровождается изменением площади поверхности композита, т.е. деградацией матрицы композита. Модель Корсмейера–Пеппаса(5)
$\frac{{{{M}_{t}}}}{{{{M}_{\infty }}}} = k{{t}^{n}};\,\,\,\,\frac{{{{M}_{t}}}}{{{{M}_{\infty }}}} \leqslant 0.6,$Здесь k0, k1, kH–C, k – константы скорости в моделях нулевого и первого порядка, Хиксона–Кроувелла, Корсмейера–Пеппаса; Q0 и Qt – начальное количество лекарственного вещества в растворе и в момент времени t; Mt и M∞ – кумулятивные количества высвободившегося вещества в момент времени t и общее количество высвободившегося вещества; n – диффузионная экспонента в модели Корсмейера–Пеппаса.
Определение антиоксидантной активности ЛК в гидрогелях. Антирадикальная активность высвободившейся ЛК была изучена спектрофотометрически с помощью 2,2-дифенил-1-пикрилгидразила. Навеску 0.01 г ДФПГ растворяли в 200 мл этанола (начальный раствор с интенсивностью поглощения (Iнач) при 515 нм). Этот раствор добавляли к каждому образцу (отобранная через определенный промежуток времени центрифугированная проба среды высвобождения) в соотношении 1 : 1. Через 15 мин измеряли интенсивность полосы поглощения образца при 515 нм (It). Измерения для каждого образца проводили трижды. Антиоксидантную активность ЛК в пробе определяли как
где Iнач и It – интенсивности поглощения начального и конечного растворов.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Гидрогелевые композиты представляют собой однородные, слегка опалесцирующие желтоватые коллоидные системы. Желтоватый цвет им придает присутствие липоевой кислоты. Чистые неорганические гидрогели, приготовленные в тех же условиях, не окрашены. В качестве примера на рис. 2 представлены фотографии двух гидрогелевых композитов: ЛК-ГГ3(Б) и ЛК-ГГ1(Б). Как видно на фотографии, ЛК-ГГ1(Б) имеет более плотную консистенцию и не стекает вниз при перевертывании по сравнению с ЛК-ГГ3(Б). Об этом свидетельствуют и приведенные в табл. 1 данные по плотности синтезированных гидрогелей, которые показывают, что плотность гидрогелей падает с ростом концентрации HCl, применяемой в их золь-гель синтезе, и с увеличением содержания антиоксиданта в композите. Рост концентрации HCl при синтезе гидрогелей приводит к увеличению количества жидкой фазы, так как для приготовления гидрогеля с величиной рН, близкой к нейтральной, бóльшее количество буферного раствора с рН 7.4 необходимо добавить для нейтрализации повышенной концентрации кислоты. Как результат, гидрогели, приготовленные с использованием 0.5 М кислоты, имеют пониженное соотношение SiO2 : жидкая фаза и меньшую плотность. Введение ЛК в гидрогели приводит к уменьшению их плотности, однако плотность увеличивается с ростом загрузки лекарственного вещества. Этот эффект может быть связан с взаимодействием лекарственного вещества с силоксановой сеткой диоксида кремния, при этом с увеличением количества антиоксиданта, который обладает высокой гидрофобностью, может возрастать роль гидрофобного эффекта, приводящего к упрочнению водной фазы гидрогеля. Следует отметить, что плотность гидрогелей – важнейшая характеристика с точки зрения потенциального применения гидрогелей в качестве дермальных филлеров в косметологии [26, 27].
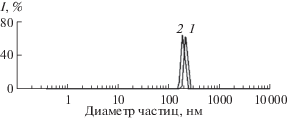
Синтезированные гидрогели являются наноразмерными. Как показал анализ размера частиц чистых гидрогелей диоксида кремния и их композитов с ЛК после их обработки ультразвуком, их частицы имеют размер ~200 нм (табл. 1) и мономодальное распределение частиц по размерам. На рис. 3 в качестве примера приведено распределение частиц по размерам для ГГ1 и ЛК-ГГ1(М). Для остальных образцов распределение частиц по размерам имеет аналогичный вид. Однако, как показывают снимки, сделанные с помощью оптического микроскопа (в качестве примера на рис. 4 представлен снимок ЛК-ГГ1(М)), в реальном виде частицы гидрогелей образуют агрегаты и агломераты с пористой структурой.
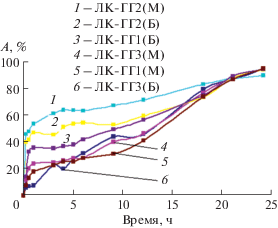
Как было отмечено выше, главная задача настоящей работы заключалась в оценке способности синтезированных гидрогелевых композитов к длительному контролируемому высвобождению ЛК в среды, имитирующие плазму крови и поверхность кожи. Экспериментальные профили высвобождения в виде кумулятивных кривых представлены на рис. 5. Как видно из рисунка, кривые однотипны: после эффекта выброса (0.5–2.0 ч) высвобождение происходит по закону, близкому к линейному. Это подтверждается наилучшим описанием участка кривой после выброса (эффект и время выброса определяли по методике, предложенной в [13]) моделью нулевого порядка (табл. 2). Величины диффузионной константы модели Корсмейера–Пеппаса (n = 0.52–0.89) свидетельствуют о том, что высвобождение контролируется аномальной диффузией. Этот механизм включает два процесса: дезинтеграцию (деградацию) матрицы композита и диффузию лекарственного вещества в среду высвобождения [12–14, 28, 29]. По-видимому, силоксановая сетка гибридных материалов подвергается дезинтеграции в процессе высвобождения на более мелкие агрегаты (на что указывает хорошее описание профилей моделью Хиксона–Кроувелла, а также помутнение среды после 3–4 ч высвобождения), что способствует диффузии лекарственных веществ в среду высвобождения. Полученные результаты свидетельствуют о том, что скорость высвобождения нулевого порядка (к0)
Рис. 5.
Кинетические профили высвобождения ЛК из гидрогелевых композитов в среду с рН 7.4 при температуре 37°С (а) и в среду с рН 5.5 при температуре 32°С (б) (средние значения трех независимых измерений).
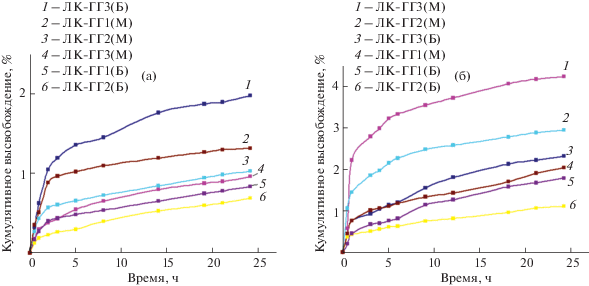
Таблица 2.
Кинетические параметры высвобождения ЛК и ЛА из гибридных гидрогелей (k0, k1, мг/ч; k, ч–n; R2 – коэффициент корреляции)
| Гидрогель | Время выброса, ч |
Эффект выброса, % |
Модель | |||
|---|---|---|---|---|---|---|
| нулевого порядка |
первого порядка |
Хиксона– Кроувелла |
Корсмейе- ра–Пеппаса |
|||
| рН среды высвобождения 7.4, температура 37°С | ||||||
| ЛК-ГГ1(М) | 2 | 0.9 | k0 = 0.0178 R2 = 0.9686 |
k1 = 8 × 10–5 R2 = 0.9453 |
R2 = 0.9653 | k = 3.35 n = 0.58 R2 = 0.9655 |
| ЛК-ГГ1(Б) | 2 | 0.4 | k0 = 0.0191 R2 = 0.9972 |
k1 = 8 × 10–5 R2 = 0.9677 |
R2 = 0.9994 | k = 3.65 n = 0.79 R2 = 0.9679 |
| ЛК-ГГ2(М) | 2 | 1.0 | k0 = 0.0205 R2 = 0.9979 |
k1 = 9 × 10–5 R2 = 0.9534 |
R2 = 0.9965 | k = 3.52 n = 0.83 R2 = 0.9798 |
| ЛК-ГГ2(Б) | 1 | 0.7 | k0 = 0.0215 R2 = 0.9886 |
k1 = 9 × 10–5 R2 = 0.9630 |
R2 = 0.9886 | k = 3.69 n = 0.78 R2 = 0.9634 |
| ЛК-ГГ3(М) | 1 | 0.7 | k0 = 0.0236 R2 = 0.9778 |
k1 = 1 × 10–4 R2 = 0.9653 |
R2 = 0.9677 | k = 3.78 n = 0.60 R2 = 0.9776 |
| ЛК-ГГ3(Б) | 2 | 0.3 | k0 = 0.0235 R2 = 0.9762 |
k1 = 2 × 10–4 R2 = 0.9423 |
R2 = 0.9674 | k = 3.97 n = 0.72 R2 = 0.9709 |
| рН среды высвобождения 5.5, температура 32°С | ||||||
| ЛК-ГГ1(М) | 1 | 0.8 | k0 = 0.0485 R2 = 0.9968 |
k1 = 2 × 10–4 R2 = 0.9553 |
R2 = 0.9673 | k = 3.32 n = 0.67 R2 = 0.9708 |
| ЛК-ГГ1(Б) | 1 | 0.5 | k0 = 0.0619 R2 = 0.9642 |
k1 = 2 × 10–4 R2 = 0.9477 |
R2 = 0.9786 | k = 3.40 n = 0.52 R2 = 0.9522 |
| ЛК-ГГ2(М) | 1 | 1.5 | k0 = 0.0502 R2 = 0.9979 |
k1 = 2 × 10–4 R2 = 0.9229 |
R2 = 0.9666 | k = 2.65 n = 0.83 R2 = 0.9718 |
| ЛК-ГГ2(Б) | 1 | 0.4 | k0 = 0.0638 R2 = 0.9887 |
k1 = 1 × 10–4 R2 = 0.9630 |
R2 = 0.9881 | k = 3.90 n = 0.86 R2 = 0.9745 |
| ЛК-ГГ3(М) | 0.5 | 2.2 | k0 = 0.0576 R2 = 0.9809 |
k1 = 3 × 10–4 R2 = 0.9653 |
R2 = 0.9777 | k = 2.76 n = 0.52 R2 = 0.9660 |
| ЛК-ГГ3(Б) | 1 | 0.8 | k0 = 0.0681 R2 = 0.9757 |
k1 = 3 × 10–4 R2 = 0.9577 |
R2 = 0.9683 | k = 3.93 n = 0.89 R2 = 0.9644 |
– увеличивается с ростом концентрации кислоты, использованной при приготовлении гидрогелей, что объясняется уменьшением соотношения SiO2 : вода и прочности структуры гидрогелей;
– увеличивается с ростом загрузки ЛК в гидрогели; это связано, по-видимому, с тем, что, чем больше вещества в композите, тем бóльшие нарушения оно вносит в силоксановую сетку диоксида кремния и структуру композита, и такие композиты более подвержены деградации; подобный эффект влияния количества лекарственного вещества в композитах с диоксидом кремния на скорость высвобождения наблюдался в работах [30, 31]. Следует отметить, что скорость высвобождения ЛК из синтезированных гидрогелевых композитов (k0) в среде с рН 5.5 при температуре 32°С значительно выше по сравнению со средой с рН 7.4 при 37°С. Это может быть связано с различной степенью ионизации ЛК в указанных средах и ослаблением взаимодействия ЛК с матрицей диоксида кремния в среде с рН 5.5. рКа ЛК составляет 4.7–5.4 [32, 33]. В среде с рН 7.4 ЛК существует главным образом в анионной форме, которая образует натриевую соль с ионами натрия буфера. Таким образом, ЛК взаимодействует с депротонированными силанольными группами через ионы натрия [11]. Попадая в среду с рН 5.5, которая близка к рКа, ЛК существует преимущественно в нейтральной форме и взаимодействует с силанольными группами через образование водородных связей (О–•••НО). По-видимому, первый тип взаимодействия сильнее, чем второй.
Параллельно исследованиям кинетики и механизмов высвобождения были получены кумулятивные кинетические кривые антиоксидантной активности ЛК при высвобождении в среду с рН 5.5. Полученные кумулятивные кривые приведены на рис. 6. Видно, что антиоксидантный эффект (после эффекта выброса 0.5–2 ч) растет со временем (до 2 сут) по закону, близкому к линейному, т.е. с постоянной скоростью.
ЗАКЛЮЧЕНИЕ
Разработана методика синтеза гидрогелей диоксида кремния и их композитов с липоевой кислотой, имеющих величину рН, близкую к нейтральной. Показано, что условия золь-гель синтеза оказывают значительное влияние на плотность гидрогелей и скорость высвобождения антиоксиданта из гидрогелевых композитов. На основании проведенных исследований можно заключить, что синтезированные гидрогели являются перспективной основой для разработки новых мягких лекарственных форм, так как способны контролируемо высвобождать лекарственное вещество по закону нулевого порядка в течение 2 сут, способствуя пропорциональному увеличению антиоксидантного эффекта.
Список литературы
Chi F., Zeng Y., Liu C. et al. // Res. Phys. 2020. V. 18. P. 103315. https://doi.org/10.1016/j.rinp.2020.103315
Lowe J.B., Baker R.T. // J. Nanomater. 2014. V. 2014. P. 754076. https://doi.org/10.1155/2014/754076
Strobach E., Bhatia B., Yang S., Wang E.N. // APL Mater. 2019. V. 7. P. 081104. https://doi.org/10.1063/1.5109433
Kon’kova T.V., Gordienko M.G., Men’shutina N.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 587. [Конькова Т.В., Гордиенко М.Г., Меньшутина Н.В. и др. // Журн. неорган. химии. 2018. Т. 63. № 5. С. 554.]https://doi.org/10.1134/S0036023618050054
Narayan R., Nayak U.Y., Raichur A.M. et al. // Pharmaceutics. 2018. V. 10. № 3. P. 118. https://doi.org/10.3390/pharmaceutics10030118
Lisichkin G.V., Olenin A.Yu. // Russ. J. Gen. Chem. 2021. V. 91. P. 870. [Лисичкин Г.В., Оленин А.Ю. // Журн. общ. химии. 2021. Т. 91. № 5. С. 794.]https://doi.org/10.1134/S1070363221050182
Sábio R.M., Meneguin B., dos Santos A.M. et al. // Micropor. Mesopor. Mater. 2021. V. 312. P. 110774. https://doi.org/10.1016/j.micromeso.2020.110774
Dement’eva O.V. // Colloid J. 2020. V. 82. P. 479. [Дементьева О.В. // Коллоидный журнал. 2020. Т. 82. № 5. С. 523.]
Oh J.K., Kohli N., Zhang Y. et al. // Nanotechnol. 2016. V. 27. P. 085705. https://doi.org/10.1088/0957-4484/27/8/085705
Food Additive Status List. https://www.fda.gov/food/food-additives-petitions/food-additive-status-list#ftnS
Конорев М.Р. // Вест. фармац. 2013. Т. 62. № 4. С. 79.
Dolinina E.S., Akimsheva E.Yu., Parfenyuk E.V. // Pharmaceutics. 2020. V. 12. P. 228. https://doi.org/10.3390/pharmaceutics12030228
Dolinina E.S., Parfenyuk E.V. // J. Pharm. Sci. 2016. V. 105. № 6. P. 1952. https://doi.org/10.1016/j.xphs.2016.03.042
Akimsheva E.Yu., Dolinina E.S., Parfenyuk E.V. // Izv. Vyssh. Uchebn. Zaved. Khim. Khim. Tekhnol. [Russ. J. Chem. Chem. Tech.] 2020. V. 63. № 4. P. 63. [Акимшева Е.Ю., Долинина Е.С., Парфенюк Е.В. // Изв. вузов. Химия и хим. технология. 2020. Т. 63. № 4. С. 63.]https://doi.org/10.6060/ivkkt.20206304.6136
Kakkar P., Madhan B.// Mater. Sci. Eng., C. 2016. V. 66. P. 178. https://doi.org/10.1016/j.msec.2016.04.067
Lee H.-Y., Kim H.-E., Jeong S.-H. // Colloids Surf., B. 2019. V. 174. P. 308. https://doi.org/10.1016/j.colsurfb.2018.11.034
Papathanasiou K.E., Turhanen P., Brückner S.I. et al. // Sci. Rep. 2017. V. 7. P. 4743. https://doi.org/10.1038/s41598-017-04956-3
Serban B.A., Barrett-Catton E., Serban M.A. // Gels. 2020. V. 6. № 4. P. 38. https://doi.org/10.3390/gels6040038
Serban B.A., Stipe K.T., Alverson J.B. et al. // Gels. 2017. V. 3. № 2. P. 19. https://doi.org/10.3390/gels3020019
Dolinina E.S., Kraev A.S., Parfenyuk E.V. // Mendeleev Commun. 2020. V. 30. № 6. P. 812. https://doi.org/10.1016/j.mencom.2020.11.041
Salehi B., Yılmaz Y.B., Antika G. // Biomolecules. 2019. V. 9. № 8. P. 356. https://doi.org/10.3390/biom9080356
Bruschi M.L. Strategies of Modify the Drug Release from Pharmaceutical Systems. Woodhead Publ, 2015. Ch. 5. P. 63. https://www.elsevier.com/books/strategies-to-modify-the-drug-release-from-pharmaceutical-systems/bruschi/978-0-08-100092-2
Ritger P.L., Peppas N.A. // J. Control. Release. 1987. V. 5. № 1. P. 23. https://doi.org/10.1016/0168-3659(87)90034-4
Pisani S., Dorati R., Chiesa E. et al. // Pharmaceutics. 2019. V. 11. P. 161. https://doi.org/10.3390/pharmaceutics11040161
Weiser J.R., Yueh A., Putnam D. // Acta Biomater. 2013. V. 9. № 9. P. 8245. https://doi.org/10.1016/j.actbio.2013.05.020
Greene J.J., Sidle D.M. // Facial Plast. Surg. Clin. North Am. 2015. V. 23. № 4. P. 423. https://doi.org/10.1016/fsc.2015.07002
Wypych G. Handbook of Fillers. Chem. Tec. Publ., 2021. https://doi.org/10.1016/C2020-0-00387-7
Zhang S., Chu Z., Yin C. et al. // J. Am. Chem. Soc. 2013. V. 135. № 15. P. 5709. https://doi.org/10.1021/ja3123015
Chakraborty S., Biswas S., Sa D. et al. // Colloid. Surf. A. 2014. V. 455. P. 111. https://doi.org/10.1016/j.colsurfa.2014.04.046
Prokopowicz M. // J. Pharm. Pharmacol. 2007. V. 59. № 10. P. 1365. https://doi.org/10.1211/jpp.59.10.0006
Kortesuo P., Ahola M., Kangas M. et al. // Int. J. Pharm. 2001. V. 221. № 1–2. P. 107. https://doi.org/10.1016/S0378-5173(01)00656-1
Smith A.R., Shenvi S.V., Widlansky M. et al. // Curr. Med. Chem. 2004. V. 11. № 9. P. 1135. https://doi.org/10.2174/0929867043365387
Kofuji K., Nakamura M., Isobe T. et al. // Food Chem. 2008. V. 109. № 1. P. 167. https://doi.org/10.1016/j.foodchem.2007.11.078
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии