Журнал неорганической химии, 2022, T. 67, № 3, стр. 409-415
Комплексообразование бензоаннелированных порфиразинов с ацетатами цинка(II) и кобальта(II) в пиридине
А. С. Малясова a, *, П. Н. Смирнова a, О. И. Койфман a, b
a Ивановский государственный химико-технологический университет
153000 Иваново, Шереметевский пр-т, 7, Россия
b Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, ул. Академическая, 1, Россия
* E-mail: bubnalla@yandex.ru
Поступила в редакцию 16.08.2021
После доработки 09.11.2021
Принята к публикации 10.11.2021
- EDN: RKRNMC
- DOI: 10.31857/S0044457X22030096
Аннотация
Исследован процесс комплексообразования трибензодиазепинопорфиразина с ацетатами Cu(II), Zn(II) и Co(II). Образование комплекса трибензодиазепинопорфиразина Cu(II) происходит мгновенно, поэтому в качестве солей использовали ацетаты Zn(II) и Co(II). Установлено, что скорости образования комплексов трибензодиазепинопорфиразина в пиридине с ионами металлов уменьшаются в ряду: Cu(II) > Zn(II) > Co(II), данный ряд хорошо согласуется с литературными данными, полученными для тетраазапорфина. При замене диазепинового фрагмента на пиразиноновый скорость реакции образования комплекса порфиразина с Zn(II) уменьшается. Предполагается, что в случае трибензодиазепинопорфиразина процесс внедрения металла протекает через стадию образования внешнего комплекса, что благоприятствует дальнейшему введению иона цинка(II) в координационный центр макроцикла. Реакции образования комплексов Zn(II) и Co(II) исследуемых порфиразинов характеризуются низкими значениями энергии и энтропии активации, что может свидетельствовать о сильной сольватации переходного состояния.
ВВЕДЕНИЕ
Координационные соединения фталоцианина (тетрабензопорфиразина) и их производные нашли практическое применение в различных областях науки, техники, технологии и медицины [1–3]. Эти макрогетероциклы применяются в качестве катализаторов различных химических процессов [4–6], например, при структурировании олигосилоксандиолов [7], электрохимических [8], фотохимических [9–11] процессов, сенсоров и полупроводниковых материалов [12–14], материалов для нелинейной оптики [15], стабилизаторов полимеров и стационарных фаз для газовой хроматографии [16]. Такой широкий спектр применения обусловлен строением макроциклического кольца, наличием различных заместителей, находящихся в аннелированных бензольных кольцах, а также наличием или, наоборот, отсутствием центрального атома металла. В случае замены одного или нескольких бензольных колец на гетероциклические [17], молекула приобретает дополнительные активные центры, что, в свою очередь, оказывает существенное влияние на физико-химические свойства молекулы.
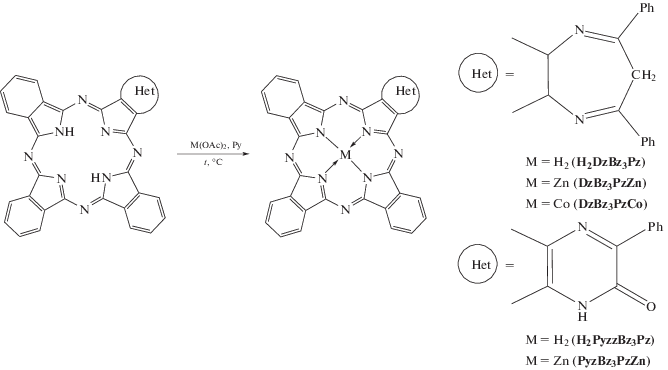
В настоящей работе исследовано комплексообразование трибензодиазепинопорфиразина с ацетатами Cu(II), Co(II) и Zn(II) в пиридине, показано влияние замены диазепинового фрагмента на пиразиноновый на скорость реакции введения иона Zn(II) в координационную полость макрокольца.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Лиганды трибензопорфиразинов H2DzBz3Pz и H2PyzBz3Pz синтезировали по методикам [18, 19] соответственно.
Пиридин сушили согласно [20]. Ацетаты цинка и кобальта марки “х.ч.” перекристаллизовывали из ледяной уксусной кислоты. Для проведения кинетических измерений в термостатируемую кювету спектрофотометра помещали раствор порфиразина и ацетата цинка или кобальта известной концентрации при заданной температуре и через определенные промежутки времени измеряли оптическую плотность раствора на длинах волн, соответствующих максимумам полос поглощения образующихся комплексов (при λI = 695 и λII = 657 нм для DzBz3PzZn, λI = 674 и λII = = 640 нм для DzBz3PzCo, λI = 679 и λII = 653 нм для PyzBz3PzZn). Текущие и конечные концентрации порфиразинов определяли по уравнению
(1)
${{C}_{{{{{\text{H}}}_{2}}{\text{Pz}}}}}{\text{\;}} = {\text{\;}}~C_{{{{{\text{H}}}_{2}}{\text{Pz}}}}^{0}\left( {{{A}_{\tau }} - {{A}_{\infty }}} \right){\text{/}}\left( {{{A}_{0}} - {{A}_{\infty }}} \right),$РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Порфиразины образуют внутрикомплексные соединения с ионами металлов за счет замещения внутрициклических атомов водорода с полным (или почти полным) разрушением координационной сферы исходной соли (схема). В результате происходит образование четырех связей иона металла с атомами азота координационного центра. При этом ион металла начинает оказывать сильное воздействие на лиганд за счет σ-электронного эффекта, обратного и прямого дативных π-эффектов и эффекта заряда в многозарядных ионах [21, 22], которое может вызывать искажение геометрической структуры макроцикла.
Порфиразины-лиганды вступают в реакцию комплексообразования с М(OAc)2 в пиридине в соответствии с уравнением [22, 23]:
(2)
${{{\text{H}}}_{{\text{2}}}}{\text{Pz}} + {\text{М(OAc}}{{{\text{)}}}_{{\text{2}}}}{{\left( {{\text{Ру}}} \right)}_{4}} \to {\text{PzМ}} + 2{\text{HOAc}} + {\text{4Ру}}.$Исходный лиганд трибензодиазепинопорфиразина (H2DzBz3Pz) получали по методике, описанной в [18].
Одним из факторов, определяющих скорость координации порфиринов солями металлов в пиридине, является состояние N–H-связей в реакционном центре [23]. Этот фактор играет для тетраазапорфиринов главную роль.
Наибольшие скорости комплексообразования наблюдаются с ионами Cu(II), что связано с эффектом тетрагонального искажения (эффект Яна–Теллера) координационных сфер в ионе Cu2+ [24, 25] и хорошим соответствием его координационной сферы структурным параметрам макроцикла. Предпринята попытка изучения комплексообразования трибензодиазепинопорфиразина с ионом Cu(II), однако реакция протекает мгновенно. Поэтому в качестве солей, участвующих в исследуемом процессе выбрали ацетаты Zn(II) и Co(II).
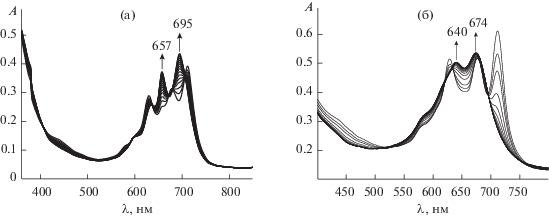
На рис. 1 показаны изменения электронного спектра поглощения (ЭСП) трибензодиазепинопорфиразина при комплексообразовании с ацетатом цинка и кобальта. В видимой области ЭСП порфиразина в ходе комплексообразования с ацетатами металлов в пиридине наблюдается уменьшение интенсивности полос поглощения исходного лиганда порфиразина и увеличение интенсивности полос поглощения соответствующих комплексов. Комплексообразование проводили в присутствии большого избытка соли [26, 27], т.е. в условиях реакции псевдопервого порядка.
Рис. 1.
Изменение ЭСП порфиразина H2DzBz3Pz в процессе комплексообразования с Zn(OAc)2 (а) и Co(OAc)2 (б) в пиридине.
Кинетическое уравнение реакции имеет вид:
(3)
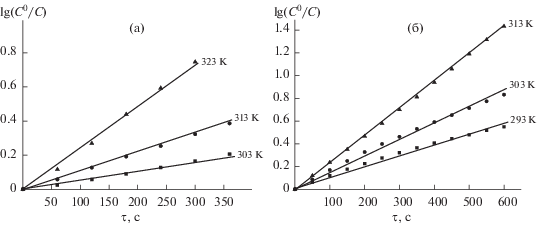
$ - d{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pz}}}}}{\text{/}}d\tau = {{k}_{{{\text{эф}}}}}{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pz}}}}}.$Реакция образования комплексов цинка(II) и кобальта(II) имеет первый порядок по концентрации лиганда, о чем свидетельствуют прямолинейные зависимости lg(C0/C) от времени протекания реакции. На рис. 2 показаны такие зависимости для исследуемого порфиразина.
Рис. 2.
Зависимости lg( C0/C) от времени τ для реакции комплексообразования порфиразина H2DzBz3Pz. $C_{{{\text{Zn(OAc}}{{{\text{)}}}_{2}}}}^{0}$ = 0.6 × × 10–4 моль/л (а); $C_{{{\text{Co(OAc}}{{{\text{)}}}_{2}}}}^{0}$ = 6.0 × 10–4 моль/л (б).
В этом случае эффективные константы скорости реакции могут быть рассчитаны по уравнению:
(4)
${{k}_{{{\text{эф}}}}} = \frac{1}{\tau }\ln \frac{{C_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pz}}}}^{0}}}{{{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pz}}}}}}}.$Экспериментальные данные показывают, что эффективные константы скорости зависят от концентрации соли.
где kv – истинная константа скорости реакции, n – порядок реакции по концентрации ацетата цинка. Истинная константа скорости kv не зависит от концентрации соли.Так как скорости комплексообразования лигандов порфиразинов на несколько порядков меньше, чем скорости образования комплексов с простыми лигандами, они могут быть измерены обычными кинетическими методами. В табл. 1, 2 представлены кинетические параметры образования комплексов Zn(II) и Co(II).
Таблица 1.
Кинетические параметры образования DzBz3PzZn в пиридине ($C_{{{{{\text{H}}}_{{\text{2}}}}{\text{DzB}}{{{\text{z}}}_{{\text{3}}}}{\text{Pz}}}}^{0}$ = 1.53 × 10–5 моль/л)
| $C_{{{\text{Zn(OAc}}{{{\text{)}}}_{2}}}}^{0}$ × 104, моль/л | Т, K | kэф × 104, с–1 | kv × 10–4, с–2 моль–2 л | Е, кДж/моль | ΔS≠, Дж/(моль K) |
|---|---|---|---|---|---|
| 0.6 | 298 | 8.3* | 23.05 | 49 ± 5 | –150 ± 13 |
| 303 | 16.1 ± 0.4 | 44.72 ± 1 | |||
| 313 | 30.2 ± 0.2 | 83.88 ± 1 | |||
| 323 | 56.1 ± 1.7 | 155.83 ± 4 | |||
| 0.75 | 298 | 13.52* | 24.05 | 43 ± 6 | –163 ± 10 |
| 303 | 31.0 ± 0.6 | 55.14 ± 1 | |||
| 313 | 52.2 ± 0.5 | 92.85 ± 1 | |||
| 323 | 86.3 ± 3.4 | 153.52 ± 6 | |||
| 0.9 | 298 | 17* | 21.68 | 46 ± 3 | –152 ± 10 |
| 303 | 46.1 ± 1.4 | 56.92 ± 2 | |||
| 313 | 74.0 ± 2.2 | 91.37 ± 3 | |||
| 323 | 140 ± 7 | 172.87 ± 8 | |||
| 1.05 | 298 | 25* | 22.67 | 43 ± 6 | –162 ± 11 |
| 303 | 59 ± 2 | 53.50 ± 2 | |||
| 313 | 96 ± 3 | 87.07 ± 3 | |||
| 323 | 160 ± 5 | 145.70 ± 5 |
Таблица 2.
Кинетические параметры образования DzBz3PzСо в пиридине ($C_{{{{{\text{H}}}_{{\text{2}}}}{\text{DzB}}{{{\text{z}}}_{{\text{3}}}}{\text{Pz}}}}^{0}$ = 1.53 × 10–5 моль/л)
| $C_{{{\text{Co(OAc}}{{{\text{)}}}_{2}}}}^{0}$ × 104, моль/л | Т, K | kэф × 104, с–1 | kv × 10–4, с–2 моль–2 л | Е, кДж/моль | ΔS≠, Дж/(моль К) |
|---|---|---|---|---|---|
| 1.5 | 298 | 1.34* | 0.39 | 61 ± 3 | –122 ± 12 |
| 293 | 1.34 ± 0.61 | 0.39 ± 0.3 | |||
| 303 | 3.59 ± 0.51 | 1.04 ± 0.2 | |||
| 313 | 6.72 ± 0.32 | 1.95 ± 0.1 | |||
| 3.0 | 298 | 5.4* | 0.39 | 59 ± 3 | –118 ± 14 |
| 293 | 5.4 ± 1.3 | 0.39 ± 0.1 | |||
| 303 | 11.69 ± 1 | 0.85 ± 0.1 | |||
| 313 | 25.15 ± 1 | 1.83 ± 0.1 | |||
| 4.5 | 298 | 11.43* | 0.37 | 51 ± 3 | –138 ± 13 |
| 293 | 11.43 ± 4 | 0.37 ± 0.2 | |||
| 303 | 23.33 ± 1 | 0.75 ± 0.1 | |||
| 313 | 43.93 ± 2 | 1.42 ± 0.1 | |||
| 6.0 | 298 | 16.54* | 0.30 | 46 ± 3 | –152 ± 14 |
| 293 | 16.53 ± 3 | 0.30 ± 0.1 | |||
| 303 | 36.24 ± 4 | 0.67 ± 0.1 | |||
| 313 | 55.31 ± 2 | 1.02 ± 0.1 |
Для определения порядка реакции по соли (n) построены зависимости lg kэф от lg ${{C}_{{{\text{М(OAc}}{{{\text{)}}}_{{\text{2}}}}}}}$ (рис. 3). Порядок реакции по ацетату кобальта, определенный как тангенс угла наклона, выше указанных зависимостей, он близок к 2 (1.8–2), как и в случае образования комплекса цинка.
Рис. 3.
Зависимости lg kэф от lg $C_{{{\text{Zn(OAc}}{{{\text{)}}}_{2}}}}^{0}$ для реакции образования DzBz3PzZn (а) и DzBz3PzCo (б) в пиридине.
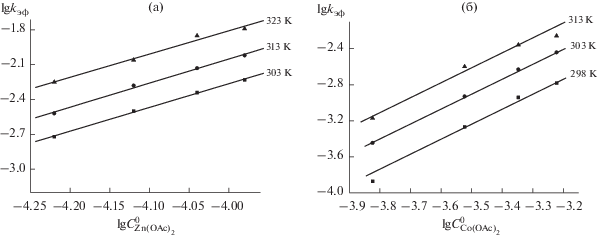
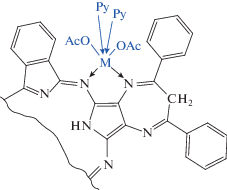
Столь необычный факт обнаружен для реакции комплексообразования порфиразинов впервые. Второй порядок по концентрации соли может быть следствием взаимодействия ионов Zn2+ и Co2+ с атомами азота в мезо-положении макроцикла и диазепинового фрагмента с образованием первичного внешнего комплекса (рис. 4). Поскольку реакция проходит в условиях избытка соли, можно полагать, что лиганд полностью превращается во внешний комплекс, т.е. равновесие (6) сдвинуто вправо.
(6)
$\begin{gathered} {{{\text{H}}}_{{\text{2}}}}{\text{DzB}}{{{\text{z}}}_{{\text{3}}}}{\text{Pz }} + {\text{ М(OAc}}{{{\text{)}}}_{{\text{2}}}}{{\left( {{\text{Ру}}} \right)}_{4}} \rightleftarrows \\ \rightleftarrows {\text{М(OAc}}{{)}_{2}}{{\left( {{\text{Ру}}} \right)}_{2}} \to {{{\text{H}}}_{{\text{2}}}}{\text{DzB}}{{{\text{z}}}_{{\text{3}}}}{\text{Pz}} + 2{\text{Ру}}. \\ {\text{внешний комплекс\;}} \\ \end{gathered} $Затем внешний комплекс реагирует со второй молекулой ацетата цинка или кобальта с образованием металлокомплекса.
(7)
$\begin{gathered} {\text{М(OAc}}{{{\text{)}}}_{{\text{2}}}}{{\left( {{\text{Ру}}} \right)}_{2}} \to {{{\text{H}}}_{{\text{2}}}}{\text{DzB}}{{{\text{z}}}_{{\text{3}}}}{\text{Pz}} + \\ + \,\,{\text{М(OAc}}{{{\text{)}}}_{{\text{2}}}}{{\left( {{\text{Ру}}} \right)}_{{\text{4}}}} \to {\text{DzB}}{{{\text{z}}}_{{\text{3}}}}{\text{PzМ}} + 2{\text{НOAc + }} \\ + \,\,6{\text{Py}} + {\text{ М(OAc}}{{)}_{2}}, \\ \end{gathered} $Тогда кинетическое уравнение реакции имеет вид:
(8)
$ - \frac{{d{{C}_{{{{{\text{H}}}_{2}}{\text{DzB}}{{{\text{z}}}_{3}}{\text{Pz}}}}}}}{{d\tau }} = {{k}_{v}}~{{C}_{{{{{\text{H}}}_{2}}{\text{DzB}}{{{\text{z}}}_{3}}{\text{Pz}}}}}~C_{{{\text{М}}{{{({\text{OAc}})}}_{2}}}}^{2}.$Справедливость данного уравнения подтверждается хорошим постоянством значения kv реакции (табл. 1, 2).
Образование промежуточного внешнего комплекса (рис. 4) в процессе комплексообразования H2DzBz3Pz с ацетатами исследуемых металлов возможно вследствие того, что n-электронные пары атомов азота иминных N=C-групп 6Н-1,4-диазепинового фрагмента выходят из плоскости макроцикла. Факт искажения кольца подтвержден данными рентгеноструктурного анализа 5,7-дифенил-2,3-дициано-6Н-1,4-диазепина [28]. Реакции образования комплексов Zn(II) и Co(II) характеризуются низкими значениями энергии и энтропии активации, что может свидетельствовать о сильной сольватации переходного состояния.
Известно [27], что скорости образования комплексов тетраазапорфирина H2TAP в пиридине с ионами металлов уменьшаются в ряду: Cu(II) > Zn(II) > Cd(II) > Co(II), данный ряд хорошо согласуется с экспериментальными данными, полученными в настоящей работе.
Скорости реакции и различия в скоростях образования комплексов металлов определяются в основном особенностями координационной сферы соли, стерическими факторами, действующими в переходном состоянии, а также полярностью связей N–H в макроцикле.
В ряду металлокомплексов энергетические параметры комплексообразования сильно зависят от иона металла. Уменьшению скорости комплексообразования с Co(II) по сравнению с Zn(II) соответствует увеличение значений E и ∆S≠.
Ранее показана возможность модификации диазепинового кольца либо при проведении сублимации H2DzBz3Pz [29], либо в условиях реакции циклотетрамеризации. В ходе синтеза H2DzBz3Pzв при темплатной конденсации фталодинитрила и 2,3-дициано-5,7-дифенил-1,4-диазепина в присутствии алкоголята лития получен 5-фенилтрибензо-1,4-пиразин-1(1Н)-6-он-2,3-порфиразин H2PyzBz3Pz [19]. Образование данного соединения, вероятно, обусловлено высокой щелочностью среды при использовании алкоголята лития.
Для данного соединения изучена реакция комплексообразования с ацетатом цинка [19]. Реакцию проводили в присутствии большого избытка соли. Прямолинейные зависимости lg(C0/C) от времени прохождения реакции подтверждают первый порядок по концентрации лиганда. На рис. 5 показаны спектральные изменения в ходе процесса образования комплекса PyzBz3PzZn, а на рис. 6 – зависимости lg kэф от lg $C_{{{\text{Zn(OAc}}{{{\text{)}}}_{2}}}}^{0}$. В табл. 3 представлены кинетические параметры образования Zn(II) комплекса.
Рис. 5.
Изменение ЭСП порфиразина H2PyzBz3Pz в процессе комплексообразования с Zn(OAc)2 (а) и Co(OAc)2 (б) в пиридине.
Рис. 6.
Зависимости lgkэф от lg$C_{{{\text{Zn(OAc}}{{{\text{)}}}_{2}}}}^{0}$ для реакции образования PyzBz3PzZn в пиридине.
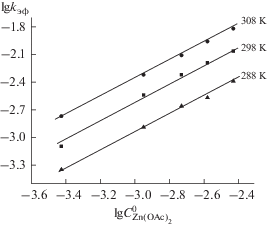
Таблица 3.
Кинетические параметры образования PyzBz3PzZn в пиридине ($C_{{{{{\text{H}}}_{{\text{2}}}}{\text{PyzB}}{{{\text{z}}}_{{\text{3}}}}{\text{Pz}}}}^{0}$ = 6.72 × 10–5 моль/л)
| $C_{{{\text{Zn(OAc}}{{{\text{)}}}_{2}}}}^{0}$ × 104, моль/л | Т, K | kэф × 104, с–1 | kv, с–1 моль–1 л | Е, кДж/моль | ΔS≠, Дж/(моль K) |
|---|---|---|---|---|---|
| 3.75 | 288 298 308 |
4.5 ± 0.2 8.0 ± 0.4 17.0 ± 0.5 |
1.20 ± 0.05 2.11 ± 0.10 4.45 ± 0.13 |
6 ± 1 | –280 ± 12 |
| 11.25 | 288 298 308 |
13.0 ± 0.5 29.0 ± 1.2 48.0 ± 0.9 |
1.22 ± 0.04 2.90 ± 0.11 4.30 ± 0.08 |
6 ± 1 | –280 ± 12 |
| 18.75 | 288 298 308 |
22.0 ± 1.1 48.0 ± 1.4 78.0 ± 1.6 |
1.22 ± 0.06 2.61 ± 0.07 4.22 ± 0.09 |
6 ± 1 | –277 ± 10 |
| 26.25 | 288 298 308 |
27.0 ± 1.0 64.0 ± 1.9 110.0 ± 3.3 |
1.01 ± 0.04 2.43 ± 0.07 4.22 ± 0.13 |
5 ± 1 | –278 ± 12 |
| 37.5 | 288 298 308 |
41.0 ± 1.6 86.0 ± 2.6 150.0 ± 3.0 |
1.13 ± 0.04 2.31 ± 0.07 4.01 ± 0.08 |
6 ± 1 | –274 ± 10 |
Для реакции образования комплекса PyzBz3PzZn порядок реакции по концентрации соли оказался равным 1. В соответствии с представлениями о механизме комплексообразования порфиринов [21, 30] установлено, что реакция протекает по бимолекулярному механизму, установленному ранее для большинства порфиринов. Необходимо отметить, что в пределах изученных концентраций соли в пиридиновых растворах состав сольватной координационной сферы ацетата цинка, структура и свойства растворителя практически не изменяются. Таким образом, кинетическое уравнение образования комплекса PyzBz3PzZn имеет вид:
(9)
$ - \frac{{d{{C}_{{{{{\text{H}}}_{2}}{\text{PyzB}}{{{\text{z}}}_{3}}{\text{Pz}}}}}}}{{d\tau }} = {{k}_{v}}~{{C}_{{{{{\text{H}}}_{2}}{\text{PyzB}}{{{\text{z}}}_{3}}{\text{P}}z}}}~{{C}_{{{\text{Zn}}{{{({\text{OAc}})}}_{2}}}}}.$Полагаем, что порфиразин PyzBz3PzZn имеет более плоскую сопряженную структуру по сравнению с DzBz3PzZn, и периферическое взаимодействие иона Zn(II) с атомами пиразинонового фрагмента становится невозможным. Более плоская сопряженная структура пиразинонового кольца в молекуле H2PyzBz3Pz подтверждается характером его ЭСП. В отличие от порфиразина H2DzBz3Pz, в этом случае исключается возможность сопряжения n-орбитали азометинового атома азота гетероциклического фрагмента с π-системой макроцикла и Qn-полоса не проявляется. Более подробное исследование аномалии электронного спектра поглощения диазепинотрибензопорфиразина проведено в работе [31].
ЗАКЛЮЧЕНИЕ
Исследованы реакции комплексообразования трибензопорфиразинов, содержащих диазепиновое кольцо H2DzBz3Pz и пиразиноновое кольцо H2PyzBz3Pz, с ацетатами Zn(II) и Co(II). Сравнение констант скоростей комплексообразования показало, что реакция образования DzBz3PzZn протекает быстрее, чем PyzBz3PzZn. Можно предположить, что образование внешнего комплекса благоприятствует внедрению иона цинка(II) в координационный центр макроцикла. Уменьшение скорости образования PyzBz3PzZn возможно за счет увеличения сольватации переходного состояния в случае порфиразина DzBz3PzZn.
Список литературы
Койфман О.И., Агеева Т.А., Базанов М.И. и др. Функциональные материалы на основе тетрапиррольных макрогетероциклических соединений, М.: Ленанд, 2019. 848 с.
Koifman O.I., Ageeva T.A., Beletskaya I.P. et al. // Macroheterocycles. 2020. V. 13. № 4. P. 311. https://doi.org/10.6060/mhc200814k
Kaigorodova E.Y., Mamardashvili G.M., Mamardashvili N.Z. // Russ. J. Inorg. Chem. 2018. V. 63. № 9. P. 1192. [Кайгородова Е.Ю., Мамардашвили Г.М., Мамардашвили Н.Ж. // Журн. неорган. химии. 2018. Т. 63. № 9. С. 1167.] https://doi.org/10.1134/S0036023618090061
Khelevina O.G., Malyasova A.S., Koifman O.I. // Russ. J. Gen. Chem. 2016. V. 86. № 6. P. 1494. [Хелевина О.Г., Малясова А.С., Койфман О.И. // Рос. хим. журн. 2014. Т. 58. № 3-4. С. 62.] https://doi.org/10.1134/S1070363216060451
Malyasova A.S., Ishutkina M.V., Maizlish V.E. et al. // Macroheterocycles. 2012. V. 5. № 2. P. 166. https://doi.org/10.6060/mhc2012.120574k
Vashurin A., Filippova A., Znoyko S. et al. // J. Porph. Phthal. 2015. V. 19. P. 983. https://doi.org/10.1142/S1088424615500753
Хелевина О.Г., Малясова А.С., Койфман О.И. // Журн. общ. химии. 2020. Т. 90. № 9. С. 1387. [Khelevina O.G., Malyasova A.S., Koifman O.I. // Russ. J. Gen. Chem. 2020. V. 90. № 9. P. 1646.] https://doi.org/10.1134/S1070363220090108
Koptyaev A.I., Khamdoush M., Fedoseev A.N. et al. // Macroheterocycles. 2018. V. 11. № 4. P. 412. https://doi.org/10.6060/mhc181114p
Torre P.V., Agullo-Lopez F., Torres T. // Chem. Rev. 2004. V. 104. P. 3723. https://doi.org/10.1021/cr030206t
Mikhina P.A., Mishchenko D.V., Lapshina M.A. et al. // Macroheterocycles. 2020. V. 13. № 2. P. 113. https://doi.org/10.6060/mhc200391g
Bichan N.G., Ovchenkova E.N., Mozgova V.A. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 5. P. 605. [Бичан Н.Г., Овченкова Е.Н., Мозгова В.А. и др. // Журн. неорган. химии. 2019. Т. 64. № 5. С. 490.] https://doi.org/10.1134/S0036023619050024
Ouedraogo S., Meunier-Prest R., Kumar A. et al. // ACS Sens. 2020. V. 5. P. 1849. https://doi.org/10.1021/acssensors.0c00877
Radiunas E., Dapkevičius M., Raišys S. et al. // Phys. Chem. 2020. V. 22. P. 7392. https://doi.org/10.1039/D0CP00144A
Motorina E.V., Lomova T.N., Mozhzhukhina E.G. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 12. P. 1538. [Моторина Е.В., Ломова Т.Н., Можжухина Е.Г. и др. // Журн. неорган. химии. 2019. Т. 64. № 12. С. 1294.] https://doi.org/10.1134/S0036023619120106
Ibrahim-Ouali M., Dumur F. // Molecules. 2019. V. 2. P. 1412. https://doi.org/10.3390/molecules24071412
Kuvshinova S.A., Novikov I.V., Kuvshinov G.V. et al. // Russ. J. Gen. Chem. 2019. V. 89. № 3. P. 574. [Кувшинова С.А., Новиков И.В., Кувшинов Г.В. и др. // Рос. хим. журн. 2016. Т. 60. № 5–6. С. 40.] https://doi.org/10.1134/S1070363219030381
Rodríguez-Morgade M.S., Stuzhin P.A. // J. Porph. Phthal. 2004. V. 8. № 9. P. 1129. https://doi.org/10.1142/S1088424604000490
Donzello M.P., Ercolani K., Mannina L. et al. // Austral. J. Chem. 2008. V. 61. P. 262. https://doi.org/10.1071/CH08071
Malyasova A.S., Kokareva E.A., Tarakanov P.A. et al. // Russ. J. Org. Chem. 2013. V. 49. № 12. P. 1812. [Малясова А.С., Кокарева Е.А., Тараканов П.А. и др. // Журн. орган. химии. 2013. Т. 49. № 12. С. 1830.] https://doi.org/10.1134/S1070428013120178
Органикум: практикум по органической химии. Т. 2. М.: Мир, 1979. 392 с.
Березин Б.Д. Координационные соединения порфиринов и фталоцианина. М.: Наука, 1978. 280 с.
Khelevina O.G., Bubnova A.S., Romanenko Yu.V. // Russ. J. Coord. Chem. 2007. V. 33. № 9. P. 634. [Хелевина О.Г., Бубнова А.С., Романенко Ю.В. // Коорд. химия. 2007. Т. 33. № 9. С. 646.] https://doi.org/10.1134/S1070328407090023
Berezin B.D., Koifman O.I. // Russ. Chem. Rev. 1973. V. 42. №11. P. 922. [Березин Б.Д., Койфман О.И. // Успехи химии. 1973. Т. 42. № 11. С. 2007.] https://doi.org/10.1070/RC1973v042n11ABEH002775
Берсукер И.Б. Строение и свойства координационных соединений. Л.: Химия, 1976. 352 с.
Березин Б.Д. // Теорет. эксперим. химия. 1973. Т. 9. № 4. С. 500.
Успехи химии порфиринов / Под ред. Голубчикова О.А. СПб.: НИИ химии СПбГУ, 1997. 170 с.
Khelevina O.G., Malyasova A.S. // J. Porph. Phthal. 2019. V. 23. № 11-12. P. 1251. https://doi.org/10.1142/S1088424619300246
Donzello M.-P., Ercolani C., Stuzhin P.A. et al. // Eur. J. Inorg. Chem. 1999. P. 2075. https://doi.org/10.1002/(SICI)1099-0682(199911)1999:11<2075::AID-EJIC2075>3.0.CO;2-X
Kokareva E.A., Khelevina O.G. // Russ. J. Org. Chem. 2012. V. 48. № 11. P. 1484. [Кокарева Е.А., Хелевина О.Г. // Журн. орган. химии. 2012. Т. 48. № 11. С. 1500.] https://doi.org/10.1134/S1070428012110115
Koifman O.I., Trifonova I.P., Burmistrov V.A. // Russ. Chem. Bull. 2015. V. 64. № 11. P. 2562. [Койфман О.И., Трифонова И.П., Бурмистров В.А. // Изв. АН. Сер. хим. 2015. № 11. С. 2562.] https://doi.org/10.1007/s11172-015-1191-0
Knyukshto V.N., Kuzmitsky V.A., Borisevich E.A. et al. // J. Appl. Spectr. 2009. V. 76. № 3. P. 341. [Кнюкшто В.Н., Кузьмицкий В.А., Борисевич Е.А. и др. // Журн. прикл. спектроскопии. 2009. Т. 76. № 3. С. 365.] https://doi.org/10.1007/s10812-009-9189-8
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии