Журнал неорганической химии, 2022, T. 67, № 3, стр. 403-408
Координация ионов в водных растворах хлорида и нитрата лантана согласно данным по дифракции рентгеновских лучей
П. Р. Смирнов a, *, О. В. Гречин b, А. С. Вашурин b
a Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, ул. Академическая, 1, Россия
b НИИ термодинамики и кинетики химических процессов, Ивановский государственный
химико-технологический университет
153000 Иваново, Шереметевский пр-т, 7, Россия
* E-mail: prs@isuct.ru
Поступила в редакцию 06.09.2021
После доработки 06.10.2021
Принята к публикации 15.10.2021
- EDN: SDGHKI
- DOI: 10.31857/S0044457X22030114
Аннотация
Из полученных в ходе эксперимента по дифракции рентгеновских лучей на жидкостях данных вычислены функции радиального распределения водно-электролитных систем, содержащих хлорид и нитрат лантана, в значительном интервале концентраций. Созданы разнообразные модели структуры исследованных систем. Для каждой модели рассчитан набор теоретических функций и проведено их сравнение с функциями, установленными в результате эксперимента. На основании наилучшей корреляции между экспериментом и расчетом определены оптимальные варианты. Получены количественные значения структурного описания ближнего окружения ионов, такие как числа координации, расстояния в рассеивающих группах и параметры ионных пар различных типов. Выявлено, что упорядоченность в ближнем окружении, формируемая ионом La3+ в водно-электролитных смесях его хлорида и нитрата, и ее трансформация при изменении концентрации схожи в обеих системах.
ВВЕДЕНИЕ
Физико-химические свойства иона La3+ и, в частности, структура ближней упорядоченности, формируемая им в растворах, вызывают значительный интерес исследователей в силу его высокой комплексообразующей способности. Структурные исследования водных растворов солей лантана, выполненные до 2012 г., обобщены в обзорах [1, 2]. Из работы [1] следует, что в разбавленных растворах, где достаточно молекул растворителя для полного структуроформирования, координационное число (КЧ) иона La3+ равно девяти, координационная оболочка имеет форму тригональной призмы с тремя дополнительными молекулами воды вне ее. Усредненное расстояние до шести ближних молекул воды составляет 0.252 нм, а до трех других, расположенных в аксиальном положении, – 0.265 нм. Вторая оболочка координации четко не установлена: количество молекул в ней составляет от 6 до 23.4, а расстояния – от 0.460 до 0.500 нм. Ион La3+ проявляет способность к ионной ассоциации. Выявлены как контактные, так и неконтактные ионные пары в зависимости от химической природы анионов и концентрации. В обзоре [2] приведенный диапазон расстояний La3+–O находится в интервале от 0.250 до 0.265 нм, а КЧ – от 8 до 9.1.
Впоследствии методом молекулярной динамики (МД) определено среднее КЧ иона La3+, равное 9.5, и расстояние до молекул воды, координируемых в первой оболочке, – 0.261 нм. Вторая оболочка координации имеет 25.6 молекул растворителя на расстоянии 0.470 нм. Помимо нона- и декагидратов с трехшапочной тригональной и квадратной призматической структурой в системе присутствует незначительное количество октагидратов [3]. Тем же методом установлено, что первая сфера из девяти молекул воды находится на расстоянии 0.250 нм, вторая из 18-ти молекул – на расстоянии 0.469 нм [4]. Путем вычислений с использованием волновых функций также подтверждено КЧ иона La3+, равное девяти [5]. На основании анализа угловых функций распределения сделан вывод о том, что предпочтительной геометрией первой координационной сферы иона лантана является не трехшапочная тригональная призма, а удлиненная квадратная антипризма [6]. В другой работе отмечается, что геометрия координационной сферы иона лантана представляет собой либо искаженную трехшапочную тригональную призму, либо искаженную удлиненную квадратную антипризму [7]. Методами МД и EXAFS-спектроскопии установлено, что в 0.1 М растворе нитрата лантана катион координирует в первой сфере 9.5 молекул воды на расстоянии 0.257 нм [8, 9]. Вторая оболочка сформирована из семнадцати молекул воды на расстоянии 0.471 нм. Установлено, что нитрат-ион отсутствует в первой координационной сфере иона La3+. Координация катионом девяти молекул воды подтверждена и методом спектроскопии КР [10, 11]. Расстояние La3+–O, равное 0.257 нм, при КЧ иона La3+, равном девяти, было также подтверждено методом МД [12].
Результаты исследований ионной ассоциации в растворах лантана весьма неоднозначны. Так, методом абсорбционной спектроскопии установлено, что в водных растворах хлорида и бромида лантана при увеличении концентрации вплоть до 3.3 моль/л образуются только неконтактные ионные пары [13]. Методом спектроскопии КР в концентрированных растворах перхлората лантана выявлено образование неконтактных и контактных ионных пар [14]. В растворах LaCl3 хлорокомплексы вида {La(OH2)9–nCln}+3–n (n = 1–3) обнаружены в более широком концентрационном диапазоне 0.5–3.05 моль/л. Отмечена слабая устойчивость этих комплексов и их исчезновение при концентрациях <0.1 моль/л. В растворах La(NO3)2 в интервале концентраций от 0.121 до 1.844 моль/л также обнаружены комплексы вида {La(OH2)9–n(NO3)n}+3–n (n = 1, 2), исчезающие при разбавлении. В растворах сульфата лантана образуются внутрисферные комплексы, в которых сульфат-ион ведет себя как монодентатный лиганд [15]. При этом даже при очень сильном разбавлении (0.00026 моль/л) предполагается частичное сохранение контактных ионных пар (КИП). Растворы хлорида, нитрата и сульфата лантана исследованы с применением спектроскопии диэлектрической релаксации [16]. Доказана высокая степень гидратируемости катиона вплоть до частичного формирования им третьей координационной сферы. Установлено, что его ассоциация с анионами усиливается в следующем порядке Cl– < ${\text{NO}}_{3}^{ - }$ < ${\text{SO}}_{4}^{{2 - }}$ , при этом образуются дважды сольваторазделенные ионные пары типа 1 : 1. Отсутствие в растворах хлорида лантана КИП при концентрациях <1.3 моль/л выявлено методом спектроскопии КР в работе [17]. Авторы отмечают увеличение количества сольваторазделенных ионных пар с ростом концентрации.
Несмотря на многообразие проведенных исследований, не установлено очевидного влияния концентрации на структуру гидратных оболочек катиона. С целью определения изменения структуры ближнего окружения ионов с концентрацией в настоящей работе исследованы растворы хлорида и нитрата лантана в наиболее широком для метода РСА концентрационном диапазоне. Следует отметить, что данная работа является продолжением системного исследования нашей группой растворов солей лантаноидов [18, 19].
О структуроопределяющих свойствах изучаемых в работе анионов известно, что ион Cl– гидратирован шестью–семью молекулами, находящимися на среднем расстоянии 0.315 нм [20, 21]. Весьма спорно значение его гидратного числа 7.5–8, определенного в концентрированном растворе хлорида лития [22]. Нитрат-ион имеет слабоструктурированную, очень подвижную гидратную оболочку [23], поэтому количество молекул воды в ней сильно зависит от концентрации и природы катиона. Так, расстояние N–OH2 определяется в весьма широком интервале значений от 0.340 до 0.385 нм.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали модельный подход к анализу функций радиального распределения (ФРР), полученных в ходе эксперимента для насыщенных растворов хлорида и нитрата лантана и растворов с мольными соотношениями 1 : 20, 1 : 40 и 1 : 80, определенных методом дифракции рентгеновских лучей на жидкостях в работе [24]. Он заключается в создании разнообразных моделей структурной упорядоченности в водно-электролитных смесях и последующем вычислении набора теоретических функций для каждой модели. Далее оценивали корреляцию теории и эксперимента с последующей оптимизацией моделей до достижения лучшего согласования теоретических и экспериментальных функциональных зависимостей. Это позволило получить наилучшие варианты структурной организации исследуемых растворов.
Для вычисления структурно значимых функциональных зависимостей из результатов эксперимента и их аналогов для разработанных моделей применяли программу KURVLR [25]. В расчеты были включены величины интенсивностей рассеяния рентгеновского излучения, определенные в ходе эксперимента при каждом шаге углового сканирования, которые корректировали путем введения поправок на фоновое излучение и поглощение образца, число сортов атомов и соответствующие им концентрации, число точек, достигнутых в ходе эксперимента, величины волнового вектора для каждой экспериментальной точки, стехиометрический объем, длину волны излучения, значения амплитуд рассеяния каждым атомом, интенсивности некогерентного рассеяния и их долю в общей интенсивности рассеяния.
Структурные функции i(s) определяли по выражению:
в котором Icoh(s) – интенсивность когерентного рассеяния, xi – число атомов сорта i в стехиометрическом объеме V, fi(s) – рассеивающие факторы i-го атома.ФРР рассчитывали путем преобразования Фурье по формуле:
Исходя из определенной в ходе проведения эксперимента информации и литературных источников созданы модели структуры исследуемых водно-электролитных систем. Размещение ионов и молекул в них осуществляли путем задания координат для каждой частицы. Собственную структуру растворителя, которая не была нарушена ионами, включали в расчеты в виде фрагментарных тетраэдрических комплексов. Для расчета теоретических функций вводили количество молекулярных комплексов, их концентрации и радиусы, число и координаты частиц, составляющих молекулярный комплекс, а также их среднеквадратичные отклонения от положения равновесия. Радиусы молекулярных комплексов определяли на основе сложения ионных радиусов и эффективного радиуса молекулы воды. Расчет теоретических структурных функций для этих моделей проводили по формуле:
(3)
$\begin{gathered} i{{(s)}_{{calc}}} = \sum\limits_i {\sum\limits_j {{{x}_{i}}{{n}_{{ij}}}{{f}_{i}}(s){{f}_{j}}(s)\sin ({{r}_{{ij}}}s){{{({{r}_{{ij}}}s)}}^{{ - 1}}}\exp \left( { - {{b}_{{ij}}}{{s}^{2}}} \right) - } } \\ i \ne j \\ - \,\,\sum\limits_i {\sum\limits_j {{{x}_{i}}{{x}_{j}}{{f}_{i}}(s){{f}_{j}}(s)4\pi R_{j}^{3}{{V}^{{ - 1}}}} } \left\{ {\sin ({{R}_{j}}s) - {{R}_{j}}s{\kern 1pt} \cos ({{R}_{j}}s)} \right\}{{({{R}_{j}}s)}^{{ - 3}}}\exp ( - {{B}_{j}}{{s}^{2}}). \\ \end{gathered} $Первая часть уравнения относится к взаимодействиям на коротких расстояниях, характеризуемых расстоянием rij, температурным фактором bij и количеством парных взаимодействий nij между атомами i и j. Вторая часть уравнения соответствует взаимодействию между сферическим объемом и непрерывной электронной плотностью, находящейся за этим объемом. Rj – радиус сферического объема вокруг j-го атома, а Bj – параметр, описывающий ослабление континуума электронной плотности. Математическим критерием соответствия функций служил фактор рассогласования, рассчитанный по методу наименьших квадратов в каждой точке структурных функций.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
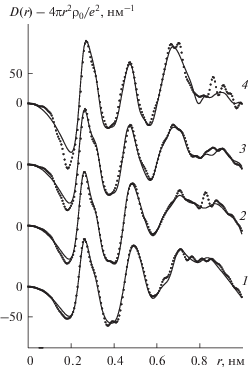
На рис. 1, 2 представлены ФРР исследованных растворов. Они схожи между собой. Первый пик на всех ФРР при 0.260–0.265 нм отражает вклады от рассеивающих групп катион–первая координационная сфера (La3+–OH2) в общую картину рассеяния и включает в себя вклады от расстояний между ближайшими молекулами воды, реализуемые при 0.290 нм. На ФРР водно-электролитной системы, включающей хлорид лантана, на первом пике имеется плечо с правой стороны. Оно определяется вкладами от гидратации анионов (Cl––H2O) на среднем расстоянии 0.310 нм. Второй пик у насыщенного раствора LaCl3 имеет место при 0.490 нм и сдвигается в сторону меньших расстояний при разбавлении. У насыщенного раствора La(NO3)3 он находится на расстоянии 0.470 нм и не меняет своего положения с разбавлением. Этот пик содержит вклады от расстояний от катиона до второй координационной сферы (La3+–H2OII) с примерным расстоянием 0.470 нм и вклады от расстояний между молекулами воды по ребру тетраэдра в сетке растворителя ~0.450 нм. В четвертый широкий и интенсивный пик, находящийся в интервале 0.6–0.7 нм, вносит вклад большое количество взаимодействий, поэтому не ставилась задача его расшифровки и количественной обработки.
Рис. 1.
Экспериментальные функции радиального распределения водных растворов хлорида лантана с мольными соотношениями соль : вода = 1 : 14.5 (1), 1 : 20 (2), 1 : 40 (3), 1 : 80 (4) (точки) и теоретические функции, рассчитанные для оптимальных моделей (сплошные линии).
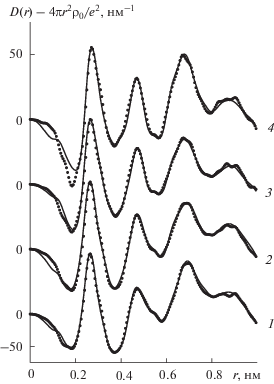
Рис. 2.
Экспериментальные функции радиального распределения водных растворов нитрата лантана с мольными соотношениями соль : вода = 1 : 13 (1), 1 : 20 (2), 1 : 40 (3), 1 : 80 (4) (точки) и теоретические функции, рассчитанные для оптимальных моделей (сплошные линии).
Модельный подход изначально использовался для насыщенного раствора хлорида лантана. Первичная модель, включавшая девять молекул воды в ближайшем окружении катиона и шесть молекул воды в гидратной сфере аниона при независимой гидратации ионов, не привела к удовлетворительному соответствию экспериментальной и расчетной функций. Интенсивность первого пика, соответствующего взаимодействию иона La3+ с его первой координационной сферой, и плеча с правой стороны этого пика на расчетных функциях была значительно завышена. Интенсивность второго пика, наоборот, была существенно ниже. Поэтому в следующей модели количество молекул воды в ближнем окружении ионов было уменьшено. Для описания второго пика в модель была включена неконтактная ионная пара. Рассчитанные функции хорошо соответствовали экспериментальным. В результате проведенной корректировки в качестве оптимального выявлен вариант, в котором катион координирует шесть молекул воды на расстоянии 0.256 нм. Сформированы неконтактные ионные ассоциаты с расстоянием La3+–Cl– 0.490 нм. Анионы также имеют несколько устойчивых взаимодействий с молекулами воды их гидратных сфер на расстоянии 0.310 нм. Такие взаимодействия, нехарактерные для анионов в столь концентрированной системе, возникают из-за их устойчивого расположения в начинающей формироваться второй координационной сфере катиона и соседства с определяющими ее молекулами растворителя и молекулами воды первой сферы. Соответствие расчетной и экспериментальной функций показано на рис. 1, а основные параметры модели приведены в табл. 1.
Таблица 1.
Основные структурные параметры оптимальных моделей водных растворов хлорида лантана
| Тип взаимодействия | Мольное соотношение | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 : 14.5 | 1 : 20 | 1 : 40 | 1 : 80 | |||||
| r | n | r | n | r | n | r | n | |
| La3+–O | 0.258 – |
6.2 – |
0.253 0.265 |
6.0 1.45 |
0.252 0.265 |
6.0 3.0 |
0.252 0.265 |
6.0 3.0 |
| La3+–OII | 0.460 | 4.2 | 0.467 | 6.5 | 0.470 | 10.4 | 0.470 | 16.0 |
| Cl––O | 0.310 | 3.8 | 0.316 | 4.5 | 0.320 | 6.0 | 0.325 | 6.5 |
| La3+–Cl– | 0.490 | 2.2 | 0.505 | 2.2 | 0.505 | 1.7 | 0.495 | 1.5 |
Примечание. Здесь и в табл. 2 r – межчастичное расстояние, нм; n – количество парных взаимодействий, реализующихся на расстоянии r.
Далее анализировали раствор с мольным соотношением 1 : 20. За основу при разработке модели была взята модель, полученная в качестве оптимальной для насыщенного раствора с соответствующим изменением концентраций компонентов. Расчетные функции показали необходимость корректировки первоначального варианта. Первый и второй пики на расчетных функциях оказались менее интенсивными, чем экспериментальные. Это свидетельствовало о недостатке молекул воды, включенных в координационные оболочки катиона. Добавление в модели молекул воды в аксиальные положения первой координационной сферы катиона и увеличение количества молекул растворителя в его второй координационной сфере привели к хорошему соответствию функций.
По аналогичному алгоритму осуществляли модельный подход и к анализу более разбавленных растворов. Соответствие расчетных и экспериментальных функций показано на рис. 1, а основные параметры оптимальных моделей приведены в табл. 1. В результате можно заключить, что при разбавлении насыщенного водного раствора хлорида лантана происходят следующие структурные изменения в ближнем порядке, формируемом ионами. Число молекул воды в первой координационной сфере иона La3+ возрастает от шести до девяти. При этом три молекулы растворителя занимают в координационной сфере катиона аксиальные положения. Количество молекул воды во второй координационной оболочке иона La3+ возрастает до шестнадцати, неконтактный ионный тройник теряет один анион, превращаясь в неконтактную ионную пару. Анионы формируют гидратное окружение из 6.5 молекул воды.
Затем по аналогичному алгоритму был использован модельный подход для анализа структуры водных растворов нитрата лантана. Нитрат-ион был задан в виде плоской фигуры с расстояниями N–O и O–O 0.126 и 0.219 нм соответственно. Функции, рассчитанные для моделей, включавших независимую гидратацию ионов, не полностью соответствовали экспериментальным. На расчетных функциях отсутствовало плечо с правой стороны основного пика и интенсивность в области 0.4 нм была ниже, чем на экспериментальных ФРР. Включение в модели ионных ассоциатов неконтактного типа, в которых атом кислорода иона ${\text{NO}}_{3}^{ - }$ находился на расстоянии La3+–O(${\text{NO}}_{3}^{ - }$) 0.315 нм, а расстояние La3+–N составляло 0.405 нм, привело в итоге к хорошему соответствию функций (рис. 2). Параметры оптимальных моделей приведены в табл. 2. Анализ таблицы показал, что при разбавлении насыщенного водного раствора нитрата лантана число молекул воды в первой координационной сфере иона La3+ возрастает от шести до девяти. При этом три молекулы растворителя занимают в координационной сфере катиона аксиальные положения. Количество молекул воды во второй координационной оболочке катиона возрастает до шестнадцати, неконтактный ионный ассоциат сохраняется во всем исследованном концентрационном интервале. Дробное значение количества взаимодействий La3+–N свидетельствует о том, что в растворах присутствуют как неконтактные ионные пары, так и более сложные ассоциаты. Количество молекул воды в гидратных сферах анионов с разбавлением возрастает до девяти.
Таблица 2.
Основные структурные параметры оптимальных моделей водных растворов нитрата лантана
| Тип взаимодействия |
Мольное соотношение | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 : 13 | 1 : 25 | 1 : 40 | 1 : 80 | |||||
| r | n | r | n | r | n | r | n | |
| La3+–O | 0.258 – |
6.1 – |
0.255 0.266 |
6.0 0.5 |
0.252 0.265 |
6.0 2.8 |
0.252 0.265 |
6.0 3.0 |
| La3+–OII | 0.480 | 3.0 | 0.480 | 4.1 | 0.484 | 12.8 | 0.484 | 15.0 |
| N–${{{\text{O}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | 0.345 | 4.0 | 0.345 | 4.0 | 0.345 | 6.0 | 0.345 | 9.0 |
| La3+–N | 0.405 | 1.5 | 0.403 | 1.5 | 0.403 | 1.5 | 0.403 | 1.5 |
ЗАКЛЮЧЕНИЕ
Уменьшение концентрации растворов хлорида и нитрата лантана ведет к схожим изменениям в структуре ближнего окружения катиона, а именно к увеличению количества молекул воды в его первой координационной оболочке от шести до девяти. При этом три молекулы воды последовательно занимают аксиальные положения. Неконтактные ионные ассоциаты сохраняются в растворах во всем исследованном интервале концентраций.
Список литературы
Смирнов П.Р., Тростин В.Н. // Журн. общей химии. 2012. Т. 82. № 3. С. 366. [Smirnov P.R., Trostin V.N. // Russ. J. Gen. Chem. 2012. V. 82. № 3. P. 3600.] https://doi.org/10.1134/S1070363212030036
D'Angelo P., Spezia R. // Chemistry. 2012. V. 18. № 36. P. 11162. https://doi.org/10.1002/chem.201200572
Lutz O.M.D., Hofer T.S., Randolf B.R. et al. // Chem. Phys. Lett. 2012. V. 536. P. 50. https://doi.org/10.1016/j.cplett.2012.03.065
Marjolin A., Gourlaouen C., Clavaguéra C. et al. // J. Mol. Model. 2014. V. 20. P. 2471. https://doi.org/10.1007/s00894-014-2471-6
Zhang J., Heinz N., Dolg M. // Inorg. Chem. 2014. V. 53. № 14. P. 7700. https://doi.org/10.1021/ic500991x
Morales N., Galbis E., Martínez J.M. et al. // J. Phys. Chem. Lett. 2016. V. 7. № 21. P. 4275. https://doi.org/10.1021/acs.jpclett.6b02067
Qiao B., Skanthakumar S., Soderholm L. // J. Chem. Theory Comput. 2018. V. 14. № 3. P. 1781. https://doi.org/10.1021/acs.jctc.7b01018
Migliorati V., Serva A., Terenzio F.M. et al. // Inorg. Chem. 2017. V. 56. № 11. P. 6214. https://doi.org/10.1021/acs.inorgchem.7b00207
Migliorati V., Serva A., Sessa F., et al. // J. Phys. Chem. B. 2018. V. 122. № 10. P. 2779. https://doi.org/10.1021/acs.jpcb.7b12571
Rudolph W.W., Irmer G. // Dalton Trans. 2017. V. 46. P. 4235. https://doi.org/10.1039/C7DT00008A
Rudolph W.W., Irmer G. // J. Solut. Chem. 2020. V. 49. P. 316. https://doi.org/10.1007/s10953-020-00960-w
Shiery R.C., Fulton J.L., Balasubramanian M. et al. // Inorg. Chem. 2021. V. 60. № 5. P. 3117. https://doi.org/10.1021/acs.inorgchem.0c03438
Sharma V., Böhm F., Seitz M. et al. // Phys. Chem. Chem. Phys. 2013. V. 15. № 21. P. 8383. https://doi.org/10.1039/c3cp50865j
Rudolph W.W., Irmer G. // Dalton Trans. 2015. V. 44. P. 295. https://doi.org/10.1039/C4DT03003F
Rudolph W.W., Irmer G. // RSC Adv. 2015. V. 5. P. 84999. https://doi.org/10.1039/c5ra16900c
Friesen S., Krickl S., Luger M. et al. // Phys. Chem. Chem. Phys. 2018. V. 20. P. 8812. https://doi.org/10.1039/C8CP00248G
Roy S., Patra A., Saha S. et al. // J. Phys. Chem. B. 2020. V. 124. № 37. P. 8141. https://doi.org/10.1021/acs.jpcb.0c05681
Смирнов П.Р., Гречин О.В. // Журн. физ. химии. 2018. Т. 92. № 1. С. 96. [Smirnov P.R., Grechin O.V. // Russ. J. Phys. Chem. A. 2018. V. 92. № 1. P. 79.] https://doi.org/10.1134/S0036024418010259
Смирнов П.Р., Гречин О.В. // Известия АН. Сер. хим. 2018. № 1. С. 23. [Smirnov P.R., Grechin O.V. // Russ. Chem. Bull. Intern. Edition. V. 67. № 1. P. 23.]
Antalek M., Pace E., Hedman B. et al. // J. Chem. Phys. 2016. V. 145. № 4. P. 044318. https://doi.org/10.1063/1.4959589
Bankura A., Santra B., DiStasio R.A. Jr. et al. // Mol. Phys. 2015. V. 113. № 17–18. P. 2842. https://doi.org/10.1080/00268976.2015.1059959
Pluhařová E., Fischer H.E., Mason P.E. et al. // Mol. Phys. 2014. V. 112. № 9–10. P. 1230. https://doi.org/10.1080/00268976.2013.875231
Cordeiro R.M., Yusupov M., Razzokov J. et al. // J. Phys. Chem. B. 2020. V. 124. № 6. P. 1082. https://doi.org/10.1021/acs.jpcb.9b08172
Гречин О.В., Смирнов П.Р., Тростин В.Н. // Изв. ВУЗов. Химия и хим. технология. 2013. Т. 56. Вып. 3. С. 15.
Johansson G., Sandström M. // Chem. Scripta. 1973. V. 4. № 5. P. 195.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


