Журнал неорганической химии, 2022, T. 67, № 3, стр. 342-359
Химия и направления практического применения дипиррометеновых лигандов, солей и координационных соединений как оптических сенсоров аналитов различной природы (обзор)
Е. В. Антина a, М. Б. Березин a, А. И. Вьюгин a, Г. Б. Гусева a, Н. А. Бумагина a, *, Л. А. Антина a, А. А. Ксенофонтов a, Е. Н. Нуранеева a, b, А. А. Калягин a, П. С. Бочаров a, b, М. М. Луканов a, b, З. С. Красовская a, b, В. А. Калинкина a, b, С. А. Догадаева a, b
a Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, ул. Академическая, 1, Россия
b Ивановский государственный химико-технологический университет
153000 Иваново,
Шереметевский пр-т, 7, Россия
* E-mail: nad@isc-ras.ru
Поступила в редакцию 03.09.2021
После доработки 18.10.2021
Принята к публикации 21.10.2021
- EDN: EQOVVQ
- DOI: 10.31857/S0044457X22030035
Аннотация
Дано краткое описание результатов, полученных за последние два десятилетия сотрудниками ИХР РАН, и будущих перспективных разработок в области физической, неорганической и супрамолекулярной химии дипиррометеновых красителей и люминофоров. Основное внимание уделено описанию спектральных и других практически значимых характеристик дипиррометеновых лигандов, солей и устойчивых координационных соединений, обеспечивающих им свойства хромофорных и флуоресцентных хемосенсоров для обнаружения аналитов различной природы.
ВВЕДЕНИЕ
Фундаментальная база химии олигопиррольных соединений была заложена в первой половине XX в. основателем Мюнхенской школы синтетиков Хансом Фишером. Важнейшим достижением этой школы стало получение и изучение свойств порфина, пигментов крови – гема (1929 г.), желчи – билирубина (1931 г.), растений – хлорофиллов и фитохромов (1940 г.). В последующие десятилетия наряду с большими достижениями в химии порфиринов и желчных пигментов начинает формироваться направление химии дипиррометенов и других открытоцепных олигопиррольных соединений, построенных из двух и более дипиррометеновых доменов. Отмеченные еще Хансом Фишером интересные хромофорные и координационные свойства дипиррометенов на протяжении долгого времени оставались неизученными, а синтезированные дипиррометены, биладиены и билатриены находили применение преимущественно в качестве прекурсоров в матричном синтезе макроциклических структур. Повышенный интерес ученых к этой группе соединений возник после опубликования Хансом Фальком в 1989 г. монографии, в которой впервые были обобщены перспективные результаты исследований в области химии олигопиррольных пигментов [1].
Сформированные за прошедшие 30 лет фундаментальные представления об особенностях физико-химических свойств лигандов, солей и координационных соединений дипиррометеновых красителей стали базой для развития наиболее актуального современного направления практического применения олигопиррольных красителей и люминофоров в качестве сенсоров, маркеров, агентов фотодинамической терапии и др.
Амфотерность, обусловленная протонодонорным (>NH) и электронодонорным (≥N) центрами, позволяет дипиррометеновому лиганду образовывать соли с кислотами и координационные соединения. Протяженная ароматическая система обеспечивает интенсивное поглощение в видимой области спектра лигандам, солям и координационным соединениям дипиррометенов. Высокая характеристичность электронных спектров поглощения (ЭСП) лигандов, солей и комплексов дипиррометенов, интенсивная флуоресценция и высокая устойчивость ряда координационных соединений обеспечивают условия для применения различных химических форм дипиррометенов в сенсорике.
К настоящему времени известны комплексы открытоцепных моно- и бис(дипиррометенов) со многими s-, p-, d-элементами и лантанидами. В зависимости от природы и заряда иона-комплексообразователя, строения лиганда продуктами реакций комплексообразования дипиррометенов или бис(дипиррометенов) могут быть моно-, би- или полиядерные, гомо- или гетеролигандные хелаты с различной трехмерной структурой, в том числе двойной и тройной спирали и др.
Синтез открытоцепных моно-, бис(дипиррометенов) и их комплексов относительно прост и менее трудоемок [1–11] по сравнению с методиками получения макроциклических олигопиррольных красителей. Алкил-, галогензамещенные моно- и бис(дипиррометены) получают в виде солей с бромистоводородной или другими минеральными кислотами [2, 3], в составе которых хромофоры наиболее стабильны по сравнению с арилзамещенными аналогами, устойчивыми в молекулярной форме [4]. Синтез дипиррометенатов осуществляют в одну стадию реакцией олигопиррола с соответствующей солью или эфиратом трифторида бора(III) в соответствующем органическом растворителе с высоким (до 97%) выходом [6–11].
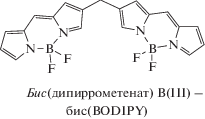
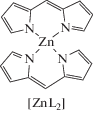
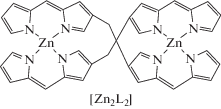
Среди известных к настоящему времени олигопиррольных координационных соединений наиболее устойчивыми, фото- и термостабильными оказались комплексы бора(III), кобальта(II), никеля(II), меди(II), цинка(II), кадмия(II) и ртути(II). Сочетание этих характеристик с интенсивными хромофорными и люминесцентными свойствами придает наибольшую практическую значимость, в первую очередь комплексам дипиррометенов и бис(дипиррометенов) с B(III), Zn(II), Cd(II) и Hg(II). В области сенсорики лиганды, их соли с минеральными кислотами и хелаты (табл. 1) образуют группу наиболее практически перспективных дипиррометеновых соединений, чьи сенсорные свойства обеспечиваются яркими спектральными и люминесцентными откликами следующих реакций: протонирования лигандов при взаимодействии с кислотами с образованием солей, депротонирования лигандов при диссоциации солей в присутствии сильных протоноакцепторов, комплексообразования лигандов с ионами ряда металлов с образованием хелатов, супрамолекулярного комплексообразования хелатов с полярными или ароматическими соединениями.
Таблица 1.
Лиганды, бромистоводородные соли и комплексы с B(III) и Zn(II) дипиррометенов и 3,3′-бис(дипиррометенов)
| Дипиррометены и их комплексы с B(III) и Zn(II) | Бис(дипиррометены) и их комплексы с B(III) и Zn(II) |
|---|---|
 |
 |
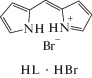 |
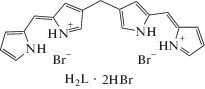 |
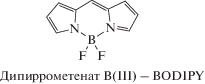 |
 |
 |
 |
Особенно большой практический потенциал заложен в уникально высокой чувствительности флуоресценции ряда дипиррометеновых хелатов к природе среды, обусловленной дополнительной координацией электронодонорных аналитов во внутренней координационной сфере молекулярного комплекса или супрамолекулярным комплексообразованием с протоно- и электронодонорными ароматическими аналитами за счет кислотно-основных взаимодействий или π–π-стекинга.
В обзоре дано краткое описание спектральных и других практически значимых характеристик дипиррометеновых лигандов, солей и важнейших координационных соединений, обеспечивающих им свойства хромофорных и флуоресцентных хемосенсоров для обнаружения аналитов различной природы.
Практически значимые спектральные свойства лигандов, солей и хелатов дипиррометенов и бис(дипиррометенов)
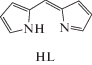
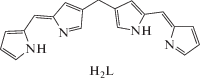
Лиганды и соли дипиррометенов (HL, HL · HBr) и бис(дипиррометенов) (H2L, H2L · 2HBr) – высокоактивные хромофоры с интенсивной окраской от ярко-желтого до оранжево-красного цвета (табл. 2). Поглощающая способность дипиррометеновых хромофоров напрямую зависит от степени поляризации сопряженных π-электронных систем их молекул за счет специфических и универсальных контактов, возникающих при обратимом протонировании, комплексообразовании, сольватации. Среди структурных факторов заметное влияние на хромофорные свойства открытоцепных олигопирролов оказывает природа (электронные и стерические эффекты) периферийных заместителей, природа и способ присоединения межпиррольных спейсеров, а также количество дипиррометеновых доменов в олигопиррольной цепи [12–20].
Таблица 2.
Некоторые структуры синтезированных олигопирролов со значениями положений максимумов полос в ЭСП ($\lambda _{{\max }}^{{погл}}$) и коэффициентами экстинкции (lg ε) в растворах органических растворителей
| Дипиррометены | ||
|---|---|---|
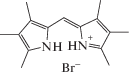 |
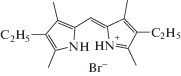 |
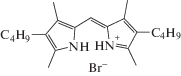 |
| 1 | 2 | 3 |
| C6H6: 484 (4.66); 364 (3.41) CHCl3: 483 (4.75); 362 (4.02) PrOH: 478 (4.61); 361 (3.75) ДМФА: 435 (4.67) |
C6H6: 494; 364 CHCl3: 488; 363 PrOH: 479; 362 ДМФА: 438 |
C6H6: 498; 368 CHCl3: 490; 362 PrOH: 480; 363 ДМФА: 440 |
| Бис(дипиррометены) | ||
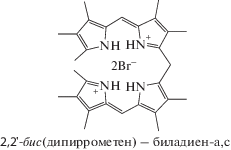 |
 |
|
| 4 | 5 | |
| C6H6: 485; 366 CHCl3: 482; 363 CCl4: 484; 370 ДМФА: 438 (4.55) |
CHCl3: 509 (5.23); 462 (4.69); 363 (4.11) EtOH: 503 (5.05); 454 (4.73); 364 (4.07) ДМФА: 505 (4.82); 458 (4.56); 373 (4.01) (c ~ 1 × 10–4 моль/л) ДМФА: 426 (c ~ 1 × 10–6 моль/л) |
|
 |
C6H6: 507; 466пл; 365 CHCl3: 502 (5.43); 461пл; 364 ДМФА: 496 (4.87); 456пл; 372-375 (c = 1 × 10–4 моль/л) ДМФА: 456 (4.67) (c ~ 1 × 10–6 моль/л) |
|
| 6 | ||
Характерным признаком ЭСП протонированных форм дипиррометенов и бис(дипиррометенов) в составе соответствующих солей HL · HBr и H2L · 2HBr в неполярных, ароматических, протонодонорных и высококонцентрированных электронодонорных средах является наличие высокоинтенсивной полосы S0–S1 с максимумом при 478–508 нм (lg ε ~ 3.9–5.5) и плечом в области 458–467 нм и низкоинтенсивной полосы S0–S2 с максимумом при 360–380 нм (lgε ~ 3.4–4.3) [3, 20]. В ЭСП разбавленных растворов (≤10–5 моль/л) в электронодонорных средах длинноволновая полоса протонированного хромофора с гипсогипохромным эффектом преобразуется в полосу молекулярной формы лиганда (HL или H2L) как продукта сольволитической диссоциации соли из-за связывания электронодонорным растворителем протона HBr (рис. 1а) [3, 20].
Рис. 1.
Изменения в ЭСП при депротонировании соли тетрапиррола H2L · 2HBr до молекулярного лиганда H2L (а) и комплексообразовании алкилзамещенного 3,3′-бис(дипиррометена) H2L с Zn(AcO)2 в диметилформамиде (ДМФА) (б).
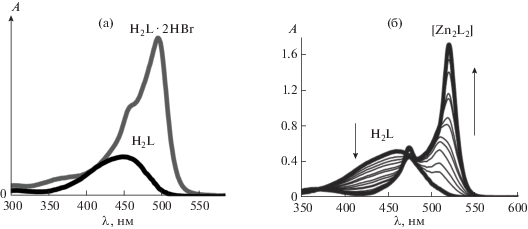
Ауксохромный эффект поляризации ароматической системы дипиррометена протоном, рассчитанный как $\Delta {{\lambda }^{{{{{\text{H}}}^{ + }}}}}$ = $\lambda _{{\max }}^{{соли}} - \lambda _{{\max }}^{{лиганда}}$, достигает 30–70 нм.
Координация лигандов с двух- и трехзарядными катионами s-, p-, d- или f-элементов в хелаты сопровождается бато- и гиперхромными эффектами интенсивной S0–S1-полосы поглощения (рис. 1б) [5]. Ауксохромный эффект иона-комплексообразователя ($\Delta {{\lambda }^{{{{M}^{{2 + }}}}}}$) достигает 50–96 нм в зависимости от его природы и эффективности координационных взаимодействий [20, 21]. Поэтому большой интерес представляет анализ термодинамики реакций комплексообразования и особенностей координационных взаимодействий металл–лиганд в зависимости от структурных особенностей реагентов.
Анализ термодинамических констант реакций комплексообразования [20, 21] свидетельствует, что наиболее устойчивыми являются металлокомплексы дипиррометенов и бис(дипиррометенов) с Zn(II), Co(II), Ni(II), Cd(II), Hg(II), Cu(II) состава [ML2] и [M2L2] соответственно. Константы устойчивости (lg Ko) комплексов [ML2] увеличиваются в ряду комплексообразователей Ni(II) < Zn(II) < Co(II) < Cu(II) от 7.56 до 11.88 [20]. Для геликатов [M2L2] получена другая закономерность: термодинамические константы устойчивости (lg Ko) увеличиваются от 5.91 до 13.73 в ряду Cu(II) < Cd(II) < Hg(II) < Ni(II) < < Co(II) < Zn(II) [21].
Среди координационных соединений олигопирролов ряд комплексов бора(III), цинка(II), кадмия(II) и ртути(II) отличаются интенсивной флуоресценцией, чувствительной к свойствам среды, что делает их перспективными флуоресцентными сенсорами. Для дипиррометенатов кадмия(II) и ртути(II) флуоресцентный отклик менее эффективен вследствие меньших (на порядок и более) показателей квантового выхода флуоресценции, в отличие от комплексов цинка(II). Квантовый выход флуоресценции комплексов цинка(II) может достигать 100% в неполярных и слабополярных средах, значительно уменьшаться в присутствии ароматических соединений и понижаться почти до нуля в электронодонорных средах. Схожие по эффективности флуоресцентные отклики недавно были обнаружены для бис(дипиррометенатов) бора(III) в протоно- и (особенно) электронодонорных средах.
Хемосенсоры на основе лигандов моно- и бис(дипиррометенов)
Спектральные изменения в реакциях обратимого депротонирования и комплексообразования моно- и бис(дипиррометенов), сопровождаемые визуально регистрируемым изменением цвета растворов и существенными изменениями количественных характеристик спектров поглощения и флуоресценции, а также чувствительность флуоресценции комплексов к свойствам среды открывают возможности практического применения открытоцепных олигопирролов как колориметрических и/или флуоресцентных “off-on” хемосенсоров катионов металлов, протоно- и электронодонорных соединений (рис. 2).
Рис. 2.
Изменения в ЭСП при депротонировании α-незамещенного 3,3′-бис(дипиррометена) H2L · 2HBr до молекулярного лиганда H2L в пропаноле-1 в присутствии триэтиламина (а) и в спектрах флуоресценции в реакции тетраметилзамещенного 3,3′-бис(дипиррометена) H2L c ацетатом цинка(II) в среде пропанол-1/циклогексан (б).
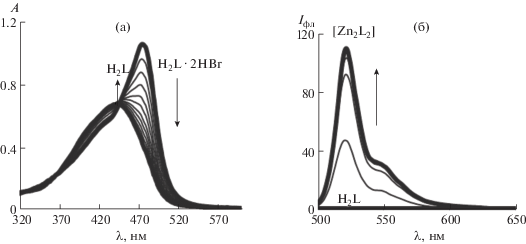
На примере серии солей алкилзамещенных бис(дипиррометенов) H2L · 2HBr [18] нами впервые продемонстрирована возможность “naked-eye” и количественного определения аминов. В присутствии триэтиламина процесс депротонирования H2L · 2HBr до молекулярной формы лиганда H2L протекает с гипсохромным (до 20–60 нм) и гипохромным (до ~2 раз) эффектами интенсивной полосы поглощения реакционной смеси (рис. 2а). Оцененные из спектральных данных константы реакции (lg $K_{a}^{o}$) составили от 0.68 до 1.14 в зависимости от особенностей алкилирования H2L [18].
По результатам флуориметрического титрования продемонстрирована высокая хемосенсорная чувствительность алкил-, галоген- и фенилзамещенных дипиррометенов и бис(дипиррометенов) по отношению к катионам цинка, кадмия и ртути [22–27]. “Off-on” отклик в виде разгорания флуоресценции в реакции ацетата цинка(II) c галоген- и фенилзамещенными дипиррометенами HL варьируется в диапазоне от 120 до 215 в смеси пропанол-1/циклогексан (1 : 30) [24, 25]. В отличие от дипиррометенов, флуоресцентные сенсоры на основе 3,3′-бис(дипиррометенов) H2L в тех же условиях среды дают значительно более высокий (от 200 до 550-кратный) флуоресцентный отклик на присутствие катионов Zn2+ (рис. 2б) [28]. Максимальное 550-кратное разгорание флуоресценции наблюдается для реакции ацетата цинка(II) с тетраметилзамещенным 3,3'-бис(дипиррометеном). Величина флуоресцентного отклика чувствительна также и к природе среды. Так, замена полярного растворителя (ДМФА) на среду с доминирующим содержанием неполярного сорастворителя (циклогексана) позволяет в 65 раз увеличить флуоресцентный отклик реакции ацетата цинка(II) с декаметилзамещенным бис(дипиррометеном) H2L [27]. Весьма перспективные результаты получены при использовании метилзамещенных 3,3′-бис(дипиррометенов) H2L как флуоресцентных хемосенсоров токсичных Cd2+ и Hg2+ [29]. Показатели “off-on” отклика (относительной интенсивности флуоресценции) реакции H2L с ацетатами кадмия или ртути могут быть увеличены от 25 до 270 простым варьированием алкильного замещения лиганда олигопиррола.
Особенности алкилирования оказывают большое влияние и на многие практически значимые характеристики флуоресцентных H2L хемосенсоров – селективность и предел обнаружения (DL) ионов Zn2+, Cd2+ и Hg2+. Отмечена высокая селективность обнаружения катионов Zn2+, Cd2+ и Hg2+ в присутствии катионов других металлов (Na+, K+, Mg2+, Ca2+, Mn2+, Co2+, Ni2+, Cu2+, Pb2+ и др.) [29]. Предел обнаружения катионов цинка с использованием тетрафенилзамещенного дипиррометена равен 1.4 × 10–7 моль/л. При использовании в качестве хемосенсоров галогензамещенных дипиррометенов значение DL составляет от 3.0 × 10−8 до 3.3 × 10−9 моль/л, а в случае применения декаметилзамещенного 3,3′-бис(дипиррометена) – до 10−10 моль/л.
Хемосенсоры на основе моно- и бис(дипиррометенов) по показателям флуоресцентного отклика, селективности и предела обнаружения превосходят большинство известных сенсоров [30–37]. Моно- и бис(дипиррометеновые) хемосенсоры имеют ряд преимуществ, включая достаточно простой синтез; яркие и мгновенные колористические “naked-eye” и спектральные отклики по отношению к аналитам; высокие “off-on” флуоресцентные отклики (до 550-кратного разгорания флуоресценции); высокие селективность и предел обнаружения катионов (до 10–10 моль/л) (табл. 3).
Таблица 3.
Хемосенсорные характеристики красителей различной природы по отношению к катионам Zn2+
BODIPY-люминофоры – новые направления применения в качестве оптических сенсоров
BODIPY и бис(BODIPY) к настоящему времени заняли позиции наиболее перспективных и активно изучаемых координационных соединений не только среди дипиррометеновых, но и большинства других известных люминофоров. Спектр применения BODIPY очень активно расширяется и к настоящему времени уже охватывает такие разнообразные направления применения, как сенсоры, биомаркеры, средства доставки лекарственных соединений, агенты фотодинамической терапии, антибактериальные, противомикробные и противогрибковые средства, флуоресцентные переключатели, лазерные красители и др. Основными преимуществами этих красителей-люминофоров являются максимально высокие значения квантовых выходов флуоресценции, интенсивный профиль поглощения, хорошие фото- и термическая стабильность и др. [38–41].
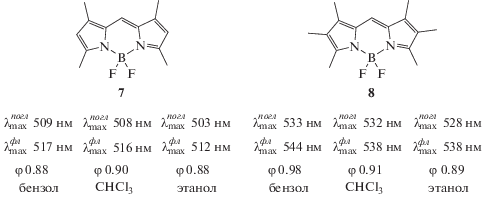
Важно отметить, что флуоресценция большинства синтезированных и изученных к настоящему времени алкилзамещенных BODIPY оказалась практически не чувствительной к природе среды. Приведенные в большинстве работ, в том числе в [6, 38, 42], показатели свидетельствуют о том, что доходящий до 100% квантовый выход флуоресценции (φ) BODIPY мало изменяется в зависимости от природы сольватного окружения (структуры 7 и 8, схема 1 ).
Схема 1 .
В связи с нечувствительностью флуоресценции алкилзамещенных борфторидных комплексов дипиррометенов к природе среды они успешно применяются в качестве биомаркеров [38], лазерных красителей, оптических и электронных устройств различного назначения [43], но неэффективны как оптические сенсоры компонентов ближнего сольватного окружения, в том числе в биосистемах, а также токсичных аналитов в растворах и парах.
С другой стороны, результаты последних исследований [42, 44] показали, что неполярные алкил- или водорастворимые сульфозамещенные BODIPY являются оптимальной платформой для создания высокоселективных и простых в использовании “naked-eye” маркеров гидрофобных или гидрофильных областей транспортных белков, в том числе бычьего сывороточного альбумина, а также визуализаторов процессов взаимодействия в системах белок–лекарственное вещество. Это обусловлено наличием у транспортных белков комплементарных гидрофобных и гидрофильных полостей для локализации гидрофобных и водорастворимых BODIPY-молекул или их фрагментов. Анализ физико-химических характеристик процесса разгорания (или тушения) флуоресценции таких сенсоров при связывании с определенным сайтом белка позволяет быстро и с минимальными экспериментальными затратами получить информацию о строении и физико-химическом состоянии определенного сайта белка, выявить изменения в его трехмерной структуре или точечные мутации. Так, в работе [45] было доказано образование супрамолекулярного комплекса водорастворимого сульфозамещенного комплекса BODIPY с бычьим и человеческим сывороточными альбуминами (BSA и HSA), которое сопровождается тушением флуоресценции вследствие переноса энергии по ферстеровскому механизму (FRET), и продемонстрирована возможность использования этого эффекта для селективного качественного и количественного обнаружения BSA и HSA в физиологических жидкостях. Предел обнаружения HSA в моче человека составляет 0.05 мг/мл, что позволяет рекомендовать сульфозамещенный BODIPY-краситель в качестве эффективного флуоресцентного сенсора в клинической медицине для раннего выявления микроальбуминурии и сопутствующих заболеваний [45].
Поскольку вязкость является одним из ключевых параметров состояния в биологических средах, в настоящее время широко популярна разработка высокоэффективных роторов на основе BODIPY [46–53].
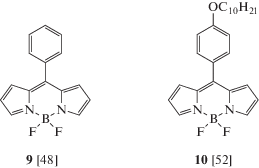
Целенаправленная функционализация молекул BODIPY путем введения объемных арильных заместителей в мезо-спейсер (в позицию 8 индаценового остова BODIPY, соединения 9, 10) [49] и алкил-арильных заместителей [46, 50, 51] позволила получить флуоресцентные сенсоры вязкости среды (схема 2 ).
Схема 2 .
Роторные характеристики BODIPY-красителей чувствительны как к дополнительной функционализации BODIPY-остова, так и к модификации самих фенильных заместителей. Разгорание флуоресценции таких красителей в высоковязких средах происходит за счет TICT-механизма и ограничения движения объемных заместителей в молекулах комплексов.
Неограниченные возможности модификации за счет введения функциональных заместителей как в мезо-спейсер, так и в пиррольные ядра индаценового остова молекулы BODIPY позволяют целенаправленно настраивать практически значимые свойства красителей под конкретную задачу [54]. Например, введение атомов галогенов приводит к способности проявлять фосфоресценцию и генерировать синглетный кислород с квантовым выходом до 0.98 (вследствие проявления эффекта “тяжелого атома”) и рекомендовать их в качестве высокоэффективных фотосенсибилизаторов [55, 56].
Введение определенного типа функциональных заместителей в молекулы BODIPY позволяет также получать сенсоры различных катионов, рН среды, температурных датчиков и т.д. [41, 54, 57–59].
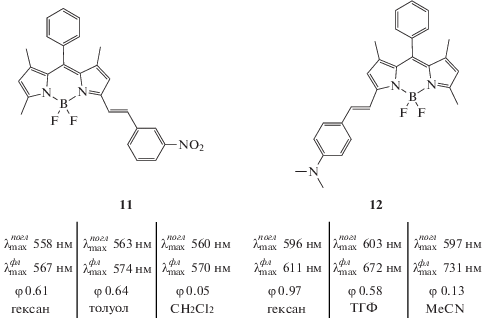
Особую группу флуоресцентных сенсоров среды на основе функционализированных BODIPY-люминофоров представляют “red-emitting” стирилзамещенные BODIPY [60–62]. В отличие от алкил- и галогензамещенных BODIPY, стирилзамещенные аналоги за счет увеличения контура сопряжения характеризуются интенсивным поглощением в ИК-области, что делает их наиболее интересными объектами для биохимии и медицины. На примере стирил-BODIPY 11 и 12 (схема 3 ) показано, что при увеличении полярности среды квантовый выход флуоресценции комплексов заметно снижается [63, 64].
Схема 3 .
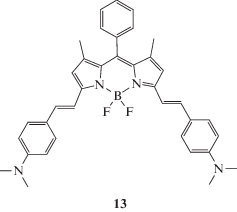
Кроме того, в работе [65] продемонстрирована чувствительность дистирилзамещенного BODIPY 13 к рН среды. Процесс обратимого протонирования изучен при добавлении к раствору 13 в хлороформе небольшого количества трифторуксусной кислоты (схема 4 ). Полученный спектр поглощения соответствует спектру дважды протонированной частицы.
Схема 4 .
Особый интерес представляет новый класс димерных аналогов BODIPY – алкилзамещенные бис(BODIPY) [7, 66–72].
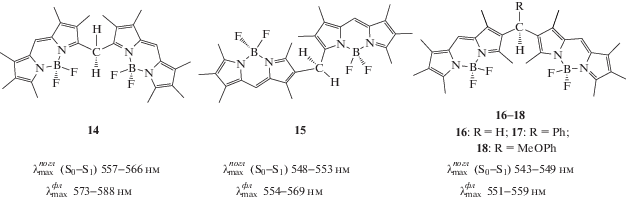
Спектральные и сенсорные свойства BODIPY-димеров зависят как от типа ковалентного связывания дипиррометеновых доменов по Сα- и Сβ-атомам проксимальных пиррольных ядер, так и от химической природы спейсера и периферийных заместителей. В общем случае сопоставление характеристик электронных спектров поглощения мономеров и димеров в органических растворителях свидетельствует о существенном гиперхромном эффекте и красном сдвиге максимума первой полосы S0–S1, вызванном экситонными взаимодействиями димеризованных через –СН2– спейсер доменов. В спектрах поглощения бис(BODIPY), в отличие от моно-BODIPY, наблюдается экситонное расщепление интенсивной длинноволновой полосы на две благодаря взаимодействию дипольных моментов переходов близко расположенных друг к другу хромофоров. Именно этот фактор обусловливает важные особенности физико-химических свойств, в том числе и сенсорных, бис(BODIPY), в отличие от моно-BODIPY. Так, весьма высокая чувствительность характеристик флуоресценции к природе среды обнаружена у 2,2'-, 2,3'- и 3,3'-СН(R)-бис(BODIPY)-димеров (структуры 14–18) [7, 66]. Квантовый выход флуоресценции СН(R)-бис(BODIPY) 14–18 достигает 80–95% в неполярных предельных и ароматических углеводородах (циклогексан, гептан, бензол, толуол) и снижается в ~12 раз в спиртах и до 2 порядков в электронодонорных ацетоне, ДМФА, ДМСО и пиридине (рис. 3, схема 5 ).
Рис. 3.
Квантовый выход флуоресценции CH(R)-бис(BODIPY) 14–18 в неполярных и полярных протоно- и электронодонорных растворителях (а) и зависимость относительной интенсивности флуоресценции CH(R)-бис(BODIPY) 14–18 от вязкости бинарных систем этанол–глицерин (б).
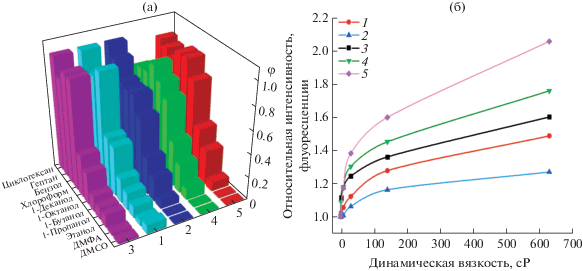
На примере соединений 14–16 показано [7, 66], что эффект тушения флуоресценции СН(R)-бис(BODIPY) в спиртах и электронодонорных средах обусловлен реакциями самосборки устойчивых супрамолекулярных комплексов СН2-бис(BODIPY) · 2Solv за счет образования водородных связей между протоном гидроксильной группы спирта и одного из атомов фтора каждого координационного узла или электронодонорных молекул с атомом водорода метинового спейсера каждого BODIPY-домена. Значения логарифмов констант (lg K) процессов образования супрамолекулярных продуктов CH2-бис(BODIPY) · 2Solv укладываются в диапазон от 2.4 до 5.2, что свидетельствует о сравнительно высокой устойчивости супрамолекулярных структур бис(BODIPY) со спиртами и электронодонорами (ДМФА, ДМСО).
Схема 5 .
Кроме того, конформационная подвижность, свойственная СН(R)-бис(BODIPY) за счет колебания BODIPY-доменов относительно центрального метиленового (–CH2–) спейсера, а также колебания мезо-арильных заместителей в случае мезо-фенил- и мезо-метоксифенилзамещенных димеров 17 и 18 обеспечивают чувствительность характеристик флуоресценции к микровязкости сольватного окружения.
Доминирующее влияние эффектов полярности, протоно- и электронодорных свойств растворителей не позволяет однозначно судить об эффекте вязкости среды в смесях различных по природе растворителей, особенно в области составов с невысокими значениями вязкости. В смеси полярных протонодорных растворителей этанол–глицерин при изменении вязкости от 1.096 cП (C2H5OH; fглицерин = 0 об. %) до 630 cП (fглицерин = 90 об. %) относительная интенсивность флуоресценции CH(Ar)-бис(BODIPY) 17 и 18 увеличивается в среднем в два раза, при этом константы Ферстера–Хоффмана (от 0.04 до 0.12) оказываются ниже значений для известных эффективных флуоресцентных BODIPY-роторов [43–50]. Значительное (до 60 раз) разгорание флуоресценции мезо-метоксифенилзамещенного димера 18 обнаружено при увеличении вязкости до 330 сП за счет роста объемного содержания слабополярного касторового масла до 90% в его смеси с электронодонорным ДМФА. Этот эффект вызван в первую очередь понижением содержания электронодонорного полярного компонента (ДМФА), который тушит флуоресценцию CH(Ar)-бис(BODIPY) за счет образования супрамолекулярных комплексов.
В последнее время активно появляются работы, посвященные разработке флуоресцентных сенсоров полярности среды [73]. Причем сенсорный отклик многих из них основан на смещении полосы испускания люминофора и времени жизни флуоресценции в зависимости от природы окружения, как, например, для производных пиразина [74] и 3-пиразолил-2-пиразолина [75]. Вместе с тем наличие высокой чувствительности интенсивности флуоресценции к природе растворителя димерных красителей CH(R)-бис(BODIPY) 14–18, в отличие от большинства алкил- и арил-BODIPY-прекурсоров, позволяет рекомендовать их в качестве флуоресцентных зондов в средах с определенными комбинациями показателей вязкости, полярности, протоно- и электронодорной способности.
Флуоресцентные зонды на основе люминесцентных комплексов цинка(II) с моно- и бис(дипиррометенами)
Одной из наиболее перспективных платформ для создания полифункциональных флуоресцентных сенсоров оказался новый класс люминофоров на основе хелатов цинка(II) с моно- и бис(дипиррометеновыми) лигандами.
Долгое время металлокомплексы открытоцепных олигопирролов, в том числе с цинком(II), “скрывали” свою способность к флуоресценции. Первые отрицательные результаты исследования люминесцентных свойств хелатов цинка(II) с мезо-арилзамещенными дипиррометеновыми лигандами были опубликованы в 1987 г. [76]. И только в 2004 г. [77] было выяснено, что причина отсутствия флуоресценции заключается в подвижности мезо-арильных групп, колебания которых приводят к увеличению вероятности безызлучательных переходов и почти полному тушению флуоресценции комплексов. Проведенная впоследствии замена мезо-арильной группы на почти неподвижную мезитильную вызвала многократное разгорание флуоресценции и вернула интерес ученых к люминофорам на основе дипиррометенатов цинка(II) [77].
Комплексы цинка(II) с бис(дипиррометенами) не уступают BODIPY по спектральным, термическим и ряду других свойств [78]. Их электронные спектры содержат интенсивные полосы поглощения в области ~500–550 нм (ε ~ 100 000–300 000 л/(моль см)) и флуоресценции в диапазоне ~535–565 нм. Соответствующие значения квантового выхода флуоресценции моно- и бис(дипиррометенатов) цинка(II) достигают 20 и 100% в неполярных средах [79], что отличает их от более слабо флуоресцирующих дипиррометенатов кадмия(II), ртути(II), некоторых лантанидов и полностью нефлуоресцирующих устойчивых комплексов дипиррометенов с другими металлами.
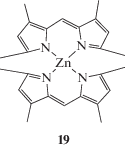
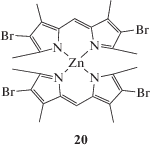
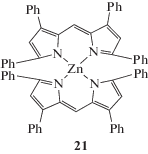
Значения квантового выхода флуоресценции таких комплексов (структуры 19–21, схема 6 ) очень чувствительны к полярности среды. Флуоресценция комплексов, максимально интенсивная в неполярных средах, существенно тушится в ароматических и почти полностью в полярных электронодонорных растворителях. Аналогичная закономерность была обнаружена для бис(дипиррометенатов) цинка(II) [79].
 |
 |
 |
||||
|---|---|---|---|---|---|---|
| $\lambda _{{\max }}^{{погл}}$; $\lambda _{{\max }}^{{фл}}$, нм | φ | $\lambda _{{\max }}^{{погл}}$; $\lambda _{{\max }}^{{фл}}$, нм | φ | $\lambda _{{\max }}^{{погл}}$; $\lambda _{{\max }}^{{фл}}$, нм | φ | |
| Циклогексан | 488; 501 | 0.024 | 509; 520 | 0.148 | 574; 608 | 0.331 |
| Бензол | 490; 503 | 0.028 | 509; 521 | 0.060 | 575; 615 | 0.157 |
| Этанол | 485; 497 | 0.001 | 503; 513 | 0.002 | 572; 607 | 0.007 |
Схема 6 .
Согласно опубликованным данным [80, 81], причины тушения флуоресценции алкил- и галогензамещенных дипиррометенатов цинка(II) [ZnL2] в бинарных смесях циклогексан–Solv (Solv: этанол, ацетон, ДМФА, пиридин, диэтиламин и триэтиламин) заключаются в увеличении вероятности безызлучательных переходов вследствие образования супрамолекулярных структур [ZnL2(Solv)n]. На примере соединений 19, 20 и других дипиррометенатов цинка(II) [80] было показано, что добавка в циклогексан полярного компонента Solv до мольной доли χ < 0.2 вызывает гипсохромный сдвиг (на 1–13 нм) максимума полосы испускания и резкое тушение флуоресценции люминофоров [ZnL2] (рис. 4).
Рис. 4.
Спектры флуоресценции (а, б) и зависимость квантового выхода флуоресценции (в) хелатов [ZnL2] (c ~ 1.0 × × 10–7 моль/л) в растворах циклогексана с варьируемой от 0 до 1 мольной доли полярного компонента Solv: 19 – С6Н12–C2H5OH (а), 20 – С6Н12– AcOH (б), 20 (в).
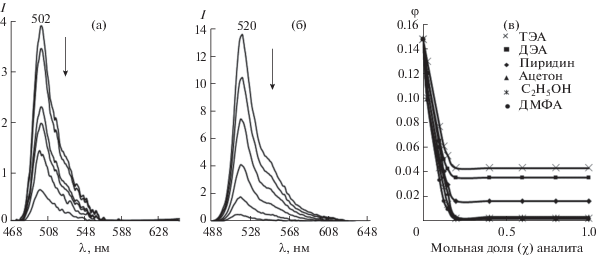
Полученные экспериментальные результаты позволяют рекомендовать люминофоры на основе олигопиррольных комплексов цинка(II) в качестве флуоресцентных сенсоров специфически сольватирующих электроно-, протонодонорных и ароматических соединений [78, 80] наряду с известными флуоресцентными сенсорами [73].
В общем случае алкил- и галогензамещенные хелаты [ZnL2] образуют супрамолекулярные комплексы состава [ZnL2(Solv)2] с пиридином и O-содержащими аналитами (ацетоном, этанолом, ДМФА) и состава [ZnL2Solv] с N-электронодонорными ди- и триэтиламинами. При этом устойчивость молекулярных галогензамещенных комплексов [ZnL2(Solv)n] до ~15 раз выше по сравнению с алкилзамещенными аналогами [80]. Важно отметить, что тушение флуоресценции алкил- и галогензамещенных дипиррометенатов цинка(II) в присутствии О-содержащих аналитов существенно (до ~5 раз) выше по сравнению с аминами. Эффективность тушения флуоресценции дипиррометенатов цинка(II) [ZnL2] увеличивается с ростом электронодонорной способности и полярности кислородсодержащих компонентов в последовательности: ацетон → этанол → ДМФА. Обратная закономерность отмечена для группы N-содержащих соединений, что вызвано стерическими факторами, затрудняющими доступ объемных молекул пиридина, диэтаноламина (ДЭА) и триэтаноламина (ТЭА) к координационным центрам люминофоров.
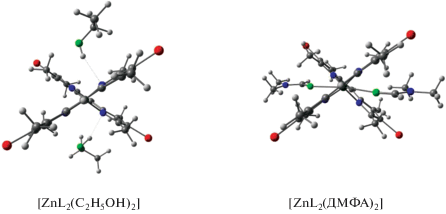
Согласно результатам теоретических и экспериментальных исследований кристаллосольватов 4,4'-дибромзамещенного дипиррометената цинка(II) [ZnL2] с этанолом и ДМФА [82], сольват [ZnL2(ДМФА)2] формируется за счет дополнительной координации молекулярных лигандов атомом цинка (Znδ+← :O) (рис. 5).
Дополнительный вклад в стабилизацию супрамолекулярной структуры [ZnL2(C2H5OH)2] вносят водородные связи между протонами гидроксильных групп спирта и атомами азота (C2H5OH ← :N≤) дипиррометенового лиганда в составе хелата (рис. 5) [82].
Пределы обнаружения O- и N-содержащих аналитов с использованием алкил- и галогензамещенных люминофоров [ZnL2] в среде циклогексана достаточно высоки (от 8 × 10–5 до 7 × 10–6 моль/л) [80], что позволяет рекомендовать данный тип люминофоров в качестве высокочувствительных и селективных “on-off” флуоресцентных сенсоров следовых количеств полярных растворителей в органических средах.
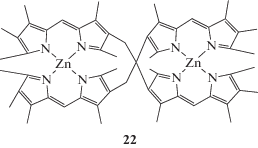
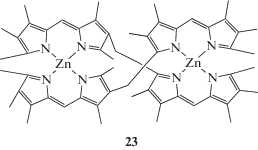
Разработана экспериментально-теоретическая база для практического применения бис(дипиррометенатов) цинка(II) (например, структуры 22 и 23, схема 7 ) в качестве высокочувствительных и селективных флуоресцентных сенсоров электронодонорных и ароматических соединений в органических средах. Результаты исследований [78, 83–90] 3,3′-, 2,3′- и 2,2′-бис(дипиррометенатов) цинка(II) показали, что в присутствии N- или O-электронодонорных (X) и ароматических (Ar) соединений происходят реакции самосборки устойчивых супрамолекулярных комплексов [Zn2L2Хn] (n = 1, 2, 4) и [Zn2L2Arn] (n = 1, 2), что отражается спектрально и визуально регистрируемым эффектом тушения флуоресценции комплексов. По данным квантово-химических расчетов (B3LYP(PCM)/6-31G(d,p)), в составе сольватокомплексов [Zn2L2Xn] и [Zn2L2Arn] бис(дипиррометенат) цинка(II) является акцептором, а молекулярные лиганды X/Ar – донорами электронов. Тушение флуоресценции сольватов происходит за счет внутримолекулярного переноса электрона с высшей занятой молекулярной орбитали X/Ar на высшую занятую молекулярную орбиталь акцептора – флуорофора [Zn2L2], т.е. по PeT-механизму [78], а рассматриваемые сенсоры электронодонорных и ароматических молекул на основе бис(дипиррометенатов) цинка(II) могут быть отнесены к “on-off” типу.
Схема 7 .
Понижение термической (от 427 до 366 K) и энергетической стабильности супрамолекулярных структур наблюдается в последовательности 2,2′-, 2,3′- и 3,3′-бис(дипиррометенатов) цинка(II) и с уменьшением электронодонорной способности координируемых лигандов [78]. Аналогичные закономерности изменения констант устойчивости супрамолекулярных комплексов в растворах получены на основании данных 1Н ЯМР и спектрофлуориметрического титрования [78].
Определены аналитические флуоресцентные характеристики сенсоров на основе геликатов [Zn2L2]. Обосновано использование показателя относительного изменения интенсивности на двух выбранных длинах волн полосы испускания [Zn2L2] в качестве селективного аналитического критерия идентификации N-, O-донорных и ароматических аналитов и их количественного определения. Пределы обнаружения исследованных ароматических соединений (бензол, толуол, ксилолы) с использованием [Zn2L2] в среде циклогексана составляют от 1.2 × 10–7 до 9.9 × 10–5 моль/л, пределы обнаружения электронодонорных соединений (ДМФА, ДМСО, пиридин) в среде циклогексана – от 2.5 × 10–7 до 9.3 × 10–5 моль/л, что сопоставимо и в некоторых случаях на порядок выше по сравнению с описанными ранее дипиррометенатами цинка(II) [78, 80].
На основе допированного в этилцеллюлозу 3,3′-бис(дипиррометената) цинка(II) авторами [78, 84] разработан новый сенсор паров ацетона и этанола. Предел обнаружения паров ацетона в газовой смеси с использованием сенсора составляет 1.68 ppb, этанола – 0.56 ppt. Для полученного флуоресцентного сенсора характерны мгновенный отклик, высокая чувствительность и селективность к присутствию паров ацетона и этанола, не уступающие известным флуоресцентным сенсорам, например, на основе производных о-карборана [91], металлоорганических полимеров [92]. Простота использования полученного сенсора [75, 81] позволяет рекомендовать его для мониторинга содержания паров ацетона и этанола в промышленных и лабораторных помещениях, а также для неинвазивной диагностики сахарного диабета и в качестве альтернативной основы карманных алкотестеров.
Комплексы 3,3′-бис(дипиррометената) цинка(II) предложены также в качестве флуоресцентных сенсоров для обнаружения петлевых диуретиков, в том числе фуросемида и торасемида, в органических средах и физиологических жидкостях с пределом обнаружения 65–78 мг/л [83, 93]. Наличие в структуре молекул диуретиков и их метаболитов нескольких электронодонорных гетероатомов (Cl, N, O, S и т.д.) в сочетании с ароматическими фрагментами (бензола, пиридина, фурана и т.д.) создает возможность образования супрамолекулярных комплексов с бис(дипиррометенатами) цинка(II) за счет конкретного набора специфических взаимодействий. Специфика межчастичных взаимодействий в супрамолекулярных комплексах бис(дипиррометенатов) цинка(II) с диуретиками и их метаболитами [Zn2L2Хn] обеспечивает высокую индивидуальность быстрого флуоресцентного отклика реакции комплексообразования и представляет возможность рекомендовать их для детектирования микроколичеств диуретиков и их метаболитов при помощи дипиррометеновых сенсоров.
ЗАКЛЮЧЕНИЕ
Таким образом, хромофорные и люминесцентные лиганды, соли и координационные соединения с дипиррометеновыми доменами наряду с теоретическим представляют и значительный практический интерес, в том числе в области хемосенсорики.
Индивидуальность ЭСП лигандов, протонированных форм олигопирролов и их комплексов, яркие колористические и флуоресцентные отклики процессов депротонирования и комплексообразования, значительные различия в количественных характеристиках ЭСП дипиррометенов и бис(дипиррометенов), их солей и комплексов являются основой для развития прикладных аспектов использования олигопирролов в качестве оптических сенсоров. Очевидна перспективность развития направлений применения:
– солей олигопирролов как колориметрических (“naked-eye”) и оптических хемосенсоров для качественного анализа и количественного спектрофотометрического определения следовых количеств (C2H5)3N и других аминов в органических средах с условной чувствительностью аналитического определения не менее 1.0 × 10–8 моль/л;
– лигандов олигопирролов в качестве эффективных флуоресцентных хемосенсоров катионов Zn2+, Cd2+ и Hg2+ с высокими показателями чувствительности (флуоресцентный отклик I/I0 до 550), селективности и предела обнаружения катионов от 10–7 до 10–10 моль/л;
– дипиррометеновых комплексов цинка(II) как колориметрических (“naked-eye”) и флуоресцентных хемосенсоров для качественного и количественного спектрального анализа N-, O-донорных и ароматических аналитов с высокими показателями флуоресцентного отклика и высокими (до 10–5–10–7 моль/л) пределами обнаружения;
– BODIPY-люминофоров как наиболее востребованных в настоящее время биомаркеров, а также высокоэффективных “naked-eye” маркеров транспортных белков и сенсоров вязкости биологических сред;
– бис(BODIPY) в качестве сенсоров полярности среды и микровязкости сольватного окружения в средах с определенными комбинациями показателей вязкости, полярности, протоно- и электронодорной способности.
Результаты исследований авторов в области физической, координационной и супрамолекулярной химии олигопиррольных соединений, эффективность и чувствительность их спектральных откликов на кислотно-основные и координационные взаимодействия, а также супрамолекулярное комплексообразование создают научную базу для получения новых спектральных сенсоров соединений различных классов (наркотики, стероиды, витамины и другие биоактивные вещества и их метаболиты).
Список литературы
Falk H. The Chemistry of Linear Oligopyrroles and Bile Pigments. Vienna: Springer, 1989. V. 1.
Berezin M.B., Semeikin A.S., Antina E.V. et al. // Russ. J. Gen. Chem. 1999. V. 69. № 12. P. 1949. [Березин М.Б., Семейкин А.С., Антина Е.В. и др. // Журн. общей химии. 1999. Т. 69. № 12. С. 2040.]
Antina E.V., Guseva G.B., Dudina N.A. et al. // Russ. J. Gen. Chem. 2009. V. 79. № 11. P. 2425. [Антина Е.В., Гусева Г.Б., Дудина Н.А. и др. // Журн. общей химии. 2009. Т. 79. № 11. С. 1903.]https://doi.org/10.1134/S1070363209110243
Rogers M.A.T. // J. Chem. Soc. 1943. P. 590. https://doi.org/10.1039/JR9430000590
Shikha Singh R., Prasad Paitandi R., Kumar Gupta R., Shankar Pandey D. // Coord. Chem. Rev. 2020. V. 414. P. 213269. https://doi.org/10.1016/j.ccr.2020.213269
Bumagina N.A., Antina E.V., Berezin M.B., Kalyagin A.A. // Spectrochim. Acta, Part A. 2017. V. 173. P. 228. https://doi.org/10.1016/j.saa.2016.09.026
Antina L.A., Ksenofontov A.A., Kalyagin A.A. et al. // Spectrochim. Acta, Part A. 2019. V. 218. P. 308. https://doi.org/10.1016/j.saa.2019.03.117
Yutanova S.L., Berezin M.B., Semeikin A.S. et al. // Russ. J. Gen. Chem. 2013. V. 83. № 3. P. 545. [Ютанова С.Л., Березин М.Б., Семейкин А.С. и др. // Журн. общей химии. 2013. Т. 83. № 3. С. 492.]https://doi.org/10.1134/S1070363213030237
Antina E.V., Berezin M.B., Dudina N.A. et al. // Russ. J. Gen. Chem. 2010. V. 80. № 6. P. 1216. [Антина Е.В., Березин М.Б., Дудина Н.А. и др. // Журн. общей химии. 2010. Т. 80. № 6. С. 1048.]https://doi.org/10.1134/S1070363210060332
Marfin Y.S., Rumyantsev E.V. // Spectrochim. Acta, Part A. 2014. V. 130. P. 423. https://doi.org/10.1016/j.saa.2014.04.031
Antina E.V., Berezin M.B., Dudina N.A. et al. // Russ. J. Inorg. Chem. 2014. V. 59. № 10. P. 1187. [Антина Е.В., Березин М.Б., Дудина Н.А. и др. // Журн. неорган. химии. 2014. Т. 59. № 1. С. 1427.]https://doi.org/10.1134/S0036023614100027
Semeikin A.S., Berezin M.B., Chernova O.M. et al. // Russ. Chem. Bull. 2003. V. 52. № 8. P. 1807. https://doi.org/10.1023/A:1026064923515
Berezin M.B., Chernova O.M., Shatunov P.A. et al. // Molecules. 2000. V. 5. № 12. P. 809. https://doi.org/10.3390/50600809
Guseva G.B., Antina E.V., Berezin M.B. et al. // Russ. J. Gen. Chem. 2002. V. 72. № 1. P. 126. [Гусева Г.Б., Антина Е.В., Березин М.Б. и др. // Журн. общей химии. 2002. Т. 72. № 1. С. 135.]https://doi.org/10.1023/A:1015318017581
Antina E.V., Zakharova S.P., Rumyantsev E.V. // Russ. J. Gen. Chem. 2006. V. 76. № 7. P. 1157. [Антина Е.В., Захарова С.П., Румянцев Е.В. // Журн. общей химии. 2006. Т. 76. № 7. С. 1205.]https://doi.org/10.1134/S1070363206070279
Makarova S.P., Rumyantsev E.V., Antina E.V. // Russ. J. Gen. Chem. 2008. V. 78. № 9. P. 1770. [Макарова С.П., Румянцев Е.В., Антина Е.В. // Журн. общей химии. 2008. Т. 78. № 9. С. 1539.]https://doi.org/10.1134/S107036320809020X
Guseva G.B., Dudina N.A., Antina E.V. et al. // Russ. J. Gen. Chem. 2008. V. 78. № 6. P. 1215. [Гусева Г.Б., Дудина Н.А., Антина Е.В. и др. // Журн. общей химии. 2008. Т. 78. № 6. С. 987.]https://doi.org/10.1134/S1070363208060200
Antina E.V., Guseva G.B., Dudina N.A., V’yugin A.I. // Russ. J. Inorg. Chem. 2010. V. 55. № 8. P. 1172. [Антина Е.В., Гусева Г.Б., Дудина Н.А., Вьюгин А.И. // Журн. неорган. химии. 2010. Т. 55. № 8. С. 1246.]https://doi.org/10.1134/S0036023610080036
Berezin M.B., Semeikin A.S., Yutanova S.L. et al. // Russ. J. Gen. Chem. 2012. V. 82. № 7. P. 1287. [Березин М.Б., Семейкин А.С., Ютанова С.Л. и др. // Журн. общей химии. 2012. Т. 82. № 7. С. 1189.]https://doi.org/10.1134/S1070363212070183
Антина Е.В., Румянцев Е.В. Химия билирубина и его аналогов. М.: Красанд, 2009. 352 с.
Dudina N.A., Antina E.V., Guseva G.B. // Russ. J. Coord. Chem. 2011. V. 37. № 5. P. 333. [Дудина Н.А., Антина Е.В., Гусева Г.Б. // Коорд. химия. 2011. Т. 37. № 5. С. 331.]https://doi.org/10.1134/S1070328411040026
Nuraneeva E.N., Guseva G.B., Antina E.V. // Russ. J. Gen. Chem. 2017. V. 87. № 7. P. 1550. [Нуранеева Е.Н., Гусева Г.Б., Антина Е.В. // Журн. общей химии. 2017. Т. 87. № 7. С. 1157.]https://doi.org/10.1134/S1070363217070180
Dudina N.A., Antina E.V., Guseva G.B., Vyugin A.I. // J. Fluoresc. 2014. V. 24. № 1. P. 13. https://doi.org/10.1007/s10895-013-1278-7
Bumagina N.A., Antina E.V., Nikonova A.Y. et al. // J. Fluoresc. 2016. V. 26. № 6. P. 1967. https://doi.org/10.1007/s10895-016-1890-4
Nuraneeva E.N., Guseva G.B., Antina E.V. // J. Fluoresc. 2021. V. 31. № 2. P. 415. https://doi.org/10.1007/s10895-020-02670-4
Nuraneeva E.N., Guseva G.B., Antina E.V. et al. // Russ. Chem. Bull. 2018. V. 67. № 7. P. 1231. https://doi.org/10.1007/s11172-018-2206-4
Dudina N.A., Antina E.V., Guseva G.B. et al. // Russ. J. Org. Chem. 2013. V. 49. № 12. P. 1734. [Дудина Н.А., Антина Е.В., Гусева Г.Б. и др. // Журн. орг. химии. 2013. Т. 49. № 12. С. 1754.]https://doi.org/10.1134/S107042801312004X
Dudina N.A., Antina E.V., Sozonov D.I., V’yugin A.I. // Russ. J. Org. Chem. 2015. V. 51. № 8. P. 1155. [Дудина Н.А., Антина Е.В., Созонов Д.И., Вьюгин А.И. // Журн. орг. химии. 2015. Т. 51. № 8. С. 1174.]https://doi.org/10.1134/S107042801508014X
Bumagina N.A., Antina E.V., Sozonov D.I. // J. Lumin. 2017. V. 183. P. 315. https://doi.org/10.1016/j.jlumin.2016.11.057
Bie F., Cao H., Yan P. et al. // Inorg. Chim. Acta. 2020. V. 508. P. 119652. https://doi.org/10.1016/j.ica.2020.119652
Dong W.-K., Akogun S.F., Zhang Y. et al. // Sens. Actuators, B: Chem. 2017. V. 238. P. 723. https://doi.org/10.1016/j.snb.2016.07.047
Erdemir S., Malkondu S. // Sens. Actuators, B: Chem. 2013. V. 188. P. 1225. https://doi.org/10.1016/j.snb.2013.08.031
Moradi S.E., Molavipordanjani S., Hosseinimehr S.J., Emami S. // Photochem. Photobiol. A. Chem. 2020. V. 389. P. 112184. https://doi.org/10.1016/j.jphotochem.2019.112184
Shi Z., Tu Y., Pu S. // RSC Adv. 2018. V. 8. P. 6727. https://doi.org/10.1039/C7RA13592K
Wang L., Li W., Zhi W. et al. // Sens. Actuators. B. Chem. 2018. V. 260. P. 243. https://doi.org/10.1016/j.snb.2017.12.200
Xu J., Xiong J., Qin Y. et al. // Mater. Chem. Front. 2020. V. 4. P. 3338. https://doi.org/10.1039/D0QM00446D
Yan L., Wen X., Fan Z. // Anal. Bioanal. Chem. 2020. V. 412. P. 1453. https://doi.org/10.1007/s00216-019-02378-w
Loudet A., Burgess K. // Chem. Rev. 2007. V. 107. № 11. P. 4891. https://doi.org/10.1021/cr078381n
Solomonov A.V., Marfin Y.S., Rumyantsev E.V. // Dyes Pigm. 2019. V. 162. P. 517. https://doi.org/10.1016/j.dyepig.2018.10.042
Squeo B.M., Ganzer L., Virgili T., Pasini M. // Molecules. 2021. V. 26. № 1. P. 153. https://doi.org/10.3390/molecules26010153
Bañuelos J. // Chem. Record. 2016. V. 16. № 1. P. 335. https://doi.org/10.1002/tcr.201500238
Antina L.A., Ksenofontov A.A., Kalyagin A.A. et al. // J. Mol. Liq. 2020. V. 304. P. 112717. https://doi.org/10.1016/j.molliq.2020.112717
Kuznetsova R.T., Aksenova I.V., Prokopenko A.A. et al. // J. Mol. Liq. 2019. V. 278. P. 5. https://doi.org/10.1016/j.molliq.2019.01.049
Ksenofontov A.A., Bocharov P.S., Antina E.V. // J. Photochem. Photobiol., A. 2019. V. 368. P. 254. https://doi.org/10.1016/j.jphotochem.2018.10.002
Ksenofontov A.A., Bocharov P.S., Ksenofontova K.V., Antina E.V. // J. Mol. Liq. 2021. V. 33. P. 117031. https://doi.org/10.1016/j.molliq.2021.117031
Lee S.-C., Heo J., Woo H.C. et al. // Chemistry. Eur. J. 2018. V. 24. № 52. P. 13706. https://doi.org/10.1002/chem.201801389
Dong B., Zhong K., Lu Y. // Dyes Pigm. 2019. V. 164. № 11. P. 156. https://doi.org/10.1016/j.dyepig.2019.01.017
Lou Z., Hou Y., Chen K. et al. // J. Phys. Chem. C. 2018. V. 122. № 1. P. 185. https://doi.org/10.1021/acs.jpcc.7b10466
Marfin Y.S., Merkushev D.A., Usoltsev S.D. et al. // J. Fluoresc. 2015. V. 25. № 5. P. 1517. https://doi.org/10.1007/s10895-015-1643-9
Polita A., Toliautas S., Žvirblis R., Vyšniauskas A. // Phys. Chem. Chem. Phys. 2020. V. 22. № 16. P. 8296. https://doi.org/10.1039/c9cp06865a
Vyšniauskas A., Lopez-Duarte I., Thompson A.J. et al. // Methods and applications in Fluorescence. 2018. V. 6. № 3. P. 34001. https://doi.org/10.1088/2050-6120/aabb2c
Vyšniauskas A., López-Duarte I., Duchemin N. et al. // Phys. Chem. Chem. Phys. 2017. V. 19. № 37. P. 25252. https://doi.org/10.1039/c7cp03571c
Raut S., Kimball J., Fudala R. et al. // Phys. Chem. Chem. Phys. 2014. V. 16. № 48. P. 27037. https://doi.org/10.1039/c4cp04260c
Lakshmi V., Sharma R., Ravikanth M. // Rep. Org. Chem. 2016. V. 6. P. 1. https://doi.org/10.2147/ROC.S60504
Zhang X.-F. // J. Photochem. Photobiol., A. 2018. V. 355. P. 431. https://doi.org/10.1016/j.jphotochem.2017.07.019
Nuraneeva E.N., Guseva G.B., Antina E.V. et al. // Russ. J. Gen. Chem. 2016. V. 86. № 4. P. 840. [Нуранеева Е.Н., Гусева Г.Б., Антина Е.В. и др. // Журн. общей химии. 2016. Т. 86. № 4. С. 653.]https://doi.org/10.1134/S1070363216040149
Boens N., Leen V., Dehaen W. // Chem. Soc. Rev. 2012. V. 41. № 3. P. 1130. https://doi.org/10.1039/C1CS15132K
Hecht M., Kraus W., Rurack K. // Analyst. 2013. V. 138. № 1. P. 325. https://doi.org/10.1039/C2AN35860C
Müller B.J., Rappitsch T., Staudinger C. et al. // Anal. Chem. 2017. V. 89. № 13. P. 7195. https://doi.org/10.1021/acs.analchem.7b01373
Peterson J.A., Wijesooriya C., Gehrmann E.J. et al. // J. Am. Chem. Soc. 2018. V. 140. № 23. P. 7343. https://doi.org/10.1021/jacs.8b04040
Tzeli D., Petsalakis I.D., Theodorakopoulos G. // Int. J. Quantum. Chem. 2019. V. 119. № 16. P. 47. https://doi.org/10.1002/qua.25958
Sutter A., Elhabiri M., Ulrich G. // Chemistry. Eur. J. 2018. V. 24. № 43. P. 11119. https://doi.org/10.1002/chem.201801540
Wang S., Liu H., Mack J. et al. // Chem. Commun. 2015. V. 51. № 69. P. 13389. https://doi.org/10.1039/C5CC05139H
Rurack K., Kollmannsberger M., Daub J. // Angew. Chem. Int. Ed. 2001. V. 40. № 2. P. 385. https://doi.org/10.1002/1521-3773(20010119)40:2<385:AID-ANIE385>3.0.CO;2-F
Deniz E., Isbasar G.C., Bozdemir Ö.A. et al. // Org. Lett. 2008. V. 10. № 16. P. 3401. https://doi.org/10.1021/ol801062h
Antina L.A., Kalyagin A.A., Ksenofontov A.A. et al. // J. Mol. Liq. 2021. V. 337. P. 116416. https://doi.org/10.1016/j.molliq.2021.116416
Knippenberg S., Bohnwagner M.V., Harbach P.H.P. et al. // J. Phys. Chem. A. 2015. V. 119. № 8. P. 1323. https://doi.org/10.1021/acs.jpca.5b00637
Lundrigan T., Baker A.E.G., Longobardi L.E. et al. // Org. Lett. 2012. V. 14. № 8. P. 2158. https://doi.org/10.1021/ol300681w
Savoldelli A., Paolesse R., Fronczek F.R. et al. // Org. Biomol. Chem. 2017. V. 15. № 35. P. 7255. https://doi.org/10.1039/c7ob01797a
Ventura B., Marconi G., Bröring M. et al. // New J. Chem. 2009. V. 33. № 2. P. 428. https://doi.org/10.1039/B813638F
Liu Y., Zhao J., Iagatti A. et al. // J. Phys. Chem. C. 2018. V. 122. № 5. P. 2502. https://doi.org/10.1021/acs.jpcc.7b10213
Stachelek P., Harriman A. // J. Phys. Chem. A. 2016. V. 120. № 41. P. 8104. https://doi.org/10.1021/acs.jpca.6b08284
Xiaoa H., Lia P., Tanga B. // Coord. Chem. Rev. 2021. V. 427. P. 213582. https://doi.org/10.1016/j.ccr.2020.213582
Saito R., Matsumura Y., Suzuki S., Okazaki N. et al. // Tetrahedron. 2010. V. 66. P. 8273. https://doi.org/10.1016/j.tet.2010.08.036
Sarkar A., Mandal T., Rana D.K. et al. // J. Lumin. 2010. V. 130. P. 2271. https://doi.org/10.1016/j.jlumin.2010.07.004
Ганжа В.А., Гуринович Г.П., Джагаров Б.М. и др. // Журн. прикладной спектроскопии. 1987. Т. 47. С. 84.
Sazanovich I.V., Kirmaier C., Hindin E. et al. // J. Am. Chem. Soc. 2004. V. 126. № 9. P. 2664. https://doi.org/10.1021/ja038763k
Ksenofontov A.A., Antina E.V., Guseva G.B. et al. // J. Mol. Liq. 2019. V. 274. P. 681. https://doi.org/10.1016/j.molliq.2018.11.025
Antina E.V., Kuznetsova R.T., Antina L.A. et al. // Dyes Pigm. 2015. V. 113. № 20. P. 664. https://doi.org/10.1016/j.dyepig.2014.10.002
Nuraneeva E.N., Guseva G.B., Antina E.V., V’yugin A.I. // J. Mol. Liq. 2020. V. 298. № 5. P. 112026. https://doi.org/10.1016/j.molliq.2019.112026
Ksenofontov A.A., Guseva G.B., Antina E.V. et al. // J. Fluoresc. 2015. V. 25. № 6. P. 1875. https://doi.org/10.1007/s10895-015-1680-4
Nuraneeva E.N., Guseva G.B., Antina E.V. // Thermochim. Acta. 2021. V. 699. P. 178911. https://doi.org/10.1016/j.tca.2021.178911
Ksenofontov A.A., Stupikova S.A., Bocharov P.S. et al. // J. Photochem. Photobiol., A. 2019. V. 382. P. 111899. https://doi.org/10.1016/j.jphotochem.2019.111899
Ksenofontov A.A., Guseva G.B., Stupikova S.A., Antina E.V. // J. Fluoresc. 2018. V. 28. № 2. P. 477. https://doi.org/10.1007/s10895-018-2220-9
Ksenofontov A.A., Guseva G.B., Antina E.V., Nuraneeva E.N. // J. Lumin. 2017. V. 192. P. 1203. https://doi.org/10.1016/J.JLUMIN.2017.08.058
Ksenofontov A.A., Guseva G.B., Antina E.V., Nuraneeva E.N. // Spectrochim. Acta, Part A. 2017. V. 173. P. 222. https://doi.org/10.1016/j.saa.2016.09.014
Ksenofontov A.A., Guseva G.B., Antina E.V. et al. // Sens. Actuators, B. 2017. V. 251. P. 858. https://doi.org/10.1016/j.snb.2017.05.143
Guseva G.B., Ksenofontov A.A., Antina E.V. et al. // J. Coord. Chem. 2016. V. 69. № 5. P. 901. https://doi.org/10.1080/00958972.2016.1147562
Guseva G.B., Ksenofontov A.A., Antina E.V. et al. // J. Therm. Anal. Calorim. 2016. V. 126. № 3. P. 1481. https://doi.org/10.1007/s10973-016-5647-8
Guseva G.B., Ksenofontov A.A., Antina E.V. // J. Mol. Struct. 2017. V. 1130. P. 385. https://doi.org/10.1016/j.molstruc.2016.10.048
Huang R., Liu K., Liu H. et al. // Anal. Chem. 2018. V. 90. P. 14088. https://doi.org/10.1021/acs.analchem.8b04897
Yi F.-Y., Yang W., Sun Zh.-M. et al. // J. Mater. Chem. 2012. V. 22. P. 23201. https://doi.org/10.1039/C2JM35273G
Ksenofontov A.A., Lukanov M.M., Antina E.V. // Dyes Pigm. 2020. V. 179. P. 108389. https://doi.org/10.1016/j.dyepig.2020.108389
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии