Журнал неорганической химии, 2020, T. 65, № 10, стр. 1350-1356
НИТРАТОКОМПЛЕКСЫ ПЛАТИНЫ(IV) С 1,10‑ФЕНАНТРОЛИНОМ
П. А. Топчиян a, b, *, И. А. Байдина a, И. В. Корольков a, С. В. Ткачев a, Д. Б. Васильченко a
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
b Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, ул. Пирогова, 1, Россия
* E-mail: p.topchiian@g.nsu.ru
Поступила в редакцию 23.03.2020
После доработки 02.04.2020
Принята к публикации 30.04.2020
Аннотация
Исследовано взаимодействие 1,10-фенантролина (phen) и азотнокислого раствора гидроксида платины. Показано, что, в отличие от ранее исследованных реакций с пиридином и пиперазином, в данном случае не происходит образования твердых фаз солей анионных нитратокомплексов платины(IV) с катионом фенантролиния ввиду их высокой растворимости. При длительном выдерживании растворов получен новый молекулярный комплекс платины(IV), содержащий 1,10-фенантролин [Pt(phen)(NO3)4] (1). При взаимодействии динитрата фенантролиния (phen · 2HNO3) и соли (Bu4N)2[Pt(NO3)6] в ацетонитриле с высоким выходом получена соль (phenH)4(NO3)2[Pt(NO3)6] (2). Методом рентгеноструктурного анализа установлена кристаллическая структура соединений 1 и 2. Соединение 2 исследовано методами ИК-спектроскопии, термического анализа и спектроскопии ЯМР на ядрах 195Pt в твердом теле с вращением под магическим углом. Результаты работы могут быть использованы при разработке синтеза новых комплексных соединений платины и для приготовления гетерогенных катализаторов, содержащих платину.
ВВЕДЕНИЕ
Азотнокислые растворы гидроксида платины(IV) (растворы “нитрата платины”), содержащие смесь нитратокомплексов платины, находят применение в качестве предшественника для приготовления гетерогенных Pt-содержащих катализаторов [1–4]. Их основное преимущество – отсутствие галогенид-ионов, зачастую негативно влияющих на активность и стабильность катализаторов [5, 6]. Однако наличие большого избытка азотной кислоты в растворах “нитрата платины” вызывает коррозию материалов оксидных носителей в процессе приготовления катализаторов. Снижение же концентрации азотной кислоты приводит к интенсивному гидролизу нитратокомплексов платины с образованием гидратированного оксида платины(IV) (PtO2 · 3H2O) [7, 8].
Как было показано ранее, посредством добавления макроциклических кавитандов [9] и органических катионов [8, 10, 11] из растворов “нитрата платины” можно выделять индивидуальные нитратокомплексы платины(IV) различной ядерности. Растворимые в органических растворителях соединения нитратокомплексов платины(IV) являются удобными прекурсорами для нанесения наноразмерных оксоформ платины (PtnOm) на поверхность оксидных носителей при приготовлении гетерогенных катализаторов для процесса окисления угарного газа [10, 12]. Таким образом, разработка методов синтеза новых соединений, содержащих нитратокомплексы платины, а также исследование их свойств и структуры являются актуальной задачей в области координационной химии платины.
Один из опробованных ранее подходов для выделения нитратокомплексов платины(IV) из азотнокислых растворов ее гидроксида заключается во введении в растворы солей гетероциклических азотистых оснований (пиридин, пиперазин) [8, 11]. Катионы данных оснований стабильны в азотной кислоте и позволяют селективно извлечь из растворов “нитрата платины” анионный комплекс [Pt(NO3)6]2– с достаточно высоким выходом. С целью расширения этого подхода в рамках данной работы изучена возможность применения катиона 1,10-фенантролиния в качестве противоиона для получения солей анионных нитратокомплексов платины(IV).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Гексагидроксоплатиновую кислоту (тетрагидроксодиакваплатина(IV) [Pt(H2O)2(OH)4]) получали из гексахлороплатиновой кислоты (39.1 мас. % Pt, ОАО “Красноярский завод цветных металлов им. В.Н. Гулидова”) по методике [8]. Для приготовления растворов использовали азотную кислоту (ос. ч.) с концентрацией 70 мас. % (15.9 M) производства фирмы EuroChem (“Новомосковский азот”). Динитрат 1,10-фенантролиния (phen · · 2HNO3) получали осаждением этилацетатом из азотнокислого раствора 1,10-фенантролина. Синтез соли (Bu4N)2[Pt(NO3)6] проводили согласно методике [10].
Синтез [Pt(phen)(NO3)4] (1). Гексагидроксоплатиновую кислоту (100 мг) растворяли при перемешивании в 2 мл концентрированной азотной кислоты (15.9 M), охлажденной до 0°С. К полученному раствору добавляли раствор, содержащий 150 мг 1,10-фенантролина в 1.5 мл HNO3 (15.9 M), и помещали в эксикатор над KOH. В течение 4 сут происходило медленное испарение азотной кислоты с образованием смолообразной массы темно-желтого цвета. Последующее выдерживание этой массы в течение 6 сут на воздухе привело к кристаллизации в ее объеме нескольких желтых призматических кристаллов, которые были отобраны и исследованы методом рентгеноструктурного анализа (РСА). Выход ∼5%.
Синтез (phenH)4(NO3)2[Pt(NO3)6] (2). Навеску (Bu4N)2[Pt(NO3)6] (150 мг) растворяли в 2 мл ацетонитрила, затем к полученному раствору по каплям добавляли 0.5 мл водного раствора phen · 2HNO3 (220 мг). При этом наблюдали образование светло-желтого осадка, который отделяли на стеклянном пористом фильтре (пористость 40 мкм), промывали ацетоном и сушили в токе воздуха. Выход 92%.
При испарении маточного раствора в течение нескольких часов образовывались желтые призматические монокристаллы соединения 2, пригодные для исследования методом РСА.
Элементный CHN-анализ выполняли на CHNS-анализаторе Vario Micro cube.
РФА проводили на дифрактометре ДРОН-RM4 (CuKα-излучение, графитовый монохроматор, d001 = 3.345 Å, комнатная температура). Образцы готовили нанесением суспензии вещества в гексане на полированную сторону стандартной кварцевой кюветы. В качестве внешнего эталона использовали образец поликристаллического кремния (a = 5.4309 Å), приготовленный аналогичным образом. Регистрацию дифрактограмм проводили в пошаговом режиме (∆2θ = 0.1°) в диапазоне углов 2θ от 5° до 60°.
Термический анализ соединения 2 выполняли на аппарате STA 449F1 (Netzsch) в потоке смеси O2/Ar (20 об. % O2, 70 мл/мин) со скоростью нагрева 10 град/мин.
Спектры ЯМР 195Pt в твердом теле с вращением под “магическим” углом (ЯМР ВМУ) записывали на спектрометре Bruker Аvance-500 на частоте 107.5 МГц в роторах из диоксида циркония диаметром 4 мм. Скорость вращения образцов составляла 12 000 об/с, для определения положения центрального сигнала дополнительно записывали спектры при скорости вращения 10 000 об/с. Использовали 90° импульсы длительностью 17 мкс, задержка между импульсами составляла 60 с. Ширина развертки 163 кГц. Для кривой спада свободной индукции (FID) записывали 32 000 точек. За 18 ч регистрировали 1100 накоплений спектра. При обработке спектра применяли экспоненциальное умножение с параметром уширения 100 Гц. В качестве внешнего эталона использовали 1.2 моль/л раствор Na2[PtCl6] в D2O. Обработку данных ЯМР ВМУ проводили при помощи программного обеспечения dmfit.
Рентгеноструктурный анализ. Экспериментальные данные для расшифровки кристаллической структуры получены на автоматическом трехкружном дифрактометре Bruker APEX-II, оснащенном двухкоординатным CCD-детектором, с использованием графитового монохроматора и MoKα-излучения. Структура расшифрована прямым методом и уточнена в анизотропно-изотропном (для Н) приближении. Все расчеты выполнены в комплексе программ SHELX-97 [13]. Поглощение учтено эмпирически при помощи программы SADABS [14]. Анализ поверхности Хиршфельда соединения 2 был выполнен с применением программного обеспечения CrystalExplorer 3.1 [15].
Кристаллографические характеристики соединений 1, 2 и параметры дифракционных экспериментов представлены ниже.
C12H8N6O12Pt (1): М = 623.33 г/моль; орторомбическая сингония; a = 8.4144(5), b = 13.1344(9), c = 15.922(1) Å; V = 1759.7(2) Å3; пр. гр. P212121; Z = 4; ρ = 2.353 г/см3; F(000) = 1184; коэффициент поглощения 8.058 мм–1. Диапазон индексов h, k, l: –11 < h < 12, –18 < k < 18, –22 < l < 22. Число измеренных рефлексов 36541, независимых – 5421; Rint = 0.0512. R-фактор (все данные): R1 = 0.0226, wR2 = 0.0395; R-фактор [I > 2σ(I)]: R1 = 0.0204, wR2 = 0.0392.
C48H36N16O24Pt (2): М = 1416.01 г/моль; триклинная сингония; a = 8.6981(8), b = 10.205(1), c = = 16.086(1) Å, α = 102.856(4)°, β = 100.331(4)°, γ = = 108.556(4)°; V = 1270.3(2) Å3; пр. гр. P$\bar {1};$ Z = 1; ρ = 1.851 г/см3; F(000) = 706; коэффициент поглощения 2.871 мм–1. Диапазон индексов h, k, l: –12 < < h < 12, –15 < k < 14, –23 < l < 23. Число измеренных рефлексов 20425, независимых – 6528; Rint = = 0.0424. R-фактор (все данные): R1 = 0.0248, wR2 = 0.0486; R-фактор [I > 2σ(I)]: R1 = 0.0247, wR2 = 0.0486.
Дополнительные кристаллографические данные доступны в Кембриджском центре кристаллографических данных (№ 1 987 459 (1), 1 990 562 (2)), http://www.ccdc.cam.ac.uk.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Общий подход, использованный нами ранее для извлечения индивидуальных нитратокомплексов из раствора “нитрата платины”, заключается в добавлении макроциклических кавитандов или нитратных солей органических катионов с последующим медленным испарением таких растворов до кристаллизации искомых соединений. Однако в случае растворов, содержащих избыток 1,10-фенантролина, испарение приводит к образованию смолообразной массы без формирования твердых фаз. При продолжительном выдерживании этой массы на воздухе в ней было обнаружено небольшое количество кристаллов соединения [Pt(phen)(NO3)4] (1), пригодных для рентгеноструктурного анализа. Примечательно, что данное соединение является первым структурно охарактеризованным комплексом платины типа {Pt(${\text{N}}\frown {\text{N}}$)O4} с 1,10-фенатролином в качестве N,N-донорного лиганда.
Молекулярный комплекс 1 кристаллизуется в орторомбической (пр. гр. Р212121) ячейке (Z = 4). Полиэдр {PtN2O4} в комплексных частицах [Pt(phen)(NO3)4] имеет искаженное октаэдрическое строение (рис. 1). Однако по сравнению с аналогичными галогенидными комплексами [Pt(phen)Cl4] (№ 721 968) и [Pt(phen)I4] (№ 1 180 587) в данном случае геометрия первой координационной сферы платины значительно ближе к антипризматической, характерной для аниона [Pt(NO3)6]2– [8, 11, 16, 17]. Отклонения углов в октаэдре {PtN2O4} от 90° достигают 12° для O4APtO2A и O2APtO1A (78.3° и 102.1° соответственно). Угол N5PtN6 составляет 82.1°. Интересно отметить, что длины связей Pt–O и Pt–N в [Pt(phen)(NO3)4] практически идентичны и находятся в диапазоне 2.01–2.02 Å.
Рис. 1.
Структура комплексной частицы [Pt(phen)(NO3)4] в соединении 1. Атомы представлены в виде термоэллипсоидов с уровнем вероятности 50%, атомы водорода не показаны.
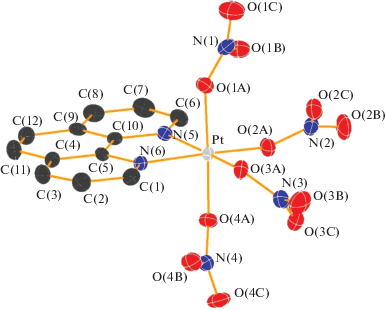
В структуре комплекса 1 можно выделить цепочки молекул [Pt(phen)(NO3)4], расположенные вдоль оси a (рис. S1 ). Расстояние между атомами платины соседних молекул в таких цепочках составляет 8.4 Å. Между цепочками наблюдается обширная сеть контактов С–Н…О в диапазоне от 2.5 до 2.7 Å, в то время как внутри цепочек подобные контакты практически не наблюдаются.
Поскольку испарение азотнокислого раствора платины с добавлением избытка 1,10-фенантролина не привело к образованию каких-либо твердых фаз, за исключением незначительного количества кристаллов соединения 1, мы предприняли попытку получения соли, содержащей анион [Pt(NO3)6] и катион 1,10-фенантролиния, путем замены катиона в ранее полученной соли (Bu4N)2[Pt(NO3)6].
При добавлении к раствору соли (Bu4N)2[Pt(NO3)6] в ацетонитриле избытка динитрата фенантролиния достаточно быстро образуется желтый кристаллический осадок соединения, согласующегося, по данным CHN-анализа, с брутто-формулой (phenH)4(NO3)2[Pt(NO3)6].
Соль 2 практически нерастворима в диметиловом эфире, этилацетате и тетрагидрофуране, плохо растворима в ацетонитриле и ацетоне, что обусловливает высокий выход данного соединения, однако хорошо растворяется в концентрированной азотной кислоте. По всей видимости, именно высокая растворимость препятствует получению солей фенантролиния с анионными нитратокомплексами платины(IV) непосредственно из азотнокислых растворов. Кроме того, соединение 2 хорошо растворяется в диметилформамиде и диметилсульфоксиде.
Соединение 2 кристаллизуется в триклинной (пр. гр. Р$\bar {1}$) ячейке с одной формульной единицей. Данные РФА порошка соли 2 хорошо согласуются с теоретической дифракционной картиной, рассчитанной из монокристальных данных (рис. S2 ), что подтверждает однофазность поликристаллического материала.
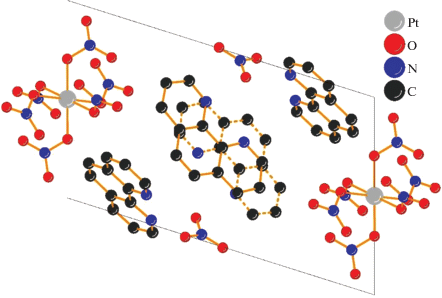
В элементарной ячейке четыре комплексных аниона [Pt(NO3)6]2– расположены по центру ребер, направленных вдоль оси b, при этом основной объем ячейки занят четырьмя катионами фенантролиния и двумя нитрат-ионами (рис. 2). Можно также отметить, что между парой катионов фенантролиния и NO3-ионом имеют место водородные связи N–H…O длиной ∼2.7 Å.
Рис. 2.
Упаковка молекул в структуре 2, вид вдоль оси b. Пунктиром показаны связи в катионе фенантролиния, расположенном в дальней части ячейки. Атомы водорода не показаны для ясности.
Комплексный анион [Pt(NO3)6]2–, как и в случае ранее описанных структур с гексанитратоплатинат-анионом [8, 10, 11, 16], имеет геометрию треугольной антипризмы, в которой нитратолиганды размещаются вокруг атома платины, образуя структуру, подобную пропеллеру (рис. 3). В структуре комплекса 2 длина связей Pt–O1A, направленных вдоль оси b, несколько короче, чем Pt–O2A и Pt–O3A (2.001 и 2.007 Å соответственно). При этом углы OPtO' в треугольных пирамидах O1AO2AO3APt находятся в диапазоне 78.5°–79.0°.
Рис. 3.
Структура комплексного аниона [Pt(NO3)6]2– в составе соединения 2. Атомы представлены в виде термоэллипсоидов с уровнем вероятности 50%.
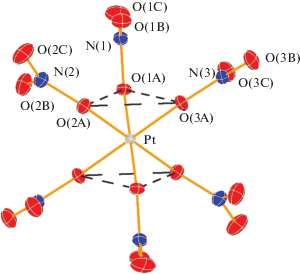
Следует отметить, что достаточно крупные катионы фенантролиния в заметной степени изолируют анионы [Pt(NO3)6]2– друг от друга. По данным анализа поверхности Хиршфельда (табл. 1), доля контактов комплексного аниона [Pt(NO3)6]2– и катиона фенантролиния достигает 87% от всех контактов аниона (сумма по контактам O–H, N–H, O–C и N–C). Вследствие такой изоляции антипризматическая геометрия полиэдра {PtO6} анионов [Pt(NO3)6]2– в структуре 2 практически не искажена. Подобный эффект наблюдался также в структуре соли (Bu4N)2[Pt(NO3)6], где тетрабутиламмонийные катионы за счет своего размера полностью изолируют комплексные анионы друг от друга.
Таблица 1.
Вклад контактов разного типа на поверхности Хиршфельда для комплексного аниона [Pt(NO3)6]2– в структуре 2, %
| O…H | N…H | O…C | N…C | O…N | O…O | N…O |
|---|---|---|---|---|---|---|
| 69.2 | 3.0 | 14.1 | 0.2 | 2.6 | 10.7 | 0.2 |
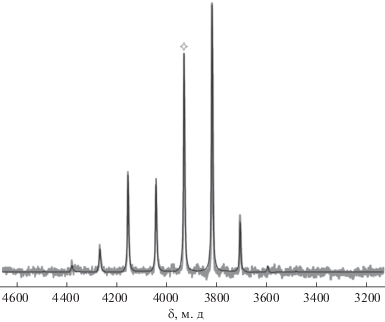
Указанная особенность структуры 2 находит отражение в данных твердотельной спектроскопии ЯМР на ядрах 195Pt. Спектр ЯМР ВМУ соединения 2 и его симуляция в программе dmfit представлены на рис. 4. Анализ профиля спектра (форма и интенсивность сателлитов вращения) позволил определить главные значения тензора химического сдвига (δ11, δ22, δ33) и рассчитать параметры анизотропии (δaniso = δ33 – δiso, где δiso = = 1/3(δ11 + δ22 + δ33)) и асимметрии магнитного экранирования (η = (δ22 – δ11)/ δaniso): δiso = 3931, δ11 = 3764, δ22 = 3764, δ33 = 4266, δaniso = 335 м.д., η = 0.00. Аксиально-симметричная форма тензора химического сдвига (η = 0) свидетельствует о неискаженной антипризматической геометрии (D3d) полиэдров {PtO6} в анионах [Pt(NO3)6]2–. Положение изотропной линии (δiso) и величина параметра анизотропии для платиновых центров в структуре 2 близки к соответствующим данным, полученным ранее для соли (n-Bu4N)2[Pt(NO3)6] (δiso = 3968, δaniso = 374 м.д.).
Рис. 4.
Спектр ЯМР ВМУ соли (phenH)4(NO3)2[Pt(NO3)6] на ядре 195Pt (серая линия) и соответствующий теоретический спектр, сгенерированный в программе dmfit (черная линия). Знаком ◊ отмечено положение изотропной линии.
В ИК-спектре соединения 2 в диапазоне 4000–400 см–1 присутствуют как характеристичные сигналы гетероциклического катиона, так и сигналы, обусловленные нитратокомплексом платины(IV) [18]. Полосы поглощения, соответствующие валентным колебаниям NO3-групп в комплексном анионе [Pt(NO3)6]2–, расположены при 1545, 1250 и 910 см–1. В спектре можно выделить широкую полосу поглощения с максимумом около 3500 см–1, относящуюся к валентным колебаниям связей N–H в катионе фенантролиния. Хорошо выраженные сигналы при 1598 и 1572 см–1 соответствуют валентным колебаниям связей С=С и С=N в гетероциклическом катионе. Сигналы, относящиеся к колебаниям связей С–H, выражены в спектре значительно слабее, однако можно отметить набор малоинтенсивных полос в области 3100–3050 см–1, соответствующих валентным колебаниям С–Н в ароматическом кольце.
Термический анализ соединения 2 в атмосфере Ar/O2 (рис. S3 ) показал, что разложение соединения начинается при 200°С, при этом процесс полностью завершается при ∼520°С. Конечная масса продукта составляет 13.83% от начальной навески, что соответствует полному разложению вещества до металлической платины (теоретическое содержание металла в соединении 2 – 13.81%).
ЗАКЛЮЧЕНИЕ
В ходе исследования установлено, что непосредственное взаимодействие 1,10-фенантролина и азотнокислого раствора гидроксида платины не приводит к образованию твердых фаз солей катиона фенантролиния с анионными нитратокомплексами платины(IV). Причиной этого, по-видимому, является высокая растворимость таких солей в азотной кислоте. Однако при взаимодействии нитрата фенантролиния и соли (Bu4N)2[Pt(NO3)6] в ацетонитриле с высоким выходом получена соль (phenH)4(NO3)2[Pt(NO3)6]. Метод замены катиона был использован ранее для синтеза соли (Pr4N)2[Pt(NO3)6] (Pr = n-C3H7) [10] и, таким образом, является удобным способом получения солей гомолептического аниона [Pt(NO3)6]2– с различными органическими катионами. Описанная в настоящей работе структура молекулярного комплекса [Pt(phen)(NO3)4] позволяет надеяться, что в подходящих условиях нитратокомплексы платины(IV) могут выступать в качестве удобных стартовых реагентов для приготовления разнолигандных комплексов платины.
Список литературы
Karhu H., Kalantar A., Väyrynen I.J. et al. // Appl. Catal. A. Gen. 2003. V. 247. № 2. P. 283. https://doi.org/10.1016/S0926-860X(03)00098-X
Arzumanov S.S., Stepanov A.G. // J. Phys. Chem. C. 2013. V. 117. № 6. P. 2888. https://doi.org/10.1021/jp311345r
Ahmadi M., Macias E.E., Jasinski J.B. et al. // J. Mol. Catal. A: Chem. 2014. V. 386. P. 14. https://doi.org/10.1016/j.molcata.2014.02.004
Gatla S., Aubert D., Agostini G. et al. // ACS Catal. 2016. V. 6. № 9. P. 6151. https://doi.org/10.1021/acscatal.6b00677
Beck I.E., Kriventsov V.V., Fedotov M.A. et al. // Nucl. Instrum. Methods Phys. Res., Sect. A. 2009. V. 603. № 1–2. P. 182. https://doi.org/10.1016/j.nima.2009.03.005
Oran U., Uner D. // Appl. Catal., B. 2004. V. 54. № 3. P. 183. https://doi.org/10.1016/j.apcatb.2004.06.011
Dou D., Liu D.J., Williamson W.B. et al. // Appl. Catal., B. 2001. V. 30. № 1–2. P. 11. https://doi.org/10.1016/S0926-3373(00)00223-X
Vasilchenko D., Tkachev S., Baidina I. et al. // Inorg. Chem. 2013. V. 52. № 18. P. 10532. https://doi.org/10.1021/ic401499j
Vasilchenko D., Berdugin S., Tkachev S. et al. // Inorg. Chem. 2015. V. 54. № 10. P. 4644. https://doi.org/10.1021/ic502896s
Vasilchenko D., Topchiyan P., Berdyugin S. et al. // Inorg. Chem. 2019. V. 58. P. 6075. https://doi.org/10.1021/acs.inorgchem.9b00370
Vasilchenko D., Topchiyan P., Tkachev S. et al. // J. Struct. Chem. 2019. V. 60. № 8. P. 1379. https://doi.org/10.1134/S0022476619080122
Vasilchenko D., Asanova T., Kolesov B. et al. // Chem. Cat. Chem. V. 12. № 5. P. 1413. https://doi.org/10.1002/cctc.201902146
Sheldrick G.M. // Acta Crystallogr., Sect. A: Found. Crystallogr. 2008. V. 64. № 1. P. 112. https://doi.org/10.1107/S0108767307043930
Bruker AXS Inc. Bruker. SADABS. Madison, Wisconsin, USA, 2001.
packman M.A., Jayatilaka D. // Cryst. Eng. Comm. 2009. V. 11. № 1. P. 19. 10.1039/b818330
Vasilchenko D., Tkachev S., Baidina I. et al. // J. Mol. Struct. 2017. V. 1130. № 3. P. 855. https://doi.org/10.1016/j.molstruc.2016.10.088
Wickleder M.S., Gerlach F., Gagelmann S. et al. // Angew. Chem. Int. Ed. 2012. V. 51. № 9. P. 2199. https://doi.org/10.1002/anie.201106107
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds. Part B. John Wiley & Sons, Inc, 2009. 408 p.
Дополнительные материалы
- скачать EMS.docx
- Рис. S1. Упаковка молекул в структуре 1. Вид вдоль оси a. Атомы водорода не показаны для наглядности.
Рис. S2. Дифрактограмма нитратокомплекса 2. Пунктирной линией представлена теоретическая дифрактограмма, полученная с монокристалла соединения 2.
Рис. S3. Кривая потери массы при разложении нитратокомплекса платины 2 в атмосфере Ar/O2. Конечная потеря массы 86,17%.
Инструменты
Журнал неорганической химии


