Журнал неорганической химии, 2020, T. 65, № 10, стр. 1345-1349
Синтез и физико-химические свойства C-борилированных сложных эфиров на основе клозо-декаборатного аниона
И. Н. Клюкин a, *, Н. А. Селиванов b, А. Ю. Быков b, А. П. Жданов b, К. Ю. Жижин b, Н. Т. Кузнецов b
a Санкт-Петербургский государственный технологический институт (Технический университет)
190013 Санкт-Петербург, Московский пр-т, 26, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: klukinil@gmail.com
Поступила в редакцию 24.04.2020
После доработки 10.05.2020
Принята к публикации 27.05.2020
Аннотация
Рассмотрено взаимодействие монокарбонильного производного клозо-декаборатного аниона [2-B10H9CO]– с O-нуклеофилами. Обнаружено, что в реакции присоединения способны вступать как первичные, так вторичные и третичные спирты. Показано, что в полученных клозо-боратных производных общего вида [2-B10H9COOR]2– связь C–O является крайне лабильной и при нагревании происходит процесс ее расщепления с образованием исходного [2-B10H9CO]–. В кислой среде в водных растворах происходит гидролиз борилированных сложных эфиров с образованием карбоксилатного производного общего вида [2-B10H9COOH]2–. Все полученные производные выделены и охарактеризованы методами ИК-, ЯМР(1H, 11B, 13C)-спектроскопии.
ВВЕДЕНИЕ
Кластерные соединения бора играют важную роль в современной неорганической химии [1, 2]. Борсодержащие полиэдры обладают широким структурным многообразием и способностью включать в кластерный остов различные химические элементы – металлы и неметаллы [3, 4]. Все это позволяет варьировать ключевое соотношение структура–свойства в широких пределах и получать системы с заданными физико-химическими параметрами [5, 6]. Данное обстоятельство позволяет рассматривать кластерные соединения бора как потенциально перспективные молекулярные платформы в оптике, медицине, экстракции радиоактивных элементов [7–9].
В нашей научной группе на протяжении длительного времени ведутся экспериментальные и теоретические работы по изучению особого класса кластерных соединений бора – клозо-бороводородов с общей формулой [BnHn]2– (n = 5–12) [10–13]. Клозо-бораты обладают высокой термической, окислительной и гидролитической устойчивостью, а также способны вступать в широкий круг химических превращений в мягких условиях [14, 15].
Особый интерес в химии клозо-бороводородов вызывают введение экзополиэдрических групп и разработка высокоселективных методов образования экзополиэдрических связей B–X (X = C, N, O, S, Hal) [16–18]. Основное внимание исследователей направлено на создание производных с экзополиэдрическими кратными связями, такими как нитрилиевые производные клозо-декаборатного аниона. Данный тип производных может подвергаться дальнейшей функционализации на основе процессов нуклеофильного присоединения.
Производные со связью B–C также способны иметь в своем составе экзополиэдрическую кратную связь. Производные общего вида [BnHn– x(CO)x]2 –x (n = 6, 10, 12, x = 1, 2) интенсивно изучаются теоретически и экспериментально [19]. Наиболее изученным соединением подобного рода является монокарбонильное производное общего вида [B10H9CO]– [20]. Благодаря наличию активированной кратной связи C–O данные производные способны вступать в реакции нуклеофильного присоединения с широким кругом органических субстратов [21–23].
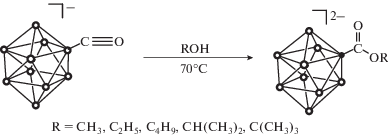
В настоящей работе мы продолжаем исследования по изучению процессов нуклеофильного присоединения к кратной связи C–O монокарбонильного производного клозо-декаборатного аниона общего вида [2-B10H9CO]–. Основной целью работы было изучение закономерностей взаимодействия карбонил-клозо-декаборатного аниона и моноатомных спиртов различного строения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Элементный анализ на углерод и водород осуществляли на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Бор определяли методом ICP MS на атомно-эмиссионном спектрометре с индуктивно-связанной плазмой iCAP 6300 Duo в ЦКП Научно-аналитического центра ФГУП “ИРЕА” Национального исследовательского центра “Курчатовский институт”.
ИК-спектры соединений записывали на ИК-Фурье-спектрофотометре Инфралюм ФТ-08 (НПФ АП “Люмекс”) в области 4000–600 см–1 с разрешением 1 см–1. Образцы готовили в виде суспензии исследуемого вещества в вазелиновом масле (Aldrich).
Спектры ЯМР (1H, 11B, 13C) растворов исследуемых веществ в CD3CN записывали на спектрометре Bruker Avance II-300 на частотах 300.3, 96.32 и 75.49 МГц соответственно с внутренней стабилизацией по дейтерию. В качестве внешних стандартов использовали тетраметилсилан или эфират трехфтористого бора. Исследования выполняли с использованием оборудования ЦКП ФМИ ИОНХ РАН, функционирующего при поддержке государственного задания ИОНХ РАН в области фундаментальных научных исследований.
Синтез и очистка исходных веществ и реагентов
((C6H5)4P)[2-B10H9CO] получали по известной методике [20]. Ацетонитрил CH3CN (Aldrich, 99%) и гидрид натрия NaH (Aldrich, 98%) использовали без предварительной очистки. Метанол CH3OH, этанол C2H5OH, пропанол C3H7OH, бутанол C4H9OH, изо-пропанол C3H7OH, трет-бутанол (CH3)3СOH абсолютизировали по методике [24].
Синтез борилированных сложных эфиров
((C6H5)4P)2[2-B10H9COOCH3]. ((С6H5)4P)[2–B10H9CO] (0.30 г, 0.0006 моль) растворяли в ацетонитриле (CH3CN) (5.0 мл), добавляли метанол (CH3OH) (1.0 мл) и гидрид натрия (NaH) (0.04–0.05 г). Полученный раствор нагревали в течение 4 ч при температуре 70°C. После окончания процесса раствор охлаждали до комнатной температуры, добавляли ((С6H5)4P)Cl (0.23 г, 0.0006 моль) и концентрировали на роторном испарителе. Целевой продукт перекристаллизовывали из метанола и промывали двумя порциями диэтилового эфира. Выход 0.48 г (91%). ИК-спектр (суспензия в вазелиновом масле): ν(BH): 2470 см–1, ν(CO): 1730 см–1; ЯМР 11B-{1H} (CD3CN, м.д.): 0.6 (д, 1B, Bап), –0.8 (д, 1B, Bап), –23.1 (с, 1B, Bзам), –28.1 (д, 7B, Bэкв); ЯМР 1H (CD3CN, м.д.)11: 0.50–2.00 (м, 9H, B10H9), 8.07 (м, 8H, Ph4P+), 7.90 (м, 16H, Ph4P+), 7.80 (м, 16H, Ph4P+), 3.81 (м, 3H, CH3(α)); ЯМР 13С (CD3CN, м.д.): 174.7 (BCOO), 140.6 (Ph4P+), 139.8 (Ph4P+), 135.8 (Ph4P+), 122.7 (Ph4P+), 51.2 (СН3(α)).
((С6H5)4P)2[2-B10H9СOOC2H5] получали по методике, аналогичной для ((С6H5)4P)2[2–B10H9СOOCH3], с использованием этанола (C2H5OH) в качестве нуклеофильного субстрата. Выход 0.44 г (85%). ИК-спектр (суспензия в вазелиновом масле): ν(BH): 2485 см–1, ν(CO): 1745 см–1; ЯМР 11B-{1H} (CD3CN, м.д.): –0.1 (д, 1B, Bап), ‒0.9 (д, 1B, Bап), –23.3 (с, 1B, Bзам), –27.2 (д, 7B, Bэкв); ЯМР 1H (CD3CN, м.д.): 0.50–2.00 (м, 9H, B10H9), 8.07 (м, 8H, Ph4P+), 7.90 (м, 16H, Ph4P+), 7.80 (м, 16H, Ph4P+), 4.17 (т, 2H, CH2(α)), 1.26 (д, 3H, CH3(β)); ЯМР 13С (CD3CN, м.д.): 169.1 (BCOO), 140.6 (Ph4P+), 139.8 (Ph4P+), 135.8 (Ph4P+), 122.7 (Ph4P+), 60.7 (СН2(α)), 14.3 (СН3(β)).
((С6H5)4P)2[2-B10H9СOOC3H7] получали по методике, аналогичной для ((С6H5)4P)2[2–B10H9СOOCH3], с использованием пропанола (C3H7OH) в качестве нуклеофильного субстрата. Выход 0.48 г (91%). ИК-спектр (суспензия в вазелиновом масле): ν(BH): 2485 см–1, ν(CO): 1751 см–1; ЯМР 11B-{1H} (CD3CN, м.д.): –0.4 (д, 1B, Bап), ‒1.6 (д, 1B, Bап), –24.0 (с, 1B, Bзам), –27.5 (д, 7B, Bэкв); ЯМР 1H (CD3CN, м.д.): 0.50–2.00 (м, 9H, B10H9), 8.07 (м, 8H, Ph4P+), 7.90 (м, 16H, Ph4P+), 7.80 (м, 16H, Ph4P+), 3.91 (т, 2H, CH2(α)), 1.51 (м, 2H, CH2(β)), 0.85 (т, 3H, CH3(γ)); ЯМР 13С (CD3CN, м.д.): 168.1 (BCOO), 140.6 (Ph4P+), 139.8 (Ph4P+), 135.8 (Ph4P+), 122.7 (Ph4P+), 65.9 (СН2(α)), 22.5 (СН2(β)), 10.1 (СН2(γ)).
((С6H5)4P)2[2-B10H9СOOC4H9] получали по методике, аналогичной для ((С6H5)4P)2[2–B10H9СOOCH3], с использованием бутанола (C4H9OH) в качестве нуклеофильного субстрата. Выход 0.50 г (93%). ИК-спектр (суспензия в вазелиновом масле): ν(BH): 2485 см–1, ν(CO): 1739 см–1; ЯМР 11B-{1H} (CD3CN, м.д.): –0.4 (д, 1B, Bап), –1.6 (д, 1B, Bап), –24.0 (с, 1B, Bзам), –27.5 (д, 7B, Bэкв); ЯМР 1H (CD3CN, м.д.): 0.50–2.00 (м, 9H, B10H9), 8.07 (м, 8H, Ph4P+), 7.90 (м, 16H, Ph4P+), 7.80 (м, 16H, Ph4P+), 4.01 (т, 2H, CH2(α)), 1.64 (м, 2H, CH2(β)), 1.39 (м, 2H, CH2(γ)), 0.91 (м, 3H, CH3(δ)); ЯМР 13С (CD3CN, м.д.): 172.3 (BCOO), 140.6 (Ph4P+), 139.8 (Ph4P+), 135.8 (Ph4P+), 122.7 (Ph4P+), 64.1 (СН2(α)), 30.9 (СН2(β)), 19.1 (СН2(γ)), 13.6 (СН2(δ)).
((С6H5)4P)2[2-B10H9СOOCH(CH3)2] получали по методике, аналогичной для ((С6H5)4P)2[2–B10H9СOOCH3], с использованием изо-пропанола (C3H7OH) в качестве нуклеофильного субстрата, однако нагревание проводили в течение 6 ч. Получено 0.46 г (87%). ИК-спектр (суспензия в вазелиновом масле): ν(BH): 2485 см–1, ν(CO): 1733 см–1; ЯМР 11B-{1H} (CD3CN, м.д.): –0.2 (д, 1B, Bап), –1.1 (д, 1B, Bап), –22.8 (с, 1B, Bзам), –28.1 (д, 7B, Bэкв); ЯМР 1H (CD3CN, м.д.): 0.50–2.00 (м, 8H, B10H9), 8.07 (м, 8H, Ph4P+), 7.90 (м, 16H, Ph4P+), 7.80 (м, 16H, Ph4P+), 4.75 (м, H, CH (α)), 1.41 (м, 6H, CH3(β)); ЯМР 13С (CD3CN, м.д.): 169.5 (BCOO), 140.6 (Ph4P+), 139.8 (Ph4P+), 135.8 (Ph4P+), 122.7 (Ph4P+), 67.1 (СН(α)), 20.9 (СН3(β)).
((С6H5)4P)2[2-B10H9СOOC(CH3)3] получали по методике, аналогичной для ((С6H5)4P)2[2–B10H9СOOCH3], с использованием трет-бутанола ((CH3)3СOH) в качестве нуклеофильного субстрата, однако нагревание проводили в течение 6 ч. Получено 0.46 г (86%). ИК-спектр (суспензия в вазелиновом масле): ν(BH): 2485 см–1, ν(CO): 1735 см–1; ЯМР 11B-{1H} (CD3CN, м.д.): –0.5 (д, 1B, Bап), –1.2 (д, 1B, Bап), –23.7 (с, 1B, Bзам), –28.3 (д, 7B, Bэкв); ЯМР 1H (CD3CN, м.д.): 0.50–2.00 (м, 8H, B10H9), 8.07 (м, 8H, Ph4P+), 7.90 (м, 16H, Ph4P+), 7.80 (м, 16H, Ph4P+), 1.41 (т, 9H, CH3(α)); ЯМР 13С (CD3CN, м.д.): 172.1 (BCOO), 140.6 (Ph4P+), 139.8 (Ph4P+), 135.8 (Ph4P+), 122.7 (Ph4P+), 78.9 (C(α)(СН3)3), 28.9 (C(СН3(β))3).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Взаимодействие монокарбонильного производного [2-B10H9CO]– с молекулами спиртов протекает в мягких условиях в ацетонитриле при температуре 70°С и приводит к образованию борилированных сложных эфиров общего вида [2–B10H9COOR]2–. Наличие основания, гидрида натрия (NaH) позволяет существенно сократить время процесса и повысить суммарный выход целевого продукта. В отличие от взаимодействия с первичными спиртами, процесс присоединения вторичных и третичных спиртов происходит более длительное время. Контроль за ходом реакции и определение структуры полученных производных осуществляли методами мультиядерной ЯМР, ИК-спектроскопии. Так, спектр ЯМР 11B соединения (C6H5)4P)[2-B10H9COOCH3] имеет следующий вид: два сигнала от двух неэквивалентных апикальных атомов бора при 0.6 и –0.8 м.д., сигнал от замещенного атома бора при –23.1 м.д., который не расщепляется в дублет в отсутствие широкополосного подавления спин-спинового взаимодействия, а также сигнал в сильном поле от экваториальных атомов бора при –28.1 м.д. Данный вид спектра соответствует монозамещенному производному клозо-декаборатного аниона с экваториальной позицией заместителя. В спектре ЯМР 1H ((C6H5)4P)2[B10H9COOCH3] помимо сигналов от тетрафенилфосфониевых катионов наблюдается сигнал от атомов экзополиэдрического заместителя – сигнал при 3.81 м.д. от протонов метильной группы. В спектре ЯМР 13С этого соединения помимо сигналов катиона наблюдаются сигналы от углеродного атома экзополиэдрического заместителя, а именно: сигнал при 175.0 м.д. от карбоксилатного атома углерода и сигнал при 50.7 м.д. от атома углерода метильной группы.
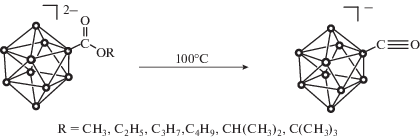
В ходе исследования обнаружено, что, в отличие от органических сложных эфиров, в полученных борилированных производных связь C–O является лабильной и способной расщепляться при нагревании с образованием исходного аниона [2-B10H9CO]–. Данное обстоятельство аналогично тому, что наблюдается в случае борилированных амидов. Так, при нагревании растворов полученных производных до ~100°C в целевых производных происходит расщепление связи C–O с образованием исходного аниона [B10H9CO]–. Образование исходного монокарбонильного производного легко подтверждается методами мультиядерной ЯМР-спектроскопии. Так, в 11B ЯМР-спектре полностью исчезают сигналы, отвечающие целевым соединениям, и наблюдаются сигналы, характерные для монозамещенного карбонильного производного. Сигнал при 4.6 м.д. соответствует двум апикальным позициям, группа сигналов при –19.9, –27.7, –30.2 м.д. отвечает экваториальным атомам бора, и сигнал от атома бора в замещенной позиции находится при –45.8 м.д.
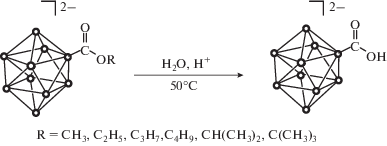
При умеренном нагревании (~50°С) водных растворов продуктов в кислотной среде при pH < 3 в течение 3 ч происходит полный гидролиз борилированных эфирных производных с образованием карбоксилатного производного общего вида [B10H9COOH]2–. Процесс гидролиза сложноэфирных производных легко подтверждается данными спектроскопии ЯМР 1Н и 13С, так как в спектрах борсодержащих веществ, полученных после выделения и очистки из водных растворов, исчезают сигналы от экзополиэдрических алкильных заместителей. В 1H ЯМР-спектре появляется сигнал при 4.15 м.д., соответствующий протону экзополиэдрической группы COOH. В спектре ЯМР 13С наблюдается сильное смещение карбоксилатного атома углерода в слабое поле.
ЗАКЛЮЧЕНИЕ
Рассмотрено взаимодействие монокарбонильного производного клозо-декаборатного аниона [B10H9CO]– с O-нуклеофилами. Показано, что данный процесс протекает в мягких условиях и с высоким выходом. В полученных борилированных производных связь C–O является крайне лабильной, и при нагревании происходит процесс ее расщепления с образованием исходного аниона [B10H9CO]–. В кислой среде в водных растворах происходит гидролиз борилированных сложных эфиров с образованием карбоксилатного производного общего вида [B10H9COOH]2–.
Список литературы
Fisher S.P., Tomich A.W., Lovera S.O. et al. // Chem. Rev. 2019. V. 119. № 14. P. 8262. https://doi.org/10.1021/acs.chemrev.8b00551
Shmal’ko A.V., Sivaev I.B. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1726. https://doi.org/10.1134/S0036023619140067
Nandi C., Kar S., Zafar M. et al. // Inorg. Chem. 2020. V. 59. № 6. P. 3537. https://doi.org/10.1021/acs.inorgchem.0c00122
Kononova E.G., Klemenkova Z.S. // J. Mol. Struct. 2013. V. 1036. P. 311. https://doi.org/10.1016/j.molstruc.2012.11.053
Quan Y., Xie Z. // Chem. Soc. Rev. 2019. V. 48. № 13. P. 3660. https://doi.org/10.1039/c9cs00169g
Yan H., Tu D., Poater J. et al. // Angew. Chem. Int. Ed. 2020. https://doi.org/10.1002/anie.201915290
Stockmann P., Gozzi M., Kuhnert R. et al. // Chem. Soc. Rev. 2019. V. 48. № 13. P. 3497. https://doi.org/10.1039/c9cs00197b
Keener M., Hunt C., Carroll T.G. et al. // Nature. 2020. V. 577. № 7792. P. 652. https://doi.org/10.1038/s41586-019-1926-4
Allis D.G., Spencer J.T. // Inorg. Chem. 2001. V. 40. № 14. P. 3373. https://doi.org/10.1021/ic0007761
Klyukin I.N., Novikov A.S., Zhdanov A.P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1825. https://doi.org/10.1134/S0036023619140031
Nelyubin A.V., Klyukin I.N., Zhdanov A.P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1750. https://doi.org/10.1134/S0036023619140043
Bykov A.Y., Zhdanov A.P., Zhizhin K.Y. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 13. P. 1629. https://doi.org/10.1134/S0036023616130027
Zhizhin K.Y., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Semioshkin A.A., Sivaev I.B., Bregadze V.I. // Dalton Trans. 2008. V. 11. № 8. P. 977. https://doi.org/10.1039/b715363e
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czechoslov. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1135/cccc2010054
Laila Z., Yazbeck O., Ghaida F.A. et al. // J. Organomet. Chem. 2020. V. 910. P. 121132. https://doi.org/10.1016/j.jorganchem.2020.121132
Kaszyński P., Ringstrand B. // Angew. Chem. Int. Ed. 2015. V. 54. № 22. P. 6576. https://doi.org/10.1002/anie.201411858
Zhdanov A.P., Voinova V.V., Klyukin I.N. et al. // J. Clust. Sci. 2019. V. 2. https://doi.org/10.1007/s10876-019-01628-2
Klyukin I.N., Novikov A.S., Zhdanov A.P. et al. // Mendeleev Commun. 2020. V. 30. № 1. P. 88. https://doi.org/10.1016/j.mencom.2020.01.029
Shelly K., Knobler C.B., Hawthorne M.F. // Inorg. Chem. 1992. V. 31. № 13. P. 2889. https://doi.org/10.1021/ic00039a041
Lisovskii M.V., Plyavnik N.V., Serebrennikova G.A. et al. // Russ. J. Inorg. Chem. 2005. V. 50. № 1. P. 20. [Лисовский М.В., Плавник Н.В., Серебренникова Г.А. и др. // Журн. неорган. химии 2005. Т. 50. № 1. С. 24.]
Abi-ghaida F., Laila Z., Ibrahim G. // Dalton Trans. 2014. P. 13 087. https://doi.org/10.1039/c4dt00772g
Klyukin I.N., Selivanov N.A., Bykov A.Y. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 11. P. 1405. [Клюкин И.Н., Селиванов Н.А., Быков А.Ю. и др. // Журн. неорган. химии 2019. Т. 64. № 11. С. 1179.] https://doi.org/10.1134/S0036023619110081
Leonard J., Lygo B., Procter G. Advanced Practical Organic Chemistry, Boca Raton, 2013. 356 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии