Журнал неорганической химии, 2020, T. 65, № 10, стр. 1357-1364
Термическое взаимодействие в системе [Pt(NH3)4]Cl2–(NH4)10[H2W12O42]
Е. В. Фесик a, *, Т. М. Буслаева a, Л. С. Тарасова b, В. П. Сиротинкин c
a МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
119571 Москва, пр-т Вернадского, 86, Россия
b Федеральный исследовательский центр “Красноярский научный центр СО РАН”
660036 Красноярск, ул. Академгородок, 50, Россия
c Институт металлургии и материаловедения им. А.А. Байкова РАН
119334 Москва, Ленинский пр-т, 49, Россия
* E-mail: 1707-fesik@mail.ru
Поступила в редакцию 30.04.2020
После доработки 11.05.2020
Принята к публикации 27.05.2020
Аннотация
Изучено термическое взаимодействие в системе [Pt(NH3)4]Cl2–(NH4)10[H2W12O42] (Pt : W = 1 : 2) в атмосфере аргона, которое начинается при температуре выше 200°C, протекает через ряд последовательных стадий и завершается при 450°С. Методами ТГ, ДТА, масс-спектрометрии, РФА, РФЭС и элементного анализа исследованы промежуточные продукты, образующиеся в твердой и газовой фазе. Конечный твердый продукт, полученный при 542 и 550°С, представлен твердым раствором на основе платины Pt1 –xWx с параметром ячейки a = 3.9261(6) и 3.9262(3) Å соответственно, а также оксидными фазами вольфрама – гексагональной h-WO3 и моноклинной m-WO3. Предложена реакция, описывающая взаимодействие компонентов в рассматриваемой системе. Полученные результаты могут быть положены в основу способов приготовления катализаторов на основе платины и вольфрама для различных химических процессов.
ВВЕДЕНИЕ
Биметаллические сплавы на основе платины и вольфрама известны как катализаторы селективного каталитического восстановления водорода, окисления пропана, изомеризации н-гептана и др. процессов [1–4]. Их получают обычно методом “сухой” и/или “влажной” пропитки оксидного носителя растворами соединений-предшественников с последующей сушкой и прокаливанием в инертной, восстановительной или воздушной среде [1–4]. Изучение термических превращений соединений-предшественников и смесей прекурсоров имеет большое значение для установления возможности получения твердых продуктов разного состава и определения структуры, свойств, степени дисперсности [5–7].
В литературе имеются примеры изучения термолиза соединений, представляющих собой соли комплексных аммиакатов платины и палладия с оксоанионами переходных металлов состава [M(NH3)4][M'O4]2 (M = Pt, Pd; M' = Re, Mn) [8, 9]. В частности, установлено, что термолиз [Pt(NH3)4](ReO4)2 в атмосфере водорода приводит к образованию твердого раствора на основе платины Pt0.35Re0.65 [8], а на воздухе в интервале температур 370–444°C – к образованию металлической платины [9]. В случае комплекса [Pd(NH3)4][ReO4]2 в атмосфере гелия до 500°С образуются Pd0 и аморфные оксиды рения, в атмосфере водорода выше 300°С – твердый раствор Pd0.33Re0.67. При нагревании [Pd(NH3)4](MnO4)2 происходит интенсивный окислительно-восстановительный процесс (тепловой взрыв) при ∼200°C с образованием рентгеноаморфных продуктов и в инертной, и в восстановительной атмосфере [8, 9]. Отмечено, что последующая выдержка продуктов термического разложения в инертной или восстановительной атмосфере при 200–400°С не сопровождается их кристаллизацией. Согласно [10], при термическом разложении вольфраматов [Pd(NH3)4]WO4 и [Pd(NH3)4]3W7O24 · 4.4H2O в присутствии восстановителя (LiH) в атмосфере гелия при 1273 K образуются сплавы Pd-W.
В продолжение проводимых нами исследований взаимодействия комплексных аммиакатов платины(II) и палладия(II) c аммонийными солями кислородсодержащих кислот элементов IV группы – моно- и дихроматами аммония [11–13] в настоящей работе мы поставили задачу выявить особенности взаимодействия в системе [Pt(NH3)4]Cl2–(NH4)10[H2W12O42] (Pt : W = 1 : 2) в атмосфере аргона в интервале температур от 50 до 600°С и возможность получения металлических фаз.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных соединений в работе использовали [Pt(NH3)4]Cl2 ∙ H2O, синтезированный из платинохлористоводородной кислоты (ТУ 2612-059-00196533-2002, ОАО “Красцветмет” им. В.Н. Гулидова) по методике [14], и коммерческий препарат (NH4)10W12O41 · nH2O (ч. д. а., CAS 11120-25-5).
К смеси навесок исходных соединений, взятых в заданном соотношении, добавляли минимальное количество дистиллированной воды и тщательно перемешивали в выпарительной чашке. Затем смесь сушили до постоянной массы при температуре 100 ± 10°C.
Термогравиметрический анализ рассматриваемой смеси выполняли на приборе синхронного термического анализа STA 449С Jupiter (Netzsch, Германия), совмещенном с масс-спектрометром QMS 403С Aeolos (Красноярский региональный центр коллективного пользования ФИЦ КНЦ СО РАН). Образцы приготовленных смесей помещали в корундовый тигель и нагревали со скоростью 10 град/мин в токе аргона (40 мл/мин). Промежуточные продукты термического разложения для изучения их фазового и химического состава получали в проточном кварцевом реакторе, вставленном в трубчатую печь, в токе аргона со скоростью 40 мл/мин при температурах, соответствующих эндо- и экзоэффектам на термограммах.
Рентгенограммы снимали на порошковом дифрактометре ARL X’TRA (Termo Fisher Scientific, Швейцария) с использованием монохроматического CuKα-излучения c длиной волны 1.54056 Å и линейной коррекцией длины волны 1.54433 Å (сканирование с шагом 0.02°, время набора импульсов 3 с, интервал углов 2θ = 5°−80°). Для идентификации образовавшихся фаз проводили рентгенофазовый анализ (РФА) с использованием автоматизированной базы данных Pcpdfwin PDF2. Параметры элементарной ячейки уточняли с помощью программы Dicvol04 [15].
Рентгенофотоэлектронные спектры (РФЭС) исследуемых порошков получали на рентгенофотоэлектронном спектроскопе Omicron ESCA+ при возбуждении монохроматическим Al-излучением с энергией 1486.6 эВ и мощностью 252 Вт. Давление в камере анализатора не превышало 10–9 Торр. Энергия анализатора составляла 20 эВ. Положение линий элементов, входящих в состав поверхностного слоя, стандартизовали по пику C1s остаточных углеводородных загрязнений при получении порошков и из атмосферы, энергию связи которой принимали равной 285.0 эВ [16].
Элементный состав продуктов термолиза смеси устанавливали, используя энергодисперсионный микроанализатор Analysis Station JED-2300 (JEOL Ltd., Япония) при ускоряющем напряжении 20 кВ.
Элементный CHNS-анализ проводили на элементном анализаторе Flash EA 1112 (Thermo Finnigan Italia S.p.A., Италия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Термические свойства [Pt(NH3)4]Cl2 ∙ H2O хорошо изучены, и известно [5, 17], что в атмосфере гелия соединение термически устойчиво до 200°С, а в диапазоне температур 300–350°C Pt2+ восстанавливается до металлического состояния даже на воздухе.
Сведения о поведении вольфрамата (NH4)10W12O41 · nH2O при нагревании в разных атмосферах неоднозначны. С одной стороны, согласно [18], в атмосфере водорода он разлагается до металла с небольшими примесями оксидных фаз, с другой – приводятся данные о термическом разложении указанной соли на воздухе и в инертной атмосфере до оксида вольфрама(VI) [19–21]. По утверждению авторов [19–21], на воздухе образуется стехиометрический оксид вольфрама, а в атмосфере инертного газа – аммоний-оксидная бронза, которая далее переходит в субоксид вольфрама. В процессе разложения вода и аммиак выделяются в несколько этапов с различными стехиометрическими соотношениями [21].
Исходя из вышеизложенного, мы сочли целесообразным прежде, чем исследовать термическое взаимодействие в системе, обратиться к рассмотрению поведения исходной соли вольфрама (NH4)10W12O41 · nH2O22 в процессе нагревания в инертной атмосфере. Полученная термограмма и масс-спектры продуктов в газовой фазе приведены на рис. 1.
Рис. 1.
Термограмма (NH4)10[H2W12O42] · 2H2O (а) и масс-спектры продуктов газовой фазы (б) в атмосфере аргона.
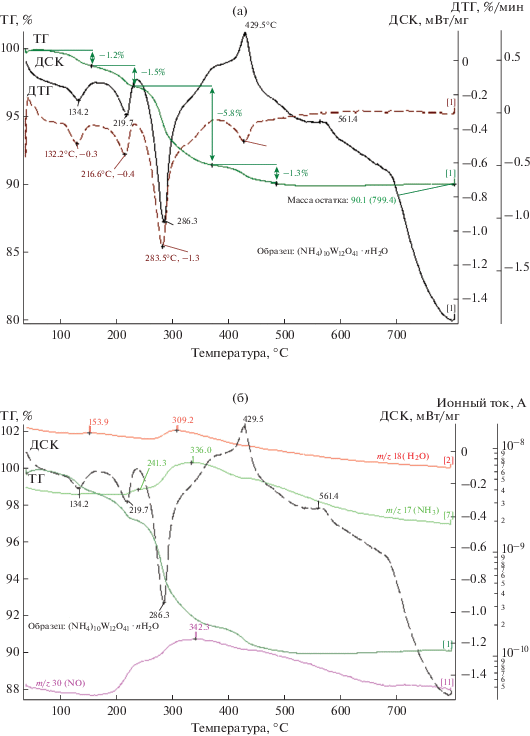
На кривой ДСК наблюдаются три эндоэффекта с максимумами при 134.2, 210.7, 286.3°С и два экзоэффекта при 429.5 и 561.4°С (рис. 1а). Общая потеря массы образца составляет 9.9% (Δmтеор = = 10.1%). Масса остатка составляет 90.1% (Δmтеор = 89.9%), что соответствует превращению (NH4)10[H2W12O42] · 2H2O в WO3. Разложение (NH4)10[H2W12O42] · 2H2O может быть описано уравнением (1):
(1)
$\begin{gathered} {{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{10}}}}}{\text{[}}{{{\text{H}}}_{{\text{2}}}}{{{\text{W}}}_{{{\text{12}}}}}{{{\text{O}}}_{{{\text{42}}}}}{\text{] }}\cdot{\text{ }}2{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to \\ \to 12{\text{W}}{{{\text{O}}}_{3}} + 10{\text{N}}{{{\text{H}}}_{3}}{\kern 1pt} \uparrow + \,8{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} \uparrow {\kern 1pt} . \\ \end{gathered} $Термограмма системы [Pt(NH3)4]Cl2–(NH4)10[H2W12O42] и масс-спектры продуктов газовой фазы в аргоне представлены на рис. 2.
Рис. 2.
Термограмма системы [Pt(NH3)4]Cl2–(NH4)10[H2W12O42] (а) и масс-спектры продуктов газовой фазы (б) в атмосфере аргона.
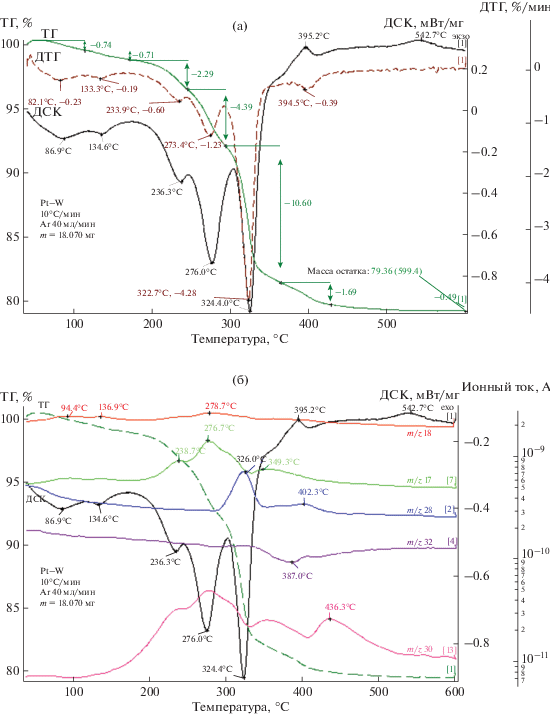
На кривой ДТГ выделяются шесть ступеней потери массы, которые сопровождаются семью эндотермическими эффектами на кривой ДСК, аналогично (NH4)10[H2W12O42] · 2H2O (рис. 2а). Очевидно, что термическая устойчивость системы [Pt(NH3)4]Cl2–(NH4)10[H2W12O42] определяется (NH4)10[H2W12O42] · 2H2O, поскольку, как и в случае индивидуального соединения, разложение начинается после 135°С, а формирование конечного продукта завершается при 450°С.
Данные термического и масс-спектрометрического анализа системы [Pt(NH3)4]Cl2–(NH4)10[H2W12O42] и предполагаемые брутто-составы промежуточных твердых продуктов приведены в табл. 1.
Таблица 1.
Данные термического и масс-спектрометрического анализа системы [Pt(NH3)4]Cl2–(NH4)10[H2W12O42] (Pt : W = 1 : 2) и предполагаемые брутто-составы промежуточных твердых продуктов
| Стадия | t, °С | t-эффект, °С | Δm, % | m/формула | Брутто-состав | |||
|---|---|---|---|---|---|---|---|---|
| ДТГ* | ДСК | эксп | теор | газовая фаза | твердая фаза | |||
| 1 | 50–200 | “–” 82.1 “–” 133.3 |
“–” 86.9 “–” 134.6 |
1.45 | 1.42 | 18/H2O | 4H2O | Pt6W12O38Cl12N34H106 |
| 2 | 200–300 | “–” 233.9 “–” 273.4 |
“–” 236.3 “–” 276.0 |
6.68 | 6.86 | 17/NH3 18/H2O |
12NH3 8H2O |
Pt6W12O30Cl12N22H54 |
| Σ Δm1-2 | 8.1 | 8.3 | ||||||
| 3 | 300–600 | “–” 322.7 “–” 394.5 |
“–” 324.4 “+” 395.2 “+” 542.7 |
12.8 | 12.8 | 17/NH3 18/H2O 28/N2 32/O2 |
8NH3 15H2O 7N2 3/2O2 |
Pt6W12O12Cl12 |
| Σ Δm2-3 | 20.9 | 21.1 | ||||||
| m тв. остатка | 79.1 | 78.9 | ||||||
На первой и второй ступенях при незначительной потере массы происходит удаление четырех молекул H2O (Δmэксп = 1.45%, Δmтеор = 1.42%). На кривой ДСК фиксируются эндоэффекты с соответствующими максимумами при температурах 89 и 137°С, а в масс-спектрах (рис. 2б) – сигналы воды.
Третья и четвертая ступени в интервале температур 150–300°С плохо разделены, сопровождаются двумя минимумами на кривой ДТГ при 234 и 273°С и двумя эндоэффектами на кривой ДСК с максимумами при 236 и 276°С. По данным масс-спектрометрии, в газовой фазе в указанном температурном интервале обнаруживаются сигналы аммиака и воды. Потеря массы здесь составляет Δmэксп = 6.68% (вычислено Δmтеор = 6.86%), что соответствует удалению 12NH3 и 8H2O.
Мы полагаем, что сдвоенный эндоэффект может указывать на образование новых фаз и существование в промежуточном продукте дегидратированного вольфрамата и промежуточных оксидов вольфрама, а также на протекание параллельных процессов, например на лигандную перегруппировку в комплексе платины(II).
На последней ступени в интервале температур 300–500°С происходит окончательное формирование конечного продукта, сопровождаемое резкой потерей массы 12.8% (Δmтеор = 12.8%) с максимумами эндо- и экзоэффектов при 324 и 395°С соответственно и удалением 8NH3, 15H2O, 7N2 и 3/2O2.
В масс-спектрах продуктов газовой фазы присутствует NO (m/z = 30), образующийся при окислении аммиака по уравнению (2):
(2)
${\text{4N}}{{{\text{H}}}_{3}} + 5{{{\text{O}}}_{2}} \to 4{\text{NO}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$В то же время обращает на себя внимание отсутствие в масс-спектрах газовой фазы сигналов хлорсодержащих продуктов (Cl˙, Cl2, HCl), что отличает рассматриваемую систему от описанных в работах [11–13]. Образование WO2Cl2 здесь возможно по уравнениям (4) и/или (5) [23]:
(4)
${\text{W}}{{{\text{O}}}_{2}} + {\text{C}}{{{\text{l}}}_{2}} \to {\text{W}}{{{\text{O}}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{2}}\left( {{\text{при }}540^\circ {\text{С}}} \right),$(5)
${\text{W}}{{{\text{O}}}_{{\text{3}}}} + {\text{HCl}} \to {\text{W}}{{{\text{O}}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{{\text{2}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}\left( {{\text{при }}400^\circ {\text{С}}} \right).$Вероятнее всего, WO2Cl2 на воздухе превращается в WO3 [23]33.
Общая потеря массы составляет 20.9% (Δmтеор = 21.1%), масса твердого остатка – 79.1% (Δmтеор = 78.9%), содержание металлов в смеси – 66.9%, вычисленная масса остатка (6Pt + 6W + + 6WO2Cl2) – 78.9%, что хорошо согласуется с экспериментальными данными (табл. 1).
По данным элементного анализа, состав конечного продукта, полученного в аргоне при 550°С, описывается формулой Pt0.29W0.32O0.38. Содержание кислорода в образце, вероятно, указывает на присутствие в нем оксидных фаз вольфрама.
Дифрактограмма продукта термолиза смеси при температуре 236°С содержит один пик с d = = 2.07 (рис. 3а). РФА позволяет предположить, что в образце содержится метастабильная кубическая фаза β-W, которая, вероятно, стабилизируется за счет вхождения в структуру некоторого количества атомов Pt. О возможности получения химическими методами фазы β-W при температурах ниже 650°С и необходимости присутствия некоторого количества примесных атомов для стабилизации структуры упоминается в работах [24, 25].
Рис. 3
Рентгенограммы твердых продуктов взаимодействия в системе [Pt(NH3)4]Cl2–(NH4)10[H2W12O42] (Pt : W = 1 : 2) в аргоне при 236 и 276°С (а), 324 и 395°С (б), 542 и 550°С (в).
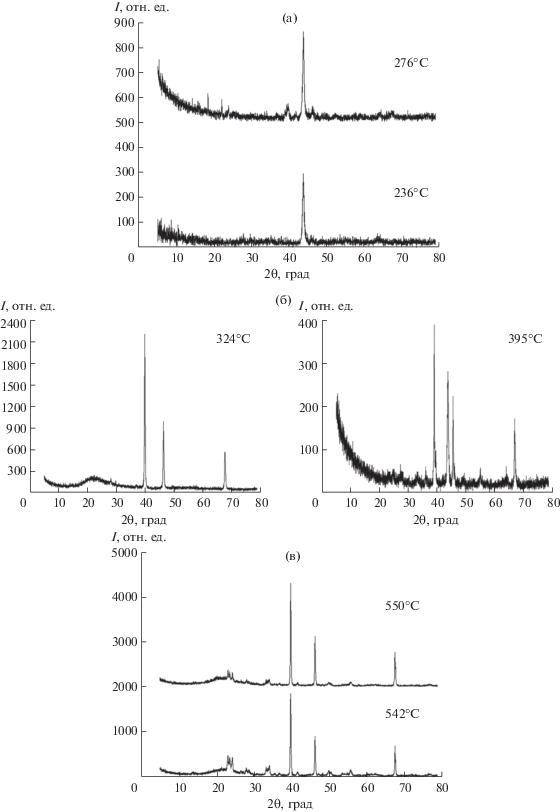
Согласно данным РФА, твердый продукт при температуре 276°С имеет в составе стабилизированную некоторым количеством атомов Pt кубическую фазу β-W, транс[Pt(NH3)2Cl2] и кубический твердый раствор на основе платины Pt1 –xWx (пр. гр. Fm$\bar {3}$m) с a = 3.935(7) Å (рис. 3а). Промежуточный твердый продукт, полученный при температуре 324°С, представлен кубическим твердым раствором на основе платины Pt1 – xWx (пр. гр. Fm$\bar {3}$m) с a = 3.9252(1) Å и оксидной фазой WO3 (рис. 3б).
Несмотря на то, что радиус W (r(W) = 1.40 Å) несколько больше радиуса Pt (r(Pt) = 1.38Å) [26], параметр ячейки образовавшегося твердого раствора a = 3.9252(1) Å меньше параметра ячейки полученной в этих же условиях чистой платины Pt (a = 3.935(4) Å). Подобное изменение параметра ячейки в твердых растворах Pt1 –xWx типично для таких сплавов [27].
В продукте, полученном при 395°С, присутствуют упорядоченные интерметаллические фазы PtxWy (рис. 3б), что не противоречит литературным данным [28]. Следует отметить, что представленные результаты по фазовому составу продуктов реакций при 236–395°С вследствие присутствия аморфных составляющих и плохо закристаллизованных фаз во многом носят предположительный характер и требуют в дальнейшем более детального исследования.
В продуктах, полученных при 542 и 550°С, содержатся кубические твердые растворы на основе платины Pt1 –xWx (пр. гр. Fm$\bar {3}$m) с a = 3.9261(6) и 3.9262(3) Å соответственно, гексагональная h-WO3 и моноклинная m-WO3 оксидные фазы (рис. 3в).
Исследование образцов методом РФЭС позволило выявить на поверхности металлические состояния платины Eсв(Pt4f7/2) = 71.8 эВ и вольфрама Eсв(W4f7/2) = 31.0 эВ [16]. Хотя линии спектра уширены как в случае платины, так и в случае вольфрама, выделить два или более состояний платины и вольфрама было бы некорректно по причине слабой интенсивности сигнала и неразрешенности линии.
Наблюдаемый пик кислорода O1s имеет сложную структуру и состоит из нескольких компонент: Eсв(O1s) = 530.8, 532.1 и 533.3 эВ. Первая компонента относится к кислороду в составе оксидов, а вторая и третья – к гидроксильной группе и воде соответственно, присутствие которых на поверхности образца, возможно, объясняется адсорбцией воды из воздуха при подготовке образца к анализу.
На основании полученных данных можно сделать вывод, что общая интенсивность линий Pt4f7/2 и W4f7/2 в спектрах образца достаточно низкая и соответствует концентрации платины и вольфрама 0.12 и 0.01 ат. % соответственно. Такая низкая интенсивность линий Pt4f7/2 и W4f7/2 может быть обусловлена образованием крупных агрегатов (или частиц) платины и/или твердого раствора Pt-W. Вольфрам, не вошедший в состав твердого раствора, находится в виде оксидов, что подтверждается данными РФА.
Анализ данных, полученных в настоящей работе, дает основание предположить, что термическое взаимодействие в системе [Pt(NH3)4]Cl2–NH4)10[H2W12O42] может быть описано уравнением (5):
(3)
$\begin{gathered} 6{\text{[Pt(N}}{{{\text{H}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{4}}}}{\text{]C}}{{{\text{l}}}_{2}} + {{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{{\text{10}}}}}{\text{[}}{{{\text{H}}}_{{\text{2}}}}{{{\text{W}}}_{{{\text{12}}}}}{{{\text{O}}}_{{42}}}] \to 6{\text{Pt}} + \\ + \,\,6{\text{W}}\, + \,6{\text{W}}{{{\text{O}}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{2}}\, + \,7{{{\text{N}}}_{2}} \uparrow \, + \,20{\text{N}}{{{\text{H}}}_{{\text{3}}}} \uparrow \, + \,27{{{\text{H}}}_{{\text{2}}}}{\text{O}}\, + \,3/2{{{\text{O}}}_{2}}. \\ \end{gathered} $ЗАКЛЮЧЕНИЕ
Продукт взаимодействия в системе [Pt(NH3)4]Cl2–(NH4)10[H2W12O42] (Pt : W = 1 : 2) в атмосфере аргона при 550°С представлен тремя фазами: твердыми растворами на основе платины Pt1 – xWx с параметром ячейки a = 3.9261(6) и 3.9262(3) Å (для Pt a = 3.935(4) Å), а также гексагональным h-WO3 и моноклинным m-WO3. Образование твердого раствора Pt1 –xWx указывает на возможность восстановления ионов [H2W12O42]10– аммиаком до металлического состояния в присутствии Pt2+ в инертной атмосфере, что согласуется с ранее полученными нами данными [11, 13].
Эти результаты могут быть положены в основу способов приготовления катализаторов на основе платины и вольфрама для различных химических процессов.
Список литературы
Ellert O.G., Tsodikov M.V., Nikolaev S.A., Novotortsev V.M. // Russ. Chem. Rev. 2014. V. 83. № 8. P. 718. [Эллерт О.Г., Цодиков М.В., Николаев С.А., Новоторцев В.М. // Успехи химии. 2014. Т. 83. № 8. С. 718.] https://doi.org/10.1070/RC2014v083n08ABEH004432?locatt
Zhang X., Wang X., Zhao X. et al. // Chem. Eng. J. 2015. V. 260. № 15. P. 419. https://doi.org/10.1016/j.cej.2014.09.030
Wu X., Zhou Zh., Weng D. et al. // J. Environ. Sci. 2012. V. 24. № 3. P. 458.
Shkurenok V.A., Smolikov M.D., Yablokova S.S. et al. // Proc. Eng. 2015. V. 113. P. 62. https://doi.org/10.1016/j.proeng.2015.07.291
Pechenyuk S.I., Domonov D.P. // J. Struct. Chem. 2011. V. 52. № 2. P. 412. [Печенюк С.И., Домонов Д.П. // Журн. структур. химии. 2011. Т. 52. № 2. С. 419.]https://doi.org/10.1134/S0022476611020259
Borisov R.V., Belousov O.V., Zhizhaev A.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 3. P. 308. [Борисов Р.В., Белоусов О.В., Жижаев А.М. и др. // Журн. неорган. химии. 2018. Т. 63. № 3. С. 308.]https://doi.org/10.1134/S0036023618030038
Soloveva A.Yu., Eremenko N.K., Obraztsova I.I. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 444. [Соловьева А.Ю., Еременко Н.А., Образцова И.И. и др. // Журн. неорган. химии. 2018. Т. 63. № 4. С. 416.].https://doi.org/10.1134/S0036023618040204
Korolkov I.V., Zadesenets A.V., Gromilov S.A. et al. // J. Struct. Chem. 2006. V. 47. № 3. P. 489. [Корольков И.В., Задесенец А.В., Громилов С.А. и др. // Журн. структур. химии. 2006. Т. 47. № 3. С. 503.]https://doi.org/10.1007/s10947-006-0327-3
Zadesenets A.V., Khranenko S.P., Shubin Yu.V. et al. // Russ. J. Coord Chem. 2006. V. 32. № 5. P. 374. [Задесенец А.В., Храненко С.П., Шубин Ю.В. и др. // Коорд. химия. 2006. Т. 32. № 5. С. 389.]
Khranenko S.P., Sukhih A.S., Komarov B.Yu. et al. // J. Struct. Chem. 2020. V. 61. № 3. P. 472. [Храненко С.П., Сухих А.С., Комаров В.Ю. и др. // Журн. cтруктур. химии. 2020. Т. 61. № 3. С. 472. https://doi.org/10.26902/JSC_id52880]
Fesik E.V., Buslaeva T.M., Mel’nikova T.I. et al. // Neorg. Mater. 2017. V. 53. № 10. P. 1033. [Фесик Е.В., Буслаева Т.М., Мельникова Т.И. и др. // Неорган. материалы. 2017. Т. 53. № 10. С. 78.]https://doi.org/10.1134/S0020168517100065
Fesik E.V., Buslaeva T.M., Mel’nikova T.I. et al. // Neorg. Mater. 2018. V. 54. № 12. P. 1299. [Фесик Е.В., Буслаева Т.М., Мельникова Т.И. и др. // Неорган. материалы. 2018. Т. 54. № 12. С. 1363.]https://doi.org/10.1134/S0020168518120038
Fesik E.V., Buslaeva T.M., Mel’nikova T.I. et al. // J. Phys. Chem. 2019. V. 93. № 6. P. 1011. [Фесик Е.В., Буслаева Т.М., Мельникова Т.И. и др. // Журн. физ. химии. 2019. Т. 93. № 6. С. 803.]https://doi.org/10.1134/S0036024419060098
Синтез комплексных соединений металлов платиновой группы. Справочник / Отв. ред. акад. Черняев. И.И. М.: Наука, 1964. 339 с.
Boultif A., Louer D. // J. Appl. Crystallogr. 2004. V. 37. P. 724.
NIST X-ray Photoelectron Spectroscopy Database. https://srdata.nist.gov/xps/EngElmSrchQuery.aspx?EType=PE&CSOpt=Retri_ex_dat&Elm=W
Lucia R. Raddi de Araujo, Martin Schmal // Appl. Catal., A: Gen. 2000. V. 203. № 2. P. 275.
Fouad N.E., Nohman A.K.H., Zaki M.I. // Thermochim. Acta. 2000. V. 343. P. 139.
Kalpakli A.O., Arabaci A., Kahruman C.I. et al. // Int. J. Ref. Met. Hard Mater. 2013. V. 37. P. 106.
Singh V., Sharma I.B. // Mater. Today: Proc. 2018. V. 5. P. 15 277.
Fait M.J.G., Moukhina E., Feist M. et al. // Thermochim. Acta. 2016. V. 637. № 10. P. 38. https://doi.org/10.1016/j.tca.2016.05.009
Гринвуд Н., Эрншо А. Химия элементов. М.: БИНОМ Лаборатория знаний, 2008. Т. 2. 667 с.
Неорганическая химия / Под ред. Третьякова Ю.Д. Т. 3. Кн. 1. М.: Издательский центр “Академия”, 2007. 352 с.
Morcom W.R., Worrell W.L., Sell H.G. et al. // Metallurg. Transact. 1974. V. 5. P. 155.
Уэллс А. Структурная неорганическая химия. М.: Мир, 1988. Т. 3. 564 с.
Бокий Г.Б. Кристаллохимия. М.: Наука, 1971. 400 с.
Luo H.L. // J. Less-Common. Met. 1968. V. 15. P. 299.
Knapton A.G. // Platinum Metals Rev. 1980. V. 24. P. 64.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


