Журнал неорганической химии, 2019, T. 64, № 10, стр. 1089-1094
Стеклообразование в системе AlCl3–(CH3)2SO–H2O
И. А. Кириленко 1, *, Л. И. Демина 2, В. П. Данилов 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Ленинский пр-т, 31, корп. 5, Россия
* E-mail: iakirilenko@mail.ru
Поступила в редакцию 12.03.2019
После доработки 29.03.2019
Принята к публикации 15.04.2019
Аннотация
Впервые в системе AlCl3–(CH3)2SO–H2O обнаружено явление стеклообразования, определены границы области стеклообразования и получено стекло состава AlCl3 ⋅ 2.9(CH3)2SO ⋅ 4.8H2O. Исследованы ИК-спектры стеклообразующих растворов в границах области стеклообразования и стекло состава AlCl3 ⋅ 2.9(CH3)2SO ⋅ 4.8H2O. Сделан вывод о вхождении (CH3)2SO в первую координационную сферу иона алюминия через атом кислорода. Проведено калориметрическое исследование стекла состава AlCl3 ⋅ 2.9(CH3)2SO ⋅ 4.8H2O и определена его температура стеклования Tg = –32.3°С.
ВВЕДЕНИЕ
Явление стеклообразования широко распространено в водно-электролитных и водно-неэлектролитных системах, и установление границ области стеклообразования в этих системах позволяет выделить область концентраций, растворы которой отличаются особым строением и силой водородных связей [1]. Актуальность работы заключается в значимости решения двух важных проблем: поиска новых составов для криопротекторов (одним из важнейших является диметилсульфоксид (CH3)2SO) [2–6] и разработки методов получения алюминия электролизом солей алюминия в органических растворителях [7].
Настоящее исследование является продолжением работы [2], посвященной изучению конкуренции между диметилсульфоксидом и водой – двумя универсальными растворителями – за вхождение в первую координационную сферу иона алюминия в неорганических солях алюминия с сохранением стеклообразного состояния. В работе [2] показано, что в системе Al2(SO4)3–(CH3)2SO–H2O для стекла состава Al2(SO4)3 ⋅ 3H2O ⋅ 8(CH3)2SO возможна полная замена молекул воды в первой координационной сфере иона алюминия на молекулы (CH3)2SO. Возникает вопрос: возможен ли аналогичный вариант при замене сульфата алюминия на хлорид алюминия. Интерес к хлориду алюминия обусловлен возможностью его использования при получении алюминия электролизом безводной соли в органическом растворителе, но наличие воды в первой координационной сфере алюминия в AlCl3 ⋅ 6H2O препятствует этому процессу, поэтому замена молекул воды в первой координационной сфере алюминия на органическое соединение может способствовать решению данной проблемы [7].
В связи с этим представляется целесообразным рассмотреть систему AlCl3–(CH3)2SO–H2O с позиций конкуренции между такими сильными донорами, как (CH3)2SO и H2O, за вхождение в первую координационную сферу иона алюминия при сохранении стеклообразного состояния. Различные методы исследований показывают, что в жидком (CH3)2SO имеются агрегаты цепочечного строения, обусловленные кислородными связями [8, 9]. При смешивании с водой выделяется большое количество теплоты и смесь становится вязкой. Считается, что это обусловлено разрушением цепочечной структуры на основе кислородных связей и образованием новой, тоже цепочечной структуры, включающей водородные и кислородные связи. Известно [10], что силы взаимодействия между молекулами (CH3)2SO и воды в 1.5 раза больше, чем между молекулами воды.
Известно, что в бинарных системах AlCl3–H2O и (CH3)2SO–H2O, входящих в состав тройной системы AlCl3–(CH3)2SO–H2O, обнаружено явление стеклообразования.
В системе (CH3)2SO–H2O [11] границы области стеклообразования простираются от 13.5 до 31.5 мол. % (CH3)2SO, что соответствует соотношению (CH3)2SO : H2O от 1.0 : 6.5 до 1.0 : 2.2. В границах области стеклообразования вблизи состава (CH3)2SO ⋅ 2H2O наблюдаются экстремумы на концентрационных зависимостях ряда физико-химических свойств растворов: теплоты смешения [12], вязкости [13], диэлектрической проницаемости [14]. В работе [15] отмечаются аномальные явления, связанные с особенностями рассеяния света водными растворами (CH3)2SO, входящими в границы области стеклообразования системы H2O–(CH3)2SO.
Стеклообразующие растворы системы (CH3)2SO–H2O при нагревании от температур жидкого азота до комнатной проходят через кристаллизацию, о чем свидетельствуют данные термического анализа [11]. Сам (CH3)2SO (безводный) не стеклуется. В границах области стеклообразования значение Tg (температура стеклования) изменяется незначительно (от –132 до –124°С).
Область стеклообразования в системе AlCl3–H2O невелика – от 3 до 6 мол. % AlCl3, что соответствует соотношению AlCl3 : H2O от 1 : 32 до 1 : 16. Тg в границах области стеклообразования изменяется в интервале температур от –135 до –105°С [16].
Поскольку в работе [2] обнаружено явление стеклообразования в системе Al2(SO4)3–(CH3)2SO–H2O и установлено вхождение диметилсульфоксида в первую координационную сферу иона алюминия, интересно сравнить ее с системой AlCl3–(CH3)2SO–H2O на предмет сходства и различия в способности к стеклообразованию, а также рассмотреть формирование первой координационной сферы иона алюминия лигандами (CH3)2SO и H2O при сохранении стеклообразующей способности образцов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза использовали AlCl3 ⋅ 6H2O “ч. д. а.” и (CH3)2SO марки Aldrich (99.9%). Стеклообразующие составы 1, 2, 3 готовили смешением заданных количеств хлорида алюминия и воды с дальнейшим замораживанием полученных растворов в жидком азоте по методике [16]. Синтез стеклообразующих образцов с меньшим содержанием воды проводили методом испарения насыщенных водных растворов в открытых контейнерах при температуре не выше 100°C (для (CH3)2SO Ткип = = 189°С) по методике, описанной в работе [17].
ИК-спектры образцов регистрировали в интервале 4000–550 см–1 методом нарушенного полного внутреннего отражения на ИК-Фурье-спектрометре NEXUS фирмы NICOLET с использованием приставки MIRacle фирмы PIKETechnologies с алмазным кристаллом.
Калориметрические исследования выполняли на дифференциальном сканирующем калориметре DSC823eMETLERToledo в атмосфере аргона при скорости изменения температуры 10 град/мин в диапазоне температур от –100 до 100°С.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Стеклообразование в системе AlCl3–(CH3)2SO–H2O обнаружено впервые. Все растворы, входящие в границы области стеклообразования, при комнатной температуре представляют собой бесцветные прозрачные растворы разной степени вязкости. При охлаждении в жидком азоте они застывают в прозрачные стекла. При изъятии из жидкого азота замороженные стеклообразующие растворы в ходе нагревания переходят из стеклообразного состояния в раствор через кристаллизацию.
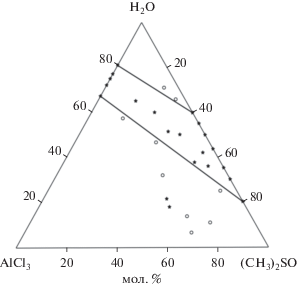
Область стеклообразования в этой тройной системе простирается непрерывно от области стеклообразования в бинарной системе AlCl–H2O на соответствующей стороне треугольника составов через тройную систему AlCl3–(CH3)2SO–H2O до области стеклообразования в бинарной системе (CH3)2SO–H2O на другой стороне треугольника (рис. 1). Впервые область стеклообразования, непрерывно пересекающая все поле треугольника составов, установлена в тройных водно-солевых системах [18]. Учитывая выводы работы [18], такая непрерывность области стеклообразования в данной системе, по-видимому, может быть обусловлена взаимозаменой молекул воды и (CH3)2SO в полимерных структурах стеклообразующих составов, образованных посредством водородных связей.
Рис. 1.
Границы области стеклообразования в системе AlCl3–(CH3)2SO–H2O. * – стеклообразующий образец, o – кристалл.
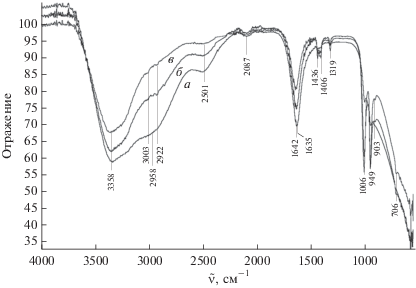
Были исследованы ИК-спектры трех стеклообразующих растворов, входящих в границы области стеклообразования: 1 – 20 мас. % AlCl3, 15 мас. % (CH3)2SO, 65 мас. % H2O; 2 – 15 мас. % AlCl3, 25 мас. % (CH3)2SO, 60 мас. % H2O; 3 – 10 мас. % AlCl3, 40 мас. % (CH3)2SO, 50 мас. % H2O.
Анализ ИК-спектров этих растворов (рис. 2) позволяет выделить в составе образцов по крайней мере два разных функциональных типа молекул воды. Широкая полоса ν1(OH) с максимумом при 3356 см–1 относится к валентным колебаниям ОН-групп молекул воды, не входящих в первую координационную сферу иона Al3+. Полоса ν2(OH) в области более низких частот с максимумом при 2958 см–1 характеризует валентные колебания ОН молекул воды, непосредственно связанных с ионом Al3+ (аналогичная полоса в спектре AlCl3 ⋅ 6H2O ν(OH) = 2993 см–1). Уширенные полосы средней интенсивности при 2501 и 2087 см–1 описывают сложную систему водородных связей, осуществляющих взаимодействие между молекулами воды гидратной оболочки иона алюминия и молекулами (CH3)2SO. Полоса деформационных колебаний молекул воды δ(H2O) в спектрах образцов 1–3 несколько уширена и имеет два подмаксимума: 1635 см–1 для координированных молекул, как в спектре AlCl3 ⋅ 6H2O, и 1642 см–1 для гидратных молекул воды, не входящих в первую координационную сферу иона алюминия.
Интенсивность полос, характеризующих колебания молекул воды, уменьшается от раствора 1 к 3. Одновременно увеличивается интенсивность полос, описывающих колебания молекул (CH3)2SO. Следует отметить, что полоса ν(S=O) в спектрах образцов 1–3 (1006 см–1) смещается в низкочастотную область относительно ν(S=O) свободного (CH3)2SO (1042 см–1). Величина смещения ∆ν(S=O) 36 см–1 в спектрах образцов 1–3 соответствует значению ∆ν(S=O) в спектре раствора (CH3)2SO в воде. Это является подтверждением того, что молекулы (CH3)2SO образуют водородные связи с молекулами воды гидратной оболочки иона алюминия. Молекулы (CH3)2SO в спектрах 1–3 характеризуются также полосами ν(СH3) при 3003 и 2923 см–1 (на фоне ν2(OH)), δ(CH3) при 1436 и 1406 см–1, δ(HCS) при 1319 см–1 и ν(СS) при 706 см–1.
Поскольку полоса ν(S=O) при 1042 см–1 [19], описывающая колебания свободного (CH3)2SO, в спектрах стеклообразующих растворов отсутствует, можно предположить, что молекулы (CH3)2SO участвуют в строении этих растворов. Исходя из составов этих растворов, в которых на одну молекулу хлорида алюминия приходится от 24 до 30 молекул воды, можно заключить, что молекулы (CH3)2SO не входят в первую сферу алюминия.
Для выяснения возможности вхождения (CH3)2SO в первую координационную сферу иона алюминия была предпринята попытка получить стеклообразные образцы с меньшим содержанием воды в области, прилегающей к бинарной системе AlCl3–(CH3)2SO. Как и в работе [2], получить качественные стеклообразующие образцы в широкой области концентраций не удалось.
Получены стеклообразующие образцы общей формулы AlCl3 ⋅ n(CH3)2SO ⋅ mH2O, где n = 2.6–4.1, m = 3.7–5, которые в течение 3–5 сут теряют прозрачность. Однако среди них стекло состава AlCl3 ⋅ 2.9(CH3)2SO ⋅ 4.8H2O оказалось очень стабильным. Это стекло представляет собой прозрачный, слегка мягкий образец, при надавливании металлической палочкой на поверхность которого появляется небольшая вмятина, быстро исчезающая.
Невозможность получения качественного стеклообразного образца с бóльшим содержанием (CH3)2SO в первой координационной сфере алюминия, чем у состава AlCl3 ⋅ 2.9(CH3)2SO ⋅ 4.8H2O, хорошо согласуется с выводами работ [20–22], посвященных исследованию конкуренции между молекулами (CH3)2SO и H2O за вхождение в первую сферу. В работе [20] методом ЯМР исследована система AlCl3–(CH3)2SO–H2O и установлено, что ионы алюминия в первой координационной сфере предпочтительно сольватируются молекулами воды, сделано заключение, что полная замена молекул воды на молекулы (CH3)2SO невозможна из-за геометрии иона хлора.
Анализ ИК-спектров, представленных на рис. 3, показал, что молекулы (CH3)2SO, входящие в состав стекла, связаны с ионом Al3+ через атом кислорода. Об этом свидетельствует смещение в спектре стекла полосы ν(S=O) в низкочастотную область до 995 см–1. Согласно [19], частота валентных колебаний ν(S=O) в комплексах, в которых (CH3)2SO входит в первую сферу атома металла через атом кислорода, соответствует интервалу частот валентных колебаний ν(S=O) 915–1008 см–1. Зафиксировано смещение в высокочастотную область и некоторых других полос в спектре стекла состава AlCl3 ⋅ 2.9(CH3)2SO ⋅ 4.8H2O по сравнению со спектром свободного (CH3)2SO: ν(CS) c 697 до 723 см–1; δ(HCS) c 1310 до 1324 см–1. Молекулы воды, не участвующие в образовании связи с Al3+, характеризуются полосой ν(OH) при 3320 см–1. Эти молекулы, по-видимому, участвуют в образовании водородных связей с молекулами воды первой координационной сферы иона алюминия и между собой. Согласно [23], эти водородные связи являются довольно сильными, характеризующимися в спектре уширенными полосами при 2465 и 2120 см–1.
Рис. 3.
ИК-спектры: а – AlCl3 ⋅ 6H2O , б – (CH3)2SO, в – AlCl3 ⋅ 2.9(CH3)2SO ⋅ 4.8H2O, г – AlCl3 ⋅ 2.8(CH3)2SO ⋅ 5.9H2O.
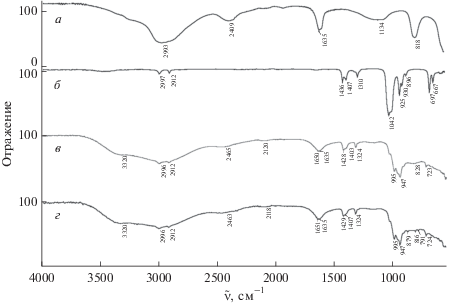
Наличие в стекле состава AlCl3 ⋅ 2.9(CH3)2SO ⋅ ⋅ 4.8H2O как координированных с ионом Al3+, так и некоординированных молекул воды приводит к уширению полосы δ(HОН) с расщеплением ее на подмаксимумы: 1635 см–1 (координированные молекулы) и 1650 см–1 (некоординированные молекулы).
На основании анализа ИК-спектра стекла состава AlCl3 ⋅ 2.9(CH3)2SO · 4.8H2O и выводов работ [19–24] можно заключить, что в стекле этого состава в первую координационную сферу иона алюминия входят и молекулы (CH3)2SO (координируются через атом кислорода), и молекулы воды.
Было проведено наблюдение за состоянием стекла AlCl3 ⋅ 2.9(CH3)2SO ⋅ 4.8H2O во времени. Основанием для этого послужило наблюдаемое в работе [2] свойство стекла состава Al2(SO4)3 ⋅ 3H2O ⋅ ⋅ 8(CH3)2SO поглощать воду из воздуха. В течение двух месяцев прозрачный, мягкий, но не теряющий форму образец стекла AlCl3 · 2.9(CH3)2SO · ⋅ 4.8H2O превратился в очень вязкую, прозрачную, с едва заметной подвижностью субстанцию, отвечающую составу AlCl3 · 2.8(CH3)2SO · 5.9H2O, что породило вопрос, как адсорбированная из воздуха вода проявится в ИК-спектре.
Для ответа на этот вопрос был получен ИК-спектр стеклообразующего состава AlCl3 ⋅ ⋅ 2.8(CH3)2SO ⋅ 5.9H2O (рис. 3г) и проведено его сравнение с ИК-спектром стекла состава AlCl3 ⋅ ⋅ 2.9(CH3)2SO ⋅ 4.8H2O (рис. 3в). Очевидно, что ИК-спектры обоих образцов практически идентичны. Различие наблюдается только в низкочастотной области спектра и выражается в четко разрешаемых крутильных колебаниях воды, что, по-видимому, связано с ослаблением межмолекулярных связей [25, 26], обусловленным уменьшением вязкости по причине адсорбции воды из воздуха исследуемым образцом. В ИК-спектре это выражается появлением узких полос внеплоскостных деформационных колебаний воды при 879, 816, 791 см–1 в спектре стекла состава AlCl3 ⋅ ⋅ 2.8 (CH3)2SO ⋅ 5.9H2O, тогда как в спектре образца состава AlCl3 ⋅ 2.9(CH3)2SO ⋅ 4.8H2O имеется одна уширенная полоса при 828 см–1.
Таким образом, изменений в первой координационной сфере иона алюминия при сравнении спектров стеклообразующих составов AlCl3 ⋅ ⋅ 2.9(CH3)2SO ⋅ 4.8H2O и AlCl3 ⋅ 2.8(CH3)2SO ⋅ ⋅ 5.9H2O не наблюдается, следовательно, увеличение количества воды в образце на одну молекулу, не приводит к существенным изменениям в составе координационной сферы атома алюминия.
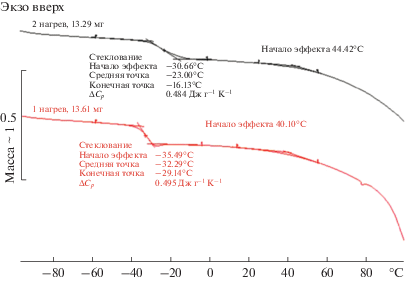
Было проведено калориметрическое исследование стекла состава AlCl3 ⋅ 2.9(CH3)2SO ⋅ 4.8H2O. На рис. 4 представлена кривая нагревания в диапазоне температур от –100 до 100°С. На термограммах образца наблюдаются два термических эффекта. Первый – “ступенька теплоемкости”, второй – эндотермический эффект после 40°С, связанный с испарением воды. После первого нагрева образец потерял 2.35% массы, при этом температура стеклования для второго нагрева увеличилась на 10оС (Tg1 = –32,3оС, а Tg2 = –23°С). Второй нагрев привел к потере массы на 1.43%. Таким образом, исходя из поставленной задачи по определению Tg нативного образца, можно сделать заключение, что интервал стеклования ‒35.5…–29.0°С, а Tg = –32.3°С. Отсутствие на кривой нагревания эффекта кристаллизации свидетельствует о стабильности стекла состава AlCl3 ⋅ ⋅ 2.9(CH3)2SO ⋅ 4.8H2O к кристаллизации [1].
Большая разница в температурах стеклования (Tg) образца состава AlCl3 ⋅ 2.9(CH3)2SO ⋅ 4.8H2O (Tg = –32.3) и стеклообразующих растворов бинарных систем AlCl3–H2O и (CH3)2SO–H2O (Tg = = –105…–135°С) свидетельствует, очевидно, о сильном влиянии иона алюминия на силу водородных связей, отвечающих за явление стеклообразования в системе AlCl3–(CH3)2SO–H2O.
Интересно отметить, что величина изменения теплоемкости стекла состава AlCl3 ⋅ 2.9(CH3)2SO ⋅ ⋅ 4.8H2O при Tg = –32°С (0.490 Дж–1 K) много выше аналогичных значений для ряда аморфных полимеров. По данным MettlerToledo, где приведены типичные величины изменения теплоемкости аморфных полимеров C2H3Cl, C27H22O4S и C16O8H14 (0.27–0.34 Дж–1К), их температура стеклования составляет от 80 до 225°С. Таким образом, можно предположить, что сила водородных связей, отвечающих за строение стекла состава AlCl3 ⋅ 2.9(CH3)2SO ⋅ 4.8H2O значительно выше связей, отвечающих за строение приведенных для сравнения аморфных полимеров.
Список литературы
Кириленко И.А. Водно-электролитные стеклообразующие системы. М.: Красанд, 2016. 256 с.
Кириленко И.А., Демина Л.И. // Журн. неорган. химии. 2018. Т. 63. № 10. С. 1. https://doi.org/10.1134/S0044457X18100100
Buera M.P., Roos Y., Levine H. et al. // Pure Appl. Chem. 2011. V. 83. № 8. P. 1567. https://doi.org/10.1351/PAC-REP-10-07-02
Clegg J.S. // Comp. Biochem. Physiol. B. 2001. V. 128. P. 613.
Shalaev E., Franks F. In Amorphous Food fnd Pharmaceutical Systems / Ed. Levine H. Cambridge, UK: RSC Publishing, 2002. P. 200.
Солонина И.А., Родникова М.Н., Киселев М.Р. и др. // Журн. физ. химии. 2018. Т. 92. № 5. С. 751.
Каблов В.Ф., Быкадоров Н.У., Жохова О.К. и др. // Вестн. Казанского технологического ун-та. 2013. Т. 16. № 1. С. 61.
Кукушкин Ю.Н. // Соросовский образовательный журнал. 1997. № 9. С. 54.
Белоусов В.П., Панов М.Ю. Термодинамика водных растворов неэлектролитов. Л.: Химия, 1983. 265 с.
Костяев А.А., Мартусевич А.К., Андреев А.А. и др. // Научное обозрение. Медицинские науки. 2016. № 6. С. 54.
Rasmuussen D.H., Mackenzie A.P. // Nature. 1968. V. 220. № 5174. P. 1315.
Белоусов В.П., Морачевский А.Г. Теплоты смешения жидкостей. Л.: Химия, 1970. 253 с.
Рашковский Г.В., Овчинникова З.Ф., Пенкина Н.В. // Журн. прикл. химии. 1982. Т. 55. С. 1858.
Koatze U., Brai M., Sholle H. et al. // J. Mol. Liq. 1990. V. 44. P. 197.
Родникова М.Н., Захарова Ю.А., Солонина И.А. и др. // Журн. физ. химии. 2012. Т. 86. № 5. С. 993.
Angell C.A., Sare E.J. // J. Chem. Phys. 1970. V. 52. № 3. P. 1058.
Kirilenko I.A. // Russ. J. Inorg. Chem. 2017. V. 62. № 14. P. 1819. https://doi.org/10.1134/S00360236171140042
Kirilenko I.A. // Russ. J. Inorg. Chem. 2018. V. 63. № 13. P. 1728. https://doi.org/10.1134/S0036023618130053
Накамото К. Инфракрасные спектры неорганических и координационных соединений. М.: Мир, 1991. 536 с.
Рындаревич С.Б. Комплексообразование Al(III) в неводных растворах. Дис. … канд. хим. наук. М., 1984.
Frftello A.F., Lee R.E., Nishida V.M. et al. // J. Chem. Phys. 1968. V. 48. № 8. P. 3705.
Thovas S., Reynolds W.N. // Inorg. Chem. 1970. V. 9. № 1. P. 78.
Юхневич Г.В., Коханов Е.Г. // Журн. прикл. спектроскопии. 1983. Т. 39. № 4. P. 617.
Cotton F.A., Francis R., Horrocks W.D. // J. Phys. Chem. 1960. V. 64. № 10. P. 1534.
Клементовская З.С., Носкова Т.А., Лященко А.К. // Журн. физ. химия растворов. 2008. Т. 82. № 4. С. 668.
Klemenkova Z.S., Kononova E.G. // J. Solution Chem. 2015. V. 44. P. 280. https://doi.org/10.1007/s10953-015-0300-x
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии