Журнал неорганической химии, 2019, T. 64, № 10, стр. 1095-1103
Константы устойчивости и константы скорости внутримолекулярного редокс-распада комплексов церия(IV) с некоторыми оксикарбоновыми кислотами в нитратной среде
О. О. Воскресенская 1, *, Н. А. Скорик 2, Н. И. Соковикова 2
1 Объединенный институт ядерных исследований
141980 Московская обл., Дубна, ул. Жолио-Кюри, 6, Россия
2 Томский государственный университет
634050 Томск, пр-т Ленина, 36, Россия
* E-mail: voskr@jinr.ru
Поступила в редакцию 15.02.2019
После доработки 29.03.2019
Принята к публикации 15.04.2019
Аннотация
Спектрофото-, фото-, рН-метрически и кинетически в нитратной среде в интервале pH 0−3 при ионной силе $I = 2$ и температуре $295.15$ K определены состав, константы устойчивости и константы скорости внутримолекулярного окислительно-восстановительного распада комплексов церия(IV) с анионами хинной ${{\left( {{\text{CHOH}}} \right)}_{3}}{{\left( {{\text{C}}{{{\text{H}}}_{2}}} \right)}_{2}}{\text{C}}\left( {{\text{OH}}} \right)$COOH, молочной ${\text{C}}{{{\text{H}}}_{3}}{\text{CH}}\left( {{\text{OH}}} \right){\text{COOH,}}$ винной ${\text{HOOCCH}}\left( {{\text{OH}}} \right){\text{CH}}\left( {{\text{OH}}} \right){\text{COOH}}$ и лимонной ${\text{HOOCC}}{{{\text{H}}}_{2}}{\text{C}}\left( {{\text{OH}}} \right)\left( {{\text{COOH}}} \right){\text{C}}{{{\text{H}}}_{2}}{\text{COOH}}$ оксикарбоновых кислот. Установлена прямая линейная корреляция между значениями логарифмов констант устойчивости и отрицательных логарифмов констант скорости внутримолекулярного редокс-распада изученных комплексов, отсутствующая в сульфатной среде. Указанную корреляцию можно рассматривать как проявление принципа линейных соотношений свободных энергий в координационной химии.
ВВЕДЕНИЕ
Изучение комплексообразования и окислительно-восстановительного распада комплексов, образующихся на первой стадии окисления органических соединений церием(IV), представляет теоретический и практический интерес в связи с применением церия(IV) в различных областях химии и технологии как одноэлектронного окислителя [1–7], комплексообразователя [8–11] и катализатора многочисленных реакций [5, 7, 11, 13]. Оно имеет весьма существенное значение в связи с проблемой стабилизации неустойчивых состояний окисления (с.о.) металлов [1, 6, 8, 11], применением исследуемых в работе систем как источника радикалов в процессах радикальной полимеризации виниловых мономеров, при разделении смеси редкоземельных элементов (РЗЭ), в органическом синтезе, аналитической практике [1, 5, 6, 11, 13], фармакологии и нанотехнологии [1, 6, 14–20].
Так, при разделении смеси РЗЭ используется способность церия образовывать соединения, в которых он присутствует в с.о. +4, что приводит к резкому различию в свойствах соединений церия(IV) и редкоземельных элементов в с.о. +3 и повышает эффективность отделения церия(IV) от РЗЭ [26]. Однако вопрос о стабилизации церия в с.о. +4, особенно при комплексообразовании с оксикарбоновыми кислотами, изучен недостаточно.
Ранее [27] исследовано влияние на скорость окислительно-восстановительного взаимодействия в системах, содержащих церий(IV) и органические лиганды (комплексоны, оксикарбоновые кислоты и др.), величин констант нестойкости комплексов, восстановительной способности лигандов и других факторов. Отметим, что при отсутствии бимолекулярного пути окислительно-восстановительного взаимодействия в системе и доминировании в ней одного комплекса скорость редокс-взаимодействия в системах может быть равна скорости редокс-распада данного комплекса. В случае систем, содержащих комплексоны, было установлено наличие прямой зависимости значений логарифма скорости (так называемой “условной скорости”) окислительно-восстановительного взаимодействия в системах от величин констант нестойкости комплексонатов церия(IV). Для комплексонатов ионов металлов c преимущественно ковалентным типом связи (например, комплексонатов марганца(III), ванадия(V) и др.) указанная зависимость была обратной [27, 28]. В случае же систем с оксикарбоновыми кислотами какой-либо определенной зависимости между указанными величинами установить не удалось [27–29].
Поскольку в качестве кинетического критерия стабилизации с.о. церия +4 в [27] использовали главным образом “условную скорость” редокс-распада его комплексов, в дальнейшем аналогичные исследования были проведены на основе констант скоростей их внутримолекулярного редокс-распада, различные дифференциальные и интегральные методики определения которых разработаны в [2, 6, 11, 30, 31]. Было введено понятие кинетической устойчивости комплексов переходных металлов в отношении их внутримолекулярного окислительно-восстановительного распада, характеризуемой обратной величиной константы скорости их внутрикомплексного редокс-распада ${{k}_{{n = 1}}}{\text{\;}}({{{\text{c}}}^{{ - 1}}})$ или же величиной $ - \lg {{k}_{{n = 1}}}$ [6, 11]. Результаты работ [31–33] подтвердили предварительные выводы [27–29]. Так, в [31] были установлены прямые линейные корреляции11 между найденными значениями логарифмов констант устойчивости $\lg {{\beta }_{{101}}}$ изученных комплексонатов церия(IV) и отрицательными значениями логарифмов констант скоростей их внутримолекулярного редокс-распада в нитратной и перхлоратной средах. Для комплексов церия(IV) с рядом гетероциклических соединений, имеющих большую степень ковалентности связи [34], между указанными величинами была найдена обратная корреляция [33].
Работы, посвященные определению констант устойчивости комплексов церия(IV) с рядом алифатических органических соединений, включая оксикарбоновые кислоты (${{{\text{H}}}_{k}}{\text{L}}$), и изучению их кинетической устойчивости относительно внутрикомплексного редокс-распада [6, 11, 33], привели к обнаружению в сульфатной среде прямой линейной корреляции между $ - \lg {{k}_{{n = 1}}}$ и $\lg {{\beta }_{{101}}},$ аналогичной установленной для комплексонатов церия(IV) [31], однако лишь для бидентатных лигандов. Увеличение устойчивости комплекса при дальнейшем увеличении дентатности лиганда в исследованном ряду органических соединений уже не приводило к дополнительной стабилизации с.о. +4 церия(IV) в образующихся комплексах [6, 33]. Было высказано предположение [11], что ограниченный группой бидентатных органических лигандов характер корреляции специфичен для сульфатной среды, и в других средах она может наблюдаться для более широкой группы лигандов. В настоящей работе мы исследуем данный вопрос.
ОБЪЕКТЫ И МЕТОДЫ
В данной работе спектрофото-, фото-, рН-метрически и кинетически в интервале pH ~ ~ 0−3 нитратной среды при ионной силе $I = 2$ и температуре $295.15$ K определены константы устойчивости и константы скорости внутримолекулярного редокс-распада комплексов церия(IV) с анионами хинной ${{\left( {{\text{CHOH}}} \right)}_{3}}{{\left( {{\text{C}}{{{\text{H}}}_{2}}} \right)}_{2}}{\text{C}}\left( {{\text{OH}}} \right)$COOH (${{{\text{H}}}_{2}}{\text{Quin}}$), молочной CH3CH(OH)COOH (${{{\text{H}}}_{2}}{\text{Lact}}$), винной ${\text{HOOCCH}}\left( {{\text{OH}}} \right){\text{CH}}\left( {{\text{OH}}} \right){\text{COOH}}$ (${{{\text{H}}}_{4}}{\text{Tart\;}}$) и лимонной HOOCCH2C(OH)(COOH)CH2COOH (${{{\text{H}}}_{4}}{\text{Сitr}}$) оксикарбоновых кислот, проанализирована связь кинетической устойчивости изученных комплексов с величинами логарифмов констант их устойчивости, проведено сопоставление полученных результатов с соответствующими результатами для сульфатной среды.
В работе использовали винную и молочную кислоты квалификации “х. ч.”, а также дважды перекристаллизованные хинную и лимонную кислоты. Гексанитроцереат аммония (NH4)2Ce(NO3)6 получали по методике [35], соль анализировали на содержание CeO2 термическим методом, на содержание азота – методом Кьельдаля. Определенную величину ионной силы $\left( {I = 2} \right)$ растворов создавали нитратом аммония (“ч. д. а.”). Содержание церия(IV) в свежеприготовленном растворе определяли обратным титрованием солью Мора в присутствии ферроина [36] перед началом эксперимента и по его окончании. Нормальность соли Мора устанавливали перманганатометрически. Концентрацию растворов кислот уточняли pH-метрическим титрованием раствором NaΟΗ, не содержащим иона ${\text{CO}}_{3}^{{2 - }}.$
Регистрацию оптической плотности во времени осуществляли с помощью спектрофотометра SPECORD UV VIS, оснащенного термостатируемым кюветным держателем для прямоугольных кварцевых кювет с длиной оптического пути l = = 1 см, и фотоэлектроколориметра типа KF-5 с регистрирующим устройством МЭА-4 и термостатируемой ячейкой для стандартных кювет с l = 1 см. Временем начала реакции ${\tau } = 0$ считали момент переворачивания сосуда-смесителя, в который помещали исходные компоненты реакционной смеси. Кинетические измерения проводили на длине волны 400 нм, где наблюдалось наибольшее увеличение разности ${\Delta }{{D}^{0}} = {{D}^{0}} - {{D}_{{\text{M}}}}$ с ростом pH (${{D}^{0}}$ – оптическая плотность реакционной смеси в момент ${\tau } = 0,$ ${{D}_{{\text{M}}}}$ – оптическая плотность иона металла). Измерение pH реакционной смеси проводили с помощью прецизионного pH-метра DATA METER.
Регистрацию кинетических кривых начинали через 10 с после смешения реагентов. С этого момента кинетические кривые в полулогарифмических координатах имели линейный характер, подчиняясь уравнению прямой lg D = lg D0 –$ - \,\,{{k}_{{{{n}_{{\tau }}} = 1}}}{\tau ,}$ где ${{k}_{{{{n}_{{\tau }}} = 1}}}{\text{\;}}({{{\text{c}}}^{{ - 1}}})$ – псевдоконстанта скорости первого временнóго порядка. Данная методика измерений обеспечивала хорошую воспроизводимость параллельных опытов. Начальную величину оптической плотности находили путем линейной экстраполяции кинетических кривых в координатах $\lg D$–${\tau }$ к начальному времени ${\tau } = 0.$ Начальную скорость наблюдаемого редокс-процесса $ - {{\dot {D}}^{0}} \equiv {{\partial D} \mathord{\left/ {\vphantom {{\partial D} {\partial {\tau }}}} \right. \kern-0em} {\partial {\tau }}}{\text{,}}$ ${{{\text{c}}}^{{ - 1}}}$ оценивали графически в тех же координатах по тангенсу угла наклона ${{\left( {{{D}^{0}} - {{D}^{i}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{D}^{0}} - {{D}^{i}}} \right)} {\left( {{{{\tau }}^{0}} - {{{\tau }}^{i}}} \right)}}} \right. \kern-0em} {\left( {{{{\tau }}^{0}} - {{{\tau }}^{i}}} \right)}} = {\text{const}}$ прямой, а также рассчитывали посредством линейного МНК. Начальную равновесную концентрацию $1~:n$ комплекса определяли по формулам $c_{n}^{0} = {{\left( {{{D}^{0}} - {{D}_{{\text{M}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{D}^{0}} - {{D}_{{\text{M}}}}} \right)} {(D_{\infty }^{0} - {{D}_{{\text{M}}}})}}} \right. \kern-0em} {(D_{\infty }^{0} - {{D}_{{\text{M}}}})}} = \alpha _{n}^{0}{{c}_{{\text{M}}}}$ и $\bar {c}_{1}^{0} = $ $ = {{ - ({{{\dot {D}}}^{0}} - {{{\dot {D}}}_{{\text{M}}}}){\kern 1pt} } \mathord{\left/ {\vphantom {{ - ({{{\dot {D}}}^{0}} - {{{\dot {D}}}_{{\text{M}}}}){\kern 1pt} } {(\dot {D}_{\infty }^{0} - {{{\dot {D}}}_{{\text{M}}}}){{c}_{{\text{M}}}}}}} \right. \kern-0em} {(\dot {D}_{\infty }^{0} - {{{\dot {D}}}_{{\text{M}}}}){{c}_{{\text{M}}}}}} = \bar {\alpha }_{1}^{0}{{c}_{{\text{M}}}}$ (${{c}_{{\text{M}}}} \leqslant {{c}_{{\text{L}}}}$) с использованием методов инструментального анализа и их кинетических аналогов соответственно. Здесь ${{\dot {D}}_{{\text{M}}}}$ – скорость изменения оптической плотности раствора иона металла, ${{c}_{{\text{M}}}}$ и ${{c}_{{\text{L}}}}$ – концентрации исследуемых растворов церия(IV) и органического лиганда, $\alpha _{n}^{0}$ ($\bar {\alpha }_{1}^{0}$) – выход комплекса в момент времени ${\tau } = 0.$ Черта над символом здесь и далее означает величину, определенную кинетическим методом. Максимальные значения оптической плотности реакционной смеси $D_{\infty }^{0}$ и скорости ее изменения $\dot {D}_{\infty }^{0}~\left( {{{{\text{c}}}^{{ - 1}}}} \right)$ находили из графиков зависимостей ${{D}^{0}},$ ${{\dot {D}}^{0}}$ от ${{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}}$ (рис. 1) или ${{D}^{0}},$ ${{\dot {D}}^{0}}$ от pH (рис. 2). Соотношение ${\text{металл}}:{\text{лиганд}} = m:n$ в комплексе, образующемся в начальный момент времени $\left( {{\tau } = 0} \right),$ устанавливали спектрофотометрически методами молярных отношений ${{D}^{0}}{\kern 1pt} - {\kern 1pt} {{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}},$ изомолярных серий (метод ${{D}^{0}}$–${{N}_{{\text{L}}}},$ где ${{N}_{{{\text{L\;}}}}}$ – мольная доля лиганда) и их кинетических аналогов ${{\dot {D}}^{0}}{\kern 1pt} - {\kern 1pt} {{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}}$ (рис. 1, линия 2) и ${{\dot {D}}^{0}}{\kern 1pt} - {\kern 1pt} {{N}_{{\text{L}}}}$ (рис. 3, линия 1). Форму присутствия органического лиганда в комплексе определяли методами ${{D}^{0}}$–${\text{pH}}$ и ${{\dot {D}}^{0}}$–${\text{pH}},$ описанными в [6, 11]. Константы устойчивости комплексов рассчитывали с использованием методов ${{D}^{0}}$–${\text{pH,}}$ ${{\dot {D}}^{0}}$–${\text{pH}}$ и ${{D}^{0}}{\kern 1pt} - {\kern 1pt} {{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}},$ константы скорости их редокс-распада $ - $ с помощью расширенных версий этих методов ${{D}^{0}},$ ${{\dot {D}}^{0}}$–${\text{pH}}$ и ${{D}^{0}},$ ${{\dot {D}}^{0}}{\kern 1pt} - {\kern 1pt} {{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}}$ [6, 11]. Поскольку по величинам констант диссоциации оксигрупп оксикарбоновые кислоты относятся к слабым кислотам, для всех оксикислот в расчетах использовали значение логарифма константы диссоциации оксигруппы $\lg {{B}_{1}} = 14.60$ (получено усреднением данных [37, 38]; в работе [38] значение $\lg {{B}_{1}}$ определено методом математического моделирования). Величины логарифмов общих констант протонизации $\lg {{B}_{i}}$ (i > 1), анионных форм ${{{\text{L}}}^{{k - }}}$оксикарбоновых кислот при I = 2 были приняты равными: $\lg {{B}_{2}} = 17.89$ для ${\text{Qui}}{{{\text{n}}}^{{2 - }}};$ $\lg {{B}_{2}} = 18.31$ для ${\text{Lac}}{{{\text{t}}}^{{2 - }}};$ $\lg {{B}_{2}} = 28.44,$ $\lg {{B}_{3}} = 32.55,$ $\lg {{B}_{4}} = 35.50$ для ${\text{Tar}}{{{\text{t}}}^{{4 - }}};$ $\lg {{B}_{2}} = 19.69,$ $\lg {{B}_{3}} = 23.86,$ $\lg {{B}_{4}} = 26.70$ для ${\text{Сit}}{{{\text{r}}}^{{4 - }}}$ [6, 11]. В расчетах также использовали общие константы гидролиза церия(IV) по двум ступеням ${{K}_{{h1}}} = 6.4$ и ${{K}_{{h2}}} = 1.28$ [39], константы устойчивости нитратных комплексов церия(IV) $\lg {{\beta }_{{1{\text{N}}{{{\text{O}}}_{3}}}}} = $ $0.78,$ $\lg {{\beta }_{{2{\text{N}}{{{\text{O}}}_{3}}}}} = 1.20,$ $\lg {{\beta }_{{3{\text{N}}{{{\text{O}}}_{3}}}}} = 1.34,$ $\lg {{\beta }_{{4{\text{N}}{{{\text{O}}}_{3}}}}} = 1.24,$ $\lg {{\beta }_{{5{\text{N}}{{{\text{O}}}_{3}}}}} = 1.07$ [40] и пакет программ [41].
Рис. 1.
Диаграммы ${{D}^{0}}$–${{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}}$ (1) и ${{\dot {D}}^{0}}$–${{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}}$ (2) для системы ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Lac}}{{{\text{t}}}^{{2 - }}}$−${\text{NO}}_{3}^{ - }$ при ${{c}_{{\text{M}}}} = 2.5 \times {\text{\;}}{{10}^{{ - 3}}}$ моль/л, ${\text{pH\;}}\,\,1.63$, $I = 2,$ $T = 295.15$ K и λ = 400 нм.
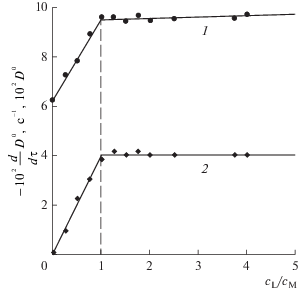
Рис. 2.
Диаграммы ${{D}^{0}}$–pH (1) и –${{\dot {D}}^{0}}$–pH (2) для системы ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Qui}}{{{\text{n}}}^{{2 - }}}$−${\text{NO}}_{3}^{ - }$ при ${{c}_{{\text{M}}}} = 5.00 \times {{10}^{{ - 4}}}$ моль/л, ${{c}_{{\text{L}}}} = 6.00 \times {{10}^{{ - 4}}}$ моль/л, $I = 2,$ $T = 295.15$ K и λ = = 400 нм.
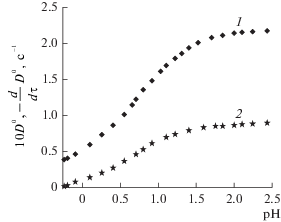
Рис. 3.
Определение мольного соотношения ${\text{металл\;}}:{\text{\;лиганд}} = m~:n$ для комплексов: ${{[{\text{C}}{{{\text{e}}}_{m}}{{{\text{H}}}_{y}}{\text{Qui}}{{{\text{n}}}_{n}}]}^{{4m + y - nk}}}$ методом ${{\dot {D}}^{0}}$–${{N}_{{\text{L}}}}$ при ${{c}_{{{\text{M}} + {\text{L}}}}} = 4.00 \times {\text{\;}}{{10}^{{ - 3}}}$ моль/л, ${\text{pH\;}}\,\,1.50,$ $I = 2,$ $T = 271.15$ K, λ = 400 нм (1) и ${{[{\text{C}}{{{\text{e}}}_{m}}{{{\text{H}}}_{y}}{\text{Lac}}{{{\text{t}}}_{n}}]}^{{4m + y - nk}}}$ методом ${{D}^{0}}$–${{N}_{{\text{L}}}}$ при ${{c}_{{{\text{M}} + {\text{L}}}}} = 1.25 \times {\text{\;}}{{10}^{{ - 2}}}$ моль/л, ${\text{pH\;}}\,\,1.40,$ $I = 2,$ $T = 295.15$ K, λ = 400 нм (2) в нитратной среде.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
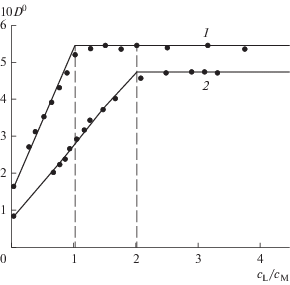
Для исследованных в работе систем ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${{{\text{L}}}^{{k - }}}$−${\text{NO}}_{3}^{ - }$ (${{{\text{L}}}^{{k - }}}$ = ${\text{Lac}}{{{\text{t}}}^{{2 - }}},{\text{\;Qui}}{{{\text{n}}}^{{2 - }}},~{\text{Tar}}{{{\text{t}}}^{{4 - }}}$) в изученном интервале pH по данным серий ${{D}^{0}}{\kern 1pt} - {\kern 1pt} {{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}},$ ${{D}^{0}} - {{N}_{{\text{L}}}}$ и их кинетических аналогов показано образование в момент смешения реагентов комплекса ${{[{\text{Ce}}{{{\text{H}}}_{y}}{\text{L}}]}^{{4 + y - k}}}~$ с соотношением ${\text{металл\;}}:{\text{\;лиганд}} = 1~:1$ (рис. 1, 3 и 4, линия 1). В системе ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Cit}}{{{\text{r}}}^{{k - }}}$−${\text{NO}}_{3}^{ - }$ методом ${{D}^{0}}{\kern 1pt} - {\kern 1pt} {{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}}$ установлено образование комплекса с мольным соотношением ${\text{металл\;}}:{\text{\;лиганд}} = 1~:2$ (рис. 4, линия 2). Полученные данные согласуются с результатами определения состава указанных комплексов в сульфатной среде [6, 11]. Таким образом, в системах ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${{{\text{L}}}^{{k - }}}$−${\text{NO}}_{3}^{ - }$ (Lk– = Quin2–, $~{\text{Lac}}{{{\text{t}}}^{{2 - }}},{\text{\;Tar}}{{{\text{t}}}^{{4 - }}}$) доминируют монокомплексы общей формулы ${{[{\text{Ce}}{{{\text{H}}}_{y}}{\text{L}}]}^{{4 + y - k}}},$ в системе Ce4+–Citrk––${\text{NO}}_{3}^{ - }$ − бис-комплекс ${{\left[ {{\text{Ce}}{{{\text{H}}}_{y}}{\text{Cit}}{{{\text{r}}}_{2}}} \right]}^{{4 + y - 2k}}}.$
Рис. 4.
Определение мольного соотношения ${\text{металл\;}}:{\text{\;лиганд}} = m~:n$ в комплексах ${{[{\text{C}}{{{\text{e}}}_{m}}{{{\text{H}}}_{y}}{\text{Tar}}{{{\text{t}}}_{n}}]}^{{4m + y - nk}}}$ (${{c}_{{\text{M}}}} = 2.50 \times {{10}^{{ - 3}}}$ моль/л, pH 2.30, $I = 2,$ $T = 295.15$ K) (1) и ${{[{\text{C}}{{{\text{e}}}_{m}}{{{\text{H}}}_{y}}{\text{Сit}}{{{\text{r}}}_{n}}]}^{{4m + y - nk}}}$ (${{c}_{{\text{M}}}} = 1.21 \times {{10}^{{ - 3}}}$ моль/л, pH 2.44$ - $2.93, $I = 2,$ $T = 295.15$ K) (2) из диаграмм ${{D}^{0}}$–${{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}}$ методом молярных отношений в нитратной среде.
Число протонов $y$ в комплексе ${{[{\text{Ce}}{{{\text{H}}}_{y}}{{{\text{L}}}_{n}}]}^{{4 + y - nk}}},$ образующемся при установлении равновесия
(1)
${\text{C}}{{{\text{e}}}^{{4 + }}} + y{{{\text{H}}}^{ + }} + n{{{\text{L}}}^{{k - }}}{\text{\;}}\mathop \Leftrightarrow \limits^{{{\beta }_{{1yn,}}}{{{\bar {\beta }}}_{{{\text{1}}yn}}}} {{[{\text{Ce}}{{{\text{H}}}_{y}}{{{\text{L}}}_{n}}]}^{{4 + y - nk}}},$(2)
$\begin{gathered} {{\beta }_{{1yn}}} = {{\left[ {{\text{Ce}}{{{\text{H}}}_{y}}{{{\text{L}}}_{n}}} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{Ce}}{{{\text{H}}}_{y}}{{{\text{L}}}_{n}}} \right]} {\left( {\left[ {{\text{Ce}}} \right]{{{\left[ {\text{L}} \right]}}^{n}}{{{\left[ {\text{H}} \right]}}^{y}}} \right)}}} \right. \kern-0em} {\left( {\left[ {{\text{Ce}}} \right]{{{\left[ {\text{L}} \right]}}^{n}}{{{\left[ {\text{H}} \right]}}^{y}}} \right)}} = {{{{\beta }_{{10n}}}} \mathord{\left/ {\vphantom {{{{\beta }_{{10n}}}} {{{{\left[ {\text{H}} \right]}}^{y}}}}} \right. \kern-0em} {{{{\left[ {\text{H}} \right]}}^{y}}}}, \\ {{{\bar {\beta }}}_{{1yn}}} = {{\overline {\left[ {{\text{Ce}}{{{\text{H}}}_{y}}{{{\text{L}}}_{n}}} \right]} } \mathord{\left/ {\vphantom {{\overline {\left[ {{\text{Ce}}{{{\text{H}}}_{y}}{{{\text{L}}}_{n}}} \right]} } {\left( {\overline {\left[ {{\text{Ce}}} \right]} {{{\overline {\left[ {\text{L}} \right]} }}^{n}}{{{\left[ {\text{H}} \right]}}^{y}}} \right)}}} \right. \kern-0em} {\left( {\overline {\left[ {{\text{Ce}}} \right]} {{{\overline {\left[ {\text{L}} \right]} }}^{n}}{{{\left[ {\text{H}} \right]}}^{y}}} \right)}} = {{{{{\bar {\beta }}}_{{10n}}}} \mathord{\left/ {\vphantom {{{{{\bar {\beta }}}_{{10n}}}} {{{{\left[ {\text{H}} \right]}}^{y}}}}} \right. \kern-0em} {{{{\left[ {\text{H}} \right]}}^{y}}}}, \\ \end{gathered} $(3)
$\lg {{\beta }_{{1yn}}} = \lg {{\beta }_{{10n}}} + y{\text{pH,}}\,\,\,\,\lg {{\bar {\beta }}_{{1yn}}} = \lg {{\bar {\beta }}_{{10n}}} + y{\text{pH\;}},$(4)
$\begin{gathered} \overline {\left[ {{\text{Ce}}{{{\text{H}}}_{y}}{{{\text{L}}}_{n}}} \right]} = \bar {c}_{n}^{0},\,\,\,\,\overline {\left[ {{\text{Ce}}} \right]} = {{\left( {{{c}_{{\text{M}}}} - \overline {\left[ {{\text{Ce}}{{{\text{H}}}_{y}}{{{\text{L}}}_{n}}} \right]} } \right)} \mathord{\left/ {\vphantom {{\left( {{{c}_{{\text{M}}}} - \overline {\left[ {{\text{Ce}}{{{\text{H}}}_{y}}{{{\text{L}}}_{n}}} \right]} } \right)} \omega }} \right. \kern-0em} \omega }{\text{,}} \\ \overline {\left[ {\text{L}} \right]} = {{\left( {{{c}_{{\text{L}}}} - \overline {\left[ {{\text{Ce}}{{{\text{H}}}_{y}}{{{\text{L}}}_{n}}} \right]} } \right)} \mathord{\left/ {\vphantom {{\left( {{{c}_{{\text{L}}}} - \overline {\left[ {{\text{Ce}}{{{\text{H}}}_{y}}{{{\text{L}}}_{n}}} \right]} } \right)} {f_{k}^{n}}}} \right. \kern-0em} {f_{k}^{n}}}, \\ \end{gathered} $где $\omega $ – функция вида ω = 1 + Κh1[H]–1 + $ + \,{{K}_{{h2}}}{{\left[ {\text{H}} \right]}^{{ - 2}}} + \sum\nolimits_{i = 1}^5 {{{\beta }_{{i{\text{N}}{{{\text{O}}}_{3}}}}}} {{[{\text{N}}{{{\text{O}}}_{3}}]}^{i}},$ ${{f}_{{\text{k}}}} = 1 + \sum\nolimits_{i = 1}^k {{{B}_{i}}[} {\text{H}}{{]}^{i}}{\text{\;}} - $ функция протонизации аниона ${{{\text{L}}}^{{k - }}}$ (табл. 1, 2).
Таблица 1.
Kонстанты устойчивости комплексов [CeQuin]2+ (1), [CeLact]2+ (2), [CeTart]0 (3) и ${{[{\text{CeСit}}{{{\text{r}}}_{2}}]}^{{4 - }}}$ (4), определенные методами ${{D}^{0}}$–${\text{pH}}$ и ${{D}^{0}}$–${{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}}$ в нитратной среде при $I = 2,$ $T = 295.15$ K, λ = 400 нм и значениях ${{c}_{{{\text{C}}{{{\text{e}}}^{{4 + }}}}}} = 5.00 \times {{10}^{{ - 4}}}$ моль/л, ${{c}_{{\text{L}}}} = 6.00 \times {{10}^{{ - 4}}}$ моль/л, $D_{\infty }^{0} = 0.217$ (1); ${{c}_{{\text{M}}}} = {{c}_{{\text{L}}}} = 6.00 \times {{10}^{{ - 3}}}$ моль/л, $D_{\infty }^{0} = 0.400$ (2); ${{c}_{{\text{M}}}} = {{c}_{{\text{L}}}} = 2.18 \times {{10}^{{ - 4}}}$ моль/л, $D_{\infty }^{0} = 0.661;$ ${{c}_{{\text{M}}}} = 2.75 \times {{10}^{{ - 4}}}$ моль/л, ${{c}_{{\text{L}}}} = 2.50 \times {{10}^{{ - 4}}}$ моль/л, $D_{\infty }^{0}~ = 0.575{\kern 1pt} *$ (3); ${{c}_{{\text{M}}}} = 1.21 \times {{10}^{{ - 3}}}$ моль/л, pH 2.44–2.93, $D_{\infty }^{0} = 0.446$ (4)
| ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Qui}}{{{\text{n}}}^{{2 - }}}$−${\text{NO}}_{3}^{ - }$ | ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Lac}}{{{\text{t}}}^{{2 - }}}$−${\text{NO}}_{3}^{ - }$ | ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Tar}}{{{\text{t}}}^{{4 - }}}$−${\text{NO}}_{3}^{ - }$ | ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Cit}}{{{\text{r}}}^{{4 - }}}$−${\text{NO}}_{3}^{ - }$ | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| ${{D}^{0}}$ | pH | $\lg {{{\beta }}_{{1y1}}}$ [л/моль] |
${{D}^{0}}$ | pH | $\lg {{{\beta }}_{{1y1}}}$ [л/моль] |
${{D}^{0}}$ | pH | $\lg {{{\beta }}_{{1y1}}}$ [л/моль] |
${{D}^{0}}$ | $ - \lg {{c}_{{\text{L}}}}$ [л/моль] |
$\lg {{{\beta }}_{{1y2}}}$ [л2/моль] |
| 0.217 0.216 0.215 0.213 0.207 0.200 0.185 0.150 0.135 0.105 0.075 0.046 | 2.44 2.24 2.11 2.00 1.70 1.52 1.30 0.92 0.80 0.40 0.25 0.20 |
24.60 24.84 24.43 24.75 24.53 24.42 24.32 24.31 24.29 24.57 24.86 24.74 |
0.355 0.340 0.342 0.330 0.324 0.320 0.322 0.322 0.308 0.312 0.306 0.300 |
1.83 1.53 1.48 1.35 1.27 1.23 1.18 1.16 1.12 1.11 1.10 1.08 |
26.25 26.22 26.26 26.90 26.97 26.80 26.91 26.85 26.55 26.60 26.54 26.43 |
0.659 0.659 0.658 0.658 0.642 0.640 0.635 0.630 0.620 0.600 0.570* 0.532* |
3.00 2.97 2.94 2.92 2.90 2.82 2.62 2.43 2.29 2.19 2.29* 2.19* |
35.02 34.85 34.92 34.97 34.74 33.98 34.21 34.36 34.30 34.11 34.36* 34.53* |
0.440 0.443 0.426 0.380 0.355 0.331 0.339 0.316 0.295 0.276 0.257 0.210 |
2.42 2.61 2.70 2.70 2.82 2.82 2.85 2.90 2.96 3.00 3.05 3.10 |
46.09 46.21 46.18 46.33 45.97 45.74 45.82 45.70 45.98 45.52 45.82 45.79 |
Таблица 2.
Константы устойчивости комплексов [CeQuin]2+ (1), [CeTart]0 (2) и ${{[{\text{CeСit}}{{{\text{r}}}_{2}}]}^{{4 - }}}$ (3), определенные методом ${{\dot {D}}_{0}}$–${\text{\;pH}}$ в нитратной и методом ${{D}^{0}}$–${\text{pH}}$ в перхлоратной средах при $I = 2,$ λ = 400 нм и значениях ${{c}_{{{\text{C}}{{{\text{e}}}^{{4 + }}}}}} = $ 5.00 × × 10–4 моль/л, ${{c}_{{\text{L}}}} = 6.00 \times {{10}^{{ - 4}}}$ моль/л, $T = 272.15$ K, $ - \dot {D}_{\infty }^{0}~ = 4.30 \times {{10}^{{ - 3}}}{\text{\;}}{{{\text{c}}}^{{ - 1}}}$ (1); ${{c}_{{\text{M}}}} = {{c}_{{\text{L}}}}$ = 2.18 × 10–4 моль/л, $T = 295.15$ K, $ - \dot {D}_{\infty }^{0} = 3.42 \times {{10}^{{ - 3}}}{\text{\;}}{{{\text{c}}}^{{ - 1}}}$ (2); ${{c}_{{\text{M}}}} = 1.21 \times {{10}^{{ - 3}}}$ моль/л, ${{c}_{{\text{L}}}} = 5.00 \times {{10}^{{ - 3}}}$ моль/л, $T = 295.15$ K, $D_{\infty }^{0} = 0.446;$ ${{c}_{{\text{M}}}} = 1.23 \times {{10}^{{ - 3}}}$ моль/л, ${{c}_{{\text{L}}}} = 5.00 \times {{10}^{{ - 3}}}$ моль/л, $T = 295.15$ K, $D_{\infty }^{0} = 0.415{\kern 1pt} *$ (3)
| ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Qui}}{{{\text{n}}}^{{2 - }}}$−${\text{NO}}_{3}^{ - }$ | ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Tar}}{{{\text{t}}}^{{4 - }}}$−${\text{NO}}_{3}^{ - }$ | ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Cit}}{{{\text{r}}}^{{4 - }}}$−${\text{\;ClO}}_{4}^{ - }$ | ||||||
|---|---|---|---|---|---|---|---|---|
| $ - {{10}^{3}}{{\dot {D}}^{0}},$${\text{\;}}{{{\text{c}}}^{{ - 1}}}$ | pH | $\lg {{{\bar {\beta }}}_{{1y1}}}$ [л/моль] | $ - {{10}^{3}}{{\dot {D}}^{0}},$${\text{\;}}{{{\text{c}}}^{{ - 1}}}$ | pH | $\lg {{{\bar {\beta }}}_{{1y1}}}$ [л/моль] | ${{D}^{0}}$ | pH | $\lg {{{\beta }}_{{1y2}}}$ [л2/моль2] |
| 4.00 3.70 3.50 3.35 3.30 2.50 2.15 1.25 0.85 0.15 | 1.80 1.52 1.40 1.30 1.22 0.92 0.80 0.40 0.25 0.20 |
24.50 24.22 24.10 24.14 24.16 24.13 24.46 24.42 24.45 24.48 |
3.29 3.29 3.26 3.15 3.15 3.02 2.80 2.20 2.03 1.90 | 3.00 2.97 2.94 2.92 2.90 2.82 2.62 2.43 2.29 2.19 |
35.02 35.12 35.12 34.96 34.98 33.73 34.62 34.27 34.39 34.51 |
0.415 0.405 0.395 0.385 0.375 0.355 0.365* 0.340* 0.320* 0.280* |
2.43 2.31 2.27 2.21 2.18 2.11 2.32* 2.22* 2.14* 2.05* |
45.14 45.66 45.79 45.97 46.08 46.34 45.40* 45.76* 45.99* 46.30* |
Доверительный интервал для усредненных значений $\lg {{\beta }_{{1yn}}}{\text{,}}$ $\lg {{\bar {\beta }}_{{1yn}}}$ и $ - \lg {{k}_{{n = 1}}}$ рассчитывали при объеме выборки N = 34–42 с доверительной вероятностью 0.95, используя программу Статобработка [41].
Поскольку расчет $\lg {{\beta }_{{1yn}}}$ и $\lg {{\bar {\beta }}_{{1yn}}}$ дает во всех точках зависимости (3) постоянное значение для всех исследуемых в работе систем (табл. 1, 2), можно говорить о равенстве $\lg {{\beta }_{{1yn}}} = \lg {{\beta }_{{10n}}},$ $\lg {{\bar {\beta }}_{{1yn}}} = $ $ = \lg {{{\bar {\beta }}}_{{1yn}}}$ и нулевом значении y в формуле комплекса ${{[{\text{Ce}}{{{\text{H}}}_{y}}{{{\text{L}}}_{n}}]}^{{4 + y - nk}}}.$ Таким образом, во всех системах образуются средние (“нормальные” [34]) комплексы церия(IV) общей формулы ${{[{\text{Ce}}{{{\text{L}}}_{n}}]}^{{4 - nk}}}$ (n = 1, 2; k = 2, 2, 4, 4). Высокозарядный ион ${\text{С}}{{{\text{е}}}^{{4 + }}}$ вытесняет из молекул ${{{\text{H}}}_{2}}{\text{Quin}}$ и ${{{\text{H}}}_{2}}{\text{Lact}}$ в процессе комплексообразования по два протона, из молекул ${{{\text{H}}}_{4}}{\text{Tart\;}}$ и ${{{\text{H}}}_{4}}{\text{Сitr\;}}$ – по четыре протона. При этом, как и при взаимодействии с оксикислотами катионов ${\text{S}}{{{\text{c}}}^{{3 + }}},$ ${\text{G}}{{{\text{a}}}^{{3 + }}},$ ${\text{I}}{{{\text{n}}}^{{3 + }}}$ и ${\text{T}}{{{\text{h}}}^{{4 + }}},$ происходит вытеснение протонов оксигрупп оксикислот [42]. Этот факт согласуется с недавними структурными исследованиями [43, 44], показавшими, что, вопреки достаточно распространенному мнению о том, что в комплексообразовании лимонной кислоты участвуют лишь карбоксильные группы, в цитратных комплексах тория(IV) и урана(IV) цитрат-анион связан с катионом металла посредством карбоксильной и находящейся в ${\alpha }$-положении по отношению к ней спиртовой групп. Результаты, полученные в представленной работе, соответствуют также данным исследования стехиометрии комплексов церия(IV) с хинной и винной оксикислотами в сульфатной среде [6, 11].
Рассчитанные в нитратной среде значения lg β101 = $ = \lg (\beta _{1}^{{{\text{ef}}}}{{f}_{2}}\omega ),$ где $\beta _{1}^{{{\text{ef}}}} = {{c_{1}^{0}} \mathord{\left/ {\vphantom {{c_{1}^{0}} {\left[ {\left( {{{c}_{{\text{M}}}} - c_{1}^{0}} \right)\left( {{{c}_{{\text{L}}}} - c_{1}^{0}} \right)} \right]}}} \right. \kern-0em} {\left[ {\left( {{{c}_{{\text{M}}}} - c_{1}^{0}} \right)\left( {{{c}_{{\text{L}}}} - c_{1}^{0}} \right)} \right]}},$ и $\lg {{\bar {\beta }}_{{101}}} = ~\lg (~\bar {\beta }_{1}^{{{\text{ef}}}}{{f}_{2}}{\omega }),$ где $\bar {\beta }_{1}^{{{\text{ef}}}} = {{\bar {c}_{1}^{0}} \mathord{\left/ {\vphantom {{\bar {c}_{1}^{0}} {\left[ {\left( {{{c}_{{\text{M}}}} - \bar {c}_{1}^{0}} \right) \times } \right.}}} \right. \kern-0em} {\left[ {\left( {{{c}_{{\text{M}}}} - \bar {c}_{1}^{0}} \right) \times } \right.}}$ $\left. { \times \,\,\left( {{{c}_{{\text{L}}}} - \bar {c}_{1}^{0}} \right)} \right],$ для комплекса [CeQuin]2+ (lg β101 = $ = 24.55 \pm 0.21,$ $\lg {{\bar {\beta }}_{{101}}} = ~24.31 \pm 0.17$) соответствуют величине $\lg {{\beta }_{{101}}} = \lg (\beta _{1}^{{{\text{ef}}}}{{f}_{2}}{\omega }) = 24.41 \pm 0.15$ для [CeQuin]2+, рассчитанному по значению lg β101 = = $\lg (\beta _{1}^{{{\text{ef}}}}{{f}_{2}})$ = 14.93 ± 0.15 для комплекса [CeOHQuin]+ в сульфатной среде [6, 11]. Найденная в нитратной среде величина lg β102 = 45.93 ± $ \pm \,\,0.24$ для ${{[{\text{CeСit}}{{{\text{r}}}_{2}}]}^{{4 - }}}$ (табл. 1) хорошо согласуется с соответствующей величиной lg β102 = 45.84 ± $ \pm \,\,0.38$ для ${{[{\text{CeСit}}{{{\text{r}}}_{2}}]}^{{4 - }}}$ в перхлоратной среде (табл. 2).
В работе изучали также кинетическую устойчивость комплексов по отношению к их внутримолекулярному редокс-распаду (табл. 3). Константы скорости первого концентрационного порядка по комплексу ${{k}_{{{{n}_{{\text{c}}}} = 1}}}{\text{\;}}\,\,{\text{(}}{{{\text{c}}}^{{ - 1}}})$ рассчитывали дифференциальным кинетическим методом по данным расширенных серий ${{D}_{0}},{{\dot {D}}_{0}}$–${\text{\;pH,}}$ ${{D}^{0}},$ ${{\dot {D}}^{0}}{\kern 1pt} - $ $ - {{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}}$ [6, 11] согласно уравнению
(5)
$\lg {{k}_{{{{n}_{{\text{c}}}} = 1}}} = \lg \left( { - {{{\dot {D}}}_{0}}} \right) - \lg \left( {l{{\varepsilon }_{n}}{\text{\;}}c_{n}^{0}} \right),$Таблица 3.
Kонстанты скорости редокс-распада комплексов [CeQuin]2+ (1), [CeLact]2+ (2), [CeTart]0 (3) и ${{[{\text{CeСit}}{{{\text{r}}}_{2}}]}^{{4 - }}}$ (4) в нитратной среде, определенные методами ${{D}_{0}},{{\dot {D}}_{0}}$–${\text{\;pH}}$ и ${{D}^{0}},$ ${{\dot {D}}^{0}}{\kern 1pt} - {\kern 1pt} {{{{c}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{c}_{{\text{L}}}}} {{{c}_{{\text{M}}}}}}} \right. \kern-0em} {{{c}_{{\text{M}}}}}}$ при $I = 2$, $T = 295.15$ K, λ = 400 нм и значениях ${{c}_{{\text{M}}}} = 5.00 \times {{10}^{{ - 4}}}$ моль/л, ${{c}_{{\text{L}}}} = 6.00 \times {{10}^{{ - 4}}}$ моль/л, $D_{\infty }^{0}~ = 0.217$ (1); ${{c}_{{\text{M}}}} = 6.00 \times {{10}^{{ - 3}}}$ моль/л, pH 1.63, $D_{\infty }^{0}~ = 0.390$ (2); ${{c}_{{\text{M}}}} = {{c}_{{\text{L}}}} = 2.18 \times {{10}^{{ - 4}}}$ моль/л, $D_{\infty }^{0}~ = 0.660$ (3); ${{c}_{{\text{M}}}} = 1.25 \times {{10}^{{ - 3}}}$ моль/л, pH 2.44$ - $2.93, $D_{\infty }^{0}~ = 0.460$ (4)
| ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Qui}}{{{\text{n}}}^{{2 - }}}$−${\text{NO}}_{3}^{ - }$ | ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Lac}}{{{\text{t}}}^{{2 - }}}$−${\text{NO}}_{3}^{ - }$ | ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Tar}}{{{\text{t}}}^{{4 - }}}$−${\text{NO}}_{3}^{ - }$ | ${\text{C}}{{{\text{e}}}^{{4 + }}}$−${\text{Cit}}{{{\text{r}}}^{{4 - }}}$−${\text{NO}}_{3}^{ - }$ | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| $ - {{10}^{2}}{{\dot {D}}^{0}},$ ${{{\text{c}}}^{{ - 1}}}$ |
pH | $\lg {{k}_{{{{n}_{{\text{c}}}} = 1}}}$${\text{[}}{{{\text{c}}}^{{ - 1}}}]$ | – ${{\dot {D}}^{0}},$ ${{{\text{c}}}^{{ - 1}}}$ |
$ - \lg {{c}_{{\text{L}}}},$ [моль/л] | $\lg {{k}_{{{{n}_{{\text{c}}}} = 1}}}$${\text{[}}{{{\text{c}}}^{{ - 1}}}]$ | $ - {{10}^{3}}{{\dot {D}}^{0}},$ ${\text{\;}}{{{\text{c}}}^{{ - 1}}}$ |
pH | $\lg {{k}_{{{{n}_{{\text{c}}}} = 1}}}$${\text{[}}{{{\text{c}}}^{{ - 1}}}]$ | $ - {{10}^{4}}{{\dot {D}}^{0}},$ ${\text{\;}}{{{\text{c}}}^{{ - 1}}}$ |
$ - \lg {{c}_{{\text{L}}}},$ [моль/л] | $\lg {{k}_{{{{n}_{{\text{c}}}} = 1}}}$${\text{[}}{{{\text{c}}}^{{ - 1}}}]$ |
| 8.45 8.16 8.09 7.84 6.44 6.02 4.92 4.17 |
2.44 2.11 2.00 1.70 1.22 1.10 0.80 0.70 |
–0.41 –0.42 –0.42 –0.42 –0.43 –0.43 –0.43 –0.43 |
0.110 0.110 0.120 0.150 0.120 0.130 0.130 0.130 |
–2.14 –2.07 –2.02 –1.92 –1.87 –1.82 –1.74 –1.62 |
–0.51 –0.51 –0.49 –0.41 –0.51 –0.45 –0.47 –0.47 |
3.35 3.46 3.34 3.34 3.33 3.34 3.25 3.46 |
3.07 3.02 3.00 2.97 2.94 2.92 2.90 2.82 |
–2.29 –2.28 –2.45 –2.29 –2.44 –2.29 –2.20 –2.30 |
3.13 2.60 3.62 4.10 4.51 4.64 4.85 5.67 |
–1.81 –1.82 –1.85 –1.86 –1.88 –1.90 –1.96 –2.00 |
–3.17 –3.25 –3.10 –3.05 –3.01 –2.99 –2.98 –2.91 |
На основе полученных усредненных значений $ - \lg {{k}_{{{{n}_{{\text{c}}}} = 1}}} \equiv - \lg ~{{k}_{{n = 1}}}$ и $\lg {{\beta }_{{101\left( 2 \right)}}}$ между данными величинами установлено корреляционное соотношение
(6)
$ - \lg ~{{k}_{{{{n}_{{\text{c}}}} = 1}}} = ~ - \lg k_{{{{n}_{{\text{c}}}} = 1}}^{0} + \rho \lg {{\beta }_{{101\left( 2 \right)}}},$В сульфатной среде аналогичная корреляция в рамках изученной авторами реакционной серии22 наблюдалась лишь для комплексов церия(IV) c бидентатными органическими лигандами (рис. 5, линия 1). Для лигандов, проявляющих дентатность выше двух, как было отмечено выше, увеличение констант устойчивости комплексов не сопровождалось увеличением их кинетической устойчивости [6, 11, 33] (рис. 5, линия 2)33. Последнее можно объяснить высокой конкурирующей способностью сульфат-анионов сернокислой среды при образовании смешанолигандных комплексов типа ${{\left[ {{\text{CeOH}}{{{\left( {{\text{S}}{{{\text{O}}}_{4}}} \right)}}_{3}}{\text{L}}} \right]}^{{\left( {3 + k} \right) - }}},$ приводящей к вхождению во внутреннюю координационную сферу комплекса не более двух функциональных групп полидентатного органического лиганда, поскольку КЧ(CeIV) = 9 [45]. Не вошедшие во внутреннюю координационную сферу функциональные группы лиганда, вероятно, уже не влияют на скорость внутрисферного переноса электрона в комплексе. В отличие от сернокислой среды, в азотно- и хлорнокислой средах анионы фона образуют с катионом церия(IV) внешнесферные комплексы [11] и практически не препятствуют полному координационному насыщению внутренней сферы функциональными группами полидентатного лиганда, а также дополнительной стабилизации этими группами неустойчивого с.о. +4 церия (рис. 5, линия 3).
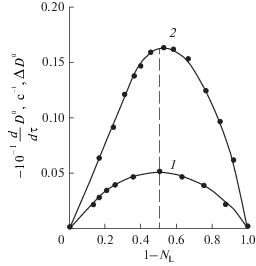
Рис. 5.
Линейные корреляции между усредненными значениями $ - \lg {{k}_{{n = 1}}}$ и $\lg {{\beta }_{{myn}}}{\text{:}}$ 1 – для [CeOxal]2+, [CeMaln]2+, [CeSucc]2+, [CeGlut]2+, [CeQuin]2+, [${\text{Ce}}{{{\text{H}}}_{2}}{\text{Citr}}$]2+, [CeGlyc]2+, [CeCsyl]2+, [CeSorb]2+, 2 – для [CeMalt]+, [CeTart]0, [${\text{C}}{{{\text{e}}}_{2}}{\text{Tart}}$]4+, ${{[{\text{Ce}}{{{\text{H}}}_{4}}{\text{Сit}}{{{\text{r}}}_{2}}]}^{0}}$ (слева направо) в сульфатной среде; 3 – для ${{[{\text{CeQuin}}]}^{{2 + }}},$ ${{[{\text{CeLact}}]}^{{2 + }}},$ ${{[{\text{CeTart}}]}^{0}}$ и ${{[{\text{CeСit}}{{{\text{r}}}_{2}}]}^{{4 - }}}$ (слева направо) в нитратной среде.
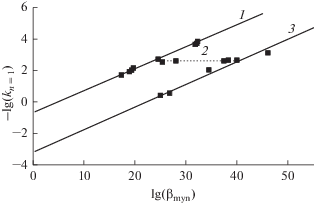
Отметим, что величина $\rho $ являющаяся аналогом так называемой “реакционной константы” в уравнениях Бренстеда, Гаммета, Тафта, не меняется при переходе от сульфатной (рис. 5, линия 1) к нитратной среде (рис. 5, линия 3). Различие между линиями 1 и 3 сводится к различию в значении их интерсепта ($\lg k_{{{{n}_{{\text{c}}}} = 1}}^{0} \approx 0.7$ и $\lg k_{{{{n}_{{\text{c}}}} = 1}}^{0} \approx 3.21$ соответственно). Преобразование уравнения (6), имеющего вид, подобный уравнению Бренстеда, к виду, подобному уравнению Гаммета–Тафта [46]
(7)
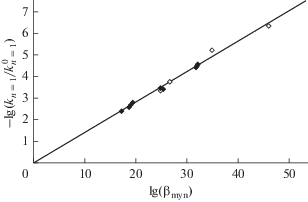
$ - {\text{lg}}~({{{{k}_{{{{n}_{{\text{c}}}} = 1}}}} \mathord{\left/ {\vphantom {{{{k}_{{{{n}_{{\text{c}}}} = 1}}}} {\lg k_{{{{n}_{{\text{c}}}} = 1}}^{0}}}} \right. \kern-0em} {\lg k_{{{{n}_{{\text{c}}}} = 1}}^{0}}}) = \rho \lg {{\beta }_{{101\left( 2 \right)}}},$Рис. 6.
Линейная корреляция между усредненными значениями $ - \lg ~({{{{k}_{{{{n}_{{\text{c}}}} = 1}}}} \mathord{\left/ {\vphantom {{{{k}_{{{{n}_{{\text{c}}}} = 1}}}} {\lg k_{{{{n}_{{\text{c}}}} = 1}}^{0}}}} \right. \kern-0em} {\lg k_{{{{n}_{{\text{c}}}} = 1}}^{0}}})$ и $\lg {{\beta }_{{myn}}}$ в сульфатной и нитратной средах для [CeOxal]2+ (${\text{SO}}_{4}^{{2 - }}$), [CeMaln]2+ (${\text{SO}}_{4}^{{2 - }}$), [CeSucc]2+ (${\text{SO}}_{4}^{{2 - }}$), [CeGlut]2+ (${\text{SO}}_{4}^{{2 - }}$), [CeQuin]2+ (${\text{SO}}_{4}^{{2 - }}$), [CeQuin]2+ (${\text{NO}}_{3}^{ - }$), [${\text{Ce}}{{{\text{H}}}_{2}}{\text{Citr}}$]2+ (${\text{SO}}_{4}^{{2 - }}$), [CeLact]2+ (${\text{NO}}_{3}^{ - }$), [CeGlyc]2+ (${\text{SO}}_{4}^{{2 - }}$), [CeCsyl]2+ (${\text{SO}}_{4}^{{2 - }}$), [CeSorb]2+ (${\text{SO}}_{4}^{{2 - }}$), ${{[{\text{CeTart}}]}^{0}}$ (${\text{NO}}_{3}^{ - }$) и ${{[{\text{CeСit}}{{{\text{r}}}_{2}}]}^{{4 - }}}$ (${\text{NO}}_{3}^{ - }$) (слева направо).
ЗАКЛЮЧЕНИЕ
Таким образом, мы приходим в выводу о том, что наблюдавшийся в сульфатной среде эффект независимости кинетической устойчивости комплексов от величин констант их устойчивости для лигандов с дентатностью выше двух (рис. 5, линия 2) характерен именно для сульфатной среды. При отсутствии (или слабой) конкуренции между анионами фона и органическим лигандом за комплексообразователь (нитратная, перхлоратная среды) обратная корреляция между константами скорости редокс-распада и константами устойчивости комплексов церия(IV), имеющих, согласно [27–31], преимущественно ионный тип связи, носит, по-видимому, достаточно распространенный характер [см., например, 6, 11, 31, 33] (рис. 5, линии 1 и 3; рис. 6). Установленные корреляционные соотношения типа (6) и (7) представляют собой проявление принципа линейных соотношений свободных энергий в координационной химии и могут быть использованы в ней для количественного описания окисления органических лигандов ионами переходных металлов.
Список литературы
Cerium: Molecular Structure, Technological Applications and Health Effects / Eds. Izyumov A., Plaksin G. N.Y.: Nova Science Publishers, Inc., 2013. 235 p.
Voskresenskaya O.O., Skorik N.A., Yuzhakova Yu.V. // Russ. J. Phys. Chem. A. 2017. V. 91. № 4. P. 627. [Воскресенская O.O., Скорик H.A., Южакова Ю.В. // Журн. физ. химии. 2017. Т. 91. № 4. С. 601.]https://doi.org/10.1134/S0036024417040318
Szymański J.K., Temprano-Coleto F., Pérez-Mercader J. // Phys. Chem. Chem. Phys. 2015. V. 17. P. 6713. https://doi.org/10.1039/c4cp05693k
Voskresenskaya O.О., Skorik N.A. // Russ. J. Phys. Chem. A. 2015. V. 89. № 10. P. 1821. [Воскресенская O.О., Скорик Н.А. // Журн. физ. химии. 2015. Т. 89. № 10. С. 1619.]
Levin J.R., Dorfner W.L., Carroll P.J. et al. // Chem. Sci. 2015. V. 6. № 12. P. 6925. https://doi.org/10.1039/c5sc02607e
Voskresenskaya O. Kinetic and Thermodynamic Stability of Cerium(IV) Complexes with a Series of Aliphatic Organic Compounds. N.Y.: Nova Science Publishers, Inc., 2013. 171 p.
Tandom P.K., Khanam S.C., Singh S.B. // Open Catal. 2012. V. 5. P. 1.
Behrle A.C., Levin J.R., Kim J.E. et al. // Dalton Trans. 2015. V. 44. P. 2693. https://doi.org/10.1039/c4dt01798f
Sroor F.M.A., Edelmann F.T. // The Rare Earth Elements: Fundamentals and Applications / Ed. Atwood R. Chichester: Wiley, 2012. P. 321.
Solola L.A., Zabula A.V., Dorfner W.L. et al. // J. Am. Chem. Soc. 2016. V. 138. № 22. P. 6928.
Воскресенская O.О., Скорик Н.А. Термодинамические и кинетические аспекты образования и редокс-распада комплексов церия(IV) с рядом гидроксилсодержащих органических соединений. Томск: НТЛ, 2011. 220 с.
Petrova N., Todorovsky D., Angelova S. et al. // J. Alloys Compd. 2008. V. 454. № 1. P. 491. https://doi.org/10.1016/j.jallcom.2007.01.005
Pat CA2775962C(en) (2017).
Ma L., Wang Q., Man W.L. et al. // Angew. Chem. Int. Ed. 2015. V. 54. № 17. P. 5246.
Jakupec M.A., Unfried P., Keller B.K. // Rev. Physiol., Biochem. Pharmacol. 2005. V. 153. P. 101. https://doi.org/10.1007/s10254-004-0024-6
Yamamoto Y., Mori M., Aiba Y. et al. // Nucleic Acids Res. 2007. V. 35. № 7. P. e53(3).
Sumaoka J., Chen W., Kitamura Y. et al. // J. Alloys Compd. 2006. V. 408–412. P. 391.
Щербаков А.Б., Иванова О.С., Спивак Н.Я. и др. Синтез и биомедицинские применения нанодисперсного диоксида церия. Томск: Издательский дом Томского гос. ун-та, 2016. 474 с.
Shcherbakov A.B., Zholobak N.M., Usatenko A.V. et al. // Biotechnologia Acta. 2011. V. 4. № 1. P. 9. [Щербаков А.Б., Жолобак Н.М., Иванов В.К. и др. // Биотехнология. 2011. Т. 4. № 1. С. 9.]
Pat WO 2008/030805 (2008).
US Pat # 9,962,406 (2016).
Pat WO/2015/058037 (2015).
Hancock M.L., Grulke E.A., Yokel R. // Proc. 2018 AIChE Annual Meeting. Pittsburg, PA, 2018. 405a.
Kovacheva P., Todorovsky D., Mirchev N. // Machines. Technologies. Materials. 2018. V. 12. № 1. P. 37.
Milenković I., Rabotić K., Matović B. et al. // J. Serb. Chem. Soc. 2018. V. 83. № 6. P. 745. https://doi.org/10.2298/JSC171205031M
Piro N.A., Robinson J.R., Walsh P.J. et al. // Coord. Chem. Rev. 2014. V. 260. P. 21.
Координационная химия редкоземельных элементов / Под ред. Спицына В.И., Мартыненко Л.И. М.: Изд-во МГУ, 1979. 254 с.
Киселев Ю.М., Добрынина Н.А. Химия координационных соединений. М.: Академия, 2007. 352 с.
Kiselev Yu.M. // Russ. J. Inorg. Chem. 2002. V. 47. № 4. P. 473. 2018. V. 88. № 4. P. 721. [Киселев Ю.М. // Журн. неорган. химии. 2002. Т. 47. № 4. С. 540.]https://doi.org/10.1134/S1070363218040163
Voskresenskaya O.O., Skorik N.A., Yuzhakova Yu.V. // Russ. J. Gen. Chem. [Воскресенская O.O., Скорик H.A., Южакова Ю.В. // Журн. общ. химии. 2018. Т. 88. № 4. С. 640.]
Voskresenskaya O.О., Skorik N.A., Stepanova N.V. // Russ. J. Appl. Chem. A. 2016. V. 89. № 11. P. 1747. [Воскресенская O.О., Скорик Н.А., Степанова Н.В. // Журн. прикл. химии. 2016. Т. 89. № 11. С. 1375.]https://doi.org/10.1134/S1070427216110033
Voskresenskaya O.O., Naprienko E.N., Skorik N.A. // Russ. J. Inorg. Chem. 2019. V. 64. № 4. P. 511. [Воскресенская O.O., Наприенко E.H., Скорик H.A. // Журн. неорган. химии. 2019. Т. 64. № 4. С. 405.]https://doi.org/10.1134/S003602361904020X
Voskresenskaya O.О., Skorik N.A. // Russ. J. Phys. Chem. A. 2009. V. 83. № 6. P. 945. [Воскресенская O.О., Скорик Н.А. // Журн. физ. химии. 2009. Т. 83. № 6. С. 1079.]
Яцимирский К.Б., Костромина Н.А., Шека З.А. и др. Химия комплексных соединений редкоземельных элементов. Киев: Наукова думка, 1966. 493 с.
Карякин Ю.В., Ангелов И.И. Чистые химические реактивы. М.: Химия, 1974. С. 393.
Kolthoff I.M. et al. Volumetric Analysis. N.Y.: Interscience, 1957. 714 p.
Кумок В.Н., Скорик Н.А. Лабораторные работы по химии комплексных соединений. Томск: Изд-во ТГУ, 1983. С. 136.
Добрынина Н.А., Мартыненко Л.И. // Проблемы современной химии координационных соединений / Под ред. Буркова К.А. Л.: Изд-во ЛГУ, 1989. С. 98.
Everett K.G., Skoog D.A. // Anal. Chem. 1971. V. 43. № 12. P. 1541.
Смелов В.С., Верещагин Ю.И. // Журн. неорган. химии. 1964. Т. 9. № 12. С. 2775.
Скорик Н.А., Чернов Е.Б. Расчеты с использованием персональных компьютеров в химии комплексных соединений. Томск: Изд-во ТГУ, 2009. 90 с.
Скорик Н.А., Артиш А.С. // Russ. J. Gen. Chem. 1985. V. 30. № 8. С. 1994. [Skorik N.A., Artich A.S. // Russ. J. Gen. Chem. 1985. V. 30. № 8. С. 1192.]
Thuéry P. // Cryst. Eng. Comm. 2008. V. 10. P. 79.
Felmy A.R., Cho H., Dixon D.A. et al. // Radiochim. Acta. 2006. V. 94. P. 205. https://doi.org/10.1524/ract.2006.94.4.205
Casari B.M., Lander V. // Acta Crystallogr., Sect. C: Cryst. Struct. Commun. 2007. V. 6. № 4. P. i25.
Жданов Ю.А., Минкин В.И. Корреляционный анализ в органической химии. Ростов-на-Дону: Изд-во Ростов. ун-та, 1966.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


