Журнал неорганической химии, 2019, T. 64, № 10, стр. 1072-1088
Термодинамические функции сложных оксидов лантаноидов на основе диоксида циркония – пирохлоров Ln2Zr2O7 (Ln = La, Pr, Sm, Eu, Gd) и флюоритов Ln2O3 · 2ZrO2 (Ln = Tb, Ho, Er, Tm)
В. Н. Гуськов 1, *, К. С. Гавричев 1, П. Г. Гагарин 1, А. В. Гуськов 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: guskov@igic.ras.ru
Поступила в редакцию 29.03.2019
После доработки 04.04.2019
Принята к публикации 15.04.2019
Аннотация
Обзор термодинамических свойств сложных оксидов лантаноидов и циркония Ln2Zr2O7 (Ln = La, Pr, Sm, Eu, Gd) со структурой пирохлора и твердых растворов Ln2O3 · 2ZrO2 (Ln = Tb, Ho, Er, Tm) со структурой флюорита представлен на основании полученных нами и литературных данных. Экспериментально изучена теплоемкость образцов Ln2Zr2O7 (для лантаноидов подгруппы церия) структурного типа пирохлора (Fd3m) и Ln2O3 · 2ZrO2 (для лантаноидов подгруппы иттрия) структурного типа флюорита (Fm3m), охарактеризованных с помощью рентгенофазового и элементного анализа, сканирующей электронной микроскопии, адиабатической и дифференциальной сканирующей калориметрии. Температурные зависимости термодинамических функций (энтропии, изменения энтальпии и приведенной энергии Гиббса) рассчитаны в широком диапазоне температур по сглаженным значениям теплоемкости. Проведено сопоставление имеющихся термодинамических данных и представлены рекомендованные значения. Вклад низкотемпературных магнитных превращений учтен для Ln2Zr2O7 (Ln = Pr, Nd, Sm, Gd). Проанализировано влияние аномалии Шоттки на теплоемкость соединений лантаноидов.
ВВЕДЕНИЕ
Исследователи прилагают серьезные усилия для поиска и создания термобарьерных материалов, превосходящих по функциональным свойствам стабилизированный иттрием оксид циркония (YSZ). Признанными претендентами на замену YSZ являются материалы на основе двойных оксидов состава Ln2O3 : 2ZrO2 [1]. Как наиболее перспективные вещества для этих целей особо выделяются цирконаты лантана, самария, гадолиния, их взаимные твердые растворы и твердые растворы на их основе с участием других лантаноидов [2–5]. Помимо теплозащитных свойств цирконаты и твердые растворы диоксида циркония и оксидов лантаноидов имеют высокие температуры плавления и химическую стойкость, характеризуются отсутствием структурных фазовых переходов в широком интервале температур, проявляют каталитические свойства [6], ионную проводимость [7–9] и представляют интерес как люминесцентные материалы [10, 11].
В системах Ln2O3–ZrO2 имеются протяженные твердые растворы замещения на основе кубического диоксида циркония xLn2O3 ⋅ 2(1–x)ZrO2 (x ~ ~ 0–0.8) структурного типа разупорядоченного флюорита (Fm3m). Внутри этой области кристаллизуются соединения состава Ln2Zr2O7 (Ln = La, Pr, Sm, Eu, Gd) структурного типа пирохлора (Fd3m) с узкой областью гомогенности [12]. При нагревании этих соединений до высоких температур происходит структурное разупорядочение, приводящее к фазовому переходу в дефектный флюорит стехиометрического состава Ln2O3 ⋅ 2ZrO2. Механизм такого превращения в литературе рассматривался неоднократно. Согласно расчетам [13], наименьшая температура фазового перехода пирохлор–флюорит должна наблюдаться у Gd2Zr2O7 (~1760 K), тогда как у цирконата лантана она превышает температуру плавления, и образования стабильной флюоритной фазы стехиометрического состава Ln2O3 ⋅ 2ZrO2 не происходит.
Существование соединения Ln2Zr2O7 структурного типа пирохлора ограничено соотношением радиусов катионов ${{r_{{{\text{Ln}}}}^{{3 + }}} \mathord{\left/ {\vphantom {{r_{{{\text{Ln}}}}^{{3 + }}} {r_{{{\text{Zr}}}}^{{4 + }}}}} \right. \kern-0em} {r_{{{\text{Zr}}}}^{{4 + }}}}$ > 1.46 [14]. При меньшем отношении радиусов (в случае Tb–Lu) образования пирохлоров в области протяженных твердых растворов со структурой флюорита не наблюдается. Однако для высокотемпературных материалов на основе оксида циркония и тяжелых лантаноидов отсутствие соединений стехиометрического состава с узкой областью гомогенности с точки зрения использования в технологических процессах скорее является преимуществом, а не недостатком, так как исключает необходимость соблюдения точных стехиометрических соотношений, например при нанесении термобарьерных покрытий. Таким образом, стехиометрические составы Ln2O3 : 2ZrO2 распадаются на два типа: пирохлоры Ln2Zr2O7 с относительно узкой областью существования и флюориты Ln2O3 ⋅ 2ZrO2 – стехиометрический состав в области протяженных твердых растворов замещения на основе кубического диоксида циркония.
Синтез цирконатов редкоземельных элементов требует высоких температур для активации диффузионных процессов, необходимых для образования равновесных кристаллических структур. Несмотря на то, что совместное осаждение гидроксидов принято считать эффективным способом понижения температуры взаимодействия компонентов, прокаливание осадков гидроксидов при относительно низких температурах (~1000–1300 K) приводит к образованию метастабильного наноразмерного твердого раствора со структурой флюорита. При стехиометрическом соотношении Ln2O3 : 2ZrO2 полученный твердый раствор не является химическим соединением, и только при нагревании до более высоких температур (>1300 K) происходит окончательное взаимодействие компонентов с образованием стабильных пирохлоров Ln2Zr2O7. Например, в случае цирконата самария образование равновесного соединения со структурой пирохлора из наноразмерного прекурсора, полученного соосаждением, начинается при температуре ~1400–1500 K и сопровождается увеличением размера кристаллических частиц [15]. Необходимость нагрева до высоких температур для активации диффузионных процессов свидетельствует о том, что при температурах ниже 1400–1500 K в системах Ln2O3–ZrO2 требуется значительное время для установления равновесия, если оно вообще достижимо. Этим объясняется тот факт, что фазовые диаграммы систем Ln2O3–ZrO2 при более низких температурах практически не изучены. Экспериментальные данные по фазовым диаграммам при более высоких температурах также довольно схематичны, поскольку проведение эксперимента при высоких температурах, с одной стороны, достаточно трудоемко, а с другой – требует более сложного оборудования и серьезных затрат. Альтернативой экспериментальным исследованиям является математическое моделирование, для которого необходимы достоверные термодинамические величины участвующих в процессе веществ. Основой для расчета термодинамических функций сложных оксидов в широком интервале температур являются экспериментальные измерения изобарной теплоемкости наряду с определением энтальпий образования. Существующие в настоящее время теоретические модели и эмпирические методы позволяют получить оценочные значения теплоемкости. Например, в работе [16] отмечено, что правило Неймана–Коппа дает лишь оценочные значения теплоемкости для оксидных систем из-за сильного взаимодействия компонентов. Опыт показывает, что подобный расчет приводит к вполне корректным результатам для высокотемпературного диапазона, если структуры простых и сложных оксидов близки, но в том случае, когда их кристаллические структуры отличаются, расхождения могут быть существенными. Для низких температур тем более вероятны значительные расхождения экспериментальных и расчетных значений теплоемкости.
Хотя фазовые равновесия в системах Ln2O3–ZrO2 неоднократно обсуждались [17], термодинамические свойства соединений и стехиометрических твердых растворов на основе оксидов лантаноидов и диоксида циркония состава Ln2O3 : 2ZrO2 изучены фрагментарно, в связи с этим цель настоящего обзора – по возможности полное представление термодинамических данных по этим веществам в широком диапазоне температур, основанное на литературных источниках и наших измерениях изобарной теплоемкости, выполненных на охарактеризованных по составу и структуре образцах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов проводили методом “обратного” осаждения аммиаком гидроксидов циркония и соответствующих лантаноидов, взятых в стехиометрических отношениях. Методика синтеза подробно описана в работе [18]. Кинетику процессов, происходящих при нагревании высушенных осадков гидроксидов, неоднократно изучали рентгеновскими методами (например, [12, 19–21]). В указанных работах, а также в наших исследованиях [22, 23] показано, что высокотемпературная обработка необходима как для перехода от наноразмерного состояния полученных образцов к полноразмерной (объемной) кристаллической структуре, так и для полного взаимодействия компонентов и фазового превращения твердого раствора Ln2O3 ⋅ 2ZrO2 флюоритного типа в цирконат Ln2Zr2O7 со структурой пирохлора при Ln = La, Pr, Nd, Sm, Eu и Gd.
Дифракционные исследования (РФА) приготовленных образцов проводили с помощью автоматического порошкового дифрактометра Bruker D8 Advance (CuKα1-излучение, λ = 1.5406 Ǻ, детектор LYNXEYE с Ni-фильтром). Дифрактограммы обрабатывали с помощью программы Bruker EVA с использованием базы данных ICDD PDF. Уточнение параметров элементарных ячеек было выполнено методом полнопрофильного анализа с применением программы TOPAS.
Электронно-микроскопические исследования морфологии образцов (СЭМ) и анализ рентгеноэлектронных спектров (РЭС) для определения их химического состава осуществляли с помощью электронного микроскопа Cross Beam Zeiss NVision 40 (ЦКП ИОНХ РАН) и полевого эмиссионного растрового электронного микроскопа JSM-6700F с приставкой для энергодисперсионной спектрометрии JED-2300F фирмы JEOL (ЦКП “Материаловедение и металлургия” НИТУ МИСИС (Технологический университет)).
Теплоемкость в интервале 5–330 K измеряли автоматическим низкотемпературным калориметром БКТ-3. Более подробное описание прибора и условий измерений приведено в работе [18]. Масса измеряемых образцов ~1–2 г. Молекулярные массы рассчитывали с использованием атомных масс, приведенных в [24]. Экспериментальные данные сглажены полиномом высокой степени по алгоритму [25] и сплайн-аппроксимацией [26].
Для получения температурных зависимостей теплоемкости в интервале 320–1400 K использовали стандартную методику установки синхронного термического анализа STA 449 F1 Jupiter Netzsch. Измерения проводили как в динамическом режиме, так и в изотермических условиях при программируемом изменении температуры оболочки (нагревателя) в атмосфере аргона.
Помимо измерения теплоемкости изучали тепловое поведение образцов цирконатов РЗЭ методом дифференциальной сканирующей калориметрии, чтобы убедиться в отсутствии у изучаемых образцов фазовых переходов, сопровождаемых тепловыми эффектами, в области температур 330–1700 K.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Соединения состава Ln2Zr2O7 (Ln = La–Gd) со структурой пирохлора
Цирконат лантана La2Zr2O7. Энтальпия образования La2Zr2O7 из оксидов и из элементов определена в работе [27] методом растворения в расплаве бората свинца: ${{\Delta }_{f}}H_{{{\text{ox}}}}^{0}$ (298.15 K) = –135.8 ± ± 6.4 кДж/моль, Δf H 0 (298.15 K) = –4130 ± ± 6.8 кДж/моль. Авторы [27] утверждают, что опубликованная ранее [28] величина энтальпии образования из оксидов (–125.9 кДж/моль) завышена из-за некорректной постановки калориметрического эксперимента. В работе [29] проведено исследование энтальпии образования из оксидов трех несколько различающихся по составу образцов цирконата лантана растворением в молибдате натрия (3Na2O ⋅ 4MoO3) и борате свинца (2PbO ⋅ B2O3). Для La2Zr2O7 получено значение –107.3 ± 5.1 кДж/моль, а рассчитанная стандартная энтальпия образования из элементов составила Δf H 0(298.15 K) = = –4102.2 ± 6.0 кДж/моль. Такое отличие от предыдущих значений авторы [29] объясняют более совершенной техникой измерений, в которой расплав перемешивали инертным газом, а также использованием более точного значения энтальпии растворения моноклинной модификации диоксида циркония. Для сравнения в табл. 1 приведены различныe данныe по энтальпии образования цирконата лантана.
Таблица 1.
Стандартная энтальпия образования La2Zr2O7 из оксидов
| Метод | ${{\Delta }_{f}}H_{{{\text{ox}}}}^{0}$ (298.15 K), кДж/моль | Литература |
|---|---|---|
| Дроп-калориметрия растворения | –107.3 ± 5.1 | [29] |
| Расчетная оптимизация термохимических данных | –110.1 | [32] |
| Гальванические измерения | –133.8 ± 5 | [31] |
| Калориметрия растворения | –135.8 ± 6.4 | [27] |
| Калориметрия в кислородной бомбе | –125.9 ± 20 | [28] |
| Оценка из межатомного расстояния La–O | –125.2 | [30] |
Важными результатами [29] являются уточнение температуры плавления цирконата лантана (2295 ± 10 K), оценка энтальпии плавления (350 кДж/моль) и экспериментальное подтверждение отсутствия каких-либо тепловых эффектов, связанных с фазовым переходом пирохлор–флюорит.
Теплоемкость цирконата лантана впервые измерена в работе [30] методами адиабатической калориметрии в интервале 4–400 K и дроп-калориметрии в интервале от 500 до 900 K. Образец цирконата лантана для этих измерений получен твердофазным синтезом с прокаливанием при температуре 1773 K в течение 10 ч. Однофазность образца установлена методом РФА. В этой работе с использованием температурной зависимости теплоемкости рассчитаны термодинамические функции вплоть до 1000 K. Температурная зависимость теплоемкости цирконата лантана в области высоких температур, полученная дифференцированием выражения для приращения энтальпии, может быть представлена в виде уравнения:
(1)
$\begin{gathered} {{С}_{р}}({{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {({\text{мольK}})}}} \right. \kern-0em} {({\text{мольK}})}}) = 241.88260 + \\ + \,\,0.0513478T--{{3{\kern 1pt} {\kern 1pt} 034{\kern 1pt} {\kern 1pt} 999.2} \mathord{\left/ {\vphantom {{3{\kern 1pt} {\kern 1pt} 034{\kern 1pt} {\kern 1pt} 999.2} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}}. \\ \end{gathered} $В публикации [33] приведены результаты измерения высокотемпературной энтальпии методом дроп-калориметрии с использованием образца цирконата лантана, синтезированного из стехиометрической смеси оксидов, и рассчитанные значения теплоемкости в области высоких температур (888–1550 K) в виде уравнения Майера–Келли [34]:
(2)
$\begin{gathered} {{С}_{р}}({{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {({\text{мольK}})}}} \right. \kern-0em} {({\text{мольK}})}}) = \left( {260.811 \pm 8.289} \right) + \\ + \,\,\left( {1.78291 \pm 0.99973} \right) \times {{10}^{{--2}}}T - \\ --\,\,\left( {3.79680 \pm 0.53444} \right) \times {{{{{10}}^{6}}} \mathord{\left/ {\vphantom {{{{{10}}^{6}}} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}}. \\ \end{gathered} $В работе [35] для измерения высокотемпературной теплоемкости La2Zr2O7 синтезировали осаждением из раствора с последующим отжигом до 1873 K. Температурная зависимость теплоемкости построена на основании измерений в двух температурных интервалах: 293–313 (Micro-DSC II Setaram) и 573–1373 K (Pegasus 404 C Netzsch) с использованием данных по низкотемпературной теплоемкости [30]. Температурная зависимость теплоемкости La2Zr2O7 аппроксимирована в [35] в виде уравнения:
(3)
$\begin{gathered} {{С}_{р}}({{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {({\text{моль}}\,\,{\text{K}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{K}})}}) = 267.225 + \\ + \,\,0.015994T--{{4{\kern 1pt} {\kern 1pt} 275{\kern 1pt} {\kern 1pt} 180} \mathord{\left/ {\vphantom {{4{\kern 1pt} {\kern 1pt} 275{\kern 1pt} {\kern 1pt} 180} {{{Т}^{2}}}}} \right. \kern-0em} {{{Т}^{2}}}}. \\ \end{gathered} $Однофазный стехиометрический цирконат лантана со структурой пирохлора получен нами обратным осаждением с последующим отжигом при 1820 K. Образец идентифицирован методом РФА и показано отсутствие посторонних кристаллических фаз, определена пр. гр. Fd3m с параметром кубической решетки а = 10.801(9) Å, хорошо совпадающим с литературными данными: a = 10.808 Å [36]. Сглаженные результаты по измерению изобарной теплоемкости и рассчитанные термодинамические функции при 10–340 K приведены в табл. 2. Полученные нами данные удовлетворительно согласуются со значениями, приведенными в [30].
Таблица 2.
Температурная зависимость изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–340 K) для La2Zr2O7
| Т, K | $C_{p}^{0}$(T) | S 0(T) | Ф 0(Т) | Н 0(Т) – Н 0(0) |
|---|---|---|---|---|
| Дж/(моль K) | Дж/моль | |||
| 10 | 0.3665 | 0.04319 | 0.01079 | 0.3240 |
| 15 | 1.705 | 0.3510 | 0.05890 | 4.382 |
| 20 | 4.490 | 1.196 | 0.2260 | 19.40 |
| 25 | 8.305 | 2.590 | 0.5505 | 51.00 |
| 30 | 12.96 | 4.505 | 1.043 | 103.9 |
| 35 | 18.27 | 6.894 | 1.703 | 181.7 |
| 40 | 24.05 | 9.708 | 2.524 | 287.4 |
| 45 | 30.12 | 12.89 | 3.495 | 422.7 |
| 50 | 36.29 | 16.38 | 4.607 | 588.7 |
| 60 | 48.76 | 24.10 | 7.200 | 1014 |
| 70 | 61.21 | 32.55 | 10.21 | 1564 |
| 80 | 73.42 | 41.52 | 13.56 | 2237 |
| 90 | 85.24 | 50.86 | 17.18 | 3031 |
| 100 | 96.61 | 60.43 | 21.03 | 3941 |
| 110 | 107.5 | 70.16 | 25.05 | 4962 |
| 120 | 117.9 | 79.96 | 29.22 | 6089 |
| 130 | 127.7 | 89.79 | 33.50 | 7318 |
| 140 | 137.0 | 99.60 | 37.87 | 8642 |
| 150 | 145.7 | 109.3 | 42.31 | 10 060 |
| 160 | 153.7 | 119.0 | 46.80 | 11 550 |
| 170 | 161.2 | 128.6 | 51.33 | 13 130 |
| 180 | 168.3 | 138.0 | 55.88 | 14 780 |
| 190 | 174.8 | 147.3 | 60.45 | 16 490 |
| 200 | 181.0 | 156.4 | 65.02 | 18 270 |
| 210 | 186.8 | 165.3 | 69.58 | 20 110 |
| 220 | 192.4 | 174.2 | 74.14 | 22 010 |
| 230 | 197.7 | 182.8 | 78.68 | 23 960 |
| 240 | 202.6 | 191.4 | 83.19 | 25 960 |
| 250 | 206.5 | 199.7 | 87.69 | 28 010 |
| 260 | 210.1 | 207.9 | 92.15 | 30 090 |
| 270 | 213.8 | 215.9 | 96.59 | 32 210 |
| 280 | 217.4 | 223.7 | 101.0 | 34 360 |
| 290 | 220.7 | 231.4 | 105.4 | 36 550 |
| 298.15 | 223.2 | 237.6 | 108.9 | 38 360 |
| 300 | 223.7 | 238.9 | 109.7 | 38 780 |
| 310 | 226.5 | 246.3 | 114.0 | 41 030 |
| 320 | 228.9 | 253.5 | 118.2 | 43 310 |
| 330 | 231.2 | 260.6 | 122.4 | 45 610 |
| 340 | 233.2 | 267.6 | 126.6 | 47 930 |
Полученные методом ДСК результаты по измерению изобарной теплоемкости в интервале температур 300–1400 K описываются уравнением Майера–Келли:
(4)
$\begin{gathered} {{C}_{p}}({{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {({\text{моль}}\,\,{\text{K}})}}} \right. \kern-0em} {({\text{моль}}\,\,{\text{K}})}}) = 254.0403 + \\ + \,\,0.039840T--{{3{\kern 1pt} {\kern 1pt} 893{\kern 1pt} {\kern 1pt} 981} \mathord{\left/ {\vphantom {{3{\kern 1pt} {\kern 1pt} 893{\kern 1pt} {\kern 1pt} 981} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}},\,\,\,\,{{R}^{2}} = 0.99987. \\ \end{gathered} $Сопоставление значений теплоемкости в области высоких температур показало, что приведенные в литературе [30, 33, 35] зависимости и полученные нами значения согласуются в области 300–1000 K в пределах 5%.
Цирконат церия Ce2Zr2O7. Теплоемкость цирконата церия измерена в работе [30] на образце с параметром решетки a = 10.5877(19) Å в адиабатическом (4–400 K) и дроп-калориметре (500–900 K). В [37] получен образец со структурой пирохлора и параметром кубической решетки a = 10.7412(3) Å и проведены измерения теплоемкости гибридным адиабатическим релаксационным методом в интервале температур 0.4–305 K и с использованием дроп-калориметрии в интервале 531–1556 K. Полученные результаты значительно отличаются от приведенных ранее [30] значений. Исследователи [37] предположили, что авторам [30] не удалось избежать окисления церия в приготовленных образцах и частичного образования флюоритной фазы. Было показано, что пирохлор легко окисляется при 450–700 K и переходит во флюорит состава Ce2Zr2O7 + δ. Частичное медленное окисление с образованием флюорита происходит даже в атмосфере аргона при нагревании до 1573 K, поэтому результаты [30] для цирконата церия можно рассматривать как ошибочные. Это утверждается в работе [38] еще и на том основании, что эти данные не вписываются в общий тренд температурных зависимостей теплоемкости для серии (La–Gd)2Zr2O7, хотя, как будет показано ниже, этот критерий не является определяющим из-за вклада аномалии Шоттки, который индивидуален для каждого лантаноида, в общую величину теплоемкости.
Максимальная температура плавления Ce2Zr2O7, по литературным данным, составляет 2423 K. Энтальпия образования цирконата церия из оксидов при 273.15 K, полученная в [30] из межатомного расстояния Ce–O2, составила –121.1 кДж/моль, а с проведенной поправкой авторы рекомендовали значение –131.7 ± 6.5 кДж/моль. Других значений ${{\Delta }_{f}}H_{{{\text{ox}}}}^{0}$ для Ce2Zr2O7 в литературе не найдено.
Цирконат празеодима Pr2Zr2O7. Празеодим, так же как и церий, способен легко окисляться до состояния +4, его оксиду приписывают формулу Pr6O11, хотя в водных растворах празеодим существует исключительно в состоянии +3. Впервые цирконат празеодима со структурой пирохлора был получен соосаждением гидроксидов металлов водным раствором аммиака с последующим прокаливанием при ~1900 K. Рентгеновские исследования подтвердили получение соединения со структурой пирохлора и параметром ячейки а = 10.699 ± 0.001 Å [39].
Энтальпия образования Pr2Zr2O7 из оксидов оценена в работе [30] и составила –117 кДж/моль, с учетом введенной в этой работе поправки было предложено значение –127.3 ± 6.6 кДж/моль. Максимальная температура существования цирконата празеодима, по данным [39], составляет 2533 ± 30 K.
Об измерениях теплоемкости цирконата празеодима в литературе имеются сведения только для области “гелиевых” (0–15 K) температур на двух монокристаллических образцах с параметрами а = 10.72 Å [40, 41] и 10.6373(7) Å [42], выполненных с использованием Quantum Design Dynacool Physical Properties Measurement System (PPMS). В обоих случаях наблюдали максимум теплоемкости при 2–2.5 K, обусловленный магнитным превращением, которое вносит существенный вклад в абсолютную энтропию цирконата празеодима.
Нами выполнен синтез и проведены измерения изобарной теплоемкости цирконата празеодима со структурой пирохлора и параметром кристаллической решетки а = 10.699(4) Å, который соответствует литературным данным [39–41, 43]. Сглаженные значения изобарной теплоемкости и рассчитанные температурные зависимости (10–340 K) термодинамических функций приведены в табл. 3. Величины энтропии и приведенной энергии Гиббса даны с учетом вклада магнитного превращения при температурах <10 K по результатам [40, 41], наиболее соответствующим полученным нами значениям теплоемкости методом адиабатической калориметрии. Изобарная теплоемкость при 300–1400 K описывается уравнением:
(5)
$\begin{gathered} {{C}_{p}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 294.993 + \\ + \,\,0.039663T--{{5{\kern 1pt} {\kern 1pt} 889{\kern 1pt} {\kern 1pt} 477} \mathord{\left/ {\vphantom {{5{\kern 1pt} {\kern 1pt} 889{\kern 1pt} {\kern 1pt} 477} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}},\,\,\,\,{{R}^{2}} = 0.99985. \\ \end{gathered} $Таблица 3.
Температурная зависимость изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–340 K) для Pr2Zr2O7
| Т, K | $C_{p}^{0}$(T) | S 0(T) | Ф0(T) | Н 0(T) – Н 0(0) |
|---|---|---|---|---|
| Дж/(моль K) | Дж/моль | |||
| 10 | 1.499 | 6.0558 | 5.6765 | 3.793 |
| 15 | 3.604 | 7.037 | 5.9539 | 16.25 |
| 20 | 6.414 | 8.443 | 6.392 | 41.01 |
| 25 | 9.873 | 10.234 | 6.975 | 81.47 |
| 30 | 13.92 | 12.383 | 7.693 | 140.7 |
| 35 | 18.51 | 14.868 | 8.536 | 221.6 |
| 40 | 23.57 | 17.66 | 9.499 | 326.6 |
| 45 | 29.06 | 20.75 | 10.576 | 458.0 |
| 50 | 34.91 | 24.12 | 11.759 | 617.8 |
| 60 | 47.48 | 31.58 | 14.427 | 1029 |
| 70 | 60.84 | 39.89 | 17.46 | 1570 |
| 80 | 74.53 | 48.91 | 20.82 | 2247 |
| 90 | 87.95 | 58.47 | 24.47 | 3060 |
| 100 | 100.0 | 68.38 | 28.36 | 4001 |
| 110 | 110.4 | 78.40 | 32.46 | 5054 |
| 120 | 120.4 | 88.43 | 36.70 | 6207 |
| 130 | 130.5 | 98.47 | 41.07 | 7462 |
| 140 | 140.6 | 108.6 | 45.5 | 8818 |
| 150 | 150.3 | 118.6 | 50.1 | 10 270 |
| 160 | 159.3 | 128.6 | 54.7 | 11 820 |
| 170 | 167.6 | 138.5 | 59.3 | 13 460 |
| 180 | 175.3 | 148.3 | 64.0 | 15 170 |
| 190 | 182.3 | 158.0 | 68.7 | 16 960 |
| 200 | 188.8 | 167.5 | 73.4 | 18 820 |
| 210 | 195.1 | 176.8 | 78.1 | 20 730 |
| 220 | 202.0 | 186.1 | 82.8 | 22 720 |
| 230 | 210.1 | 195.2 | 87.4 | 24 780 |
| 240 | 216.0 | 204.3 | 92.1 | 26 920 |
| 250 | 221.3 | 213.3 | 96.8 | 29 110 |
| 260 | 225.3 | 222.0 | 101.4 | 31 350 |
| 270 | 229.7 | 230.6 | 106.1 | 33 620 |
| 280 | 234.2 | 239.1 | 110.7 | 35 940 |
| 290 | 238.6 | 247.4 | 115.3 | 38 300 |
| 298.15 | 242.0 | 254.0 | 118.9 | 40 260 |
| 300 | 242.7 | 255.5 | 119.8 | 40 710 |
| 310 | 246.9 | 263.6 | 124.3 | 43 160 |
| 320 | 251.4 | 271.5 | 128.8 | 45 650 |
| 330 | 256.3 | 279.3 | 133.2 | 48 190 |
| 340 | 261.0 | 287.0 | 137.7 | 50 780 |
Измерения теплоемкости Pr2Zr2O7 в области низких и высоких температур (10–1400 K) выполнены впервые.
Цирконат неодима Nd2Zr2O7. Цирконат неодима кристаллизуется в структуре пирохлора и, предположительно, имеет максимальную температуру перехода в высокотемпературный флюорит, равную 2623 K. Однако структура флюорита (в метастабильном состоянии) для состава Nd2O3 : 2ZrO2 может быть получена и синтезом обратным осаждением с нагревом до 1273 K.
Энтальпия образования Nd2Zr2O7 со структурой пирохлора из оксидов впервые была определена в [28] при 298.15 K и составила –110.9 кДж/моль, по оценке из межатомного расстояния Nd–O, выполненной в [30], она равна –112.9 кДж/моль, а с учетом поправки, внесенной в той же работе, составила –127.3 ± 6.6 кДж/моль.
Низкотемпературную теплоемкость цирконата неодима измеряли в [44] с помощью адиабатической калориметрии и гибридным адиабатическим релаксационным методом в интервале температур 0.45–400 K. Образцы готовили золь-гель методом с контролем фазового состава методом РФА. Плотность полученного образца равна 97% от теоретической, а рассчитанный параметр решетки a = 10.7 Å. В области самых низких температур авторы обнаружили аномалию теплоемкости, расположенную ниже 7.2 K. Максимум этой аномалии, зафиксированный в работе [45], составил 0.37 K. Энтропию аномалии авторы этой работы оценили равной Sanom = 5.67 Дж/(моль K) ≈ R ln 2. Однако в [44] отмечено, что это значение должно быть отнесено к формуле NdZrO3.5, а значит, при переходе к мольным величинам оно должно быть удвоено.
Термодинамические свойства цирконата неодима в области высоких температур описаны в работах [33, 35, 46].
В исследовании [33] температурная зависимость инкремента энтальпии цирконата неодима изучена методом дроп-калориметрии в интервале температур 298–1550 K:
(6)
$\begin{gathered} {{C}_{p}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = \left( {278.195 \pm 7.941} \right) + \\ + \,\,\left( {8.14421 \pm 1.11407} \right) \times {{10}^{{--2}}}Т - \\ --\,\,\left( {4.31176 \pm 0.47074} \right) \times {{{{{10}}^{6}}} \mathord{\left/ {\vphantom {{{{{10}}^{6}}} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}}. \\ \end{gathered} $Авторами [35] теплоемкость Nd2Zr2O7 исследована на образце, полученном осаждением из раствора с последующим прокаливанием до 1873 K. Измерения теплоемкости, выполненные методом ДСК в калориметрах Micro-DSC II Setaram (293–313 K) и Pegasus 404 C Netzsch (573–1373 K), в аналитическом виде представлены выражением:
(7)
$\begin{gathered} {{С}_{р}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 274.1864 + \\ + \,\,0.02736T--{{4{\kern 1pt} {\kern 1pt} 399{\kern 1pt} {\kern 1pt} 651} \mathord{\left/ {\vphantom {{4{\kern 1pt} {\kern 1pt} 399{\kern 1pt} {\kern 1pt} 651} {{{Т}^{2}}}}} \right. \kern-0em} {{{Т}^{2}}}}. \\ \end{gathered} $В работе [46] высокотемпературная теплоемкость Nd2Zr2O7, синтезированного золь-гель методом, определена с помощью дифференциальной сканирующей калориметрии на приборе Netzsch STA 409C и для температурного диапазона 300–1650 K представлена в виде уравнения:
(8)
$\begin{gathered} {{С}_{р}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 240.9 + 8.913Т \times {{10}^{{--2}}}-- \\ - \,\,2.070{{Т}^{2}} \times {{10}^{{--5}}}--2.926 \times {{{{{10}}^{6}}} \mathord{\left/ {\vphantom {{{{{10}}^{6}}} {{{Т}^{2}}}}} \right. \kern-0em} {{{Т}^{2}}}}. \\ \end{gathered} $В работе [47] высокотемпературная теплоемкость цирконата неодима, полученного отжигом при 1873 K, измерена в калориметре Netzsch STA 449C Jupiter в интервале 298–1050 K. Авторы сгладили полученные экспериментально величины уравнением:
(9)
$\begin{gathered} {{С}_{р}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 263.00 + \\ + \,\,3.525 \times {{10}^{{ - 2}}}T - {{3.999237} \mathord{\left/ {\vphantom {{3.999237} {{{{10}}^{6}}{{T}^{2}}}}} \right. \kern-0em} {{{{10}}^{6}}{{T}^{2}}}}. \\ \end{gathered} $Цирконат неодима со структурой пирохлора синтезирован нами из соответствующего прекурсора прокаливанием при температуре 1820 K. Дифракционные исследования показали, что получен образец со структурой пирохлора (Fd3m) и параметром a = 10.664(4) Å. В кристаллографической базе ICCD [48] для цирконата неодима предлагается значение (пирохлор) а = 10.666 Å.
Сглаженные данные по измеренной нами изобарной теплоемкости цирконата неодима и рассчитанные термодинамические функции при 10–340 K c учетом магнитных превращений ниже 16 K приведены в табл. 4. Наши данные по низкотемпературной теплоемкости Nd2Zr2O7 и результаты работы [44] удовлетворительно согласуются.
Таблица 4.
Температурная зависимость изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–340 K) для Nd2Zr2O7
| Т, K | $C_{p}^{0}$(T) | S 0(T) | Ф0(T) | Н 0(T) – Н 0(0) |
|---|---|---|---|---|
| Дж/(моль K) | Дж/моль | |||
| 10 | 0.2455 | 13.041 | 12.9802 | 0.6073 |
| 15 | 1.726 | 13.3758 | 13.0436 | 4.983 |
| 20 | 4.447 | 14.217 | 13.2206 | 19.94 |
| 25 | 8.237 | 15.599 | 13.5492 | 51.24 |
| 30 | 12.92 | 17.502 | 14.042 | 103.8 |
| 35 | 18.33 | 19.893 | 14.702 | 181.7 |
| 40 | 24.3 | 22.725 | 15.523 | 288.1 |
| 45 | 30.64 | 25.95 | 16.499 | 425.3 |
| 50 | 37.2 | 29.52 | 17.62 | 594.8 |
| 60 | 50.63 | 37.48 | 20.25 | 1034 |
| 70 | 64.14 | 46.30 | 23.34 | 1608 |
| 80 | 77.32 | 55.73 | 26.79 | 2315 |
| 90 | 89.91 | 65.57 | 30.55 | 3152 |
| 100 | 101.9 | 75.67 | 34.56 | 4111 |
| 110 | 113.2 | 85.92 | 38.76 | 5187 |
| 120 | 123.9 | 96.23 | 43.12 | 6374 |
| 130 | 134.1 | 106.6 | 47.60 | 7664 |
| 140 | 143.5 | 116.9 | 52.18 | 9053 |
| 150 | 152.4 | 127.2 | 56.83 | 10 530 |
| 160 | 160.6 | 137.2 | 61.54 | 12 100 |
| 170 | 168.3 | 147.2 | 66.28 | 13 740 |
| 180 | 175.5 | 153.0 | 71.04 | 15 460 |
| 190 | 182.1 | 166.7 | 75.82 | 17 250 |
| 200 | 188.3 | 176.2 | 80.6 | 19 100 |
| 210 | 194.1 | 185.5 | 85.37 | 21 020 |
| 220 | 199.6 | 194.6 | 90.13 | 22 990 |
| 230 | 204.7 | 203.6 | 94.86 | 25 010 |
| 240 | 209.6 | 212.4 | 99.58 | 27 080 |
| 250 | 214.2 | 221.1 | 104.3 | 29 200 |
| 260 | 218.5 | 229.6 | 108.9 | 31 360 |
| 270 | 222.6 | 237.9 | 113.6 | 33 570 |
| 280 | 226.5 | 246.1 | 118.2 | 35 810 |
| 290 | 230.2 | 254.1 | 122.7 | 38 100 |
| 298.15 | 233.0 | 260.5 | 126.4 | 39 980 |
| 300 | 233.6 | 261.9 | 127.2 | 40 420 |
| 310 | 236.8 | 269.7 | 131.7 | 42 770 |
| 320 | 239.8 | 277.2 | 136.1 | 45 150 |
| 330 | 242.7 | 284.7 | 140.5 | 47 560 |
| 340 | 245.3 | 291.9 | 144.9 | 50 000 |
Полученные нами методом ДСК данные по измерению изобарной теплоемкости Nd2Zr2O7 (пирохлор) в интервале 300–1400 K описываются уравнением:
(10)
$\begin{gathered} {{C}_{p}}_{{}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 280.474 + 0.030722T - \\ --\,\,{{4{\kern 1pt} {\kern 1pt} 880{\kern 1pt} {\kern 1pt} 963} \mathord{\left/ {\vphantom {{4{\kern 1pt} {\kern 1pt} 880{\kern 1pt} {\kern 1pt} 963} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}},\,\,\,\,{{R}^{2}} = 0.985361. \\ \end{gathered} $Анализ температурных зависимостей теплоемкости в области высоких температур показывает, что расхождение величин теплоемкости, полученных в [35, 46, 47] и нами, не превышает 3.5%, в то время как данные [33], вычисленные из температурной зависимости инкремента энтальпии, лежат несколько ниже.
Цирконат самария Sm2Zr2O7 [22]. Соединение состава Sm2Zr2O7 со структурой пирохлора имеет стандартную энтальпию образования из оксидов, равную –106.7 кДж/моль [28] при 298.15 K, и максимальную температуру существования 2353 K [12], а по данным [49] – 2213 K. При нагревании выше этой температуры наблюдается переход в структуру флюорита, температура плавления твердого раствора Sm2O3 ⋅ 2ZrO2 составляет 2648 K. Исследование [50] – это единственная работа, в которой даны результаты измерения низкотемпературной теплоемкости цирконата самария с параметром решетки а = 10.596 Å методом адиабатической калориметрии в интервале 60–300 K.
Низкотемпературная теплоемкость цирконата самария изучена методом релаксационной калориметрии (PPMS, Quantum Design) в интервале 0.5–300 K [51], но количественно оценить полученные в этой работе значения затруднительно, поскольку они представлены только в графическом виде. В этой работе показано, что в области <6 K имеется аномалия теплоемкости, связанная с магнитным превращением. По утверждению авторов [51], энтропия аномалии близка к 6 Дж/(K моль) ≈ R ln 2 в расчете на 1 г-атом самария, и при переходе к мольным значениям эта величина должна быть удвоена.
Об измерениях высокотемпературной теплоемкости методом ДСК сообщается в работе [35], где приведено аналитическое выражение для изобарной теплоемкости цирконата самария (пирохлор):
(11)
$\begin{gathered} {{С}_{р}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 312.528-- \\ - \,\,0.000238T--{{7{\kern 1pt} {\kern 1pt} 116{\kern 1pt} {\kern 1pt} 731} \mathord{\left/ {\vphantom {{7{\kern 1pt} {\kern 1pt} 116{\kern 1pt} {\kern 1pt} 731} {{{Т}^{2}}}}} \right. \kern-0em} {{{Т}^{2}}}}. \\ \end{gathered} $Необходимо отметить, что в области температур >1000 K экспериментально измеренная в работе [35] теплоемкость цирконата самария по не совсем понятной причине имеет практически постоянные значения. Авторы отметили этот факт, который противоречит теории, и предложили проверить значения выше 1000 K иным, более точным методом. Данные по удельной теплоемкости Sm2Zr2O7 в температурном диапазоне 300–1700 K приведены в работе [52], к сожалению, только в графическом виде. Энтальпия двух образцов системы Sm2O3–ZrO2 (30 и 50% Sm2O3) измерена в работе [53] методом дроп-калориметрии в интервале температур 470–1660 K и также приведена только в графической форме.
Для получения цирконата самария со структурой пирохлора прекурсор, синтезированный обратным осаждением, мы отжигали при 1770 K, параметр кубической решетки a = 10.577(3) Å, что согласуется с данными [54]. Наши калориметрические исследования в области низких температур проведены с помощью адиабатической и релаксационной калориметрии [22]. Сглаженные данные по изобарной теплоемкости и рассчитанные с учетом магнитных превращений ниже 10 K термодинамические функции (при 10–330 K) приведены в табл. 5. Сравнение теплоемкости при температурах <300 K показывает, что кривая Ср(Т) из работы [50] в области выше 220 K резко отклоняется от полученных нами значений и данных для цирконата лантана. Косвенно об удовлетворительном согласии данных [51] с полученными нами величинами можно судить по приведенной в этой работе зависимости аномальной теплоемкости Шоттки Sm2Zr2O7, которая практически совпадает с рассчитанной нами.
Таблица 5.
Температурная зависимость изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–330 K) для Sm2Zr2O7 [22]
| Т, K | $C_{p}^{0}$(T) | S 0(T) | Ф0(Т) | Н 0(Т) – Н 0(0) |
|---|---|---|---|---|
| Дж/(моль K) | Дж/моль | |||
| 10 | 0.5213 | 11.588 | 11.447 | 1.408 |
| 15 | 1.762 | 11.975 | 11.549 | 6.383 |
| 20 | 4.618 | 12.838 | 11.752 | 21.72 |
| 25 | 8.807 | 14.296 | 12.105 | 54.79 |
| 30 | 14.04 | 16.35 | 12.633 | 111.5 |
| 35 | 20.05 | 18.96 | 13.344 | 196.5 |
| 40 | 26.53 | 22.05 | 14.235 | 312.8 |
| 45 | 33.21 | 25.56 | 15.295 | 462.1 |
| 50 | 39.84 | 29.41 | 16.51 | 644.8 |
| 60 | 52.78 | 37.82 | 19.35 | 1108 |
| 70 | 65.18 | 46.9 | 22.63 | 1699 |
| 80 | 76.97 | 56.38 | 26.25 | 2410 |
| 90 | 88.13 | 66.09 | 30.14 | 3236 |
| 100 | 98.8 | 75.93 | 34.23 | 4171 |
| 110 | 109.1 | 85.84 | 38.47 | 5211 |
| 120 | 119.1 | 95.76 | 42.83 | 6352 |
| 130 | 128.8 | 105.6 | 47.28 | 7592 |
| 140 | 138.0 | 115.5 | 51.81 | 8926 |
| 150 | 146.6 | 125.3 | 56.38 | 10 350 |
| 160 | 154.7 | 135.1 | 61.0 | 11 860 |
| 170 | 162.2 | 144.7 | 65.6 | 13 440 |
| 180 | 169.2 | 154.1 | 70.3 | 15 100 |
| 190 | 175.8 | 163.5 | 74.96 | 16 820 |
| 200 | 181.9 | 172.6 | 79.62 | 18 610 |
| 210 | 187.6 | 181.7 | 84.26 | 20 460 |
| 220 | 192.9 | 190.5 | 88.89 | 22 360 |
| 230 | 197.9 | 199.2 | 93.50 | 24 320 |
| 240 | 202.5 | 207.7 | 98.09 | 26 320 |
| 250 | 206.9 | 216.1 | 102.6 | 28 370 |
| 260 | 211.0 | 224.3 | 107.1 | 30 460 |
| 270 | 214.8 | 232.3 | 111.6 | 32 580 |
| 280 | 218.5 | 240.2 | 116.1 | 34 750 |
| 290 | 222 | 247.9 | 120.5 | 36 950 |
| 298.15 | 224.7 | 254.1 | 124.0 | 38 770 |
| 300 | 225.3 | 255.5 | 124.9 | 39 190 |
| 310 | 228.6 | 262.9 | 129.2 | 41 460 |
| 320 | 231.8 | 270.2 | 133.5 | 43 760 |
| 330 | 234.9 | 277.4 | 137.7 | 46 100 |
Изобарная теплоемкость, полученная нами методом ДСК в диапазоне температур 300–1400 K, описывается уравнением:
(12)
$\begin{gathered} {{C}_{p}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 310.980 + 0.00266T-- \\ - \,\,{{7{\kern 1pt} {\kern 1pt} 765{\kern 1pt} {\kern 1pt} 115} \mathord{\left/ {\vphantom {{7{\kern 1pt} {\kern 1pt} 765{\kern 1pt} {\kern 1pt} 115} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}},\,\,\,\,{{R}^{2}} = {\text{ }}0.9997. \\ \end{gathered} $Расхождение в величинах теплоемкости, рассчитанных по уравнению (12), с данными [35] (уравнение (11)) не превышает 3%, что находится в пределах точности метода ДСК, а сопоставление с данными работ [52, 53] затруднительно.
Цирконат европия Eu2Zr2O7. Соединение Eu2Zr2O7 со структурой пирохлора характеризуется в работе [12] следующими параметрами: а = 10.554 Å, максимальная температура существования пирохлора T = 2353 K, энтальпия образования из оксидов – 80 кДж/моль, из элементов – 3941.0 кДж/моль при 298.15 K. Низкотемпературная теплоемкость измерена в работе [38] методами релаксационной и адиабатической калориметрии в диапазоне 0.3–400 K. Авторами зафиксирован рост теплоемкости при снижении температуры от 3 K, вызванный магнитным превращением. В работе приведено лишь графическое изображение температурной зависимости теплоемкости в этой области, которое не позволяет оценить вклад магнитного превращения в общую энтропию из этого эксперимента.
Высокотемпературная теплоемкость измерена методом ДСК с помощью калориметров Micro DSC II Setaram (293–313 K) и Pegasus 404C Netzsch (600–1300 K) в работе [55]. Авторы описали полученные экспериментальные точки двумя уравнениями:
(13)
$\begin{gathered} {{C}_{p}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 278.270737 + \\ + \,\,0.0416114128T--{{4{\kern 1pt} {\kern 1pt} 923{\kern 1pt} {\kern 1pt} 895.96} \mathord{\left/ {\vphantom {{4{\kern 1pt} {\kern 1pt} 923{\kern 1pt} {\kern 1pt} 895.96} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}}. \\ \end{gathered} $(14)
$\begin{gathered} {{C}_{p}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 356.38787 - \\ --\,\,0.03484T - {{21{\kern 1pt} {\kern 1pt} 195.00} \mathord{\left/ {\vphantom {{21{\kern 1pt} {\kern 1pt} 195.00} {{{Т}^{2}}}}} \right. \kern-0em} {{{Т}^{2}}}} + 9.10619 \times \\ \times \,\,{{10}^{{--6}}}{{Т}^{2}} + 3.35117 \times {{{{{10}}^{9}}} \mathord{\left/ {\vphantom {{{{{10}}^{9}}} {{{Т}^{3}}}}} \right. \kern-0em} {{{Т}^{3}}}}.~ \\ \end{gathered} $Следует отметить, что уравнение (13) идет симбатно зависимости, полученной по правилу Неймана–Коппа, но пересекает экспериментальную кривую, в то время как выражение (14) лучше описывает экспериментальные точки. Авторы работы [55] отметили существенное расхождение хода зависимостей (13) и (14). В области температур >1000 K экспериментальные значения теплоемкости Eu2Zr2O7 становятся практически постоянными, как и в случае Y2O3. По мнению авторов [55], такое поведение теплоемкости требует дополнительной проверки иным методом, например дроп-калориметрией.
Однофазный стехиометрический цирконат европия получен нами из соответствующего прекурсора отжигом при 1773 K в течение 4 ч. Образец идентифицирован методом РФА и показано отсутствие посторонних кристаллических фаз, пр. гр. Fd3m и параметр а = 10.544(3) Å хорошо совпадают с литературными данными (a = 10.5393 Å) [56]. Сглаженные данные по изобарной теплоемкости, полученные методом адиабатической калориметрии, и рассчитанные термодинамические функции при 10–340 K приведены в табл. 6 без учета вклада низкотемпературного магнитного превращения. Полученная нами температурная зависимость теплоемкости удовлетворительно согласуется с данными [38].
Таблица 6.
Температурная зависимость изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–340 K) для Eu2Zr2O7
| Т, K | $C_{p}^{0}$(T) | S 0(T) | Ф0(Т) | Н 0(Т) – Н 0(0) |
|---|---|---|---|---|
| Дж/(моль K) | Дж/моль | |||
| 10 | 0.8044 | 0.1841 | 0.06338 | 1.643 |
| 15 | 1.697 | 0.6323 | 0.2457 | 7.322 |
| 20 | 3.911 | 1.395 | 0.4828 | 20.86 |
| 25 | 7.228 | 2.606 | 0.8215 | 48.30 |
| 30 | 11.46 | 4.285 | 1.288 | 94.69 |
| 35 | 16.43 | 6.416 | 1.894 | 164.1 |
| 40 | 22.00 | 8.967 | 2.641 | 260.0 |
| 45 | 28.02 | 11.90 | 3.528 | 384.9 |
| 50 | 34.40 | 15.18 | 4.548 | 540.8 |
| 60 | 47.82 | 22.63 | 6.961 | 951.4 |
| 70 | 61.62 | 31.03 | 9.821 | 1498 |
| 80 | 75.35 | 40.16 | 13.06 | 2183 |
| 90 | 88.69 | 49.81 | 16.63 | 3004 |
| 100 | 101.5 | 59.82 | 20.47 | 3955 |
| 110 | 113.5 | 70.06 | 24.53 | 5031 |
| 120 | 124.8 | 80.43 | 28.77 | 6223 |
| 130 | 135.4 | 90.84 | 33.16 | 7524 |
| 140 | 145.2 | 101.2 | 37.67 | 8927 |
| 150 | 154.3 | 111.6 | 42.26 | 10 425 |
| 160 | 162.7 | 121.8 | 46.93 | 12 010 |
| 170 | 170.6 | 131.9 | 51.64 | 13 677 |
| 180 | 177.9 | 141.8 | 56.39 | 15 420 |
| 190 | 184.8 | 151.7 | 61.16 | 17 234 |
| 200 | 191.2 | 161.3 | 65.94 | 19 114 |
| 210 | 197.2 | 170.8 | 70.72 | 21 057 |
| 220 | 202.9 | 180.1 | 75.49 | 23 058 |
| 230 | 208.2 | 189.2 | 80.25 | 25 114 |
| 240 | 213.2 | 198.2 | 84.98 | 27 221 |
| 250 | 217.9 | 207.0 | 89.69 | 29 377 |
| 260 | 222.3 | 215.6 | 94.39 | 31 578 |
| 270 | 226.4 | 224.1 | 99.03 | 33 822 |
| 280 | 230.2 | 232.4 | 103.7 | 36 105 |
| 290 | 233.8 | 240.5 | 108.3 | 38 425 |
| 298.15 | 236.5 | 247.1 | 112.0 | 40 340 |
| 300 | 237.2 | 248.5 | 112.8 | 40 779 |
| 310 | 240.4 | 256.3 | 117.3 | 43 167 |
| 320 | 243.5 | 264.0 | 121.8 | 45 586 |
| 330 | 246.5 | 271.6 | 126.2 | 48 036 |
| 340 | 249.7 | 279.0 | 130.6 | 50 517 |
Высокотемпературная теплоемкость в интервале 330–1400 K, по нашим экспериментальным данным, описывается уравнением:
(15)
$\begin{gathered} {{C}_{p}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 276.014 + \\ + \,\,0.045072T--{{5{\kern 1pt} {\kern 1pt} 032{\kern 1pt} {\kern 1pt} 876} \mathord{\left/ {\vphantom {{5{\kern 1pt} {\kern 1pt} 032{\kern 1pt} {\kern 1pt} 876} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}},\,\,\,\,{{R}^{2}} = 0.99994. \\ \end{gathered} $Расхождение величин теплоемкости, рассчитанных по уравнению (15), от данных работы [55] составляет не более 1%.
Цирконат гадолиния Gd2Zr2O7. Цирконат гадолиния в структуре пирохлора кристаллизуется с параметром кубической решетки а = 10.528 Å, стандартная энтальпия образования из оксидов составляет 75.8 кДж/моль, а максимальная температура плавления флюоритной фазы равна 2453 K [12]. Температура фазового перехода пирохлор–флюорит экспериментально не определена из-за низкой скорости диффузии компонентов и, по расчетам [13], составляет ~1760 K.
Низкотемпературная теплоемкость в интервале 10–400 K измерена методом адиабатической калориметрии в [38]. Для этого синтезирован образец цирконата гадолиния со структурой пирохлора (а = 10.51 Å). Теплоемкость измерена в интервале 0.36–29 K с помощью PPMS. Дополнительный вклад в термодинамические свойства вносит магнитное превращение при “гелиевых” температурах, энтропию которого авторы [38] оценивают значительной величиной – 35.430 Дж/(моль K) = = 1.025(2Rln8), тогда как вклад решеточных колебаний в области 0–20 K составляет всего лишь Slat = 1.321 Дж/(моль K). Низкотемпературная теплоемкость в области гелиевых температур была также измерена в работе [57] на образце со структурой пирохлора и параметром а = 10.522 Å. Вклад в энтропию магнитных превращений с максимумом при 0.771 K в области 0–20 K авторы определили как S = 2R ln 8, что хорошо коррелирует с полученной для GdPO4 величиной избыточной энтропии 16.61 (~R ln 8) Дж/(моль K) [58].
В литературе имеются данные об измерении теплоемкости образца цирконата гадолиния Gd2Zr2O7 в области высоких температур (298–1200 K) методом дифференциальной сканирующей калориметрии [59]. Образец для этих измерений был приготовлен осаждением из раствора с последующим отжигом при температуре 1873 K в течение 10 ч. Полученный образец исследовали методом РФА, но информация о его структуре и параметрах решетки в статье отсутствует. Приведенная в этой работе температурная зависимость теплоемкости Gd2Zr2O7 лежит несколько ниже данных по низкотемпературной теплоемкости [38] и выражена в виде уравнения:
(16)
$\begin{gathered} {{C}_{p}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 255.25 + 2.372 \times \\ \times \,\,{{10}^{{--2}}}T--4.442392 \times {{{{{10}}^{6}}} \mathord{\left/ {\vphantom {{{{{10}}^{6}}} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}}. \\ \end{gathered} $В [47] предложено несколько иное выражение:
(17)
$\begin{gathered} {{C}_{p}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 257.69 + 2.363 \times \\ \times \,\,{{10}^{{ - 2}}}T - 4.580695 \times {{{{{10}}^{6}}} \mathord{\left/ {\vphantom {{{{{10}}^{6}}} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}}. \\ \end{gathered} $Цирконат гадолиния со структурой пирохлора синтезирован нами обратным осаждением с последующим отжигом при температуре 1770 K в течение 4 ч. Полученная дифрактограмма соответствует пр. гр. Fd3m с параметром ячейки а = 10.518(8) Å, который совпадает с данными PDF, где а = 10.5169 Å [60]. Посторонние отражения на дифрактограмме отсутствуют.
Сглаженные данные по изобарной теплоемкости и рассчитанные термодинамические функции в области 50–340 K с учетом магнитных превращений приведены в табл. 7. Полученные нами значения теплоемкости согласуются с данными [38] в пределах 2%.
Таблица 7.
Температурная зависимость изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–340 K) для Gd2Zr2O7
| Т, K | $C_{p}^{0}$(T) | S 0(T) | Ф0(Т) | Н 0(Т) – Н 0(0) |
|---|---|---|---|---|
| Дж/(моль K) | Дж/моль | |||
| 50 | 34.57 | 54.02 | 40.59 | 672.3 |
| 60 | 45.46 | 61.28 | 43.44 | 1072 |
| 70 | 56.75 | 69.13 | 46.56 | 1583 |
| 80 | 68.17 | 77.45 | 49.91 | 2207 |
| 90 | 79.5 | 86.14 | 53.46 | 2946 |
| 100 | 90.57 | 95.09 | 57.18 | 3796 |
| 110 | 101.3 | 104.22 | 61.05 | 4756 |
| 120 | 111.5 | 113.48 | 65.04 | 5820 |
| 130 | 121.3 | 122.79 | 69.13 | 6985 |
| 140 | 130.5 | 132.12 | 73.3 | 8244 |
| 150 | 139.2 | 141.4 | 77.54 | 9592 |
| 160 | 147.3 | 150.6 | 81.84 | 11 025 |
| 170 | 155 | 159.8 | 86.16 | 12 537 |
| 180 | 162.2 | 168.8 | 90.50 | 14 123 |
| 190 | 168.9 | 177.8 | 94.87 | 15 779 |
| 200 | 175.2 | 186.6 | 99.25 | 17 500 |
| 210 | 181.2 | 195.3 | 103.6 | 19 282 |
| 220 | 186.9 | 203.9 | 108.0 | 21 123 |
| 230 | 192.2 | 212.3 | 112.4 | 23 018 |
| 240 | 197.3 | 220.6 | 116.7 | 24 966 |
| 250 | 202.1 | 228.7 | 121.0 | 26 963 |
| 260 | 206.6 | 236.8 | 125.3 | 29 006 |
| 270 | 210.9 | 244.6 | 129.6 | 31 094 |
| 280 | 214.9 | 252.4 | 133.9 | 33 223 |
| 290 | 218.7 | 260.0 | 138.1 | 35 391 |
| 298.15 | 221.5 | 266.1 | 141.5 | 37 185 |
| 300 | 222.1 | 267.5 | 142.3 | 37 596 |
| 310 | 225.2 | 274.8 | 146.5 | 39 832 |
| 320 | 227.9 | 282.0 | 150.6 | 42 098 |
| 330 | 230.1 | 289.0 | 154.7 | 44 388 |
| 340 | 231.8 | 295.9 | 158.8 | 46 698 |
Высокотемпературная теплоемкость цирконата гадолиния, полученная методом ДСК в интервале температур 330–1400 K, описывается уравнением вида:
(18)
$\begin{gathered} {{C}_{p}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 261.902 + \\ + \,\,0.04764T--{{5{\kern 1pt} {\kern 1pt} 113{\kern 1pt} {\kern 1pt} 180} \mathord{\left/ {\vphantom {{5{\kern 1pt} {\kern 1pt} 113{\kern 1pt} {\kern 1pt} 180} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}},\,\,\,\,{{R}^{2}} = 0.99997. \\ \end{gathered} $Сравнение значений теплоемкости показывает, что измеренные нами величины теплоемкости для высокотемпературной области в диапазоне 300–340 K хорошо согласуются с данными адиабатической калориметрии, в то время как значения, приведенные в [47, 59], лежат систематически ниже.
Твердые растворы Ln2O3 ⋅ 2ZrO2 (Ln = Tb–Tm) со структурой флюорита
Изобарная теплоемкость стехиометрических твердых растворов Ln2O3 : 2ZrO2 (Ln = Tb–Tm), соответствующих по составу цирконатам лантаноидов Ln2Zr2O7 (Ln = La–Gd), в широкой области температур определена нами впервые, кроме теплоемкости Dy2O3 ⋅ 2ZrO2, измеренной при 273–873 K в работе [61].
Образцы твердых растворов состава Ln2O3 ⋅ ⋅ 2ZrO2 (Ln = Tb–Tm) получены методом обратного осаждения с последующей сушкой и отжигом при 1773–1873 K. Все вещества исследованы методами РФА, СЭМ и РЭС для подтверждения фазовой чистоты и степени закристаллизованности. Полученные образцы кристаллизуются в структуре разупорядоченного флюорита (Fm3m). Параметры а кубической структуры удовлетворительно совпадают с имеющимися в литературе значениями (табл. 8). Образцы не содержат посторонних фаз, и размеры кристаллитов не менее 100 нм.
Таблица 8.
Параметры кристаллических решеток твердых растворов Ln2O3 ⋅ 2ZrO2. Структура дефектного флюорита (Fm3m)
Измерения изобарной теплоемкости проводили методом адиабатической калориметрии выше температур магнитных переходов (>10 K) и при расчете термодинамических функций вклад этих превращений не учитывали. Сглаженные значения теплоемкости и термодинамические функции твердых растворов состава Ln2O3 ⋅ 2ZrO2 (Ln = Tb–Tm) приведены в табл. 9–12. Полное описание эксперимента и полученных результатов приведено в работах [18, 23, 67]. Высокотемпературная теплоемкость измерена методом ДСК и аппроксимирована уравнением Майера–Келли [34], коэффициенты которого содержатся в табл. 13, как для твердых растворов, так и для цирконатов лантаноидов. В работе [61] выполнен синтез Dy2O3 ⋅ 2ZrO2 структурного типа флюорита, которому авторы ошибочно приписали формулу соединения Dy2Zr2O7. Теплоемкость измерена методом ДСК на калориметре Netzsch DSC204 в интервале 273–873 K и получена следующая зависимость (в пересчете на моль {Dy2O3 ⋅ 2ZrO2}):
(19)
$\begin{gathered} {{C}_{p}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 184.04{\text{ }} + \\ + \,\,0.15263T--9.7489255 \times {{10}^{{--6}}}{{T}^{2}}. \\ \end{gathered} $Таблица 9.
Температурная зависимость изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–340 K) для Dy2O3 ⋅ 2ZrO2 [18]
| Т, K | $C_{p}^{0}$(T) | S 0(T) | Ф0(Т) | Н 0(Т) – Н 0(0) |
|---|---|---|---|---|
| Дж/(моль K) | Дж/моль | |||
| 10 | 1.234 | 0.2108 | 0.03572 | 1.751 |
| 15 | 2.578 | 0.9372 | 0.2004 | 11.05 |
| 20 | 5.287 | 2.184 | 0.5299 | 33.08 |
| 25 | 9.625 | 3.922 | 1.027 | 72.39 |
| 30 | 14.48 | 6.118 | 1.686 | 133.0 |
| 35 | 19.73 | 8.737 | 2.501 | 218.3 |
| 40 | 25.50 | 11.74 | 3.465 | 331.2 |
| 45 | 31.69 | 15.10 | 4.568 | 474.0 |
| 50 | 38.17 | 18.77 | 5.803 | 648.5 |
| 60 | 51.59 | 26.91 | 8.630 | 1097 |
| 70 | 64.89 | 35.87 | 11.87 | 1680 |
| 80 | 77.21 | 45.36 | 15.46 | 2392 |
| 90 | 88.72 | 55.12 | 19.32 | 3221 |
| 100 | 100.4 | 65.07 | 23.40 | 4167 |
| 110 | 111.8 | 75.17 | 27.65 | 5228 |
| 120 | 122.7 | 85.37 | 32.03 | 6401 |
| 130 | 132.9 | 95.60 | 36.53 | 7679 |
| 140 | 142.5 | 105.8 | 41.11 | 9057 |
| 150 | 151.6 | 116.0 | 45.76 | 10 530 |
| 160 | 160.2 | 126.0 | 50.46 | 12 090 |
| 170 | 168.3 | 136.0 | 55.20 | 13 730 |
| 180 | 175.9 | 145.8 | 59.96 | 15 450 |
| 190 | 182.9 | 155.5 | 64.74 | 17 250 |
| 200 | 189.4 | 165.1 | 69.52 | 19 110 |
| 210 | 195.4 | 174.4 | 74.29 | 21 030 |
| 220 | 201.0 | 183.7 | 79.05 | 23 020 |
| 230 | 206.0 | 192.7 | 83.80 | 25 050 |
| 240 | 210.5 | 201.6 | 88.52 | 27 130 |
| 250 | 214.5 | 210.3 | 93.22 | 29 260 |
| 260 | 218.2 | 218.7 | 97.88 | 31 420 |
| 270 | 221.6 | 227.0 | 102.5 | 33 620 |
| 280 | 224.7 | 235.2 | 107.1 | 35 850 |
| 290 | 227.6 | 243.1 | 111.7 | 38 110 |
| 298.15 | 229.9 | 249.4 | 115.3 | 39 980 |
| 300 | 230.4 | 250.9 | 116.2 | 40 400 |
| 310 | 233.1 | 258.5 | 120.6 | 42 720 |
| 320 | 235.8 | 265.9 | 125.1 | 45 070 |
| 330 | 238.6 | 273.2 | 129.4 | 47 440 |
| 340 | 241.5 | 280.4 | 133.8 | 49 840 |
Таблица 10.
Температурная зависимость изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–330 K) для Ho2O3 ⋅ 2ZrO2 [18]
| Т, K | $C_{p}^{0}$(T) | S 0(T) | Ф0(Т) | Н 0(Т) – Н 0(0) |
|---|---|---|---|---|
| Дж/(моль K) | Дж/моль | |||
| 10 | 3.411 | 0.8664 | 0.2186 | 6.478 |
| 15 | 5.201 | 2.375 | 0.6720 | 25.54 |
| 20 | 8.101 | 4.276 | 1.329 | 58.94 |
| 25 | 11.82 | 6.485 | 2.134 | 108.8 |
| 30 | 16.26 | 9.018 | 3.065 | 178.6 |
| 35 | 21.55 | 11.91 | 4.118 | 272.8 |
| 40 | 27.37 | 15.17 | 5.292 | 395.0 |
| 45 | 33.41 | 18.74 | 6.585 | 546.9 |
| 50 | 39.48 | 22.57 | 7.990 | 729.1 |
| 60 | 51.60 | 30.84 | 11.10 | 1185 |
| 70 | 63.62 | 39.70 | 14.55 | 1761 |
| 80 | 75.47 | 48.97 | 18.27 | 2456 |
| 90 | 87.07 | 58.53 | 22.21 | 3269 |
| 100 | 98.37 | 68.30 | 26.33 | 4197 |
| 110 | 109.3 | 78.19 | 30.59 | 5236 |
| 120 | 119.9 | 88.16 | 34.97 | 6382 |
| 130 | 130.0 | 98.16 | 39.45 | 7632 |
| 140 | 139.7 | 108.1 | 44.00 | 8981 |
| 150 | 148.8 | 118.1 | 48.61 | 10 420 |
| 160 | 157.3 | 128.0 | 53.26 | 11 950 |
| 170 | 165.4 | 137.8 | 57.94 | 13 570 |
| 180 | 172.9 | 147.4 | 62.65 | 15 260 |
| 190 | 179.8 | 157.0 | 67.36 | 17 020 |
| 200 | 186.2 | 166.3 | 72.07 | 18 850 |
| 210 | 192.1 | 175.6 | 76.78 | 20 750 |
| 220 | 197.4 | 184.6 | 81.48 | 22 690 |
| 230 | 202.1 | 193.5 | 86.16 | 24 690 |
| 240 | 206.4 | 202.2 | 90.82 | 26 740 |
| 250 | 210.3 | 210.7 | 95.44 | 28 820 |
| 260 | 213.8 | 219.0 | 100.0 | 30 940 |
| 270 | 217.0 | 227.2 | 104.6 | 33 090 |
| 280 | 219.9 | 235.1 | 109.1 | 35 280 |
| 290 | 222.6 | 242.9 | 113.6 | 37 490 |
| 298.15 | 224.7 | 249.1 | 117.2 | 39 320 |
| 300 | 225.1 | 250.5 | 118.0 | 39 730 |
| 310 | 227.5 | 257.9 | 122.4 | 42 000 |
| 320 | 229.9 | 265.2 | 126.8 | 44 280 |
| 330 | 232.2 | 272.3 | 131.1 | 46 590 |
Таблица 11.
Температурная зависимость изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (6–340 K) для Er2O3 ⋅ 2ZrO2 [23]
| Т, K | $C_{p}^{0}$(T) | S 0(T) | Ф0(Т) | Н 0(Т) – Н 0(0) |
|---|---|---|---|---|
| Дж/(моль K) | Дж/моль | |||
| 6 | 0.804 | 0.268 | 0.067 | 1.212 |
| 8 | 1.910 | 0.365 | 0.159 | 3.811 |
| 10 | 3.723 | 1.252 | 0.313 | 9.388 |
| 15 | 8.395 | 3.638 | 0.998 | 39.60 |
| 20 | 13.25 | 6.714 | 2.032 | 93.64 |
| 25 | 18.23 | 10.20 | 3.312 | 172.3 |
| 30 | 23.31 | 13.98 | 4.771 | 276.1 |
| 35 | 28.44 | 17.95 | 6.368 | 405.5 |
| 40 | 33.57 | 22.09 | 8.073 | 560.5 |
| 45 | 38.66 | 26.33 | 9.865 | 741.1 |
| 50 | 43.68 | 30.67 | 11.73 | 947.0 |
| 60 | 53.57 | 39.51 | 15.62 | 1433 |
| 70 | 63.33 | 48.50 | 19.67 | 2018 |
| 80 | 73.05 | 57.59 | 23.84 | 2700 |
| 90 | 82.80 | 66.76 | 28.10 | 3479 |
| 100 | 92.52 | 75.99 | 32.43 | 4356 |
| 110 | 102.2 | 85.26 | 36.81 | 5329 |
| 120 | 111.6 | 94.55 | 41.23 | 6398 |
| 130 | 120.8 | 103.9 | 45.69 | 7561 |
| 140 | 129.8 | 113.1 | 50.18 | 8814 |
| 150 | 138.3 | 122.4 | 54.69 | 10 160 |
| 160 | 146.4 | 131.6 | 59.20 | 11 580 |
| 170 | 154.0 | 140.7 | 63.73 | 13 080 |
| 180 | 161.0 | 149.7 | 68.26 | 14 660 |
| 190 | 167.4 | 158.6 | 72.78 | 16 300 |
| 200 | 173.1 | 167.3 | 77.28 | 18 000 |
| 210 | 178.3 | 175.9 | 81.78 | 19 760 |
| 220 | 183.4 | 184.3 | 86.24 | 21 570 |
| 230 | 188.6 | 192.6 | 90.69 | 23 430 |
| 240 | 193.9 | 200.7 | 95.10 | 25 340 |
| 250 | 198.5 | 208.7 | 99.49 | 27 300 |
| 260 | 202.5 | 216.6 | 103.8 | 29 310 |
| 270 | 206.1 | 224.3 | 108.2 | 31 350 |
| 280 | 209.2 | 231.8 | 112.4 | 33 430 |
| 290 | 212.0 | 239.2 | 116.7 | 35 540 |
| 298.15 | 214.1 | 245.1 | 120.1 | 37 270 |
| 300 | 214.6 | 246.5 | 120.9 | 37 670 |
| 310 | 217.1 | 253.5 | 125.1 | 39 830 |
| 320 | 219.7 | 260.5 | 129.2 | 42 010 |
| 330 | 222.4 | 267.3 | 133.3 | 44 220 |
| 340 | 225.3 | 273.9 | 137.3 | 46 460 |
Таблица 12.
Температурная зависимость изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–340 K) для Tm2O3 ⋅ ⋅ 2ZrO2 [67]
| Т, K | $C_{p}^{0}$(T) | S 0(T) | Ф0(Т) | Н 0(Т) – Н 0(0) |
|---|---|---|---|---|
| Дж/(моль K) | Дж/моль | |||
| 10 | 3.844 | 2.131 | 0.6251 | 15.06 |
| 15 | 5.897 | 4.051 | 1.446 | 39.09 |
| 20 | 8.702 | 6.115 | 2.351 | 75.29 |
| 25 | 12.19 | 8.419 | 3.330 | 127.2 |
| 30 | 16.29 | 11.00 | 4.389 | 198.2 |
| 35 | 20.92 | 13.85 | 5.533 | 291.0 |
| 40 | 26.03 | 16.97 | 6.765 | 408.2 |
| 45 | 31.53 | 20.35 | 8.084 | 551.9 |
| 50 | 37.36 | 23.97 | 9.490 | 724.0 |
| 60 | 49.70 | 31.86 | 12.55 | 1159 |
| 70 | 62.50 | 40.48 | 15.92 | 1720 |
| 80 | 75.19 | 49.66 | 19.56 | 2408 |
| 90 | 87.30 | 59.22 | 23.43 | 3221 |
| 100 | 98.78 | 69.02 | 27.50 | 4152 |
| 110 | 109.7 | 78.95 | 31.72 | 5195 |
| 120 | 120.0 | 88.94 | 36.07 | 6344 |
| 130 | 129.8 | 98.93 | 40.53 | 7593 |
| 140 | 139.0 | 108.9 | 45.05 | 8937 |
| 150 | 147.8 | 118.8 | 49.64 | 10 370 |
| 160 | 156.1 | 128.6 | 54.27 | 11 890 |
| 170 | 163.9 | 138.3 | 58.92 | 13 490 |
| 180 | 171.2 | 147.9 | 63.60 | 15 170 |
| 190 | 178.2 | 157.3 | 68.28 | 16 910 |
| 200 | 184.6 | 166.6 | 72.97 | 18 730 |
| 210 | 190.6 | 175.8 | 77.65 | 20 610 |
| 220 | 196.2 | 184.8 | 82.31 | 22 540 |
| 230 | 201.4 | 193.6 | 86.96 | 24 530 |
| 240 | 206.2 | 202.3 | 91.58 | 26 570 |
| 250 | 210.6 | 210.8 | 96.18 | 28 650 |
| 260 | 214.6 | 219.1 | 100.8 | 30 780 |
| 270 | 218.3 | 227.3 | 105.3 | 32 940 |
| 280 | 221.7 | 235.3 | 109.8 | 35 140 |
| 290 | 224.9 | 243.1 | 114.3 | 37 380 |
| 298.15 | 227.2 | 249.4 | 117.9 | 39 220 |
| 300 | 227.7 | 250.8 | 118.7 | 39 640 |
| 310 | 230.4 | 258.3 | 123.1 | 41 930 |
| 320 | 232.8 | 265.7 | 127.4 | 44 250 |
| 330 | 235.1 | 272.9 | 131.7 | 46 590 |
| 340 | 237.2 | 279.9 | 136.0 | 48 950 |
Таблица 13.
Коэффициенты уравнения Майера–Келли: Cp (Дж/(моль K)) = a + b T + c/T 2 (300–1400 K)
| Состав | a | b | c |
|---|---|---|---|
| Пирохлор | |||
| La2Zr2O7 | 254.040 | 0.039840 | –3 893 980 |
| Pr2Zr2O7 | 294.993 | 0.039663 | –5 889 478 |
| Nd2Zr2O7 | 280.474 | 0.003072 | –4 880 963 |
| Sm2Zr2O7 | 310.980 | 0.002660 | –7 765 115 |
| Eu2Zr2O7 | 276.014 | 0.045072 | –5 032 875 |
| Gd2Zr2O7 | 261.902 | 0.047638 | –5 113 179 |
| Флюорит | |||
| Tb2O3 ⋅ 2ZrO2 | 247.804 | 0.064295 | –3 401 784 |
| Dy2O3 ⋅ 2ZrO2 | 243.098 | 0.053306 | –2 197 936 |
| Ho2O3 ⋅ 2ZrO2 | 243.760 | 0.044837 | –2 884 037 |
| Er2O3 ⋅ 2ZrO2 | 225.040 | 0.091458 | –3 597 968 |
| Tm2O3 ⋅ 2ZrO2 | 261.652 | 0.027350 | –3 811 304 |
Сравнение с нашими данными показывает совпадение значений при 298.15 K и значительное завышение теплоемкости при высоких температурах (практически на 30% при 873 K). Такой сильный рост теплоемкости в области 273–873 K нехарактерен для твердых растворов Ln2O3 ⋅ 2ZrO2 (Ln = Tb–Tm), и приведенное уравнение (19) вряд ли соответствует реальным значениям изобарной теплоемкости.
В табл. 14 содержатся значения термодинамических функций при 273.15 K для всех изученных веществ.
Таблица 14.
Стандартные термодинамические свойства исследованных образцов (298.15 K)
| Состав | $C_{p}^{0}$(T) | S 0(T) | Ф0(Т) | Н 0(Т) – Н 0(0) |
|---|---|---|---|---|
| Дж/(моль K) | Дж/моль | |||
| Пирохлор | ||||
| La2Zr2O7 | 223.2 ± 0.4 | 237.6 | 108.9 | 38 360 |
| Pr2Zr2O7 | 242.0 ± 0.5 | 254.0 | 118.9 | 40 260 |
| Nd2Zr2O7 | 233.0 ± 0.5 | 260.5 | 126.4 | 39 980 |
| Sm2Zr2O7 | 224.7 ± 0.4 | 254.1 | 124.0 | 37 185 |
| Eu2Zr2O7 | 236.5 ± 0.4 | 247.1 | 112.0 | 40 340 |
| Gd2Zr2O7 | 221.5 ± 0.5 | 266.1 | 141.5 | 39 832 |
| Флюорит | ||||
| Tb2O3 ⋅ 2ZrO2 | 224.7 ± 0.4 | 242.2 | 112.8 | 38 580 |
| Dy2O3 ⋅ 2ZrO2 | 229.9 ± 0.5 | 249.4 | 115.3 | 39 980 |
| Ho2O3 ⋅ 2ZrO2 | 224.7 ± 0.4 | 249.1 | 117.2 | 39 320 |
| Er2O3 ⋅ 2ZrO2 | 214.1 ± 0.4 | 245.1 | 120.1 | 37 270 |
| Tm2O3 ⋅ 2ZrO2 | 227.2 ± 0.5 | 249.4 | 117.9 | 39 220 |
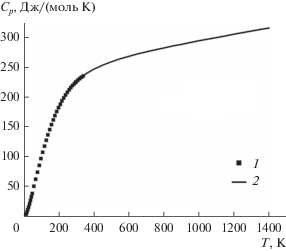
Изобарная теплоемкость Tb2O3 ⋅ 2ZrO2 приведена на рис. 1 в графической форме и будет опубликована в ближайшее время.
Твердые растворы Yb2O3 ⋅ 2ZrO2 и Lu2O3 ⋅ 2ZrO2
В литературе имеются противоречивые сведения о возможности получения цирконатов иттербия Yb2O3 ⋅ 2ZrO2 и лютеция Lu2O3 ⋅ 2ZrO2 со структурой флюорита. Наши попытки получить твердые растворы Yb2O3 ⋅ 2ZrO2 и Lu2O3 ⋅ 2ZrO2 прокаливанием прекурсоров с необходимыми стехиометрическими соотношениями компонентов при температурах 1800–1900 K для последующих измерений теплоемкости показали, что, по данным РФА, полученные образцы не были однофазными и содержали смесь оксидов, включая как Yb2O3 ⋅ 2ZrO2 (флюорит), так и Ln4Zr3O12. Тем не менее имеется сообщение об измерении высокотемпературной теплоемкости твердого раствора Yb2O3 ⋅ 2ZrO2 [59], который авторы ошибочно принимали за химическое соединение – цирконат иттербия Yb2Zr2O7. Образец получен осаждением из раствора с последующим прокаливанием при 1873 K в течение 10 ч. Судя по приведенной в этой работе дифрактограмме, образец имеет структуру флюорита и не может считаться соединением типа Ln2Zr2O7. Теплоемкость измеряли в калориметре Netzsch 409С Jupiter в интервале температур 298–1200 K. Температурная зависимость теплоемкости описана авторами уравнением:
(20)
$\begin{gathered} {{C}_{p}}\left( {{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right. \kern-0em} {\left( {{\text{моль}}\,\,{\text{K}}} \right)}}} \right) = 271.89 + 3.585 \times \\ \times \,\,{{10}^{{--2}}}T--4.527539 \times {{{{{10}}^{6}}} \mathord{\left/ {\vphantom {{{{{10}}^{6}}} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}}. \\ \end{gathered} $Оценить степень достоверности этого выражения не представляется возможным.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В настоящей работе представлены данные по измерению изобарной теплоемкости и рассчитанные на ее основе термодинамические функции в широком диапазоне температур для большинства цирконатов лантаноидов Ln2Zr2O7 (Ln = Pr–Gd) и твердых растворов Ln2O3 · 2ZrO2 (Ln = Tb–Tm) в сравнении с результатами, полученными разными авторами. Показано хорошее взаимное соответствие наших данных для цирконатов лантаноидов со структурой пирохлора, что также должно свидетельствовать о достоверности впервые полученных результатов для твердых растворов оксидов лантаноидов и циркония со структурой флюорита. Естественно, что при наличии достаточно достоверных данных по теплоемкости возникает вопрос не только об анализе, но и об установлении определенных закономерностей в термодинамических свойствах в ряду цирконатов лантаноидов со структурой пирохлора и твердых растворов с близкой структурой флюорита.
Анализ особенностей электронного строения лантаноидов и результаты по изучению свойств их соединений показывают, что теплоемкость этих соединений включает в себя ряд составляющих (вкладов). За исключением диамагнитных соединений лантана и лютеция, имеющих незаполненную или полностью заполненную f-орбиталь, соединения лантаноидов претерпевают при изменении температуры переходы из одного магнитного состояния в другое. Цирконаты, так же как и другие сложные оксиды лантаноидов, при охлаждении переходят из парамагнитного в антиферромагнитное состояние в области очень низких температур (как правило, ниже 10 K). Энтропия магнитных переходов достаточно хорошо прогнозируется с помощью модели Больцмана Smagn = R ln(g0) = R ln(n1/n2) (n1 и n2 – число возможных состояний в разупорядоченной и упорядоченной фазах) для процессов типа “порядок–беспорядок”. Эти превращения протекают в достаточно узком температурном интервале и имеют небольшие значения энтальпии, которыми можно пренебречь при расчете изменения энтальпии при стандартных условиях (нулевом избыточном давлении и температуре 298.15 K), в то время как энтропия, рассчитанная по уравнению:
при малых значениях температуры, является значимой при более высоких температурах, в том числе комнатной. Это превращение достаточно хорошо описано для цирконата гадолиния в работе [38], где показано, что аномалия фиксируется в диапазоне 0–10 K, а энтропия в диапазоне превращения, рассчитанная из температурной зависимости теплоемкости, составляет(22)
$\begin{gathered} {{S}^{0}}\left( {{\text{G}}{{{\text{d}}}_{{\text{2}}}}{\text{Z}}{{{\text{r}}}_{{\text{2}}}}{{{\text{O}}}_{7}}} \right) = S_{{{\text{lat}}}}^{0} + S_{{{\text{anom}}}}^{0} = \\ = 1.321 + 35.430 = 36.751\,\,{{{\text{Дж}}} \mathord{\left/ {\vphantom {{{\text{Дж}}} {{\text{(моль}}\,\,{\text{K)}}}}} \right. \kern-0em} {{\text{(моль}}\,\,{\text{K)}}}}. \\ \end{gathered} $Поскольку основной мультиплет гадолиния представляется как 8S7/2, вырожденность g0 составляет 8, энтропия $S_{{{\text{anom}}}}^{0}$ должна быть равна 2R ln 8 = 34.58 Дж/(K моль), что очень близко к экспериментально полученному значению 35.43 Дж/(моль K).
Вторым существенным вкладом в термодинамические свойства соединений лантаноидов, имеющих частично заполненную f-орбиталь, является аномалия Шоттки, возникающая вследствие расщепления электронных уровней под действием электрического поля кристалла (эффект Штарка). Теплоемкость этой аномалии описывается формулой:
(23)
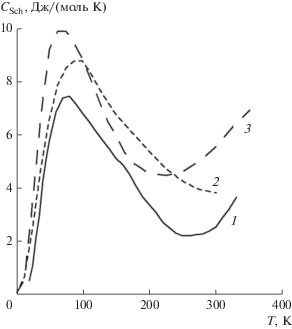
$\begin{gathered} {{{{C}_{x}}} \mathord{\left/ {\vphantom {{{{C}_{x}}} R}} \right. \kern-0em} R} = {{\left\{ {\sum\limits_i {{{g}_{i}}{{{({{{{\varepsilon }_{i}}} \mathord{\left/ {\vphantom {{{{\varepsilon }_{i}}} {kT}}} \right. \kern-0em} {kT}})}}^{2}}} \exp ({{ - {{\varepsilon }_{i}}} \mathord{\left/ {\vphantom {{ - {{\varepsilon }_{i}}} {kT}}} \right. \kern-0em} {kT}}} \right\}} \mathord{\left/ {\vphantom {{\left\{ {\sum\limits_i {{{g}_{i}}{{{({{{{\varepsilon }_{i}}} \mathord{\left/ {\vphantom {{{{\varepsilon }_{i}}} {kT}}} \right. \kern-0em} {kT}})}}^{2}}} \exp ({{ - {{\varepsilon }_{i}}} \mathord{\left/ {\vphantom {{ - {{\varepsilon }_{i}}} {kT}}} \right. \kern-0em} {kT}}} \right\}} Z}} \right. \kern-0em} Z} - \\ - \,\,{{\left[ {{{\left\{ {\sum\limits_i {{{g}_{i}}({{{{\varepsilon }_{i}}} \mathord{\left/ {\vphantom {{{{\varepsilon }_{i}}} {kT}}} \right. \kern-0em} {kT}})} \exp ({{ - {{\varepsilon }_{i}}} \mathord{\left/ {\vphantom {{ - {{\varepsilon }_{i}}} {kT}}} \right. \kern-0em} {kT}})} \right\}} \mathord{\left/ {\vphantom {{\left\{ {\sum\limits_i {{{g}_{i}}({{{{\varepsilon }_{i}}} \mathord{\left/ {\vphantom {{{{\varepsilon }_{i}}} {kT}}} \right. \kern-0em} {kT}})} \exp ({{ - {{\varepsilon }_{i}}} \mathord{\left/ {\vphantom {{ - {{\varepsilon }_{i}}} {kT}}} \right. \kern-0em} {kT}})} \right\}} Z}} \right. \kern-0em} Z}} \right]}^{2}}, \\ \end{gathered} $Величины этого вклада различны при разных температурах и зависят от конкретных энергий уровней того или иного лантаноида. Форма кривой теплоемкости в области низких температур (<298 K) может иметь как один, так и несколько максимумов или даже не достигать максимального значения (как у соединений европия). Поскольку аномальный вклад зависит как от свойств лантаноида, так и от строения кристаллической решетки, его вид для различных фаз может несколько отличаться. В качестве примера можно привести вид аномалий Шоттки для сульфида (Sm2S3) и цирконата самария (Sm2Zr2O7), рассчитанных по модели Веструма [68] (рис. 2).
При наличии у лантаноидов достаточно большого количества уровней с разной энергией (от десятков до нескольких тысяч обратных сантиметров) аномальная теплоемкость Шоттки, являющаяся следствием некооперативного эффекта, будет проявляться во всем температурном диапазоне существования этих соединений. Вклад избыточной теплоемкости, связанный с аномалией Шоттки, может быть также оценен как разность полной теплоемкости соединения лантаноида и теплоемкости кристаллической решетки. По модели Веструма [70], учитывающей эффект лантаноидного сжатия, решеточная теплоемкость для изоструктурных соединений вычисляется по уравнению:
(24)
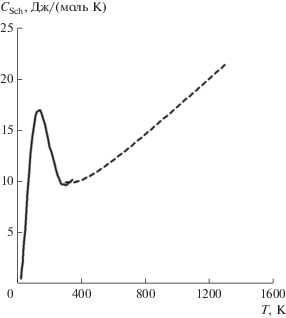
$\begin{gathered} {{С}_{р}}\left( {{\text{lat}},{\text{ LnX}}} \right) = \left( {1--f} \right){{C}_{p}}\left( {{\text{lat}},{\text{ LaX}}} \right) + \\ + \,\,f{{C}_{p}}\left( {{\text{lat}},{\text{ LuX}}} \right), \\ \end{gathered} $На рис. 3 представлена избыточная теплоемкость цирконата неодима в широком диапазоне температур, определенная с помощью модели Веструма. В качестве исходных данных для расчета решеточной теплоемкости выбраны диамагнитный La2Zr2O7 и парамагнитный Gd2Zr2O7, у которого f-оболочка наполовину заселена. Видно, что на начальной стадии кривая имеет максимум, а затем происходит постоянное увеличение аномальной теплоемкости за счет высокочастотных вкладов.
В связи с близкой к линейной зависимостью решеточной теплоемкости от ионного радиуса становится понятно, что попытки найти корреляцию между мольной теплоемкостью при конкретной температуре и атомным номером (или ионным радиусом) лантаноида вряд ли будут продуктивными и сводятся, фактически, к анализу температурных зависимостей аномалий Шоттки, влияние на теплоемкость которых меняется весьма значительно по мере роста температуры.
ЗАКЛЮЧЕНИЕ
Суммированы и проанализированы имеющиеся в литературе и полученные нами данные по термодинамическим свойствам цирконатов лантаноидов со структурой пирохлора и твердых растворов со структурой флюорита, а также получены изобарные теплоемкости и рассчитанные на их основе сглаженные температурные зависимости приращения энтальпии, энтропии и приведенной энергии Гиббса для 11 соединений Ln2Zr2O7 и твердых растворов Ln2O3 ⋅ 2ZrO2 в широком интервале температур. Установлено, что в изученном температурном интервале пирохлоры Ln2Zr2O7 (Ln = La, Pr, Sm, Eu, Gd) и флюориты Ln2O3 ⋅ 2ZrO2 (Ln = Tb, Ho, Er, Tm) не имеют аномалий теплоемкости и теплового поведения, свидетельствующих о протекании фазовых превращений. Учтен вклад в энтропию и приведенную энергию Гиббса низкотемпературных магнитных превращений в случае пирохлоров, за исключением цирконата европия. Проанализировано влияние вклада аномалии Шоттки в изобарную теплоемкость лантаноидов.
Полученные данные могут быть использованы для термодинамических расчетов и оптимизации процессов получения высокотемпературных теплозащитных и конструкционных материалов.
Список литературы
Fergus J.W. // Met. Mater. Trans. E. 2014. V. 1. P. 118.
Wu J., Wei X., Padture N.P. et al. // J. Am. Ceram. Soc. 2002. V. 85. P. 3031.
Zhang H., Sun K., Xu Q. et al. // J. Rare Earth. 2009. V. 27. P. 222.
Wang J., Pan W., Xu Q. et al. // Key Eng. Mater. 2005. V. 280–283. P. 1503.
Qin Y., Wang J., Pan W. et al. // Key Eng. Mater. 2007. V. 336–338. P. 1764.
Sohn J.M., Woo S.I. // Catalys. Lett. 2002. V. 79. P. 45.
Zhang R., Xu Q., Pan W. et al. // Key Eng. Mater. 2007. V. 336–338. P. 420.
Шляхтина А.В., Щербакова Л.Г. // Электрохимия. 2012. Т. 48. № 1. С. 3. [Shlyakhtina A.V., Shcherbakova L.G. // Russ. J. Electrochem. 2012. V. 48. P. 1.]
Shlyakhtina A.V., Kolbanev I.V., Khotko A.V. et al. // Inorg. Mater. 2005. V. 41. № 8. P. 975.
McCauley R.A., Hummel F.A. // J. Lumin. 1973. V. 6. P. 105.
Tuller H.L. // J. Phys. Chem. Solids. 1994. V. 55. P. 1393.
Арсеньев П.А., Глушкова В.Б., Евдокимов А.А. и др. Соединения редкоземельных элементов. Цирконаты, гафнаты, ниобаты, танталаты, антимонаты. М.: Наука, 1985. 261 с.
Rushton M.J.D., Grimes R.W., Stanek C.R. et al. // J. Mat. Res. 2004. V. 19. P. 1603.
Blanchard P.E.R., Clements R., Kennedy B.J. et al. // Inorg. Chem. 2012. V. 51. P. 13237.
Chiu C.-W., Lee Y.-H., Sheu H.-S. et al. // J. Chinese Chem. Soc. 2010. V. 57. P. 925.
Leither J., Voňka P., Sedmidubsky D. et al. // Thermochim. Acta. 2010. V. 497. P. 7.
Andrievskaya E.R. // J. Eur. Ceram. Soc. 2008. V. 28. P. 2363.
Гагарин П.Г., Тюрин А.В., Гуськов В.Н. и др. // Неорган. материалы. 2017. Т. 53. С. 64. [Gagarin P.G., Tyurin A.V., Guskon V.N. et al. // Inorg. Mater. 2017. V. 53. P. 86.]
Попов В.В., Петрунин В.Ф., Коровин С.А. и др. // Журн. неорган. химии. 2011. Т. 56. С. 1617. [Popov V.V., Petrunin V.F., Korovin S.A. et al. // Russ. J. Inorg. Chem. 2011. V. 56. P. 1538.]
Попов В.В., Зубавичус Я.В., Менушенков А.П. и др. // Журн. неорган. химии. 2014. Т. 59. С. 431. [Popov V.V., Zubavichus Ya.V., Menushenkov A.P. et al. // Russ. J. Inorg. Chem. 2014. V. 59. P. 279.]
Popov V.V., Menushenkov A.P., Gaynanov B.R. et al. // J. Phys.: Conf. Ser. 2017. V. 941. P. 012 079.
Гагарин П.Г., Тюрин А.В., Гуськов В.Н. и др. // Неорган. материалы. 2017. Т. 53. С. 632. [Gagarin P.G., Tyurin A.V., Guskon V.N. et al. // Inorg. Mater. 2017. V. 53. P. 619.]
Гагарин П.Г., Тюрин А.В., Гуськов В.Н. и др. // Неорган. материалы. 2017. Т. 53. № 9. С. 963. [Gagarin P.G., Tyurin A.V., Guskon V.N. et al. // Inorg. Mater. 2017. V. 53. P. 944.]
Wieser M.E. // Pure Appl. Chem. 2006. V. 78. P. 2051.
Gurevich V.M., Gorbunov V.E., Gavrichev K.S. et al. // Geochem. Int. 1999. V. 37. P. 367.
Iorish V.S., Tolmach P.I. // J. Phys. Chem. 1986. V. 60. P. 2583.
Bolech M., Cordfunke E.H.P., Janssen F.J.J.G. et al. // J. Am. Ceram. Soc. 1995. V. 78. № 8. P. 2257.
Корнеев В.Р., Глушкова В.Б., Келер Е.К. // Изв. АН СССР. Неорган. материалы. 1971. Т. 7. С. 886. [Korneev V.R., Glushkova V.B., Keler E.K. // IzV. AN SSSR. Inorg. Mater. 1971. V. 7. P. 886.]
Radha A.V., Ushakov S.V., Navrotsky A. // J. Mater. Res. 2009. V. 24. № 11. P. 3350.
Bolech M., Cordfunke E.H.P., van Genderen A.C.G. et al. // J. Phys. Chem. Solids. 1997. V. 58. № 3. P. 433.
Jacob K.T., Dasguta N., Waseda Y. // J. Am. Ceram. Soc. 1998. V. 81. P. 1926.
Wang C., Fabrichnaya O., Zinkevich M. // Calphad. 2008. V. 32. P. 111.
Sedmidubsky D., Beneŝ O., Konings R.J.M. // J. Chem. Thermodyn. 2005. V. 37. P. 1098.
Maier G., Kelley K.K. // J. Am. Chem. Soc. 1932. V. 54. P. 3243.
Fabrichnaya O., Kriegel M.J., Seidel J. // Thermochim. Acta. 2011. V. 526. P. 50.
ICCD PDF 01-074-8764.
Popa K., Konings R.J.M., Wastin F. // J. Phys. Chem. Solids. 2008. V. 69. P. 70.
Lutique S., Javorsky P., Konings R.J.M. et al. // J. Chem. Thermodyn. 2004. V. 36. P. 609.
Фу-Канг Ф., Кузнецов А.К., Келер Е.К. // Изв. АН СССР. Неорган. материалы. 1963. Т. 4. С. 585. [Fu-Kang F., Kuznetsov A.K., Keler E.K. // Izv. AN SSSR. Inorg. Mater. 1963. V. 4. P. 585.]
Kimura K., Nakatsuji S., Wen J.-J. et al. // Nature Comm. 2013. V. 4. № 1.
Matsuhira K., Sekine C., Paulsen et al. // J. Phys: Conference Series. 2009. V. 145. P. 012 031.
Hallas A. Ho2Ge2O7 and Pr2Zr2O7: a tale of two spin ices. 2013.
ICCD PDF 01-078-7481.
Lutique S., Javorsky P., Konings R.J.M. et al. // J. Chem. Thermodyn. 2003. V. 35. P. 955.
Blöte H.W., Wielinga R.F., Huiskamp W.J. // Physica. 1969. V. 43. P. 549.
Lutique S., Konings R.J.M., Rondinella V.V. et al. // J. Alloys Compd. 2003. V. 352. P. 1.
Liu Z.-G., Quyang J.H., Wang B.H. et al. // J. Alloys Compd. 2009. V. 475. P. 21.
ICCD PDF2 Number 01-078-5956.
Rouanet A. // Rev. Int. Hautes Temp. Refract. 1971. V. 8. P. 161.
Kopan A.R., Gorbachuk M.P., Lakiza S.M. et al. // Powder Metallurgy and Metal Ceramics. 2010. V. 49. P. 317.
Singh S., Saha S., Dhar S.R. et al. // Phys. Rev. B: Condens. Matter Mater. Phys. 2008. V. 77. P. 054408-1.
Liu Z.-G., Quyang J.H., Wang B.H. et al. // Ceram. Int. 2009. V. 35. P. 791.
Wang Ch., Zinkevich M., Aldinger F. // J. Am. Ceram. Soc. 2007. V. 90. P. 2210.
ICCD PDF 01-075-8266.
Fabrichnaya O., Kriegel M.J., Pavlychkov D. et al. // Thermochim. Acta. 2013. V. 558. P. 74.
ICCD PDF 01-075-8268.
Durand A.M., Klavins P., Corruccini L.P. // J. Phys.: Condens. Matter. 2008. V. 20. P. 1.
Thiriet C., Konings R.J.M., Javorsky P. et al. // J. Chem. Thermodyn. 2005. V. 37. P. 131.
Liu Z.-G., Quyang J.H., Zho Y. // Bull. Mater. Sci. 2009. V. 32. P. 603.
ICCD PDF2 Number 01-075-8269.
Qiang X., Wei P., Jingdong W. et al. // Mater. Lett. 2005. V. 59. P. 2804.
Зоз Е.И., Фомичев Е.Н., Калашник А.А., Елисеева Г.Г. // Журн. неорган. химии. 1982. Т. 27. С. 54. [Zoz E.I., Fomichvev E.N., Kalashnik A.A, Eliseeva G.G. // Russ. J. Inorg. Chem. 1982. V. 27. P. 37.]
ICCD PDF 01-078-1293.
ICCD PDF 01-078-1294.
ICCD PDF 01-078-1299.
Портной К.И., Тимофеева Н.И., Салибеков С.Е., Романович И.В. // Изв. АН СССР. Неорган. материалы. 1972. Т. 8. С. 358 [Portnoi K.I., Timofeeva N.I., Salibekov S.E., Romanovich I.V. // IzV. AN SSSR. Inorg. Mater. 1972. V. 8. P. 358.]
Гагарин П.Г., Тюрин А.В., Гуськов В.Н. и др. // Журн. неорган. химии. 2018. Т. 63. С. 1458. [Gagarin P.G., Tyurin A.V., Guskov V.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1478.]
Westrum E.F. Jr. // J. Therm. Anal. Calorim. 1985. V. 30. 1209.
Shaviv R., Westrum E.F. Jr., Gruber J.B. et al. // J. Chem. Phys. 1992. V. 96. P. 6149.
Chirico R.D., Westrum E.F. Jr. // J. Chem. Thermodyn. 1980. V. 12. P. 311.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии