Журнал неорганической химии, 2019, T. 64, № 1, стр. 63-71
КВАНТОВО-ХИМИЧЕСКИЙ РАСЧЕТ МОЛЕКУЛЯРНЫХ СТРУКТУР МЕТАЛЛОКЛАСТЕРОВ Al2Cu3 И Al2Ag3 МЕТОДОМ DFTД. В. Чачков, О. В. Михайлов
Д. В. Чачков 1, 2, О. В. Михайлов 1, 2, *
1 Казанский национальный исследовательский технологический университет
420015 Казань, ул. К. Маркса, 68, Россия
2 Казанское отделение Межведомственного суперкомпьютерного центра РАН – филиал
Научно-исследовательского института системных исследований РАН
420111 Казань, ул. Лобачевского, 2/31, Россия
* E-mail: ovm@kstu.ru
Поступила в редакцию 10.04.2017
После доработки 04.07.2018
Принята к публикации 16.04.2018
Аннотация
С использованием гибридного метода функционала плотности (DFT) в приближении OPBE/TZVP и программы Gaussian 09 рассчитаны геометрические параметры молекулярных структур алюминий-медных и алюминий-серебряных металлокластеров стехиометрического состава Al2Cu3 и Al2Ag3. Установлено, что каждый из этих металлокластеров может существовать в восьми структурных модификациях, значительно различающихся по устойчивости и геометрическим параметрам. Приведены длины связей, валентные и торсионные (двугранные) углы для каждой из этих модификаций.
ВВЕДЕНИЕ
Среди наночастиц, содержащих элементные металлы, особый интерес представляют те, которые состоят из двух и более различных p- и d-элементов и для которых теоретически можно ожидать появления новых свойств, не присущих наночастицам, состоящим из атомов металлов одной разновидности. К числу интересных объектов подобного типа относятся p,d-гетероядерные металлокластеры, содержащие в качестве p-металла алюминий, а в качестве d-металла медь и серебро и имеющие важное практическое значение. Ранее [1] методом функционала плотности в варианте OPBE/TZVP нами был проведен квантово-химический расчет основных параметров молекулярных структур (длин связей металл–металл, валентных и торсионных (двугранных) углов) алюминий-железных металлокластеров стехиометрического состава Al2Fe3. Представляло также интерес изучить, как при одном и том же стехиометрическом составе природа другого металла оказывает влияние на число возможных модификаций металло-кластера и их взаимную устойчивость. В качестве объектов исследования нами выбраны металлокластеры стехиометрического состава Al2Cu3 и Al2Ag3, в состав которых помимо алюминия входят d-элементы I группы Периодической системы Д.И. Менделеева. Выбор именно пятиатомных кластеров связан с тем, что двух- и трехатомные металло-кластеры с точки зрения структурной химии не представляют особого интереса ввиду тривиальности их структур, тетраядерные кластеры дают относительно малый набор модификаций, не позволяющий проследить влияние природы металла на их общее количество, специфику и относительную устойчивость. Насколько нам известно, квантово-химические расчеты структур алюминий-медных и алюминий-серебряных металло-кластеров, в частности пятиатомных указанного выше состава, с использованием метода функционала плотности до сих пор не проводились; в связи с этим настоящая работа посвящена выявлению возможных структур вышеуказанных химических соединений.
МЕТОД РАСЧЕТА
Использовали метод функционала плотности (DFT), сочетающий негибридный функционал OPBE [2, 3], который в случае соединений 3p- и 3d-элементов дает достаточно точное соотношение энергетической стабильности высокоспинового и низкоспинового состояний и надежно характеризует основные геометрические параметры молекулярных структур указанных соединений [3–7], и стандартный расширенный валентно-расщепленный базис TZVP, описанный в [8, 9]. Для расчета кластеров Al2Ag3 использовали базис QZP [10–12] и программу Gaussian 09 [13]. Как и в [1, 14–16], соответствие найденных стационарных точек минимумам энергии во всех случаях доказывалось расчетом вторых производных энергии по координатам атомов; при этом все равновесные структуры, соответствовавшие точкам минимума на поверхностях потенциальной энергии, имели лишь вещественные положительные значения частот. Расчет параметров молекулярных структур при мультиплетностях, отличных от 1, всегда проводили неограниченным методом (UHF); при мультиплетности 1 – ограниченным методом (RHF). При мультиплетности 1 применяли также расчет неограниченным методом в сочетании с опцией GUESS = Mix; полученные в этом случае результаты всегда были аналогичны результатам, полученным с использованием ограниченного метода. Все квантово-химические расчеты проведены в Казанском отделении Межведомственного суперкомпьютерного центра РАН – филиале Научно-исследовательского института системных исследований РАН (http://kbjscc.knc.ru).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
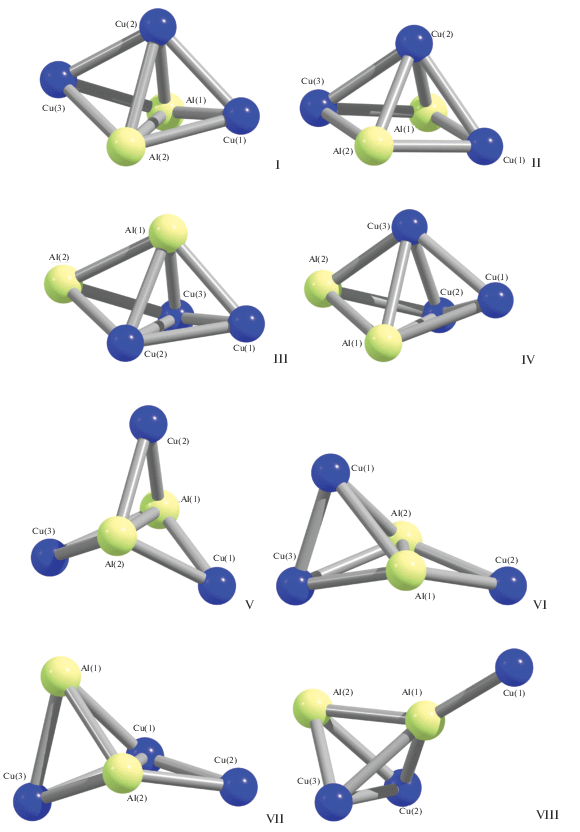
Проведенное нами квантово-химическое моделирование структур алюминий-медных и алюминий-серебряных металлокластеров с указанным выше химическим составом выявило возможность существования восьми форм как для металлокластера Al2Cu3, так и для металлокластера Al2Ag3 (рис. 1, 2). Структурные данные для Al2Cu3 представлены в табл. 1, из которой видно, что в 7 структурах реализуется прямая валентная связь Al–Al; единственным исключением является структура Al2Cu3 (II). Также в семи из восьми структур, за исключением структуры Al2Cu3 (V), имеется одна связь Cu–Cu и как минимум пять связей Al–Cu. Рассматриваемые нами металлокластеры обладают значительным числом связей металл–металл (от семи до девяти), причем в трех из восьми модификаций их число лишь на единицу меньше максимального их количества в соединениях типа Al2M3 (10) (M – металл). Относительные энергии этих структур представлены в табл. 2. Как видно из приведенных данных, наиболее устойчивой оказывается модификация Al2Cu3 (I), общее число связей металл–металл в которой равно 9. Характерно, что эта модификация обладает не самой высокой спиновой мультиплетностью (4), а более низкой (2); при этом модификации со спиновой мультиплетностью 4, а именно Al2Cu3 (II), Al2Cu3 (IV) и Al2Cu3 (VI), имеют и значительно бóльшие полные энергии, чем модификации со спиновой мультиплетностью 2.
Таблица 1.
Длины связей металл–металл, валентные и торсионные углы в молекулярных структурах кластеров Al2Cu3
| Структура | Al2Cu3 (I) | Al2Cu3 (II) | Al2Cu3 (III) | Al2Cu3 (IV) |
| Длины связей металл–металл, пм* | ||||
| Al1Al2 | 271.1 | (338.3) | 259.0 | 271.2 |
| Al1Cu1 | 244.1 | 244.1 | 241.3 | 247.9 |
| Al1Cu2 | 254.2 | 244.9 | 244.0 | 263.9 |
| Al1Cu3 | 244.1 | 244.1 | 244.0 | 263.9 |
| Al2Cu1 | 244.1 | 244.1 | (400.8) | (409.8) |
| Al2Cu2 | 254.2 | 244.9 | 244.8 | 248.2 |
| Al2Cu3 | 244.1 | 244.1 | 244.8 | 248.2 |
| Cu1Cu3 | (384.1) | (351.9) | 247.6 | 248.0 |
| Cu2Cu3 | 243.1 | 247.0 | 263.8 | 233.0 |
| Cu1Cu2 | 243.1 | 247.0 | 247.6 | 248.0 |
| Валентные углы, град** | ||||
| Cu1Al1Cu2 | 58.3 | 60.7 | 61.4 | 57.9 |
| Cu1Al2Cu2 | 58.3 | 60.7 | (35.8) | (34.3) |
| Cu1Al1Al2 | 56.3 | (46.1) | 106.5 | 104.2 |
| Cu1Al2Al1 | 56.3 | (46.1) | (35.3) | (35.9) |
| Cu2Al1Al2 | 57.8 | (46.3) | 58.2 | 55.2 |
| Cu2Al2Al1 | 57.8 | (46.3) | 57.9 | 60.9 |
| Al1Cu1Al2 | 67.4 | 87.7 | (38.3) | (39.9) |
| Al1Cu2Al2 | 64.4 | 87.4 | 64.0 | 63.9 |
| Al1Cu3Al2 | 67.4 | 87.7 | 64.0 | 63.9 |
| Cu1Al1Cu3 | 103.7 | 92.2 | 61.4 | 57.9 |
| Cu1Al2Cu3 | 103.7 | 92.2 | (35.8) | (34.3) |
| Cu1Cu3Cu2 | (37.8) | (44.6) | 57.8 | 62.0 |
| Cu2Al1Cu3 | 58.3 | 60.7 | 65.4 | 52.4 |
| Cu2Al2Cu3 | 58.3 | 60.7 | 65.2 | 56.0 |
| Cu1Cu2Cu3 | (104.4) | 90.9 | 57.8 | 62.0 |
| Торсионные (двугранные) углы, град*** | ||||
| Cu1Al2Al1Cu3 | –142.0 | (–177.6) | (39.5) | (32.5) |
| Cu2Al2Al1Cu3 | –71.0 | (–88.8) | 79.0 | 65.0 |
| Cu1Cu3Cu2Al1 | (38.6) | (53.3) | 71.1 | 65.8 |
| Cu1Cu3Cu2Al2 | (–38.6) | (–53.3) | 149.1 | 138.7 |
| Cu1Al1Al2Cu2 | 142.0 | (88.8) | 39.5 | 32.5 |
| Cu1Cu2Al1Al2 | 67.5 | (55.8) | 135.1 | 142.0 |
| Cu1Cu2Al2Al1 | –67.5 | (–55.8) | (–39.0) | –34.0 |
| Cu2Cu3Al2Al1 | –70.0 | (–56.0) | 66.3 | 72.8 |
| Структура | Al2Cu3 (V) | Al2Cu3 (VI) | Al2Cu3 (VII) | Al2Cu3 (VIII) |
| Длины связей металл–металл, пм* | ||||
| Al1Al2 | 278.1 | 267.6 | 256.0 | 256.9 |
| Al1Cu1 | 242.8 | 254.4 | 248.9 | 234.2 |
| Al1Cu2 | 242.8 | 247.1 | (405.3) | 240.9 |
| Al1Cu3 | 242.8 | 254.4 | 249.9 | 240.9 |
| Al2Cu1 | 242.8 | 254.4 | 244.5 | (472.7) |
| Al2Cu2 | 242.8 | 247.1 | 238.3 | 244.0 |
| Структура | Al2Cu3 (V) | Al2Cu3 (VI) | Al2Cu3 (VII) | Al2Cu3 (VIII) |
| Al2Cu3 | 242.8 | 254.4 | 245.3 | 244.0 |
| Cu1Cu3 | (344.8) | 232.5 | 245.4 | (449.3) |
| Cu2Cu3 | (344.8) | (407.2) | (406.1) | 261.2 |
| Cu1Cu2 | (344.8) | (407.2) | 245.9 | (449.4) |
| Валентные углы, град** | ||||
| Cu1Al1Cu2 | 90.5 | 108.6 | (34.8) | 142.1 |
| Cu1Al2Cu2 | 90.5 | 108.6 | 61.2 | (69.4) |
| Cu1Al1Al2 | 55.1 | 58.3 | 57.9 | 148.5 |
| Cu1Al2Al1 | 55.1 | 58.3 | 57.9 | (15.0) |
| Cu2Al1Al2 | 55.1 | 57.2 | (33.5) | 58.6 |
| Cu2Al2Al1 | 55.1 | 57.2 | 110.1 | 57.4 |
| Al1Cu1Al2 | 69.9 | 63.5 | 62.5 | (16.5) |
| Al1Cu2Al2 | 69.9 | 65.6 | (36.4) | 64.0 |
| Al1Cu3Al2 | 69.9 | 63.5 | 62.3 | 64.6 |
| Cu1Al1Cu3 | 90.5 | 54.4 | 58.9 | 142.0 |
| Cu1Al2Cu3 | 90.5 | 54.4 | 60.1 | (69.4) |
| Cu1Cu3Cu2 | (60.0) | (73.4) | (34.3) | (73.1) |
| Cu2Al1Cu3 | 90.5 | 108.6 | (72.2) | (65.7) |
| Cu2Al2Cu3 | 90.5 | 108.6 | 114.2 | 64.7 |
| Cu1Cu2Cu3 | (60.0) | (33.2) | (34.2) | (73.1) |
| Торсионные (двугранные) углы, град*** | ||||
| Cu1Al2Al1Cu3 | 120.0 | 65.0 | 71.0 | (140.4) |
| Cu2Al2Al1Cu3 | –120.0 | –147.5 | 107.0 | –78.9 |
| Cu1Cu3Cu2Al1 | (54.4) | (66.1) | (63.6) | (–10.8) |
| Cu1Cu3Cu2Al2 | (–54.4) | (–66.1) | (130.1) | (–88.1) |
| Cu1Al1Al2Cu2 | 120.0 | 147.5 | 36.0 | 140.7 |
| Cu1Cu2Al1Al2 | (45.2) | (28.8) | (119.1) | (147.4) |
| Cu1Cu2Al2Al1 | (–45.2) | (–28.8) | –35.3 | (–10.1) |
| Cu2Cu3Al2Al1 | (–45.3) | (–28.5) | (100.0) | –66.1 |
Примечание. Здесь и в табл. 3 в скобках указаны: *расстояния между двумя атомами, не образующими между собой химические связи; **величины углов, образуемых тремя атомами, из которых хотя бы одна пара атомов не связана между собой химическими связями, ***величины двугранных углов, образуемых четырьмя атомами, из которых по крайней мере одна пара атомов не связана между собой химическими связями.
Таблица 2.
Относительные энергии различных структур металлокластеров Al2Cu3
| Обозначение структуры |
Спиновая мультиплетность основного состояния | Относительная энергия, кДж/моль | Число химических связей в структуре | ||
|---|---|---|---|---|---|
| Al–Al | Al–Cu | Cu–Cu | |||
| Al2Cu3 (I) | 2 | 0.0 | 1 | 6 | 2 |
| Al2Cu3 (II) | 4 | 144.1 | 0 | 6 | 2 |
| Al2Cu3 (III) | 2 | 20.6 | 1 | 5 | 3 |
| Al2Cu3 (IV) | 4 | 136.9 | 1 | 5 | 3 |
| Al2Cu3 (V) | 2 | 27.0 | 1 | 6 | 0 |
| Al2Cu3 (VI) | 4 | 144.3 | 1 | 6 | 1 |
| Al2Cu3 (VII) | 2 | 40.1 | 1 | 5 | 2 |
| Al2Cu3 (VIII) | 2 | 67.6 | 1 | 5 | 1 |
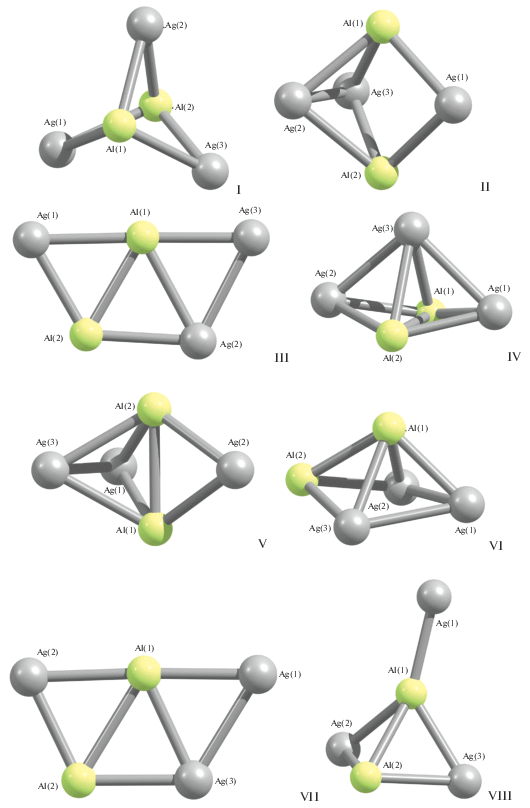
Молекулярные структуры всех найденных нами модификаций металлокластера Al2Ag3 представлены на рис. 2, основные структурные данные этих модификаций – в табл. 3. При сопоставлении рис. 1 и 2 видно большее структурное разнообразие модификаций этого металлокластера по сравнению со своим “медным” аналогом. Следует отметить, что среди металлокластеров Al2Ag3 имеются две практически компланарные модификации: Al2Ag3 (III) и Al2Ag3 (VII), которые в числе возможных модификаций кластеров Al2Cu3 не наблюдаются. В первой невалентные углы Ag1Al2Ag2 (123.3°), Al2Ag2Ag3 (113.8°), Ag2Ag3Ag1 (63.4°) и Ag3Ag1Ag2 (60.5°) в сумме дают 360.0°, что соответствует плоскому четырехугольнику, а угол Ag3Al1Ag2, равный 178.6°, почти не отличается от 180°. Во второй невалентные углы Ag3Ag1Ag2 (57.6°), Ag1Ag2Al2 (64.7°), Ag2Al2Ag3 (115.7°) и Al2Ag3Ag1 (121.8°) в сумме дают 358.8°, что соответствует практически плоскому четырехугольнику, а угол Ag1Al1Ag2 равен 177.0°, что также очень близко к 180°. Модификация Al2Ag3 (I) напоминает модификации Al2Cu3 (V) и Al2Cu3 (VI), но в отличие от последних в ней отсутствует связь Al–Al (рис. 1, 2). Остальные модификации в той или иной степени напоминают тригональную бипирамиду или близкую к ней геометрическую фигуру, в которой отсутствует одно или даже большее число ребер (рис. 2). “Гетероядерные” химические связи Al–Ag имеются в структурах всех модификаций Al2Ag3, в то время как каждая из “гомоядерных” связей Al–Al и Ag–Ag присутствует лишь в шести структурах из восьми. Относительные энергии всех найденных нами модификаций Al2Ag представлены в табл. 4. Как видно из приведенных данных, наиболее устойчивой в энергетическом отношении является модификация Al2Ag3 (I), имеющая в основном состоянии столь же низкую спиновую мультиплетность (2), что и наиболее устойчивая модификация металлокластера Al2Cu3 (I). Эта наиболее энергетически выгодная модификация металлокластера Al2Ag3 содержит только химические связи Al–Ag и характеризуется наименьшим количеством связей металл–металл (6) по сравнению с остальными модификациями. Среди теоретически возможных модификаций Al2Ag3 имеется модификация Al2Ag3 (III) со спиновой мультиплетностью 6, подобных которой среди модификаций металлокластера Al2Cu3 не обнаружено. Следует сказать, что эта модификация обладает и наибольшей полной энергией по сравнению с остальными разновидностями данного металлокластера.
Таблица 3.
Длины связей металл–металл, валентные и торсионные углы в молекулярных структурах кластеров Al2Ag3
| Структура | Al2Ag3 (I) | Al2Ag3 (II) | Al2Ag3 (III) | Al2Ag3 (IV) |
| Длины связей металл–металл, пм* | ||||
| Al1Al2 | (282.4) | (337.6) | 260.9 | 279.8 |
| Al1Ag1 | 257.2 | 252.8 | 258.0 | 257.2 |
| Al1Ag2 | 257.2 | 267.4 | 273.5 | 257.2 |
| Al1Ag3 | 257.2 | 267.4 | 252.5 | 271.1 |
| Al2Ag1 | 257.2 | 252.8 | 254.7 | 257.2 |
| Al2Ag2 | 257.2 | 267.4 | 260.4 | 257.2 |
| Al2Ag3 | 257.2 | 267.4 | (444.2) | 271.1 |
| Ag1Ag3 | (372.5) | (372.1) | (510.5) | 281.4 |
| Ag2Ag3 | (372.5) | 264.2 | 269.7 | 281.4 |
| Ag1Ag2 | (372.5) | (372.3) | (453.4) | (421.8) |
| Валентные углы, град** | ||||
| Ag1Al1Ag2 | 92.8 | 91.4 | 117.1 | 110.2 |
| Ag1Al2Ag2 | 92.8 | 91.4 | 123.3 | 110.2 |
| Ag1Al1Al2 | (56.7) | (48.1) | 58.8 | 57.1 |
| Ag1Al2Al1 | (56.7) | (48.1) | 60.0 | 57.1 |
| Ag2Al1Al2 | (56.7) | (50.9) | 58.3 | 57.1 |
| Ag2Al2Al1 | (56.7) | (50.9) | 63.3 | 57.1 |
| Al1Ag1Al2 | 66.6 | 83.8 | 61.2 | 65.9 |
| Al1Ag2Al2 | 66.6 | 78.3 | 58.4 | 65.9 |
| Al1Ag3Al2 | 66.6 | 78.3 | (30.6) | 62.1 |
| Ag1Al1Ag3 | 92.8 | 91.3 | 178.6 | 64.3 |
| Ag1Al2Ag3 | 92.8 | 91.3 | (89.6) | 64.3 |
| Ag1Ag3Ag2 | (60.0) | (69.3) | (62.4) | 97.1 |
| Ag2Al1Ag3 | 92.7 | 59.2 | 61.6 | 64.3 |
| Ag2Al2Ag3 | 92.7 | 59.2 | (33.7) | 64.3 |
| Ag1Ag2Ag3 | (60.0) | (69.2) | (85.8) | (41.5) |
| Торсионные (двугранные) углы, град*** | ||||
| Ag1Al2Al1Ag3 | (120.0) | (140.4) | 179.8 | –77.7 |
| Ag2Al2Al1Ag3 | (–120.0) | (–79.1) | (–0.1) | 77.7 |
| Ag1Ag3Ag2Al1 | (52.7) | (46.6) | (0.1) | –38.8 |
| Ag1Ag3Ag2Al2 | (–52.7) | (–46.6) | (0.0) | 38.8 |
| Ag1Al1Al2Ag2 | (120.0) | (140.5) | (–180.0) | 155.4 |
| Ag1Ag2Al1Al2 | (46.4) | (28.3) | (0.0) | (21.8) |
| Ag1Ag2Al2Al1 | (–46.4) | (–28.3) | (0.1) | (–21.8) |
| Ag2Ag3Al2Al1 | (–46.5) | (–62.5) | (–179.8) | 65.5 |
| Структура | Al2Ag3 (V) | Al2Ag3 (VI) | Al2Ag3 (VII) | Al2Ag3 (VIII) |
| Длины связей металл–металл, пм* | ||||
| Al1Al2 | 270.7 | 261.2 | 276.7 | 261.3 |
| Al1Ag1 | 272.4 | 254.3 | 252.4 | 245.4 |
| Al1Ag2 | 260.1 | 262.1 | 255.9 | 253.6 |
| Al1Ag3 | 271.8 | 262.0 | 259.0 | 253.6 |
| Al2Ag1 | 271.6 | (409.6) | (460.8) | (486.4) |
| Структура | Al2Ag3 (V) | Al2Ag3 (VI) | Al2Ag3 (VII) | Al2Ag3 (VIII) |
| Al2Ag2 | 260.2 | 258.0 | 252.4 | 260.6 |
| Al2Ag3 | 272.3 | 258.1 | 254.4 | 260.7 |
| Ag1Ag3 | 265.1 | 283.6 | 273.0 | (461.1) |
| Ag2Ag3 | (438.0) | (345.3) | (429.1) | (343.8) |
| Ag1Ag2 | (438.0) | 284.2 | (508.1) | (461.1) |
| Валентные углы, град** | ||||
| Ag1Al1Ag2 | 110.6 | 66.8 | 177.0 | 135.0 |
| Ag1Al2Ag2 | 110.9 | (43.4) | (85.6) | (68.7) |
| Ag1Al1Al2 | 60.0 | 105.2 | (121.1) | 147.4 |
| Ag1Al2Al1 | 60.3 | (36.8) | (28.0) | (15.8) |
| Ag2Al1Al2 | 58.7 | 59.1 | 56.4 | 60.8 |
| Ag2Al2Al1 | 58.6 | 60.6 | 57.6 | 58.1 |
| Al1Ag1Al2 | 59.7 | (38.0) | (31.0) | (16.8) |
| Al1Ag2Al2 | 62.7 | 60.3 | 66.0 | 61.1 |
| Al1Ag3Al2 | 59.7 | 60.3 | 65.2 | 61.1 |
| Ag1Al1Ag3 | 58.3 | 66.6 | 64.5 | 135.0 |
| Ag1Al2Ag3 | 58.3 | (43.3) | (30.2) | (68.7) |
| Ag1Ag3Ag2 | (72.4) | (52.6) | (89.8) | (68.1) |
| Ag2Al1Ag3 | 110.8 | 82.4 | 112.9 | 85.3 |
| Ag2Al2Ag3 | 110.6 | 84.0 | 115.7 | 82.5 |
| Ag1Ag2Ag3 | (35.2) | (52.5) | (32.5) | (68.1) |
| Торсионные (двугранные) углы, град*** | ||||
| Ag1Al2Al1Ag3 | –68.3 | (–50.1) | (2.0) | (129.1) |
| Ag2Al2Al1Ag3 | 145.8 | –100.3 | –176.1 | –101.9 |
| Ag1Ag3Ag2Al1 | (–63.8) | (–73.7) | (–1.3) | (–9.0) |
| Ag1Ag3Ag2Al2 | (63.4) | (–158.0) | (–175.3) | (–95.2) |
| Ag1Al1Al2Ag2 | –145.8 | –50.3 | –178.2 | 129.1 |
| Ag1Ag2Al1Al2 | (–31.3) | –126.2 | (–32.3) | (143.7) |
| Ag1Ag2Al2Al1 | (31.5) | 42.1 | (–0.9) | (–13.1) |
| Ag2Ag3Al2Al1 | (30.8) | (–59.6) | (–3.6) | (–57.0) |
Таблица 4.
Относительные энергии различных структур металлокластеров Al2Ag3
| Обозначение структуры |
Спиновая мультиплетность основного состояния | Относительная энергия, кДж/моль | Число химических связей в структуре | ||
|---|---|---|---|---|---|
| Al–Al | Al–Ag | Ag–Ag | |||
| Al2Ag3 (I) | 2 | 0.0 | 0 | 6 | 0 |
| Al2Ag3 (II) | 4 | 165.1 | 0 | 6 | 1 |
| Al2Ag3 (III) | 6 | 319.6 | 1 | 5 | 1 |
| Al2Ag3 (IV) | 2 | 18.6 | 1 | 6 | 2 |
| Al2Ag3 (V) | 4 | 145.5 | 1 | 6 | 1 |
| Al2Ag3 (VI) | 2 | 29.9 | 1 | 5 | 2 |
| Al2Ag3 (VII) | 4 | 124.6 | 1 | 5 | 1 |
| Al2Ag3 (VIII) | 2 | 39.1 | 1 | 5 | 0 |
ЗАКЛЮЧЕНИЕ
Говоря об общих структурных моментах рассматриваемых здесь алюминий-медных и алюминий-серебряных металлокластеров, отметим, что если для большинства “медных” характерно наличие нескольких связей металл–металл, образуемых одним и тем же атомом со своими “соседями” (рис. 1), то для “серебряных” эта тенденция выражена значительно слабее (рис. 2). В среднем число химических связей металл–металл в металлокластерах Al2Cu3 заметно больше, чем в металлокластерах Al2Ag3. Характерно, что наиболее устойчивые модификации рассматриваемых металлокластеров, а именно Al2Cu3 (I) и Al2Ag3 (I), внешне существенно отличаются друг от друга. Для всех без исключения модификаций рассматриваемых металлокластеров характерны сравнительно высокие значения длин связей, превышающие 230 пм; при этом наиболее длинными оказываются связи Al–Al и Ag–Ag, наиболее короткими – связи Cu–Cu, а связи Cu–Al и Ag–Al по длине занимают промежуточное положение, что с учетом атомных радиусов химических элементов (143 пм (Al), 128 пм (Cu) и 145 пм (Ag)), входящих в состав Al2Cu3 (I) и Al2Ag3, вполне ожидаемо. Валентные углы, образованные связями металл–металл, как правило, невелики и меньше 90°, аналогичная ситуация имеет место и для торсионных (двугранных) углов. Металлокластеры Al2Cu3 и Al2Ag3 обладают лишь одной плоскостью симметрии и (или) осью второго порядка; оси третьего порядка имеются лишь в металлокластерах Al2Cu3 (V) и Al2Ag3 (I) (в каждом из них есть еще по три оси второго порядка и четыре плоскости симметрии). Что же касается спиновой мультиплетности основного состояния рассматриваемых нами металлокластеров, то как в Al2Cu3, так и в Al2Ag3 имеет место достаточно отчетливо выраженная тенденция к образованию наиболее устойчивых модификаций с низкоспиновыми основными состояниями, что с учетом электронных конфигураций атомов меди 3d104s1 и серебра 4d105s1 представляется вполне естественным.
Список литературы
Михайлов О.В., Чачков Д.В. // Журн. неорган. химии. 2017. Т. 62. № 3. С. 321 [Mikhailov O.V., Chachkov D.V. // Russ. J. Inorg. Chem. 2017. V. 62. № 3. P. 336. doi 10.1134/S0036023617030135].
Hoe W.-M., Cohen A., Handy N.C. // Chem. Phys. Lett. 2001. V. 341. № 1. P. 319.
Perdew J.P., Burke K., Ernzerhof M. // Phys. Rev. Lett. 1997. V. 78. № 7. P. 1396.
Paulsen H., Duelund L., Winkler H. et al. // Inorg. Chem. 2001. V. 40. № 9. P. 2201.
Swart M., Groenhof A.R., Ehlers A.W., Lammertsma K. // J. Phys. Chem. A. 2004. V. 108. № 25. P. 5479.
Swart M., Ehlers A.W., Lammertsma K. // Mol. Phys. 2004. V. 102. № 23. P. 2467.
Swart M. // Inorg. Chim. Acta. 2007. V. 360. № 1. P. 179.
Schaefer A., Horn H., Ahlrichs R. // J. Chem. Phys. 1992. V. 97. № 4. P. 2571.
Schaefer A., Huber C., Ahlrichs R. // J. Chem. Phys. 1994. V. 100. № 8. P. 5829.
Schaefer A., Horn H., Ahlrichs R. // J. Chem. Phys. 1992. V. 97. № 4. P. 2571.
Schaefer A., Huber C., Ahlrichs R. // J. Chem. Phys. 1994. V. 100. № 8. P. 5829.
Ceolin G.A., de Berrêdo R.C. // Theor. Chem. Acc. 2013. V. 132. № 4. P. 1339.
Frisch M.J. et al. Gaussian 09, Revision A.01. Gaussian, Inc., Wallingford CT, 2009.
Чачков Д.В., Михайлов О.В. // Журн. неорган. химии. 2012. Т. 57. № 7. С. 1056 [Chachkov D.V., Mikhailov O.V. // Russ. J. Inorg. Chem. 2012. V. 57. № 7. P. 981. doi 10.1134/S0036023612070078].
Чачков Д.В., Михайлов О.В. // Журн. неорган. химии. 2013. Т. 58. № 9. С. 1199 [Chachkov D.V., Mikhailov O.V. // Russ. J. Inorg. Chem. 2013. V. 58. № 9. P. 1073. doi 10.1134/S0036023613090052].
Mikhailov O.V., Chachkov D.V. // Inorg. Chim. Acta. 2013. V. 408. № 1. P. 246.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии