Микроэлектроника, 2019, T. 48, № 4, стр. 263-271
Возможности управления концентрацией примесей в приповерхностных слоях пленок, выращенных методом ALD
А. В. Фадеев 1, **, К. В. Руденко 1, *
1 Физико-технологический институт им. К.А. Валиева РАН
117218 г. Москва, Нахимовский проспект, д. 36, к. 1, Россия
** E-mail: AlexVFadeev@gmail.com
* E-mail: rudenko@ftian.ru
Поступила в редакцию 14.12.2018
После доработки 02.03.2019
Принята к публикации 06.03.2019
Аннотация
Обсуждается теоретически обоснованный механизм, позволяющий регулировать концентрацию примесей в приповерхностных слоях пленок оксидных диэлектриков, выращенных методом атомно-слоевого осаждения из металлорганических прекурсоров. При помощи моделирования показано, что в приповерхностном слое диэлектрика толщиной ~20 монослоев, концентрация примесного углерода может быть снижена до 5 раз, к уровню значений объемной концентрации этой примеси. Предлагается проведение процессов роста пленок с модификацией параметров ALD цикла, что должно привести к улучшению параметров диэлектрика на интерфейсах многослойных структур.
ВВЕДЕНИЕ
В настоящее время в микроэлектронике при выращивании тонких пленок получил широкое применение метод атомно-слоевого осаждения (ALD) [1]. Данный метод позволяет наносить плотные сверхтонкие пленки, формируя приборные структуры, на плоские и 3D-поверхности, строго контролируя их толщину. Один идеальный ALD цикл состоит из четырех этапов. На первом этапе в камеру реактора поступает первый прекурсор (молекулы химически активных веществ) в количестве необходимом для заполнения всех функциональных поверхностных групп. Затем производится продувка камеры реактора для удаления из нее молекул прекурсора, не находящихся в состоянии хемосорбции на поверхности. В результате на поверхности остается монослой I-прекурсора. На третьем шаге в камеру реактора добавляется II-прекурсор (газообразный), и протекает гетерогенная реакция I и II прекурсоров. Продукты реакции удаляются из камеры на следующем шаге. Результатом является один монослой целевого материала. Таким образом, метод атомно-слоевого осаждения является самонасыщаемым, т.к. поверхностные реакции с молекулами сорбированного I-прекурсора прекращаются после исчерпания всех функциональных групп (радикалов) в его составе.
Однако на практике, из-за вероятностного характера, кинетики химических реакций, а также стерического эффекта не все функциональные группы хемисорбированного прекурсора вступают в реакцию [2], что приводит к загрязнению растущих пленок примесями из лигандов металлорганических молекул. Основную примесь представляет углерод, в меньшей степени – азот. Наличие примеси в растущих пленках может происходить также за счет термической деструкции прекурсора [3] при высоких температурах роста. При PEALD (плазменном варианте ALD) примесь в растущей пленке может появиться из-за дополнительного механизма: высвободившиеся с поверхности продукты реакции могут диссоциировать в плазме и переосаждаться на поверхности [4]. Поэтому во многих случаях [5–11] в тонких пленах различных материалов, выращенных методом ALD с использованием углеродсодержащих прекурсоров, наблюдается примесь углерода, концентрация которого резко увеличивается в нескольких приповерхностных монослоях. Вообще говоря, если целью является создание многослойной структуры, рост концентрации примесей у границы слоев может менять электрические свойства этой границы, например, путем образования избыточного количества электронных ловушек. В настоящей работе предпринята попытка количественного описания эффекта роста примесного углерода в поверхностных слоях ALD-пленки и поиска способов его устранения.
ЭКСПЕРИМЕНТ И МЕХАНИЗМ РОСТА КОНЦЕНТРАЦИИ ПРИМЕСЕЙ У ПОВЕРХНОСТИ ALD-ПЛЕНОК
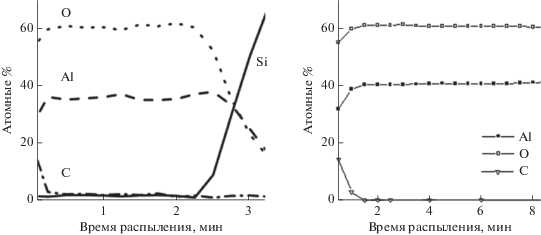
Экспериментальные результаты по исследованию химического состава пленок Al2O3, выращенных методом ALD показывают (рис. 1 [10, 11]), что вблизи поверхности существует область (приповерхностный слой), в которой содержание примеси углерода значительно превышает соответствующие значения в объеме пленки. Процент содержания углерода в этом слое увеличивается по мере приближения к поверхности. При этом процент содержания алюминия в пленке спадает быстрее, чем процент содержания кислорода, что может свидетельствовать о неполном преобразовании углеродсодержащих групп в молекулы Al2O3.
В работе [12] показано, что взаимодействие CH3 лигандов с озоном и кислородной плазмой приводит к образованию как OH групп, так и небольшого количества карбонатов на поверхности растущей пленки. Согласно [13] взаимодействие плазмы и озона с СО и СО2 приводит к образованию карбонатов (–СО3), бикарбонатов (–HСО3), а также (–HСОO) групп. Однако дальнейшее увеличение времени экспозиции в плазме кислорода приводит к понижению примеси углерода за счет повторного образования СО и СО2 групп. В случае озона образовавшиеся карбонатные группы распадаются только при высоких температурах (>300°С). В [13] также показано, что концентрация примеси углерода для ALD при 100 и 300°С выше, чем при 200°С. Полученный результат объясняется неполной реакцией углерод содержащих лигандов при низкой температуре и их термическим распадом с образованием более стабильных групп при высоких температурах. Обнаружено, что отжиг фактически не влияет на перераспределение примеси углерода в пленке [14, 15], что также может указывать на то, что углерод присутствует в пленке не в виде углеводородов, а в виде карбонатов [16, 17], которые слабо распадаются при отжиге [18].
Обнаружено [19], что энергия связанных междоузельных углеродных образований на ~5 эВ меньше, чем в случае замещения. Энергия миграции углерода по междоузлиям составляет 2.7 эВ. Образование молекул СО требует энергии <3.1 эВ, но энергетический барьер для миграции СО составляет <0.4 эВ.
Изучая энергию миграции и образование междоузлий азота вблизи поверхности Fe(100) [20] авторами было показано, что энергия напряжения играет первостепенную роль в поверхностной сегрегации и в семи слоях переходной области. Влияние напряжений на распределение энергии в подложке является ключевым фактором, который в сочетании с термической активацией помогает управлять кинетикой реакции [21]. Чем больше деформация растяжения, тем ниже энтальпия образования вакансий, барьер миграции вакансий, энергия адсорбции (отрицательная) и энергетический барьер диссоциации молекулы. Все это объясняется ослаблением межатомных связей в растянутой решетке, приводя к более низким энергетическим барьерам миграции атомов. В работе [22] показано, что активационный барьер для всех путей междоузельного атома Si вблизи поверхности кремния ниже, чем в объеме, и уменьшение направлено в сторону поверхности за счет приповерхностной релаксации.
МОДЕЛЬ НАКОПЛЕНИЯ ПРИМЕСИ УГЛЕРОДА В ПРИПОВЕРХНОСТНЫХ СЛОЯХ ПЛЕНКИ, ВЫРАЩЕННОЙ МЕТОДОМ ALD
В качестве примера рассмотрим рост пленки Al2O3 из ТМА (Al(CH3)3) и воды методом ALD, поскольку рост указанных пленок наиболее исследован в литературе. Характерные параметры ALD процесса, используемые при расчетах, приведены в табл. 1.
Таблица 1.
Типичные параметры ALD процесса
| ПАРАМЕТР | ЗНАЧЕНИЕ |
|---|---|
| Температура в газовой фазе | Tg = 120°C |
| Температура подложки | Ts = 300°C |
| Давление TMA | ${{P}_{{{\text{TMA}}}}}$ = 100 м Toрр |
| Давление H2O | ${{P}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 15 м Тoрр |
| Время подачи TMA | ${{t}_{{{\text{TMA}}}}}$ = 20 мс |
| Время продувки после TMA | ${{t}_{{p\_{\text{TMA}}}}}$ = 3 c |
| Время подачи H2O | ${{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 20 мс |
| Время продувки после H2O | ${{t}_{{p\_{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 3 c |
Начнем исследование роста пленки Al2O3 с момента, когда уже выращено N-монослоев. Во время подачи первого прекурсора (ТМА) осуществляется одна из трех наиболее вероятных реакций [24]:
После продувки реактора основная часть не связанного с алюминием углерода десорбируется с поверхности. Затем в камеру реактора подается второй прекурсор (Н2О), который реагирует с поверхностными CH3 группами [24]:
Из-за вероятностного характера протекания химической реакции, не все CH3 группы прореагируют с парами воды. Кроме того часть физадсорбированных молекул воды может диффундировать в приповерхностные слои растущей пленки. Далее, за счет продувки, поверхность очищается от физадсорбированных молекул.
Оставшиеся, после завершения ALD цикла, углерод и избыточный (не связанный с алюминием) кислород могут вступать в реакцию с образованием устойчивых карбонатов [16–18] или легко диффундирующих молекул CO и CO2 [19].
На основании всего вышесказанного предлагается модель позволяющая объяснить накопление примеси углерода вблизи поверхности пленки выращенной методом ALD. Рассмотрим поверхность, полностью покрытую OH группами. На первой стадии ALD цикла осуществляется подача первого прекурсора (TMA). Примем, что весь падающий поток с коэффициентом прилипания s1 химически адсорбируется в свободные узлы, но из-за стерического эффекта только часть (δ1) узлов может быть занята. Из-за большого размера молекул первого прекурсора пренебрежем возможностью их диффузии в подложку. Физически адсорбированный слой не рассматривается, поскольку предполагается его полное удаление во время продувки камеры реактора. Если обозначить за tc_1 критическое время, необходимое для заполнения поверхности функциональными группами первого прекурсора до необходимой величины η, то при t > tc_1, после продувки, мы получаем монослой на δ1 покрытый –Al(CH3)2 группами.
После этого, в камеру реактора подается второй, кислородсодержащий прекурсор (H2O). Этот прекурсор с вероятностью s2 взаимодействует с поверхностными функциональными группами (CH3) с образованием молекул Al2O3. При этом кислород может диффундировать в подложку и взаимодействовать с CH3 группами, которые остались после предыдущих ALD циклов. Образующиеся при этом молекулы CO/CO2 покидают поверхностный слой за времена много меньшие времени подачи прекурсора, что связано с малым энергетическим барьером и направленным в сторону поверхности характером их миграции.
Часть CH3 групп может переходить в стабильные состояния (карбонаты, карбиды), которые плохо распадаются при отжиге. Будем полагать, что энергетический барьер преобразования CH3 в стабильные состояния много больше энергии необходимой для образования OH групп.
В модели не будет учитываться возможность термического распада прекурсора в газовой фазе и переосаждение диссоциировавших продуктов реакции прекурсоров с поверхностными функциональными группами.
МОДЕЛРОВАНИЕ ОДНОГО ALD ЦИКЛА
Согласно приведенной выше модели опишем рост одного монослоя Al2O3. В работе [24] исследовалась зависимость интенсивности углеродной линии спектра от экспозиции в парах воды. В указанной работе наблюдаются два режима адсорбции. При малых экспозициях H2O интенсивность приведенного сигнала углерода спадает в ≈30 раз быстрее, чем в случае больших экспозиций. При этом было показано, что переход от одного режиму к другому происходит, когда степень покрытия поверхности достигает критического значения Θc ~ 0.5. Исходя из результатов работы [24] можно предположить, что на начальном этапе адсорбции каждый из –Al(CH3)2 взаимодействует только с одной молекулой воды, что определяет быстрый этап адсорбции. На втором этапе молекула воды взаимодействует с –Al(CH3)(OH), образуя мостовые состояния Al–O–Al, что требует больших энергетических затрат и приводит к снижению коэффициента прилипания. Запишем систему кинетических уравнений, описывающую один идеальный ALD цикл в переменных, где все концентрации, а также потоки нормированы на концентрацию узлов адсорбции молекул прекурсора, которая полагается одинаковой.
(1)
$\left\{ \begin{gathered} {{{\dot {n}}}_{1}} = {{s}_{1}}{{Q}_{1}}\left( {1 - {{n}_{1}}} \right) \hfill \\ {{{\dot {n}}}_{{21}}} = - {{s}_{{21}}}{{Q}_{2}}{{n}_{{21}}} \hfill \\ {{{\dot {n}}}_{{22}}} = - {{s}_{{22}}}{{Q}_{2}}(1 - {{n}_{{21}}}){{n}_{{22}}} \hfill \\ \end{gathered} \right.\quad \left\{ \begin{gathered} {{n}_{1}} = 0 \hfill \\ {{n}_{{21}}} = {{\delta }_{1}} \hfill \\ {{n}_{{22}}} = 0 \hfill \\ \end{gathered} \right..$Здесь
Q1 и Q2 – потоки частиц первого и второго прекурсора $\left( {Q = {P \mathord{\left/ {\vphantom {P {\sqrt {2\pi mkT} }}} \right. \kern-0em} {\sqrt {2\pi mkT} }}} \right){\text{;}}$
s1 и n1 – коэффициенты прилипания и концентрация первого прекурсора;
s21 и n21 – коэффициенты прилипания второго прекурсора и концентрация углеродсодержащих лигандов в состоянии 1;
s22 и n22 – коэффициенты прилипания второго прекурсора и концентрация углеродсодержащих лигандов в состоянии 2.
Решение первого уравнения системы (1) имеет вид:
Для s1 = 0.01 [24], время необходимое для заполнения поверхности молекулами ТМА на η = 0.99 составляет ~17 мс, что меньше времени подачи первого прекурсора ${{t}_{{{\text{TMA}}}}}$ = 20 мс. Таким образом, пренебрегая стеричиским эффектом (δ1 = 1), можно считать, что к началу подачи второго прекурсора поверхность полностью покрыта –Al(CH3)2 группами.
Решение второго уравнений системы (1) имеет вид:
При s21 = 0.25 [24], время необходимое для заполнения узлов первого типа молекулами H2O (δ1 = 1) на η = 0.99 составляет tc1 ~ 2.3 мс. Поскольку время оккупации узлов первого типа значительно меньше времени подачи второго прекурсора ${{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 20 мс, то будем считать, что все они прореагировали с молекулами H2O.
С учетом сделанных оценок, будем полагать, что выражение в скобках (1 – n21) = 1, а начальная концентрация узлов второго сорта равна δ1. Тогда
Для тех же параметров процесса и коэффициента прилипания s22 = 0.09 [24] получим, что критическое время заполнения узлов второго сорта составляет tc2 ~ 65 мс. Т.е. за время подачи второго прекурсора только ~80% узлов прореагируют с молекулами H2O. И соответственно ~20% углеродсодержащих лигандов останутся в данном монослое.
ПРОСТРАНСТВЕННЫЙ ПРОФИЛЬ КОНЦЕНТРАЦИИ ИЗБЫТОЧНОГО КИСЛОРОДА
Рассмотрим диффузию избыточного кислорода, пренебрегая на начальном этапе его взаимодействием с углеродом. Решение уравнения диффузии для кислорода:
(5)
$\frac{{\partial {{n}_{o}}(z,t)}}{{\partial t}} = D\frac{{{{\partial }^{2}}{{n}_{o}}(z,t)}}{{\partial {{z}^{2}}}},\,\,{{n}_{o}}(0,t) = 1,\,\,{{n}_{o}}(z,0) = 0,$В работах [25–27] исследовалась диффузия изотопа кислорода О18 в выращенных методом ALD пленках Al2O3 во время отжига при различных температурах. Согласно приведенным результатам энергия активации объемной диффузии кислорода в аморфном Al2O3 находится в диапазоне 1–1.3 эВ.
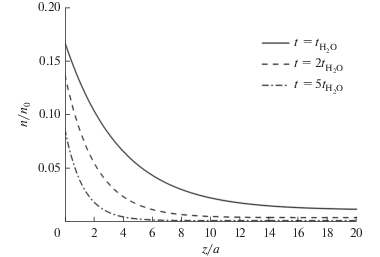
Согласно проведенным оценкам, ели энергия активации диффузии кислорода будет составлять 1 эВ, то за время его подачи, при температуре ALD процесса 300°С, глубина проникновения кислорода составит ~1–2 монослоя. После прекращения подачи кислорода поверхность будет являться для него стоком и заметного проникновения вглубь подложки ожидать не приходиться. Но согласно принятой модели именно кислород ответственен за удаление углерода из растущей пленки. Следовательно, поверхностный слой, содержащий избыточный углерод также составлял бы ~1–2 монослоя. Полученный результат противоречит экспериментальному профилю углерода (рис. 1), который имеет гладкое спадание концентрации с удалением от поверхности до глубины ~10–20 монослоев. Таким образом, следует ожидать, что энергия активации диффузии в 10–20 поверхностных монослоях должна быть меньше 1 эВ, что также следует из снижения энергетических барьеров вблизи поверхности растущей пленки. Для энергии активации 0.85 эВ диффузионный профиль кислорода при tO = 20 мс распространяется на ~15–20 монослоев (рис. 2), что соответствует экспериментальному профилю углерода (рис. 1).
Рис. 2.
Профиль концентрации кислорода при энергии активации диффузии 0.85 эВ и различных временах подачи кислорода.
Во время продувки профиль кислорода может быть описан уравнением:
(7)
$\frac{{\partial {{n}_{o}}(z,t)}}{{\partial t}} = D\frac{{{{\partial }^{2}}{{n}_{o}}(z,t)}}{{\partial {{z}^{2}}}},\,\,\,{{\left. {\frac{{\partial {{n}_{o}}(z,t)}}{{\partial z}}} \right|}_{{z = 0}}} = k{{n}_{o}}(0,t),\,\,\,{{n}_{o}}(z,0) = {{n}_{{o\_b}}}(z),$Решение уравнения (7) имеет вид:
(8)
${{n}_{o}}(z,t) = \frac{1}{{2\sqrt {\pi Dt} }}\int\limits_0^\infty {{{n}_{{o\_b}}}(\xi )\left[ {\exp \left( { - \frac{{{{{(z - \xi )}}^{2}}}}{{4Dt}}} \right) + \exp \left( { - \frac{{{{{(z + \xi )}}^{2}}}}{{4Dt}}} \right) - 2k\int\limits_0^\infty {\exp \left( { - \frac{{{{{(z + \xi + \eta )}}^{2}}}}{{4Dt}} - k\eta } \right)d\eta } } \right]d\xi } .$Расчет показывает, что за время продувки кислород, накопленный в подложке, практически полностью уходит из растущей пленки. Следовательно, каждый ALD цикл можно рассматривать независимо.
ПРОСТРАНСТВЕННЫЙ ПРОФИЛЬ КОНЦЕНТРАЦИИ УГЛЕРОДА
Будем полагать, что за время первого полуцикла в поверхностном монослое остается ncs = = 0.2 углерода Указанное значение было выбрано исходя из полученной выше оценки. На втором полуцикле в камеру реактора подается кислородсодержащий прекурсор в течение времени ${{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}.$ Система кинетических уравнений, описывающая вывод углерода из пленки, может быть записана в виде:
(9)
$\left\{ \begin{gathered} \frac{{\partial {{{\tilde {n}}}_{o}}}}{{\partial \tau }} = D\frac{{{{\partial }^{2}}{{{\tilde {n}}}_{o}}}}{{\partial {{z}^{2}}}} - \beta {{{\tilde {n}}}_{o}}{{{\tilde {n}}}_{{c1}}} \hfill \\ \frac{{\partial {{{\tilde {n}}}_{{c1}}}}}{{\partial \tau }} = - \beta {{{\tilde {n}}}_{o}}{{{\tilde {n}}}_{{c1}}} - \alpha {{{\tilde {n}}}_{{c1}}} \hfill \\ \frac{{\partial {{{\tilde {n}}}_{{c2}}}}}{{\partial \tau }} = \alpha {{{\tilde {n}}}_{{c1}}} \hfill \\ \end{gathered} \right.\quad \left\{ \begin{gathered} {{{\tilde {n}}}_{o}}(z,0) = 0,\,\,\,\,{{{\tilde {n}}}_{o}}(0,\tau ) = 1,\,\,\,\,{{{\tilde {n}}}_{o}}(\infty ,\tau ) = 0 \hfill \\ {{{\tilde {n}}}_{{c1}}}(z,0) = {{n}_{{c0}}}(z) \hfill \\ {{{\tilde {n}}}_{{c2}}}(z,0) = 0 \hfill \\ \end{gathered} \right..$В приведенной системе (9) координата измеряется в монослоях z = x/a, а время в продолжительности одного ALD цикла τ = t/t0,
no – концентрация кислорода,
nс1 и nс2 – концентрации не взаимодействовавшего углерода и углерода перешедшего в слабо растворимые состояния соответственно,
α – вероятность образования стабильного состояния углерода,
β – вероятность взаимодействия растворимого углерода с кислородом,
D – коэффициент диффузии кислорода.
Считая диффузию кислорода доминирующим процессом, пренебрежем на данном временном интервале взаимодействием кислородсодержащего прекурсора с углеродом (${{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$$ \ll $ t0). В нулевом приближении по β, решение системы уравнений (9) имеет вид:
(10)
$\left\{ \begin{gathered} {{{\tilde {n}}}_{o}}\left( {z,\tau } \right) = 1 - erf\left( {\frac{z}{{2\sqrt {D\tau } }}} \right) \hfill \\ {{{\tilde {n}}}_{{c1}}}\left( {z,\tau } \right) = {{n}_{{c0}}}\left( {z,\tau } \right)\exp ( - \alpha \tau )\exp \left( { - \beta \int\limits_0^{\tau } {{{{\tilde {n}}}_{o}}\left( {z,t} \right)dt} } \right) \hfill \\ {{{\tilde {n}}}_{{c2}}}\left( {z,\tau } \right) = \alpha \int\limits_0^{\tau } {{{{\tilde {n}}}_{{c1}}}\left( {z,t} \right)dt} \hfill \\ \end{gathered} \right..$По завершении подачи кислородсодержащего прекурсора начинается продувка аргоном. В данных условиях можно полагать, что концентрация свободного кислрода на поверхности равняется нулю. Система уравнений, описывающая изменение концентрации углерода в пленке, на данном временном интервале примет вид:
(11)
$\left\{ \begin{gathered} \frac{{\partial {{n}_{o}}}}{{\partial \tau }} = D\frac{{{{\partial }^{2}}{{n}_{o}}}}{{\partial {{z}^{2}}}} - \beta {{n}_{o}}{{n}_{{c1}}} \hfill \\ \frac{{\partial {{n}_{{c1}}}}}{{\partial \tau }} = - \beta {{n}_{o}}{{n}_{{c1}}} - \alpha {{n}_{{c1}}} \hfill \\ \frac{{\partial {{n}_{{c2}}}}}{{\partial \tau }} = \alpha {{n}_{{c1}}} \hfill \\ \end{gathered} \right.\quad \left\{ \begin{gathered} {{n}_{o}}(z,0) = {{{\tilde {n}}}_{o}}(z,{{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}),\,\,\,\,{{n}_{o}}(0,\tau ) = 0,\,\,\,\,{{n}_{o}}(\infty ,\tau ) = 0 \hfill \\ {{n}_{{c1}}}(z,0) = {{{\tilde {n}}}_{{c1}}}(z,{{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}) \hfill \\ {{n}_{{c2}}}(z,0) = {{{\tilde {n}}}_{{c2}}}(z,{{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}) \hfill \\ \end{gathered} \right..$Ее решение:
(12)
$\left\{ \begin{gathered} {{n}_{o}}(z,\tau ) = \frac{1}{{2\sqrt {\pi Dt} }}\int\limits_0^\infty {{{{\tilde {n}}}_{o}}\left( {\varsigma ,{{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} \right)\left( {\exp \left( { - \frac{{{{{(z - \xi )}}^{2}}}}{{4D\tau }}} \right) - \exp \left( { - \frac{{{{{(z + \xi )}}^{2}}}}{{4D\tau }}} \right)} \right)d\xi } \hfill \\ {{n}_{{c1}}}(z,\tau ) = {{{\tilde {n}}}_{{c1}}}\left( {z,{{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} \right)\exp ( - \alpha \tau )\exp \left( { - \beta \int\limits_0^{\tau } {{{n}_{o}}(z,t)dt} } \right) \hfill \\ {{n}_{{c2}}}\left( {z,\tau } \right) = {{{\tilde {n}}}_{{c2}}}\left( {z,{{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} \right) + \alpha \int\limits_0^{\tau } {{{n}_{{c1}}}\left( {z,t} \right)dt} \hfill \\ \end{gathered} \right..$Подставляя (10) в (12) получим выражения для концентрации углерода в различных состояниях.
(13)
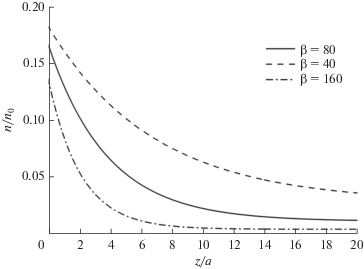
$\left\{ \begin{gathered} {{n}_{{c1}}}(z,\tau ) = {{n}_{{c0}}}\left( {z,\tau } \right)\exp ( - \alpha ({{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} + \tau ))\exp \left( { - \beta \int\limits_0^{{{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} {{{{\tilde {n}}}_{o}}\left( {z,t} \right)dt} } \right)\exp \left( { - \beta \int\limits_0^{\tau } {{{n}_{o}}(z,t)dt} } \right) \hfill \\ {{n}_{{c2}}}\left( {z,\tau } \right) = \alpha \int\limits_0^{{{t}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}} {{{{\tilde {n}}}_{{c1}}}\left( {z,t} \right)dt} + \alpha \int\limits_0^{\tau } {{{n}_{{c1}}}\left( {z,t} \right)dt} \hfill \\ \end{gathered} \right..$На рис. 3 представлены пространственные профили концентрации углерода при различных значениях вероятности реакции кислорода с углеродсодсодержащими лигандами (β). Изменение β в первую очередь определяет ширину приповерхностного слоя с избыточной концентрацией углерода. Таким образом, изменением температуры подложки можно влиять на ширину приповерхностного слоя, а также значением объемной и поверхностной концентраций примеси углерода. Для соответствия профиля углерода экспериментальным кривым (рис. 1) значение коэффициента β было выбрано равным 80. Точное решение первого уравнения системы (11) при β = 80 и nc0 = 1 дает профиль концентрации кислорода, отличающийся от полученного результата (12), не более чем на 3%, что говорит о возможности использования указанного предположения.
Коэффициент α, отвечающий за переход углерода в стабильные состояния, может быть определен из соответствия значений концентрации углерода в объеме пленки и при расчетах равняется α = 0.03.
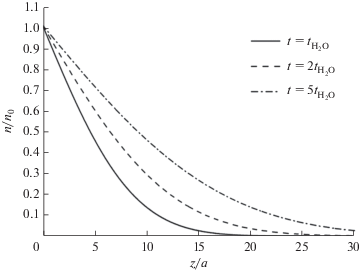
Расчеты показывают, что профиль концентрации углерода выходит на насыщение после ~20–30 ALD циклов. Поэтому, для уменьшения глубины залегания избыточного (по сравнению с объемными значениями) углерода, достаточно на последних 20–30 ALD циклах увеличить время подачи кислородсодержащего прекурсора. Увеличение продолжительности подачи кислородсодержащего прекурсора в процессе выращивания пленки методом ALD способствует более глубокому проникновению кислорода в подложку (рис. 2). В результате, концентрация углерода должна снижаться в связи с ростом количества реакций с кислородом. На рис. 4 показаны кривые изменения профиля концентрации углерода с глубиной при различных временах подачи кислородсодержащего прекурсора. Как можно видеть, с ростом времени подачи кислорода падает не только поверхностная и объемная концентрация углерода, а также ширина приповерхностного слоя с избыточной концентрацией углерода. При этом концентрация углерода выходит на насыщение соответствующее новому, более низкому, объемному значению. Из рис. 4 видно, что увеличение времени подачи кислородсодержащего прекурсора приводит к пропорциональному снижению приповерхностного слоя с избыточным содержанием углерода. Для того, чтобы полностью избавиться от избыточного углерода в пленке необходимо резко (~10 раз) повысить время подачи кислородсодержащего прекурсора на последних (1–3) ALD циклах.
ЗАКЛЮЧЕНИЕ
В данной работе развита теоретическая модель объясняющая наличие избыточной концентрации примеси углерода в приповерхностных монослоях оксидной пленки, выращенной методом ALD из металлорганического прекурсора. Модель основана на диффузии кислорода из объема газовой фазы вглубь пленки и вывода из нее примесного углерода посредством образования быстро диффундирующих молекул CO/CO2. Предлагается методика снижения избыточной концентрации примеси углерода в приповерхностном слое до объемного значения путем ступенчатого увеличения продолжительности времени подачи кислородсодержащего прекурсора на последних 20–30 ALD циклах, перед завершением роста пленки до заданной толщины.
Работа выполнена в рамках Государственного задания ФТИАН им. К.А. Валиева РАН Минобрнауки РФ по теме № 0066-2019-0004.
Список литературы
Atomic Layer Deposition of Nanostructured Materials // Ed. by Nicola Pinna and Mato Knez. Wiley-VCH Verlag & Co. KGaA, Germany 2012, 435 p.
Sultan S.M., Clark O.D., Masaud T.B., Fang Q., Gunn R., Hakim M.M.A., Sun K., Ashburn P., Chong H.M.H. Remote plasma enhanced atomic layer deposition of ZnO for thin film electronic applications // Microelectronic Engineering. 2012. V. 97. P. 162–165.
Alen P., Juppo M., Ritala M., Sajavaara T., Keinonen J., Leskela M. Atomic Layer Deposition of Ta(Al)N(C) Thin Films Using Trimethylaluminum as a Reducing Agent. // Journal of The Electrochemical Society. 2001. V. 148(10). P. G566–G571.
Knoops H.C.M., Peuter K., Kessels W.M.M. Redeposition in plasma-assisted atomic layer deposition: Silicon nitride film quality ruled by the gas residence time // Appl. Phys. Lett. 2015. V. 107. P. 014102.
Abdulagatov A.I., Ramazanov Sh.M., Dallaev R.S., Murliev E.K., Palchaev D.K, Rabadanov M.Kh., Abdulagatov I.M. Atomic Layer Deposition of Aluminum Nitride Using Tris(diethylamido)aluminum and Hydrazine or Ammonia. // Russian Microelectronics. 2018. V. 47. № 2. P. 118–130.
Cho M., Kim J.H., Hwang C.S. Effects of carbon residue in atomic layer deposited HfO2 films on their time-dependent dielectric breakdown reliability // Appl. Phys. Lett. 2007. V. 90. P. 182907.
Kwon O.K., Kim J.H., Park H.S., Kanga S.W. Atomic layer deposition of ruthenium thin films for copper glue layer // J. Electrochemical Society. 2004. V. 151(2). P. G109–G112.
Kinnunena S.A., Malma J., Arstila K., Lahtinenb M., Sajavaara T. This is an electronic reprint of the original article. This reprint may differ from the original in pagination and typographic detail // Nuclear Inst. and Methods in Physics Research B. 2017. V. 406. P. 152–155.
Hwan J.H., Kim H.Y., Lee S.C., Park K.J.-S., Jeon D., Chung T.-M., Kim C.G. Growth of tantalum nitride film as a Cu diffusion barrier by plasma-enhanced atomic layer deposition from bis((2-(dimethylamino)ethyl)(methyl)amido)methyl(tert-butylimido)tantalum complex // Applied Surface Science. 2016. V. 362. P. 176–181.
An K.-S., Cho W., Sung K., Lee S.S., Kim Y. Preparation of Al2O3 Thin Films by Atomic Layer Deposition Using Dimethylaluminum Isopropoxide and Water and Their Reaction Mechanisms // Bull. Korean. Chem. Soc. 2003. V. 24(11). P. 1659–1663.
Choi S.-W., Jang C.-M., Kim D.-Y., Ha J.-S. Plasma Enhanced Atomic Layer Deposition of Al2O3 and TiN // J. Korean Physical Society. 2003. V. 42. P. S975–S979.
Rai V.R., Vandalon V., Agarwal S. Surface Reaction Mechanisms during Ozone and Oxygen Plasma Assisted Atomic Layer Deposition of Aluminum Oxide // Langmuir. 2010. V. 26(17). P. 13732–13735.
Musschoot J. Advantages and challenges of plasma enhanced atomic layer deposition // Universiteit Gent Faculteit Wetenschappen Vakgroep Vaste-stofwetenschappen Krijgslaan 281. 2001. S1 B-9000 Gent, Belgie.
Lee K., Kim K., Jeon H. Characteristics of Cobalt Films Deposited by Using a Remote Plasma ALD Method with a CpCo(CO)2 Precursor // J. Korean Physical Society. 2007. V. 50(4). P. 1141–1146.
Fan J.-B., Liu H.-X., Ma F., Zhuo Q.-Q., Hao Y. Influences of different oxidants on the characteristics of HfAlOx films deposited by atomic layer deposition // Chin. Phys. B 2013. V. 22(2). P. 027702.
Haeberle J., Henkel K., Gargouri H., Naumann F., Gruska B., Arens M., Tallarida M., Schmeißer D. Ellipsometry and XPS comparative studies of thermal and plasma enhanced atomic layer deposited Al2O3-films // Beilstein J. Nanotechnol. 2013. V. 4. P. 732–742.
Rai V.R., Vandalon V., Agarwal S. Surface Reaction Mechanisms during Ozone and Oxygen Plasma Assisted Atomic Layer Deposition of Aluminum Oxide // Langmuir. 2010. V. 26(17). P. 13732–13735.
Hackley J.C., Gougousi T. Properties of atomic layer deposited HfO2 thin films // Thin Solid Films. 2009. V. 517. P. 6576–6583.
Köhler C., Hajnal Z., Deák P., Frauenheim T., Suhai S. Theoretical investigation of carbon defects and diffusion in a-quartz // Phis. Rev. B. 2001. V. 64. P. 085333.
Autry L., Ramprasad R. The migration and formation energies of N-interstitials near [001] Fe surfaces: an ab initio study // J. Mater. Sci. 2013. V. 48. P. 6542–6548.
Yildiz B. “Stretching” the energy landscape of oxides–Effects on electrocatalysis and diffusion // Mrs Bulletin. 2014. V. 39(2). P. 147–156.
Kitabatake M., Fons P., Greene J.E. Molecular dynamics and quasidynamics simulations of the annealing of bulk and near-surface interstitials formed in molecular-beam epitaxial Si due to low-energy particle bombardment during deposition // J. Vac. Sci. Technol A. 1991. V. 9(1). P. 91–97.
Горелкин И.И. Молекулярное наслаивание как способ управления наноструктурированием веществ и материалов. // Актуальные инновационные исследования: наука и практика 2. 2010. С. 17.
Soto C., Tysoe W.T. The reaction pathway for the growth of alumina on high surface aria alumina and in ultrahigh by a reaction between trimethilaliminum and water // J. Vac. Sci. Technol. A. 1991. V. 9(5). P. 2686–2695.
Rosa E.B.O., Baumvol I.R.J., Morais J., Almeida R.M.C. Diffusion reaction of oxygen in aluminum oxide films on silicon // Phis. Rev. B. 2002. V. 65. P. 121303(R).
Nakamura R., Toda T., Tsukui S., Tane M., Ishimaru M., Suzuki T., Nakajima H. Diffusion of oxygen in amorphous Al2O3, Ta2O5, and Nb2O5 // J. Appl. Phys. 2014. V. 116. P. 033504.
Nabatame T., Yasuda T., Nishizawa M., Ikeda M., Horikawa T., Toriumi A. Comparative Studies on Oxygen Diffusion Coefficients for Amorphous and γ-Al2O3 Films using 18O Isotope // Jpn. J. Appl. Phys. 2003. V. 42(12). P. 7205–7208.
Дополнительные материалы отсутствуют.
Инструменты
Микроэлектроника