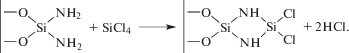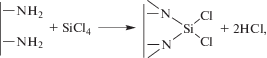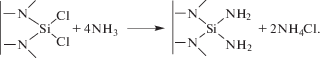Микроэлектроника, 2019, T. 48, № 4, стр. 272-278
Атомно-слоевое осаждение пленок нитрида кремния на арсениде галлия с применением тлеющего разряда
Ю. К. Ежовский 1, *, С. В. Михайловский 1
1 Санкт-Петербургский государственный технологический институт (технический университет)
190013 Санкт-Петербург, Московский проспект, 26, Россия
* E-mail: ezhovski1@mail.ru
Поступила в редакцию 25.10.2018
После доработки 03.12.2018
Принята к публикации 16.12.2018
Аннотация
Рассмотрен процесс формирования методом атомно-слоевого осаждения (молекулярного наслаивания) кремний-азотных наноструктур на поверхности GaAs c ориентацией (100) и (110). Синтез осуществляли в вакуумной установке с применением паров SiCl4 и NH3 в диапазоне температур 423–723 К и с активацией процесса тлеющим разрядом на стадии подачи аммиака. Определены условия роста наноструктур нитрида кремния и слоевого механизма их формирования. Установлено, что при температурах синтеза более 573 K прирост толщины слоя нитрида кремния достигает ≈0.5 нм/цикл, что, по-видимому, объясняется участием гидразина в процессе формирования пленок.
ВВЕДЕНИЕ
Разработка методов получения наноразмерных пленок, позволяющих контролировать их состав и толщину до уровня одного монослоя, представляет важную задачу тонкопленочных технологий для многих отраслей промышленности, среди которых микроэлектроника стоит в первых рядах. Одним из методов, отвечающий таким требованиям, является разработанный в СССР в 60-х гг. XX в. группой В.Б. Алесковского метод молекулярного наслаивания (МН) [1–3]. Несколько позднее он получил независимое развитие за рубежом сначала под наименованием “атомно-слоевая эпитаксия”, а затем – “атомно-слоевое осаждение” (АСО). В настоящий момент АСО (МН) зарекомендовал себя не только перспективным, но и, во многом, незаменимым методом в производстве современного микроэлектронного оборудования [4–7].
Метод молекулярного наслаивания заключается в проведении с химически определенной последовательностью циклически чередующихся реакций функциональных групп (или иных реакционных центров) на поверхности твердой матрицы с соответствующим компонентом (прекурсором элемента, входящего в состав растущей пленки) из газовой или жидкой фазы. Эти реакции сопровождаются направленным присоединением атомов или атомных группировок с образованием химически связанного с матрицей слоя структурных единиц, из которых при многократном повторении цикла послойно наращивается твердое вещество. При этом каждая последующая реакция проводится только после полного завершения предыдущей с удалением избытка реагента и ее продуктов (не связанных с твердой фазой).
Рассмотренный в работе [8] синтез, осуществляемый за счет последовательных циклических реакций хемосорбции тетрахлорида кремния и аммиака на поверхности кремния (100), показал, что формирование слоев нитрида кремния в этом случае происходит при температурах не ниже 673 К. В то же время, GaAs, представляющий значительный интерес, как и другие полупроводники группы AIIIBV, имеет достаточно высокую активность поверхностных гидроксильных групп [9], но обладает более низкой термостабильностью по сравнению с кремнием. Таким образом, формирование кремний-азотных наноструктур на его поверхности необходимо осуществлять при более низких температурах. Существенно снизить активационный барьер поверхностной реакции хемосорбции аммиака (а именно эта стадия лимитирует процесс роста нитрида кремния) можно, используя плазму на стадии его подачи, образуемую, например, при разряде.
В настоящей работе представлены результаты исследований процесса синтеза кремний-азотных наноструктур методом АСО на поверхности арсенида галлия и показаны особенности их формирования при инициировании хемосорбции аммиака тлеющим разрядом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез наноструктур осуществляли в вакуумной установке при давлении остаточных газов не выше 10–1 Па и давлении паров реагентов 10–13 Па путем попеременной хемосорбции паров четыреххлористого кремния и аммиака в интервале температур 423–723 К. Изучение кинетики хемосорбции тетрахлорида кремния и аммиака на кремнии показало [8], что лимитирующей стадией процесса является хемосорбция аммиака, участвующего в целом ряде параллельно и последовательно протекающих процессов. Это увеличивало необходимое для него время контакта для полного протекания процесса в 4 раза по сравнению с временем хемосорбции тетрахлорида кремния, поэтому в данной работе импульс тлеющего разряда подавался только в момент напуска в реактор аммиака. Длительность импульса зависела от температуры подложки, и ее варьировали в интервале 1–10 с, а ток разряда составлял 50–80 мА. Как будет показано далее, оптимальное время разряда в условиях синтеза слоев составило 3–5 с.
В качестве подложек в работе использовали монокристаллические пластины арсенида галлия АГЧТ-23-17 с ориентацией (100) и эпитаксиальные структуры АГЭ-4-16 с ориентацией (110). Пластины предварительно обрабатывали в травителе CH3OH : Br (100 : 1) с последующей промывкой в метаноле и бидистиллированной воде. Подложки помещали в реактор в зону разряда без подачи на них потенциала (плавающий потенциал).
Толщину синтезируемых слоев определяли по эллипсометрическим измерениям поляризационных параметров Δ и Ψ и рассчитывали в приближении однослойной модели Друде–Тронстона [10]. Параметры Δ и Ψ измеряли на эллипсометре, собранном по схеме PQSA [10] с фиксированным компенсатором. В качестве источника линейно поляризованного света использовался лазер ЛГ-75 с длиной волны излучения 632.8 нм. Для повышения точности измерений осуществлялась магнитная модуляция светового луча и погрешность в определении параметров Δ и Ψ не превышала ±0.1'. Слои синтезировали толщиной до 20 нм.
Состав слоев контролировали по данным рентгено-фотоэлектронной спектроскопии (РФЭС) с использованием спектрометров НР-5950А (излучение AlKα c ${{Е }_{{{{K}_{{\alpha }}}}}}$ = 1486 эВ). Отсчет энергии осуществлялся по углеродному стандарту С1s1/2 c Ест = 285.0 эВ.
Максимальная глубина проникновения зонда в поверхностный слой при указанных энергиях не превышала 8 нм [11]. Идентификацию энергетических линий исследуемых элементов (Еs) проводили по данным работ [11, 12], и состав слоев определяли с использованием соотношения:
(1)
$\frac{{{{I}_{1}}}}{{{{I}_{2}}}} = \frac{{{{n}_{1}}{{\sigma }_{1}}\sqrt {{{E}_{{{{K}_{2}}}}}} }}{{{{n}_{2}}{{\sigma }_{2}}\sqrt {{{E}_{{{{K}_{1}}}}}} }},$Состав слоев идентифицировали также по контролю их показателя преломления, определяемому эллипсометрически по методу Холмса [10].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Один цикл молекулярного наслаивания представлял собой последовательную однократную обработку поверхности парами SiCl4 и NH3 с промежуточным удалением избытка реагентов и газообразных продуктов реакции. Взаимодействии паров галогенида кремния с гидроксильными группами исходной поверхности (знак | в схемах реакций) можно представить следующей схемой:
(1а)
${{(|--{\text{OH}})}_{m}} + {\text{SiC}}{{{\text{l}}}_{4}} \to {{(|--{\text{O}})}_{m}}{\text{SiC}}{{{\text{l}}}_{{4--m}}} + m{\text{HCl}}{\text{.}}$При последующей обработке аммиаком поверхности, модифицированной кремний-хлоридными группами, происходит образование кремний-аминных/иминных групп:
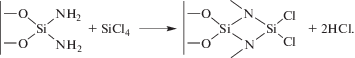
(1б)
${{(|--{\text{O}})}_{m}}{\text{SiC}}{{{\text{l}}}_{{4--m}}} + (4--m){\text{N}}{{{\text{Н }}}_{3}} \to {{(|--{\text{O}})}_{m}}{\text{SiN}}{{{\text{Н }}}_{{4--m}}} + (n--m){\text{HCl}}.$Реакции (1а) и (1б) соответствуют первому циклу МН. При последующем синтезе (т.е. увеличении числа циклов) могут протекать аналогичные реакции, за исключением того, что теперь SiCl4 должен взаимодействовать, в основном, не с гидроксильными, а с группами –NНx.
Следует отметить, что сдвиг равновесия реакции (1б) вправо достигается связыванием выделяющегося HCl парами аммиака и образованием хлорида аммония, который при повышенных температурах полностью десорбируется. При синтезе кремний-азотных слоев попеременной обработкой поверхности парами SiCl4 и NH3 последний может выступать и как протоноакцетор, что активирует хемосорбцию SiCl4 на следующем цикле МН не удалившимися на предыдущем цикле остатками NH3.
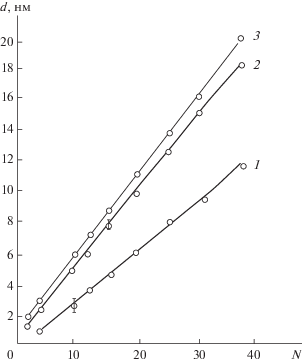
Было установлено (рис. 1), что толщина формируемых в условиях эксперимента кремний-азотных структур d линейно зависит от числа циклов N:
где d0 – коэффициент пропорциональности, показывающий усредненную толщину пленки, получаемой за один цикл МН. Он характеризует механизм формирования и строение синтезированного слоя. Тип и ориентация поверхности подложки практически не оказывали влияние на формирование слоя.Рис. 1.
Зависимость толщины кремний-азотной пленки (d), от числа циклов попеременной обработки (N) поверхности GaAs тетрахлоридом кремния и аммиаком. Температура синтеза: 1 – 453 К; 2 – 523 К; 3 ‒ 623 К. (Время разряда τр = 5 с.)
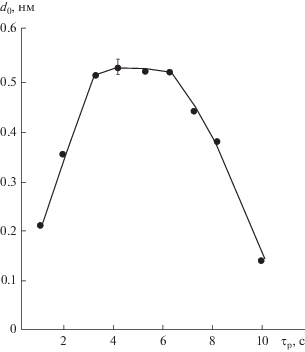
Линейность зависимостей, представленных на рис. 1, указывает на незатухающий характер реакций и сохраняющуюся химическую активность поверхностных группировок. Сопоставление величины d0, получившей название “параметр роста слоя”, с межслоевым расстоянием кремний-азот позволяет оценить степень заполнения поверхности и служит критерием для определения механизма формирования слоев. Наибольший интерес представляет слоевой механизм, который можно реализовать в неравновесных условиях реакций хемосорбции SiCl4 и NH3 (1а), (1б) при предельном гидроксилировании поверхности и достаточной активности ОН-групп.
Поскольку гидроксильные группы арсенида галлия в поверхностных реакциях проявляют достаточно высокие протонодонорные свойства [9], а топология гидроксильного покрова поверхности при 473 К < Тп < 673 К может обеспечить химическую связь молекул галогенидов элементов не более чем с двумя гидроксильными группами [9], то можно полагать, что и в реакциях (1а), (1б) m ≈ 2.
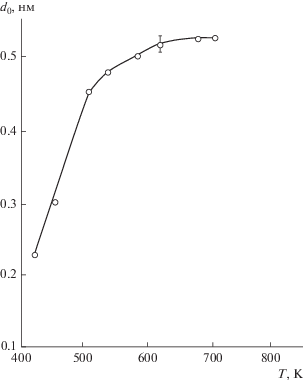
Особенностью динамики роста кремний-азотных нанослоев по сравнению с оксидными [1] является возрастание угла наклона прямых зависимостей d = f(N) (рис. 1), а, следовательно, и параметра роста d0, с увеличением температуры синтеза (рис. 2). Это указывает на активационный характер поверхностных реакций и увеличение выхода синтезируемого продукта. Однако сделать однозначные выводы о составе синтезированных слоев можно только на основе химического анализа.
Рис. 2.
Влияние температуры подложки на прирост толщины кремний-азотной пленки за один цикл попеременной обработки поверхности GaAs (d0) аммиаком и тетрахлоридом кремния. (Время разряда τр = 5 с.)
Анализ спектров РФЭС образцов, полученных при температурах синтеза 473–773 К с применением аммиачной плазмы и с толщиной кремний-азотного слоя до 20 нм, показал наличие на поверхности подложки азота, кремния, кислорода, углерода, а также следов хлора. Присутствие хлора обусловлено, по всей вероятности, существованием поверхностных кремний-хлоридных группировок. Наибольший интерес представляют рентгено-электронные спектры образцов в области энергии связи азота NIS (рис. 3), так как для них наблюдали отличия, связанные с температурными режимами синтеза. Это позволило выявить условия роста пленок нитрида кремния.
Рис. 3.
Рентгено-электронные спектры энергии связи (Есв) N1S кремний-азотных слоев, полученных на GaAs в условиях аммиачной плазмы при температурах синтеза: 1 – 473 К; 2 – 673 К. Толщина слоя 15 нм.
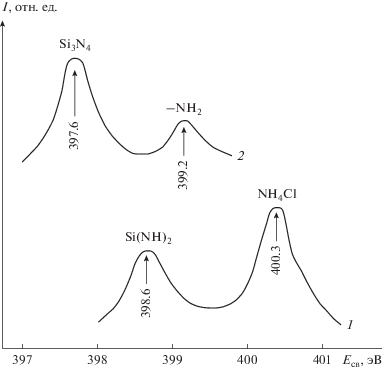
В спектрах образцов, полученных при 473 К < < Т < 523 К (рис. 3, кривая 1), преобладающим является максимум энергии связи со значением 398.6 эВ, который соответствует состоянию азота в иминной форме (>NH) [12]. Это означает наличие на поверхности образцов силикоимида Si(NH)2, который может образовываться по реакции:
Пик со значением 400.3 эВ можно отнести к присутствию на поверхности атомов азота в состоянии, соответствующем хлориду аммония. Он появляется в спектре образцов, синтезированных только при пониженных температурах (Т = 473 К), и полностью исчезает для образцов, полученных уже при Т = 523 К.
При Т > 523 К (рис. 3, кривая 2) преобладающий максимум энергии связи NIS лежит в области 397.6 эВ, что соответствует азоту в нитридной форме [12]. Таким образом, при Тп > 523 К преобладающей, по-видимому, становится реакция образования продукта с нитридной связью кремний–азот:
Пик со значением 399.2 эВ принадлежит поверхностным группам NH2, еще не вступившим в реакцию с хлоридом кремния.
Увеличение выхода нитридной формы с повышением температуры (Т > 523 К), несмотря на возможное снижение поверхностной концентрации гидроксильных групп, вызвано, как мы полагаем, тем, что в этих условиях начинает интенсивно протекать процесс нуклеофильного замещения на исходной поверхности как гидроксильных групп, так и оксидных группировок:
(4)
$|--{\text{OH}},(|{\text{ = O}}) + {\text{N}}{{{\text{H}}}_{3}} \to \,|--{\text{N}}{{{\text{H}}}_{2}} + {{{\text{Н }}}_{2}}{\text{О }}.$Оксидные группировки образуются на поверхности арсенида галлия в процессе дегидроксилирования, т.е. со снижением степени гидроксилирования исходной поверхности с повышением температуры концентрация оксидных группировок увеличивается. Процессы схемы (4) приводят к появлению активных аминных групп и интенсифицирует процесс формирования нитридной формы, т.е. при этом даже на начальных стадиях хемосорбция тетрахлорида кремния преимущественно осуществляется уже на аминных группах:
а не по схеме (1а). Последующая хемосорбция аммиака снова приводит к их появлению:Таким образом, формирование слоя нитрида кремния при Т > 523 К обеспечивается чередованием реакций (5) и (6). Следует отметить, что даже небольшая доля аминных групп, должна подавлять протонизацию гидроксильных групп за счет индуктивного эффекта [9]. Это, в свою очередь, должно приводить к малому выходу силикоимидной формы. Действительно, при повышении температуры прирост толщины слоя нитрида кремния существенно возрастал до d0≈ 0.5 нм/цикл (Тп > 573 К, рис. 2 ), что почти вдвое превышает расстояние кремний-азот в структуре нитрида. Этот результат, по-видимому, можно объяснить тем, что при воздействии разряда в аммиаке на начальных стадиях разряда образуется гидразин (как результат рекомбинации радикалов •NH2 между собой или радикала •NH с молекулой NH3), который может хемосорбироваться по схеме:
В этом случае, при последующей обработке тетрахлоридом кремния формируется уже два монослоя с нитридной связью кремний–азот:
О возможности образования гидразина в плазме аммиака известно достаточно давно. При этом он может образовываться как в тлеющем разряде, так и в других видах плазмы [13–16], но всегда есть оптимальные условия (вид, время и величина энергетического воздействия, температура, состав газовой смеси и концентрация компонентов, давление, компоновка системы, наличие катализатора) его существования, т.к. далее гидразин также может разлагаться (особенно в закрытой системе).
Действительно, определение оптимального времени разряда в объеме реактора, в течение которого происходило его максимальное инициирующее действие на процесс хемосорбции аммиака, показало экстремальный характер этой зависимости (рис. 4). Если время разряда в реакторе менее 3 с, то инициирующее действие минимально, что, на наш взгляд, вызвано малой концентрацией образующегося гидразина или азот-водородных радикалов (•NH2 и •NH). При 3–6 с действие разряда в данных условиях максимально. Увеличение времени разряда более 7 с приводит к резкому снижению толщины слоя за один цикл обработки, что, по всей вероятности, связано с уменьшением в газовой фазе концентрации гидразина и образованием малоактивных форм азота или даже плазмохимическим подтравливаннем образовавшихся структур избыточным количеством активных ионов азота, образующихся при длительном воздействии разряда.
ЗАКЛЮЧЕНИЕ
Установлено, что применение тлеющего разряда на стадии подачи аммиака при попеременной обработке подложки парами SiCl4 и NH3 приводит к интенсификации процесса формирования слоев нитрида кремния, снижает более чем на 100° рабочую температуру синтеза по сравнению с кремниевой матрицей [8] и может способствовать увеличению параметра роста до d0 ≈ 0.5 нм/цикл. Последнее, по всей вероятности, вызвано появлением в газовой фазе гидразина, и максимальное проявление этого эффекта наблюдается при времени разряда 3–6 с. Полученные результаты могут быть использованы для дальнейших исследований синтеза пленок нитрида кремния (и других элементов) методом АСО с применением аммиачной плазмы. При этом инициировать плазму для генерации чистого гидразина можно в проточной системе, в зоне, отделенной от реакционной, где протекает модифицирование поверхности твердофазной матрицы, что, очевидно, имеет много положительных моментов. Похожий подход применялся различными исследователями в других химических процессах [15, 16]. Следует отметить, что в этом случае АСО (МН) нитридов с применением плазмы может быть использован даже для модифицирования пористых матриц с высокой удельной поверхностью при атмосферном давлении.
Работа выполнена при частичной финансовой поддержке Минобрнауки в рамках выполнения государственного задания (проект 16.1798.2017/4.6).
Список литературы
Ежовский Ю.К. Формирование и диэлектрические характеристики нанослоев оксидов тантала и алюминия // Микроэлектроника. 2013. Т. 42. № 6. С. 447–453.
Ahvenniemi E., Akbashev A.R., Ali S. et al. Review Article: Recommended reading list of early publications on atomic layer deposition – Outcome of the “Virtual Project on the History of ALD” // J. Vac. Sci. Technol. A. 2017. V. 35. № 1. Article № 010801. 13 p.
Malygin A.A., Drozd V.E., Malkov A.A., Smirnov V.M., From V.B. Aleskovskii’s ‘framework’ hypothesis to the method of molecular layering/atomic layer deposition // Chemical Vapor Deposition. 2015. V. 21. I. 10. P. 216–240.
Kaariainen T., Cameron D., Kaariainen M.-L., Sherman A. Atomic Layer Deposition: Principles, Characteristics, and Nanotechnology Applicatons, 2nd ed. // Hoboken, New Jersey: John Wiley & Sons + Salem, Massachusetts: Scrivener Publishing LLC. 2013. 256 p.
Tripathi T.S., Karppinen M. Atomic Layer Deposition of p-Type Semiconducting Thin Films: a Review // Advanced Materials Interfaces. 2017. V. 4. I. 24. Article № 1 700 300. 16 p.
Sobel N., Hess C. Nanoscale Structuring of Surfaces by Using Atomic Layer Deposition // Angew. Chem. – Int. Ed. 2015. V. 54. I. 50. P. 15 014–15 021.
Belyansky M. Thin Film Deposition for Front end of Line: the Effect of the Semiconductor Scaling, Strain Engineering and Pattern Effects / In Book: Handbook of Thin Film Deposition, 4th ed., ed. by Seshan K. & Schepis D. // Kidlington, Oxford: William Andrew, Elsevier. 2018. 470 p. P. 231–268.
Ежовский Ю.К. Молекулярное наслаивание нанослоев нитрида кремния // Журн. Физич. химии. 2017. Т. 91. № 7. С. 1207–1210.
Ежовский Ю.К. Реакционная способность поверхности твердых тел в процессах химической нанотехнологии низкоразмерных систем // Поверхность. Рентгеновские, синхротронные и нейтронные исследования. 2015. № 5. С. 43–48.
Громов В.К. Введение в эллипсометрию. Л.: Изд. ЛГУ, 1986. 192 с.
Нефедов В.И., Черепин В.Т. Физические методы исследования поверхности твердых тел. М.: Наука, 1983. 296 с.
Нефедов В.И. Рентгено-электронная спектроскопия химических соединений. М.: Химия, 1984. 256 с.
Рубцова Е.А., Еремин Е.Н. Гетерогенно-каталитические эффекты при реакциях аммиака в электрических разрядах. I. Тлеющий разряд // Журн. Физич. химии. 1968. Т. 42. № 4. С. 1022–1026.
Рубцова Е.А., Еремин Е.Н. Гетерогенно-каталитические эффекты при реакциях аммиака в электрических разрядах. III.Барьерный разряд // Журн. Физич. химии. 1971. Т. 45. № 6. С. 1499–1503.
Yi Y., Zhang R., Wang L., Yan J. et al. Plasma-Triggered CH4/NH3 Coupling Reaction for Direct Synthesis of Liquid Nitrogen-Containing Organic Chemicals // ACS Omega. 2017. V. 2. I. 12. P. 9199−9210.
Mitchell J.W., Holland R.A. Microwave plasma in situ generation of nitride reagents // Materials Letters. 2006. V. 60. I. 12. P. 1524–1526.
Дополнительные материалы отсутствуют.
Инструменты
Микроэлектроника