Журнал физической химии, 2020, T. 94, № 9, стр. 1333-1336
Термохимические свойства дибензоата трифенилсурьмы Ph3Sb(OC(O)Ph)2
Д. В. Лякаев a, А. В. Маркин a, *, Н. Н. Смирнова a, А. В. Князев a, В. В. Шарутин b, О. К. Шарутина b
a Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
b Национальный исследовательский Южно-Уральский государственный университет
Челябинск, Россия
* E-mail: markin@calorimetry-center.ru
Поступила в редакцию 09.12.2019
После доработки 09.12.2019
Принята к публикации 10.12.2019
Аннотация
В калориметре сгорания со статической бомбой определена энергия сгорания кристаллического дибензоата трифенилсурьмы при Т = 298.15 K. По полученным экспериментальным данным рассчитаны стандартная энтальпия сгорания указанного вещества в кристаллическом состоянии при T = 298.15 K. Проведен расчет стандартных функций образования изученного соединения ∆fH°, ∆fG° в кристаллическом состоянии при T = 298.15 K.
Органические производные сурьмы имеют перспективу применения при лечении онкологических заболеваний [1–6]; в борьбе с болезнетворными организмами, в качестве биоцидов, фунгицидов [7–9]; в тонком органическом синтезе в качестве реагентов и компонентов катализаторов [10–12] и для получения металлосодержащих полимеров [13–15]. Органические комплексы сурьмы используются для разработки новых фотокаталитических и термо-радиорезистентных материалов [16–19]. Кроме того, различные сурьмаорганические соединения проявляют способность поглощения углекислого газа [20, 21].
В связи с широкой областью применения органических производных пятивалентной сурьмы изучение физико-химических свойств новых представителей данного класса соединений остается ключевой задачей многих исследований [22–25]. В частности, информация о термодинамических и термохимических свойствах перспективных соединений сурьмы необходима для расчета и оптимизации технологических процессов с их участием. В работах [26–30] методами адиабатической вакуумной и дифференциальной сканирующей калориметрии были определены термодинамические свойства Ph5Sb и Ph3Sb(OC(O)Ph)2 и нескольких других производных пятивалентной сурьмы типа Ph3SbX2, где X – органические заместители. Термохимические характеристики (ΔcU°, ∆cH°, ∆fH°) Ph3Sb(OC(O)Ph)2 в литературе отсутствуют.
В настоящей работе продолжено калориметрическое исследование термодинамических свойств указанных представителей ряда органических производных сурьмы(V), определена энтальпия сгорания ΔсН°, рассчитаны стандартная энтальпия образования ∆fH°, стандартная функция Гиббса образования ∆fG° в кристаллическом состоянии при T = 298.15 K дибензоата трифенилсурьмы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Характеристика изученного образца
Исследованное соединение было синтезировано и идентифицировано по методике, описанной в работе [31]. Образец дибензоата трифенилсурьмы был получен авторами работы [31] по реакции окислительного присоединения с участием трифенилсурьмы, пероксида водорода и бензойной кислоты (мольное соотношение 1:1:2) в эфире:
(1)
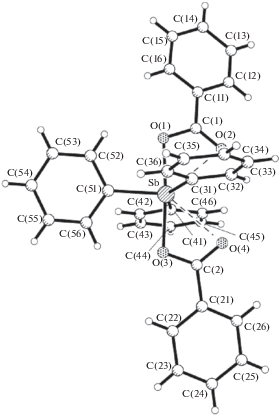
$\begin{gathered} {\text{P}}{{{\text{h}}}_{{\text{3}}}}{\text{Sb}} + 2{\text{PhCOOH}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}} \to \\ \to {\text{P}}{{{\text{h}}}_{{\text{3}}}}{\text{Sb(OC(O)Ph}}{{{\text{)}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Структуру соединения устанавливали методом рентгеноструктурного анализа. На рис. 1 представлено молекулярное строение соединения. Исследование показало, что кристаллы моноклинные a = 19.862(2), b = 15.848(2), c = 16.854(2) Å, α = 90°, β = 90°, γ = 90° V = 5305(1) Å3, пр. гр. Pccn, Z = 8, ρ(расч.) = 1.491 г/см3.
По результатам исследований [31], содержание основного вещества в образце Ph3Sb(OC(O)Ph)2 составляло 99.0 мол. %. Примеси не были идентифицированы, но, учитывая их количество, можно заключить, что они не влияли на значения термодинамических величин в пределах погрешностей их определения.
Аппаратура и методика измерений
Энтальпию сгорания исследуемого соединения определяли в усовершенствованном калориметре В-08МА со статической калориметрической бомбой [32]. Отметим, что калибровку калориметрической системы проводили по эталонной бензойной кислоте марки К-2 (ΔсU = −(26 454.4 ± ± 2.2) Дж/г) при взвешивании на воздухе). Энергетический эквивалент системы W = 14 805 ± ± 3 Дж/K с удвоенным квадратичным отклонением от среднего результата 0.02%.
Образец сжигали при давлении кислорода 3 × × 106 Па в расплавленном парафине, наличие которого, с одной стороны, обеспечивало стандартный подъем температуры в опытах, с другой – создавало условия для полного окисления исходной навески. Газообразные продукты сгорания анализировали на содержание СО2, по количеству которого рассчитывали массу взятого для опыта вещества. Методика проведения анализа газообразных продуктов сгорания приведена в работе [33]. Точность определения СО2, установленная по результатам анализа сгорания эталонной бензойной кислоты, 5 × 10–4 г. Полноту сгорания определяли по отсутствию в продуктах сгорания монооксида углерода путем пропускания исследуемого газа через специальные индикаторные трубки. В пределах погрешности анализа (6 × 10–6 г) CO не был обнаружен. Визуальный осмотр поверхности бомбы не обнаружил никаких следов неполного сгорания вещества. После опыта был проведен рентгенофазовый анализ твердых продуктов сгорания.
Для приведения измеренной величины ∆cU к стандартным условиям (∆cU°) использовали приближенную формулу Уошберна [34, 35]:
где p – начальное давление кислорода в бомбе, атм (обычно 30 атм); ∆cU/a – энергия сгорания углерода, содержащегося в сжигаемом веществе, ккал/моль; а, b, с – индексы в химической формуле сжигаемого вещества. С учетом поправки Уошберна (π) и поправки, обусловленной изменением числа молей газов (Δn), рассчитывали стандартные величины ΔсU° и ΔсН° для реакции сгорания исследуемого вещества. По полученным значениям ΔсН° рассчитывали энтальпию образования ΔfH° соединения в кристаллическом состоянии при Т = 298.15 K.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Энергию сгорания кристаллического дибензоата трифенилсурьмы Ph3Sb(OC(O)Ph)2 определяли в шести опытах. Масса навески исследуемого вещества составляла ∼0.2 г. Данные эксперимента представлены в табл. 1. После опыта проводили анализ продуктов сгорания. По данным рентгенофазового анализа, твердые продукты сгорания дибензоата трифенилсурьмы содержали тетраоксид сурьмы Sb2O4 (85 мас. %), триоксид сурьмы Sb2O3 (15 мас. %). В продуктах сгорания сурьмы в свободном виде не обнаружено.
Таблица 1.
Результаты опытов 1–6 по определению энергии сгорания дибензоата трифенилсурьмы Ph3Sb(OC(O)Ph)2
| Величина | № 1 | № 2 | № 3 | № 4 | № 5 | № 6 |
|---|---|---|---|---|---|---|
| m, г | 0.15068 | 0.13572 | 0.20269 | 0.18579 | 0.11086 | 0.35823 |
| m(пар), г | 0.70670 | 0.72230 | 0.70518 | 0.70988 | 0.71058 | 0.71337 |
| m(х.н.), г | 0.00202 | 0.00245 | 0.00185 | 0.00192 | 0.00196 | 0.00256 |
| W, Дж/г | 14805 | 14805 | 14805 | 14805 | 14805 | 14805 |
| ΔT, K | 2.51096 | 2.53252 | 2.60151 | 2.58479 | 2.44995 | 2.91304 |
| –ΔcU, Дж | 37 174.8 | 37 494.0 | 38 515.4 | 38 267.8 | 36 271.5 | 43 127.6 |
| –ΔcU(пар), Дж | 33 033.7 | 33 762.9 | 32 962.7 | 33 182.4 | 33 215.1 | 33 345.5 |
| –ΔcU(х.н.), Дж | 33.8 | 41.0 | 31.0 | 32.1 | 32.8 | 42.8 |
| ΔcU(сажа), Дж | 5.18 | 4.67 | 6.97 | 6.39 | 3.81 | 12.3 |
| –ΔfU(HNO3), Дж | 5.86 | 2.93 | 5.86 | 2.93 | 5.44 | 9.37 |
| ΔcU(Sb2O3), Дж | 3.98 | 3.59 | 5.36 | 4.91 | 2.93 | 9.47 |
| –∆cUcorr, Дж | 1.94 | 1.75 | 2.61 | 2.39 | 1.43 | 4.61 |
| –ΔcU°, Дж/г | 27 267.2 | 27 215.1 | 27 260.9 | 27 231.3 | 27 273.0 | 27 208.9 |
| −ΔсU°, кДж/моль | 16 232.1 | 16 201.1 | 16 228.3 | 16 210.7 | 16 235.5 | 16 197.4 |
| (–∆Uс = 16217.5 ± 13.7 кДж/моль) | ||||||
Обозначения: m – масса сжигаемого вещества, ∆Т – подъем температуры в опыте с поправкой на теплообмен; ΔcU(пар), ΔcU(х.н.), ΔcU(сажа), ΔfU(HNO3), ΔcU(Sb2O3) – поправки на энергию сгорания парафина, хлопчатобумажной нити, неполноту сгорания углерода, энергии образования водного раствора HNO3 и кристаллического Sb2O3 соответственно; ΔсU° – энергия сгорания исследуемого вещества, приведенная к стандартным условиям. В скобках приведены средние значения.
Погрешность рентгенофазового анализа не превышает 3%, что существенно не искажает экспериментального значения энтальпий сгорания. Поскольку продукты сгорания наряду с тетраоксидом сурьмы содержали триоксид сурьмы, то нами вводились соответствующие поправки на неполное окисление металла:
(3)
${\text{S}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{3}}({\text{кр}}.) + 0.5{{{\text{O}}}_{2}}({\text{г}}) \to {\text{S}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}{\text{(кр}}{\text{.)}}.$Процесс, протекающий в бомбе, может быть описан уравнением:
(4)
$\begin{gathered} {\text{P}}{{{\text{h}}}_{{\text{3}}}}{\text{Sb(OC(O)Ph}}{{{\text{)}}}_{{\text{2}}}}{\text{(кр}}{\text{.)}} + 37.25{{{\text{O}}}_{2}}({\text{г}}) \to \\ \to 32{\text{С}}{{{\text{О}}}_{{\text{2}}}}({\text{г}}) + 12.5{{{\text{Н}}}_{{\text{2}}}}{\text{О}}({\text{ж}}) + 0.5{\text{S}}{{{\text{b}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{4}}}}{\text{(кр}}{\text{.)}}. \\ \end{gathered} $По величине стандартной энтальпии сгорания вещества и стандартной энтальпии образования продуктов сгорания ∆fH°(CO2(г)) = –393.513 ± ± 0.046 кДж/моль [36], ∆fH°(H2O(ж)) = –285.829 ± ± 0.040 кДж/моль) [36], ∆fH°(Sb2O4(кр.)) = = ‒907.509 ± 4.602 [36], рассчитали стандартную энтальпию образования исследуемого соединения в кристаллическом состоянии при T = 298.15 K:
(5)
$\begin{gathered} 31{\text{С}}({\text{гр}}{\text{.}}) + 12.5{{{\text{H}}}_{2}}({\text{г}}) + 2{{{\text{O}}}_{2}}({\text{г}}) + {\text{Sb}}({\text{кр}}{\text{.}}) \to \\ \to {\text{P}}{{{\text{h}}}_{{\text{3}}}}{\text{Sb}}{{({\text{OC(O)Ph}})}_{{\text{2}}}}{\text{(кр}}{\text{.)}}, \\ \end{gathered} $Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта № 19-33-90070).
Список литературы
Sharma P., Perez D., Cabrera A. et al. // Acta Pharmacologica Sinica. 2008. V. 29. P. 881.
Hadjikakou S.K., Ozturk I.I., Banti C.N. et al. // J. Inorg. Biochem. 2015. V. 153. P. 293.
Tiekink E.R.T. // Hematology. 2002. V. 42. P. 217.
Islam A., Rodrigues B.L., Marzano I.M. et al. // European J. Med. Chem. 2016. V. 109. P. 254.
Lin Yu, Yong-Qiang Ma, Guo-Cang et al. // Heteroatom Chemistry. 2004. V. 15. P. 32.
Gielen M., Tiekink E.R.T. // Metallotherapeutic Drug and Metal-based Diagnostic Agents, Wiley, 2005.
Guo-Cang Wang, Yong-Na Lu, Jian Xiao // J. Organomet. Chem. 2005. V. 690. P. 151.
Kensuke Naka, Akiko Nakahashi, Yoshiki Chujo // Macromolecules. 2007. V. 40. P. 1372.
Kensuke Naka, Akiko Nakahashi, Yoshiki Chujo // Ibid. 2006. V. 39. P. 8257.
Moiseev D.V., Gushchin A.V., Shavirin A.S. et al. // J. Organomet. Chem. 2003. V. 667. P. 176.
Moiseev D.V., Morugova V.A., Gushchin A.V. et al. // J. Organomet. Chem. 2004. V. 689. P. 731.
Gushchin A.V., Moiseev D.V., Dodonov V.A. // Russ. Chem. Bull.International Edition. 2001. V. 50. P. 1291.
Naka K. // Polymer J. 2008. V. 40. P. 1031.
Chujo Y. / Conjugated Polymer Synthesis. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim. 2010.
Carraher C.E., Roner M.R., Thibodeau R. et al. // Inorg. Chimica Acta. 2014. V. 423. P. 123.
Xiao-Yin Zhang, Lian-sheng Cui, Xia Zhang et al. // J. Mol. Struct. 2017. V. 1134. P. 742.
Котон М.М. Металлоорганические соединения и радикалы. М.: Наука, 1985. 13 с.
US Patent No. 3287210 // Chem. Abstr. 1967. V. 66. P. 85070.
Карраер Ч., Шитс Д., Питтмен Ч. Металлоорганические полимеры. М.: Мир, 1981. 352 с.
Lermontov S.A., Shkavror S.V., Lermontov A.S. et al. // Russ. Chem. Bull. 1998. V. 47. P. 1607.
Dostal L., Jambor R., Ruzicka A. et al. // Organometallics 2009. V. 28. P. 2633.
Gupta A., Sharma R.K., Bohra R. et al. // Polyhedron. 2002. V. 21. P. 2387.
Honglin Geng, Min Hong, Yuanguang Yang et al. // J. Coord. Chem. 2015. V. 68. P. 2938.
Sharutin V.V., Sharutina O.K., Reshetnikova R.V. et al. // Russ. J. Inorg. Chem. 2017. V. 62. P. 1450.
Fukin G.K., Samsonov M.A., Kalistratova O.S. et al. // Struct. Chem. 2016. V. 27. P. 357.
Smirnova N.N., Letyanina I.A., Larina V.N. et al. // J. Chem. Thermodyn. 2009. V. 41. P. 46.
Markin A.V., Smirnova N.N., Lyakaev D.V. et al. // Russ. J. Phys. Chem. A. 2016. V. 90. P. 1913.
Lyakaev D.V., Markin A.V., Smirnova N.N. et al. // J. Chem. Thermodyn. 2019. V. 131. P. 322.
Lyakaev D.V., Markin A.V., Khabarova E.V. et al. // Russ. J. Phys. Chem. A. 2018. V. 92. P. 1659.
Markin A.V., Lyakaev D.V., Smirnova N.N. et al. // Russ. J. Phys. Chem. A. 2020. V. 94. P. 4.
Sharutin V.V., Sharutina O.K., Pakusina A.P. et al. // Russ. J. Coord. Chem. 2003. V. 29. P. 780.
Кирьянов К.В., Тельной В.И. Тр. по химии и хим. технологии: Межвуз. сб. Горький: Горьк. гос. ун-т, 1975. С. 109.
Лебедев Ю.А., Мирошниченко Е.А. Термохимия парообразования органических веществ. М.: Наука, 1981. 214 с.
Скуратов С.М., Колесов В.П., Воробьев А.Ф. // Термохимия. В 2 т. Т. 2. М.: Изд-во МГУ, 1966. 436 с.
Washburh E.W. // J. Res. Natl. Bur. Standards. 1933. V. 10. P. 525.
Термические константы веществ: Справочник / Под ред. В.П. Глушко. М.: ВИНИТИ, 1965–1981, Вып. I–X.
Rossini F.D. Experimental Thermochemistry. N.Y.: Interscience, 1956 (Chapter 3; Chapter 4, Chapter 5).
The NBS Tables of Chemical Thermodynamic Properties // J. Phys. Chem. Ref. Data. 1982. V. 11 (Suppl. 2).
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии