Журнал физической химии, 2020, T. 94, № 9, стр. 1343-1347
Влияние кристаллической структуры на каталитические свойства перовскитов Bi4Zr2хV2 – 2хO11 – δ в разложении изобутанола
Е. И. Князева a, *, А. И. Пылинина a, И. И. Михаленко a
a Российский университет дружбы народов
Москва, Россия
* E-mail: knyazeva-ei@rudn.ru
Поступила в редакцию 02.12.2019
После доработки 02.12.2019
Принята к публикации 17.12.2019
Аннотация
Исследовано влияние кристаллической структуры на каталитические свойства сложных цирконийсодержащих ванадатов висмута Bi4Zr2хV2 – 2хO11 – δ в разложении изобутанола. Сложные оксиды получены твердофазным синтезом и исследованы методами ИК-спектроскопии, РФА, РФС и РФЭС. Показано, что каталитическая активность перовскита Bi4Zr2хV2 – 2хO11 – δ в дегидрировании изобутанола увеличивается с ростом содержания ионов циркония(ΙV) и фазовыми изменениями α → β → → γ; наиболее активна высокопроводящая γ-фаза. Установлено, что увеличение дегидрирующей активности образцов связано со снижением энергии активации реакции и изменением состояния носителей тока твердого раствора.
Последние несколько десятилетий внимание исследователей привлекает новый класс твердых электролитов с кислород-ионным типом проводимости. Данные материалы получили название фаз Ауривиллиуса [1], к которым можно отнести достаточно большее семейство висмутсодержащих слоистых перовскитоподобных материалов [2–4]. Чистый и модифицированный катионами различной природы ванадаты висмута образуют семейство соединений BIMEVOX, которые в настоящее время активно исследуются [5, 6]. В качестве Mе могут быть использованы катионы практически любого зарядового состояния (Zn2+, Co2+, Cu2+, Ni2+, Fe3+, Ga3+, Zr4+ и др.).
Химический состав ванадата висмута описывается общей формулой Bi4V2O11 – δ. В кристаллической структуре перовскита катионы Bi3+ находятся в тетраэдрической координации, а катионы V5+ − в октаэдрической. Ионы висмута Bi3+ образуют слои катионов [Bi2O2]$_{n}^{{n \times 2 + }}$, чередующиеся с перовскитоподобными слоями анионов [VO3.5 ‒ δ$\square $0.5 + δ]$_{n}^{{n \times 2--}}$, имеющими “естественные” вакансии анионной подрешетки ($\square $), что обеспечивает возможность миграции кислорода в данной структуре. Слои [VO3.5 – δ$\square $0.5 + δ]n×2– разбиты в ряды из тетраэдров и кислород-дефицитных октаэдров. Кислородные вакансии, которые вовлечены в ионную проводимость, расположены в центральной части вокруг атомов ванадия в октаэдрах [2].
Замещение ионов ванадия на катионы d-металлов оказывает влияние на структурный тип перовскитов [7]. При небольшом содержании допирующего иона твердые растворы кристаллизуются в α-моноклинной или β-орторомбической модификации, при увеличении концентрации катиона происходит образование γ-тетрагональной высокопроводящей модификации [5]. Модифицирование составов твердых оксидов путем замещений катионов V5+ преимущественно направлено на стабилизацию тетрагональной модификации, у которой наблюдаются наибольшая проводимость при наименьшем значении энергии активации [8] и, как следствие, высокая активность ионов кислорода.
Сложные ванадаты висмута представляют определенный интерес для катализа, так как они обладают высокой термической стабильностью и способны к замещению ванадия поливалентными катионами различного радиуса в различном соотношении при сохранении структуры. Благодаря таким замещениям увеличивается не только каталитическая активность, но и подвижность кислорода, тем самым создавая дополнительные окислительно-восстановительные центры. Твердые электролиты с перовскитоподобной структурой являются хорошими катализаторами реакций окисления, например, удаления выхлопных газов от дизельного топлива [9–11], а также реакций окисления-восстановления субстратов различной природы [12, 13].
Несмотря на большой объем данных по структурным и электрофизическим характеристикам BIMEVOX, в литературе очень ограничено количество работ, посвященных изучению взаимосвязи их структурных и каталитических свойств.
Цель данной работы – исследование влияния кристаллической структуры на каталитические свойства сложных цирконийсодержащих ванадатов висмута Bi4Zr2хV2 – 2хO11 – δ (BIZRVOX) в разложении изобутанола.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Перовскитоподобные твердые растворы Bi4Zr2хV2 – 2хO11 – δ (хZr = 0.05 (1), 0.10 (2), 0.15 (3)) были получены методом твердофазного синтеза в работе [14].
Методом ИК-спектроскопии была подтверждена идентичность кристаллических структур смешанных оксидов висмута, ванадия и циркония [14]. В спектрах имеются две полосы поглощения: в интервале 670–870 см–1, которые характеризуют валентные колебания связи V–O в полиэдрах VO4, и в области 420–500 см–1, соответствующей колебаниям связей V–О в октаэдре VО6. В спектрах BIZRVOX c xZr = 0.05 проявляется полоса поглощения ∼580–630 см–1, относящаяся к колебаниям связи V–O в полиэдре VO5. Полученные данные указывают на изоструктурность данного образца.
Результаты физико-химических методов исследования твердых оксидов BIZRVOX приведены в табл. 1.
Таблица 1.
Результаты физико-химических методов исследования катализаторов Bi4V2 – 2xZr2xO11 – δ
| Рентгено-фазовый анализ [14] | ||||||
|---|---|---|---|---|---|---|
| Параметры ячеек | xZr = 0.05 | xZr = 0.10 | xZr = 0.15 | |||
| a, Å | 5.54 | 5.55 | 5.56 | |||
| b, Å | 5.60 | 5.59 | 5.59 | |||
| c, Å | 15.34 | 15.42 | 15.44 | |||
| V, Å3 | 475.9 | 478.4 | 479.9 | |||
| Рентгено-флуоресцентная спектроскопия (%) | ||||||
| Элемент | xZr = 0.05 | xZr = 0.10 | xZr = 0.15 | |||
| анализ | расчет | анализ | расчет | анализ | расчет | |
| O | − | − | − | − | − | − |
| V | 11.80 | 10.27 | 11.26 | 9.70 | 10.74 | 9.13 |
| Zr | 0.14 | 0.97 | 0.48 | 1.92 | 0.981 | 2.87 |
| Bi | 88.06 | 88.75 | 88.26 | 88.37 | 88.28 | 88.00 |
| Состав по анализу | Bi3.97V2.18Zr0.02O11 – δ | Bi3.99V2.09Zr0.05O11 – δ | Bi4.01V2.00Zr0.20O11 – δ | |||
| По стехиометрии | Bi4V1.9Zr0.1O11 – δ | Bi4V1.8Zr0.2O11 – δ | Bi4V1.7Zr0.3O11 – δ | |||
| Рентгенофотоэлектронная спектроскопия Bi4V2 – 2 × 0.15Zr2 × 0.15O11 – δ |
||||||
| Величина | С1s | O1s | Bi4f | V2p | Zr3d | |
| Исходная поверхность | ||||||
| с, ат. % | 62.64 | 25.81 | 9.58 | 1.65 | 0.32 | |
| Есв, эВ | 284.0 | 530.5 | 164.2 | 517.0 | 174.6 | |
| После катализа | ||||||
| с, ат. % | 70.00 | 26.89 | 1.58 | 1.53 | − | |
| Есв, эВ | 283.3 | 530.1 | 163.9 | 516.8 | − | |
Методом рентгенофазового анализа (РФА) определены фазовый состав и параметры кристаллической структуры (дифрактометр ДРОН-3М). Образец 1 представлял моноклинную модификацию (α-фазу), 2 – ромбическую (β-фазу), 3 – тетрагональную (γ-фазу). Увеличение объема элементарной ячейки BIZRVOX с ростом хZr, объясняется присутствием в подрешетке ванадия ионов циркония с большим радиусом.
Брутто-состав BIZRVOX анализировали на рентгеновском флуоресцентном спектрометре Clever C-31. Для всех образцов BIZRVOX установлено несколько близкие к стехиометрическим содержания ванадия (превышение не более чем на 10%). Содержание висмута и циркония в расчете и эксперименте одинаково (расхождение на 2–3%).
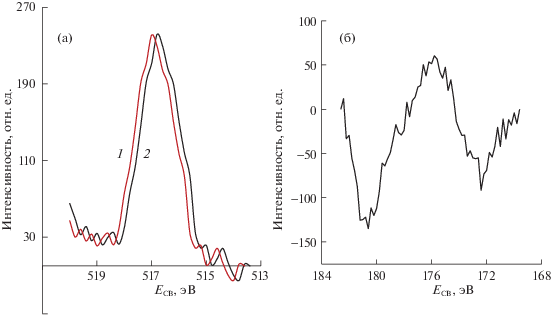
Методом РФЭС (спектрометр XSAM-800) проводили элементный анализ поверхности Bi4V1.7Zr0.3O11 – δ и зарядовые состояния элементов до и после катализа. Из табл. 1 видно, что атомное отношение V/Zr занижено в 1.1 раза, а отношение Bi/V завышено в ∼2.5 раза из-за снижения содержания ванадия. Соотношение Bi/Zr также не равно стехиометрическому. Состав поверхности и состав объема отличаются и составляют Bi4V0.6Zr0.2O13 и Bi4V1.9Zr0.3O11 – δ соответственно. Рентгенофотоэлектронные спектры ванадия и циркония показаны на рис. 1. Зарядовые состояния элементов – висмут, ванадий и цирконий (шумный спектр Zr3d) находятся в степени окисления ниже +3, +5 и +4 соответственно. После катализа положение максимумов V2p смещено в сторону меньших энергий (∼0.5 эВ), что указывает на частичное восстановление катионов ванадия в поверхностном слое [15, 16].
Рис. 1.
Спектры РФЭС элементов Bi4V2 – 2 × 0.15Zr2 × 0.15O11 – δ (1 – исходная поверхность, 2 – после катализа): V2p (а); Zr3d (б, до катализа).
Каталитические превращения изобутанола изучали в интервале температур 200–400°С на установке проточного типа с хроматографическим анализом продуктов разложения спирта (газ-носитель – гелий, детектор – ДИП, колонка с Porapak Q) [17]. Катализатор массой 30 мг в виде тонкого слоя помещали на пористый стеклянный фильтр микрореактора. Барботажную смесь паров спирта и гелия подавали в реактор со скоростью 1.2 л ч–1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На исходной поверхности катализаторов Bi4V2 – 2xZr2хO11 – δ, где хZr = 0.05, 0.10 и 0.15, протекает только реакция дегидрирования с образованием изобутаналя. Влияние температуры на степень превращения спирта (W, %) в изобутаналь представлено на рис. 2. Конверсия изобутанола линейно увеличивается с ростом содержания xZr и для кристаллической γ-модификации достигает ∼50% в случае исходной поверхности, тогда как на образцах α- и β-фаз она составляет 10 и 25% соответственно. В повторном опыте образец α-фазы сохраняет свою активность (рис. 2, табл. 2), катализатор β-фазы снижает ее в 2 раза, и только на γ-фазе наблюдается увеличение активности у “рабочей” поверхности на 25%.
Рис. 2.
Степень превращения спирта в альдегид на исходной поверхности (1) и в повторном опыте (2) на Bi4V2 – 2xZr2xO11 – δ при 400°С.
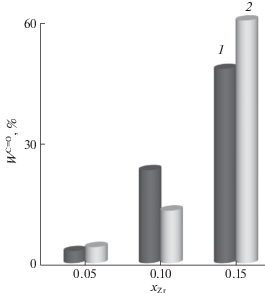
Таблица 2.
Каталитическая активность перовскитов Bi4V2–2xZr2xO11 – δ (BIZRVOX) при дегидрировании изобутанола на исходной поверхности (I) и в повторном опыте (II) при xZr = 0.05, 0.10 и 0.15
| Величина | I | II | ||||
|---|---|---|---|---|---|---|
| 0.05 | 0.10 | 0.15 | 0.05 | 0.10 | 0.15 | |
| α | β | γ | α | β | γ | |
| W350°С, % | 5 | 21 | 37 | 2 | 7 | 25 |
| $Е_{{\text{a}}}^{{{\text{С = О}}}}$, кДж/моль | 103 | 97 | 83 | 78 | 71 | 61 |
| ln N0 | –2.1 | –2.5 | –3.0 | –9.8 | –10.2 | –10.6 |
Характеристики каталитической активности Bi4V2 – 2xZr2хO11 – δ в превращениях изобутанола приведены в табл. 2.
С ростом содержания xZr и изменением структуры сложного оксида линейно снижается значение энергии активации $Е_{{\text{a}}}^{{{\text{С = О}}}}$ реакции образования изобутаналя в первом и повторном опытах (табл. 2, рис. 3), что согласуется с увеличением степени превращения спирта. На исходной поверхности у образца γ-фазы энергия активации реакции в ∼1.2 раза ниже, чем у α-, β-образцов. С ростом содержания циркония xZr линейно уменьшается и логарифм предэкспоненциального множителя реакции ln N0, связанный с числом активных центров катализа. Следовательно, ионы циркония(IV) и ванадия(V) входят в состав каталитически активного центра. Известно, что образование альдегида проходит через образование алкоксидной группировки, а лимитирующие стадии – восстановление и реокисление каталитически активного иона-допанта с изменением степени окисления [18]. Поэтому введение ионов Zr4+ способствует формированию сложных центров Zr–O–V, с последующим частичным восстановлением катионов ванадия, что подтверждается данными РФЭС. С другой стороны, увеличение числа носителей тока (анионов О2–) благоприятно для реакции дегидрирования [19], что также подтверждает их участие в образовании комплексов, из которых образуется изобутаналь. По всей видимости, активным центром исследуемых цирконийсодержащих ванадатов висмута следует рассматривать ионные пары Zr4+–О2– и V5+–О2−, поскольку на активность влияют и проводящие свойства перовскита.
Рис. 3.
Влияние содержания циркония на энергию активации образования изобутаналя на исходной поверхности (1) и в повторном (2) опыте.
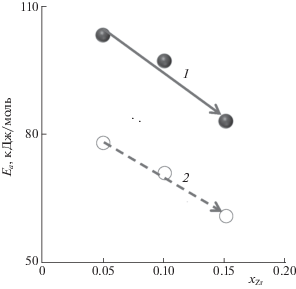
В повторном опыте значения $Е_{{\text{a}}}^{{{\text{С = О}}}}$ и ln N0 меньше, чем для исходной поверхности, но их линейная зависимость от xZr сохраняется (рис. 3). Снижение активности обусловлено уменьшением в 3 раза значений ln N0, тогда как значение энергии активации $Е_{{\text{a}}}^{{{\text{С = О}}}}$ реакции уменьшается в 1.5 раза. Изменение числа и состояния активных центров дегидрирования спирта связано с частичным восстановлением ионов V5+ → V3+ и Zr4+ → Zr2+ в присутствии водорода, что подтверждают данные анализа поверхности методом РФЭС.
Таким образом, каталитическая активность перовскитов семейства BIZRVOX в реакции дегидрирования изобутанола зависит от типа кристаллической структуры (содержания ионов циркония(IV)) и наиболее активной является высокопроводящая аниондефицитная тетрагональная γ-фаза. Увеличение дегидрирующей активности образцов в ряду фаз α → β → γ связано со снижением энергии активации реакции и изменением состояния носителей тока твердого раствора (ионов О2–), входящих в состав активных центров Zr4+–О2– и V5+–О2–.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-33-00928. Публикация подготовлена при поддержке Программы РУДН “5-100”.
Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Список литературы
Aurivillius B. // Arkiv. Kemi. 1949. V. 1. № 54. P. 463.
Власенко В.Г., Шуваев А.Т., Зарубин И.А., Шуваева Е.Т. и др. // Электронный научный журнал “Исследовано в России”. 2007. С. 291.
Belousov V.V. // Russ. Chem. Rev. 2017. V 86. № 10. P. 934.https://doi.org/10.1070/RCR4741
Nitin Labhasetwar, Govindachetty Saravanan, Suresh Kumar Megarajan, Nilesh Manwar et al. // Sci. Technol. Adv. Mater. 2015. V. 16. P. 13. https://doi.org/10.1088/1468-6996/16/3/036002
Мурашева В.В., Полетаева Н.А., Фортальнова Е.А., Сафроненко М.Г. и др. // Журн. неорган. химии. 2010. Т. 55. № 12. С. 1980. https://doi.org/10.1134/S0036023610120090
Жуковский В.М., Буянова Е.С., Емельянова Ю.В., Морозова М.В. и др. // Электрохимия. 2009. Т. 45. № 5. С. 547. https://doi.org/10.1134/S1023193509050024
Abrahams I., Krok F. // J. Mater. Chem. 2002. № 12. P. 3351. https://doi.org/10.1039/b203992n
Lasure S., Vemochet C., Vannier R.N., Nowogrocki G. et al. // Solid State Ionics. 1996. V. 90. P. 117. https://doi.org/10.1016/S0167-2738(96)00412-2
Löfberg A., Bodet H., Pirovano C., Steil M.C. et al. // Topics in Catalysis. 2006. V. 38. № 1–3. P. 169. https://doi.org/10.1007/s11244-006-0082-x
Munder B., Ye Y., Rihko-Struckmann L., Sundmacher K. // Catalysis Today. 2005. V. 104. P. 138. https://doi.org/10.1016/j.cattod.2005.03.055
Кузнецова Т.Г., Садыков В.А., Матышак В.А., Батуев Л.Ч. и др. // Химия в интересах устойчивого развития. 2005. Т. 13. С. 779.
Goodenough J.B. // Rep. Prog. Phys. 2004. V. 67. P. 1915. https://doi.org/10.1088/0034-4885/67/11/R01
Vannier R.V., Pernot E., Anne M., Isnard O. et al. // Solid State Ionics. 2003. V. 157. P. 147. https://doi.org/10.1016/S0167-2738(02)00202-3
Мурашева В.В. Твердые растворы на основе ванадата висмута со структурой фаз Ауривиллиуса: синтез, структурные особенности, физико-химические свойства: Дис… канд. хим. наук. М.: РУДН, 2012. 206 с.
Wagner C.D., Naumkin A.V., Kraut-Vass A. et al. NIST X-ray Photoelectron Spectroscopy Database. NIST Standard Reference Database 20. Version 4.1 (Web Version). 2012.
Juan Su, Xiao-Xin Zou, Guo-Dong Li, Xiao Wei et al. // J. Phys. Chem. C. 2011. V. 115. P. 8064. https://doi.org/10.1021/jp200274k
Povarova E.I., Pylinina A.I., Mikhalenko I.I. // Russ. J. Phys. Chem. A. 2012. V. 86. № 6. P. 935. https://doi.org/10.1134/S0036024412060210
Saad L., Riad M. // J. Serb. Chem. Soc. 2008. V. 6. P. 997. https://doi.org/10.2298/JSC0810997S
Povarova E.I., Pylinina A.I., Mikhalenko I.I. // Russ. J. Phys. Chem. A. 2013. V. 87. P. 560. https://doi.org/10.1134/S0036024413040237
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


