Журнал физической химии, 2020, T. 94, № 9, стр. 1361-1366
Термодинамические параметры процессов смешаннолигандного комплексообразования кобальта(II) с триглицином и L-гистидином в водном растворе
Г. Г. Горболетова a, *, С. А. Бычкова a, Е. А. Горбашова a, К. О. Фролова a
a Ивановский государственный химико-технологический университет
Иваново, Россия
* E-mail: gorboletova@mail.ru
Поступила в редакцию 12.10.2019
После доработки 05.12.2019
Принята к публикации 10.12.2019
Аннотация
Потенциометрическим и калориметрическим методами изучена система Co2+–триглицин–L-гистидин в водном растворе при Т = 298.15 K (KNO3). Установлено образование смешаннолигандного комплекса CoL2Y–, определены стандартные термодинамические характеристики (ΔrH°, ΔrG°, ΔrS°) реакции комплексообразования. Предложена структура комплекса.
Изучение совместимости лигандов в смешанных комплексах состава MLY, где L и Y – аминокислоты и пептиды, представляет интерес в связи с их научным и практическим значением. Комплексы аминокислот и олигопептидов используются в аналитической химии, сельском хозяйстве, промышленности, медицине [1, 2]. Комплексы металлов, содержащие аминогруппы, карбоксильные и амидные группы используются также в качестве лекарственных средств [3, 4]. Информацию о факторах, влияющих на совместимость двух разных лигандов в одной координационной сфере центрального иона, можно получить из энтальпийной и энтропийной характеристик реакций сопропорционирования. Однако, в литературе, как правило, отсутствуют термохимические данные о реакциях образования смешаннолигандных комплексов аминокислот и пептидов. Ранее были определены термодинамические характеристики процессов комплексообразования в системе Co2+–глицин–L-гистидин [5]. В настоящей работе проведено потенциометрическое и калориметрическое изучение процессов комплексообразования иона Co2+ с триглицином (L–) и L-гистидином (Y–).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали глицил-глицил-глицин фирмы “Sigma” и L-гистидин марки “х.ч.” без дополнительной очистки. Растворы аминокислоты и пептида готовили по точной навеске из кристаллических препаратов, высушенных до постоянной массы при 343 K. Для приготовления растворов Co(NO3)2 использовали реактив марки “х.ч.”, концентрацию устанавливали комплексонометрически. Заданное значение ионной силы поддерживали с помощью нитрата калия марки “х. ч.”.
Состав и устойчивость смешаннолигандного комплекса CoL2Y– определяли из потенциометрических измерений. Суммарная концентрация лигандов изменялась от 3.2 × 10–2 до 4.8 × 10–2 моль/л. Исследования проводили при соотношениях Co : L : Y = 1 : 3 : 1; 1 : 4 : 1; 1 : 5 : 1 (I = 0.2). Данные соотношения соответствовали максимальному выходу изучаемого комплекса.
Потенциометрическое титрование проходило по стандартной методике. Измерения ЭДС цепи:
Градуировку стеклянного электрода проводили по стандартным растворам соляной кислоты при I = 0.2 (KNO3). Полученная при обработке этих данных по методу наименьших квадратов величина tg α cоставляла 0.05950 В/ед рН. Для каждого соотношения Co : L : Y проводили по три–четыре параллельных опыта.
Экспериментальные данные обрабатывали по универсальной программе “PHMETR”, предназначенной для расчета констант равновесия с произвольным числом реакций по измеренной равновесной концентрации одной из частиц [6]. Критерием адекватности выбранной модели служили различия между рассчитанными и экспериментальными величинами pH. Они были знакопеременными и не превышали погрешности эксперимента.
Измерения тепловых эффектов проводили в ампульном калориметре смешения с изотермической оболочкой, термисторным датчиком температуры и автоматической записью кривой температура–время, надежность работы которого проверяли по теплоте растворения KCl в воде при 298.15 K [7]. Необходимое значение рН растворов триглицина L-гистидина создавали добавлением рассчитанного количества гидроксида калия марки “х.ч.”. Опыты проводили при 298.15 K и значениях ионной силы 0.2, 0.5, 1.0. Навески растворов взвешивали на весах марки ВЛР-200 с точностью 1 × 10–5 г. Величины рН контролировали с помощью прибора “Мультитест” ИПЛ-311. Для подбора условий проведения калориметрических опытов использовали программу RRSU [8]. Для расчета доверительного интервала среднего значения ΔН из трех параллельных опытов критерий Стьюдента был взят при доверительной вероятности 0.95.
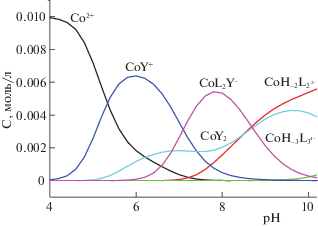
Как видно из диаграммы равновесий в системе Co2+–триглицин–L-гистидин (рис. 1), наибольший выход смешаннолигандного комплекса наблюдается при рН 7.8.
Рис. 1.
Диаграмма распределения частиц в системе Co(II)–триглицин–L-гистидин (С°(Co2+) = 1 × 10–2 моль/л, С°(L) = 4 × 10–2 моль/л, С°(Y) = 1 × 10–2 моль/л).
Для определения энтальпии образования частицы CoL2Y– измеряли тепловые эффекты смешения растворов Co(NO3)2, триглицина и L-гистидина при соотношении $c_{{{\text{Co}}}}^{0}$ : $c_{{\text{L}}}^{0}$ : $c_{{\text{Y}}}^{0}$ = 1 : 4 : 1. Навеска нитрата кобальта(II) концентрации 0.8978 моль/кг раствора в ампуле составляла ∼0.45 г. После разрушения ампулы в калориметрической ячейке объемом 39.86 мл, содержащей растворы триглицина концентрации 0.04 моль/л и L-гистидина 0.01 моль/л, концентрация Co(NO3)2 составляла ∼0.01 моль/л. В ходе калориметрического опыта значение рН изменялось в интервале 8.5–7.8. Были измерены также теплоты разведения раствора Co(NO3)2 в растворах фонового электролита. Экспериментальные данные приведены в табл. 1.
Таблица 1.
Тепловые эффекты (кДж/моль) взаимодействия раствора Co(NO3)2 (0.8978 моль/кг раствора) с растворами триглицина (0.04000 моль/л) и L-гистидина (0.01000 моль/л)
| I | m, г | –∆mixH | –∆dilH | –∆rH |
|---|---|---|---|---|
| 0.2 | 0.45015 | 41.67 | 1.72 ± 0.10 | 39.95 |
| 0.45000 | 41.64 | 39.92 | ||
| 0.45010 | 41.95 | 40.23 | ||
| 41.75 ± 0.31 | 40.03 ± 0.33 | |||
| 0.5 | 0.45005 | 43.92 | 2.97 ± 0.10 | 40.95 |
| 0.45025 | 43.80 | 40.83 | ||
| 0.45030 | 44.09 | 41.12 | ||
| 43.94 ± 0.27 | 40.97 ± 0.29 | |||
| 1.0 | 0.45025 | 46.33 | 4.05 ± 0.10 | 42.28 |
| 0.45020 | 46.24 | 42.19 | ||
| 0.44995 | 46.45 | 42.40 | ||
| 46.34 ± 0.19 | 42.29 ± 0.21 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При моделировании системы Co2+–триглицин–L-гистидин учитывали следующие равновесия:
(2)
${{{\text{L}}}^{--}} + 2{{{\text{H}}}^{ + }} \leftrightarrow {{{\text{H}}}_{{\text{2}}}}{\text{L}},$(4)
${{{\text{Y}}}^{--}} + 2{{{\text{H}}}^{ + }} \leftrightarrow {{{\text{H}}}_{2}}{{{\text{Y}}}^{ + }},$(5)
${\text{C}}{{{\text{o}}}^{{2 + }}} + {{{\text{L}}}^{--}} \leftrightarrow {\text{Co}}{{{\text{L}}}^{ + }},$(6)
${\text{C}}{{{\text{o}}}^{{2 + }}} + 2{{{\text{L}}}^{--}} \leftrightarrow {\text{Co}}{{{\text{L}}}_{2}},$(7)
${\text{C}}{{{\text{o}}}^{{2 + }}} + 3{{{\text{L}}}^{--}} \leftrightarrow {\text{CoL}}_{3}^{ - },$(8)
${\text{C}}{{{\text{o}}}^{{2 + }}} + {{{\text{L}}}^{--}}--{{{\text{H}}}^{ + }} \leftrightarrow {\text{Co}}{{{\text{H}}}_{{--1}}}{\text{L}},$(9)
${\text{C}}{{{\text{o}}}^{{2 + }}} + 2{{{\text{L}}}^{--}}--2{{{\text{H}}}^{ + }} \leftrightarrow {\text{Co}}{{{\text{H}}}_{{--2}}}{\text{L}}_{2}^{{2 - }},$(10)
${\text{C}}{{{\text{o}}}^{{2 + }}} + 3{{{\text{L}}}^{--}}--3{{{\text{H}}}^{ + }} \leftrightarrow {\text{Co}}{{{\text{H}}}_{{--3}}}{\text{L}}_{3}^{{4 - }},$(11)
${\text{C}}{{{\text{o}}}^{{2 + }}} + {{{\text{Y}}}^{--}} \leftrightarrow {\text{Co}}{{{\text{Y}}}^{ + }},$(12)
${\text{C}}{{{\text{o}}}^{{2 + }}} + 2{{{\text{Y}}}^{--}} \leftrightarrow {\text{Co}}{{{\text{Y}}}_{2}},$(13)
${\text{C}}{{{\text{o}}}^{{2 + }}} + 3{{{\text{Y}}}^{--}} \leftrightarrow {\text{CoY}}_{3}^{ - },$(14)
${\text{C}}{{{\text{o}}}^{{2 + }}} + {{{\text{Y}}}^{--}} + 2{{{\text{L}}}^{--}} \leftrightarrow {\text{Co}}{{{\text{L}}}_{2}}{{{\text{Y}}}^{--}},$(15)
${{{\text{H}}}^{ + }} + {\text{O}}{{{\text{H}}}^{--}} \leftrightarrow {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(16)
${\text{C}}{{{\text{o}}}^{{2 + }}} + {\text{HOH}} \leftrightarrow {\text{CoO}}{{{\text{H}}}^{ + }} + {{{\text{H}}}^{ + }}.$В расчетах использовали константы диссоциации триглицина (pK1 = 3.25, pK2 = 7.90) и L-гистидина (pK2 = 6.10, pK3 = 9.16), а также константы устойчивости однородных комплексов кобальта(II) с триглицином и L-гистидином [9–12]. Учитывали возможность гидролиза ионов Co2+. Термодинамические параметры диссоциации воды на фоне KNO3 взяты из [13].
Расчеты показали, что в системе Co2+–триглицин–L-гистидин происходит образование смешанного комплекса состава CoL2Y–, смешанные комплексы другого состава не образуются. Следует отметить, что при моделировании изучаемой системы с помощью универсальной программы “PHMETR” не зафиксировано образования молекулярных комплексных соединений между триглицином и L-гистидином. Полученные при разных соотношениях триглицина и L-гистидина значения lg β удовлетворительно согласуются между собой. В качестве наиболее вероятной принята величина lg β(CoL2Y–) = 11.73 ± 0.11. Погрешность рассчитывали как средневзвешенное вероятного отклонения среднеарифметического при доверительной вероятности 0.95.
Экспериментальный тепловой эффект взаимодействия растворов кобальта(II), триглицина и L-гистидина имеет вид:
(17)
${{\Delta }_{{{\text{mix}}}}}H - {{\Delta }_{{{\text{dil}}}}}H = {{\alpha }_{1}}{{\Delta }_{r}}{{H}_{{({\text{Co}}{{{\text{L}}}_{{\text{2}}}}{{{\text{Y}}}^{ - }})}}} + \sum {{{\alpha }_{i}}{{\Delta }_{{\text{r}}}}{{H}_{i}}} ,$Условия проведения калориметрических опытов выбирали таким образом, чтобы вклад побочных процессов был минимальным. Необходимые для расчета энтальпии процессов кислотно-основного взаимодействия в растворах триглицина и L-гистидина взяты из работ [10, 14], энтальпии реакций образования комплексов CoL+, CoH–1L, CoL2, CoH–2L$_{2}^{{2 - }}$, CoL$_{3}^{ - }$ – из [15], комплексов CoY+, CoY2, CoY$_{3}^{ - }$ – из [16]. Вклад теплового эффекта процесса (16) стремился к нулю.
При определении энтальпии образования комплекса кобальта(II) c триглицином и L-гистидином наряду с равновесием (14) протекали реакции (7), (8), (9), (11) и (12). Доля образования смешаннолигандного комплекса составляла ∼51%. Энтальпию образования комплекса CoL2Y– рассчитывали по универсальной программе НЕАТ [17] путем минимизации критериальной функции F по искомым параметрам:
(18)
$F = \sum\limits_{i = 1}^N {{{\omega }_{i}}{{{(\Delta H_{i}^{{{\text{эксп}}}} - \Delta H_{i}^{{{\text{выч}}}})}}^{2}}} ,$Таблица 2.
Стандартные термодинамические характеристики реакций образования комплексов кобальта(II) с глицином (Gly–), триглицином (L–) и L-гистидином (Y–)
| Процесс | lg β° | –ΔrН°, кДж/моль | –ΔrG°, кДж/моль | ΔrS°,Дж/(моль К) |
|---|---|---|---|---|
| I = 0 | ||||
| Co2+ + 2L– + Y– ↔ CoL2Y– | 12.54 ± 0.11 | 34.73 ± 0.33 | 71.58 ± 0.57 | 123.6 ± 0.8 |
| I = 0.2 | ||||
| Co2+ + 2L– + Y– ↔ CoL2Y– | 11.73 ± 0.11 | 36.61 ± 0.33 | 66.95 ± 0.57 | 101.8 ± 0.8 |
| I = 0.5 | ||||
| Co2+ + 2L– + Y– ↔ CoL2Y– | 11.59 ± 0.11 | 38.20 ± 0.33 | 66.16 ± 0.57 | 93.8 ± 0.8 |
| I = 1.0 | ||||
| Co2+ + 2L– + Y– ↔ CoL2Y– | 11.34 ± 0.11 | 39.73 ± 0.30 | 64.73 ± 0.57 | 83.8 ± 0.9 |
| I = 0 | ||||
| Co2+ + Gly– + Y– ↔ CoGlyY [5] | 12.46 ± 0.12 | 37.82 ± 0.30 | 71.12 ± 0.68 | 111.7 ± 1.5 |
Энтальпия комплексообразования в стандартном растворе была найдена экстраполяцией величин тепловых эффектов при фиксированных значениях ионной силы к нулевой по уравнению:
где ΔН и ΔН° – изменение энтальпии при конечном значении ионной силы и ΔI = 0 соответственно; Ψ(I) – функция ионной силы, вычисленная теоретически; ΔZ2 – разность квадратов зарядов продуктов реакции и исходных компонентов; b – эмпирический коэффициент. Результаты экстраполяции и рассчитанные значения стандартных термодинамических характеристик комплексообразования в системе Co2+–триглицин–L-гистидин приведены в табл. 2. Из табл. 2 видно, что энтальпия образования смешаннолигандного комплекса CoL2Y– близка к среднему значению ΔrН° однородных трискомплексов кобальта(II) с триглицином и L-гистидином (ΔrН°(CoL$_{3}^{ - }$) = = ‒18.01 ± 0.21 кДж/моль, ΔrН°(CoY$_{3}^{ - }$) = –61.54 ± ± 0.25 кДж/моль.На рис. 2 приведены спектры поглощения в системе Co2+–триглицин–L-гистидин при соотношении Co : L : Y = 1 : 4 : 1 и различных значениях рН. Максимальному выходу частицы CoL2Y–, согласно диаграмме равновесий (рис. 1), соответствуют кривые 5 и 6. Наблюдающийся для данных кривых максимум поглощения при длине волны ∼450 нм занимает промежуточное положение между максимумами поглощения в системах Co2+–триглицин и Co2+–L-гистидин, спектральные данные которых приведены на рис. 3 и 4 соответственно.
Рис. 2.
Спектры поглощения иона Co2+ (С°(Co2+) = = 1 × 10–2 моль/л) в присутствии триглицина (С°(L) = 4 × 10–2 моль/л) и L-гистидина (С°(Y) = 1 × × 10–2 моль/л) при различных значениях рН: 1 – 5.29, 2 – 5.70, 3 – 5.80, 4 – 6.21, 5 – 7.06, 6 – 7.28, 7 – 8.87, 8 – 9.05, 9 – 9.75.
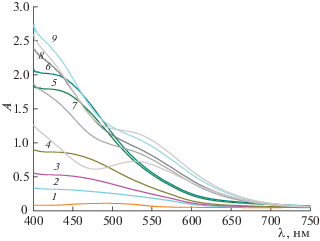
Рис. 3.
Спектры поглощения иона Co2+ (С°(Co2+) = = 1 × 10–2 моль/л) в присутствии L-гистидина (С°(Y) = 1 × 10–2 моль/л) при различных значениях рН: 1 – 5.21, 2 – 5.59, 3 – 5.71, 4 – 6.13.
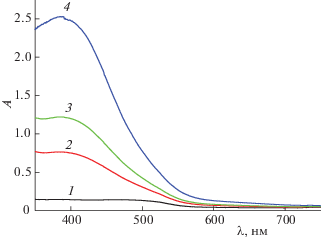
Рис. 4.
Спектры поглощения иона Co2+ (С°(Co2+) = = 8 × 10–3 моль/л) в присутствии триглицина (С°(L) = 4.0 × 10–2 моль/л) при различных значениях рН: 1 – 5.46, 2 – 7.12, 3 – 7.46, 4 – 7.75, 5 – 8.01, 6 – 8.24, 7 – 8.62, 8 – 9.23, 9 – 9.56, 10 – 9.86.
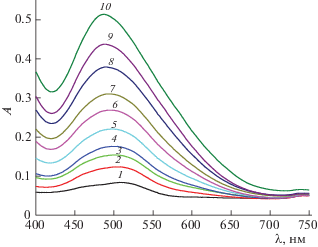
В табл. 2 приведены также стандартные термодинамические характеристики процессов комплексообразования в системе Co2+–глицин–L-гистидин, полученные ранее [5]. Обращают на себя внимание близкие величины lg β(CoL2Y–) и lg β(CoGlyY). По-видимому, присоединение третьего лиганда настолько повышает устойчивость смешанного комплекса кобальта(II) с L-гистидином и триглицином, что практически в равной мере компенсирует более низкую координационную способность карбонильного кислорода пептидной группы триглицина по сравнению кислородом карбоксильной группы глицина в CoGlyY. Абсолютное значение ΔrН°(CoL2Y–) несколько меньше, чем ΔrН°(CoGlyY). Это может быть связано с более значительными затруднениями во внутрисферной координации молекул воды для частицы CoL2Y– по сравнению с CoGlyY. Достаточно большие положительные величины ΔrS° наблюдаются для реакций образования обоих комплексов. Однако, ΔrS°(CoL2Y–) больше, чем ΔrS°(CoGlyY), что подтверждает приведенное выше предположение.
Логарифм константы равновесия реакции сопропорционирования:
(20)
$2{\text{CoL}}_{3}^{ - } + {\text{CoY}}_{3}^{ - } \leftrightarrow 3{\text{Co}}{{{\text{L}}}_{2}}{{{\text{Y}}}^{--}}$(21)
${\text{Co}}{{{\text{L}}}_{2}} + {\text{CoY}}_{3}^{ - } \leftrightarrow {\text{Co}}{{{\text{L}}}_{{\text{2}}}}{{{\text{Y}}}^{--}} + {\text{Co}}{{{\text{Y}}}_{2}},$(22)
${\text{Co}}{{{\text{Y}}}_{2}} + 2{\text{CoL}}_{3}^{ - } \leftrightarrow 2{\text{Co}}{{{\text{L}}}_{2}}{{{\text{Y}}}^{--}} + {\text{Co}}{{{\text{L}}}_{{\text{2}}}},$(23)
${\text{Co}}{{{\text{Х}}}_{2}} + {\text{Z}} \leftrightarrow {\text{Co}}{{{\text{X}}}_{2}}{\text{Z}},$В табл. 3 приведены термодинамические характеристики процессов (20)–(22), рассчитанные с использованием результатов настоящей работы (табл. 2) и данных [15, 16], а также термодинамические характеристики процессов смешаннолигандного комплексообразования в системе Co2+–глицин–L-гистидин, полученные ранее [5] для реакций:
(25)
${\text{Co}}{{({\text{Gly}})}_{2}} + {\text{Co}}{{{\text{Y}}}_{2}} \leftrightarrow 2{\text{CoGlyY}},$(26)
${\text{CoGl}}{{{\text{y}}}^{ + }} + {\text{Co}}{{{\text{Y}}}_{2}} \leftrightarrow {\text{CoGlyY}} + {\text{Co}}{{{\text{Y}}}^{ + }},$(27)
${\text{Co}}{{{\text{Y}}}^{ + }} + {\text{Co}}{{({\text{Gly}})}_{2}} \leftrightarrow {\text{CoGlyY}} + {\text{CoGl}}{{{\text{y}}}^{ + }}.$Таблица 3.
Стандартные термодинамические характеристики реакций сопропорционирования смешаннолигандных комплексов кобальта(II) с глицином (Gly–), триглицином (L–) и L-гистидином (Y–) при I = 0
| Процесс | lg K | ΔrН°, кДж/моль | –ΔrG°, кДж/моль | ΔrS°, Дж/(моль K) |
|---|---|---|---|---|
| 2CoL$_{3}^{ - }$ + CoY$_{3}^{ - }$ ↔ 3CoL2Y– | 6.19 | –6.63 | 35.37 | 96.3 |
| CoL2 + CoY$_{3}^{ - }$ ↔ CoL2Y– + CoY2 | 5.07 | –11.85 | 28.95 | 57.2 |
| CoY2 + 2CoL$_{3}^{ - }$ ↔ 2CoL2Y– + CoL2 | 1.12 | 5.22 | 6.42 | 39.1 |
| Co(Gly)2 + CoY2 ↔ 2CoGlyY [5] | 2.20 | 2.23 | 12.58 | 49.7 |
| CoGly+ + CoY2 ↔ CoGlyY + CoY+ | 1.30 | –11.67 | 7.43 | –14.2 |
| CoY+ + Co(Gly)2 ↔ CoGlyY + CoGly+ | 0.90 | 13.90 | 5.15 | 63.9 |
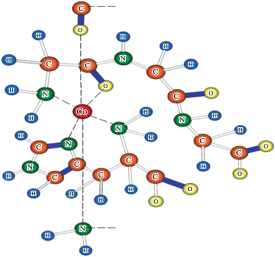
Смешанный комплекс CoL2Y– устойчив к диспропорционированию, так как логарифм константы реакции (20) lg K > 0. Сравнение величин lg K и ΔrН° для реакций (20) и (25), приведенных в табл. 3, показывает, что комплекс CoL2Y– более устойчив к распаду на однородные лиганды, чем комплекс CoGlyY. Положительные значения lg K реакций (21), (22) показывают, что присоединение триглицина и L-гистидина в качестве смешанных лигандов в комплексе CoL2Y– усиливает его устойчивость больше, чем присоединение этих лигандов в качестве однородных усиливает устойчивость образующихся при этом трис-комплексов. В большей степени это проявляется в случае присоединения L-гистидина. На основании термодинамических данных реакций (26) и (27), приведенных в табл. 3, можно сделать аналогичные выводы в отношении смешаннолигандного комплекса CoGlyY и бискомплексов Co(Gly)2 и CoY2.
Вероятная структура комплекса CoL2Y– приведена на схеме:
Работа выполнена в НИИ Термодинамики и кинетики химических процессов Ивановского государственного химико-технологического университета в рамках Государственного задания на выполнение НИР. Тема № FZZW-2020-0009.
Список литературы
Prakash O., Kumar R., Kumar R. et al. // Eur. J. Med. Chem. 2007. V. 42. P. 868.
Zhang N., Ayral-Kaloustian S., Nguyen T. et al. // Bioorg. Med. Chem. Lett. 2007. V. 17. P. 3003.
Xia-Bing Fu, Zi-Hua Lin, Hai-Feng Liu et al. // Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2014. V. 122. P. 22.
Dharmaraja J., Esakkidurai T., Subbaraj P. et al. // Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2013. V. 114. P. 607.
Горболетова Г.Г., Метлин А.А. // Журн. физ. химии. 2016. Т. 90. № 2. С. 206.
Бородин В.А., Васильев В.П., Козловский Е.В. // Журн. неорган. химии. 1986. Т. 31. № 1. С. 10.
Лыткин А.И., Черников В.В., Крутова О.Н. и др. // Журн. общ. химии. 2019. Т. 89. № 2. С. 254.
Васильев В.П., Бородин В.А., Козловский Е.В. Применение ЭВМ в химико-аналитических расчетах. М.: Высшая школа, 1993. С. 112.
Горболетова Г.Г., Бычкова С.А., Метлин А.А. // Изв. вузов. Химия и хим. технология. 2016. Т. 59. Вып. 2. С. 57.
Васильев В.П., Кочергина Л.А., Гаравин В.Ю. // Журн. общ. химии. 1985. Т. 55. № 1. С. 189.
Бычкова С.А., Горболетова Г.Г., Фролова К.О. // Изв. вузов. Химия и хим. технология. 2020. Т. 63. Вып. 2. С. 21.
Васильев В.П., Зайцева Г.А. // Журн. неорган. химии. 1989. Т. 34. № 12. С. 3082.
Васильев В.П., Лобанов Г.А. // Изв. вузов. Химия и хим. технология. 1969. Т. 12. № 6. С. 740.
Лыткин А.И., Черников В.В., Крутова О.Н. и др. // Журн. неорган. химии. 2017. Т. 62. № 2. С. 249.
Горболетова Г.Г., Бычкова С.А., Фролова К.О. // Журн. физ. химии. В печати.
Горболетова Г.Г., Метлин А.А. // Журн. физ. химии. 2015. Т. 89. № 9. С. 1382.
Бородин В.А., Козловский Е.В., Васильев В.П. // Журн. неорган. химии. 1982. Т. 27. № 9. С. 2169.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии