Журнал физической химии, 2020, T. 94, № 9, стр. 1355-1360
Звукохимические превращения метана и этилена в водных растворах в условиях кавитации
a Национальная академия наук Республики Армения, Институт химической физики им. А.Б. Налбандяна
Ереван, Армения
* E-mail: arsentiev53@mail.ru
Поступила в редакцию 01.10.2019
После доработки 25.01.2020
Принята к публикации 11.02.2020
Аннотация
Изучено превращение метана, этилена и их смесей в водных растворах при воздействии ультразвуковых колебаний с частотой 22 кГц в условиях кавитации. Установлено, что формальдегид, который является основным продуктом, образуется, даже если в исходном растворе нет растворенного кислорода. Показано, что скорость накопления формальдегида зависит от мощности подаваемого ультразвукового излучения и количества введенного в систему молекулярного кислорода.
Для интенсификации химических, физико-химических и технологических процессов применяют различные методы. Один из методов воздействия на химические реакции – использование ультразвука. При этом большинство химических реакций в ультразвуковых полях происходит в водных растворах при наличии кавитации. Известно, что под воздействием кавитации направление и скорость химических реакций, протекающих в растворе, могут существенно меняться [1–4]. В ряде случаев возможно протекание процессов, не осуществимых в обычных условиях [4–7].
Следует особо подчеркнуть, что ультразвуковое излучение непосредственно не взаимодействует с молекулами реагентов. Диапазон частот ультразвуковых колебаний значительно ниже частот собственных колебаний молекул, а удельные энергии намного меньше энергии активации. Поэтому очевидно, что звукохимические превращения вызываются кавитационными явлениями. Воздействие ультразвука на химические реакции в растворах – следствие концентрации относительно невысокой энергии, излучаемой в раствор, в малых объемах парогазовых пузырьков. При этом кинетическая энергия жидкости превращается в энергию нагрева и сжатия содержимого коллапсирующего пузырька, т.е. реагентов, находящихся в парогазовой фазе. Высокие температуры и давления, достигаемые при схлопывании парогазовых пузырьков, сочетающиеся с высокой скоростью охлаждения продуктов реакции, а также возникновение ударных волн [8–10] позволяют предположить определенное сходство процессов, протекающих в парогазовых пузырьках, образующихся в растворах в условиях кавитации с процессами в ударных трубах [11–15]. Одна из возможных причин воздействия ультразвука на химические процессы, протекающие в водных растворах, – возникновение в парогазовых пузырьках электрических разрядов [16, 17].
Широкие возможности могут открыться при осуществлении в подобных условиях процессов окисления углеводородов. К сожалению, в настоящее время в данной области исследований практически отсутствуют экспериментальные данные. Известно лишь, что при воздействии ультразвука с частотой 850 кГц на водные растворы смеси метана с этиленом возможно образование формальдегида и ацетальдегида [18].
Цель настоящей работы – изучение кинетических закономерностей окислительного превращения метана, этилена и их смесей при воздействии ультразвука на их водные растворы в отсутствие и в присутствии кислорода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Воздействие ультразвука на водные растворы метана и этилена производилось при частоте ультразвука ν = 22 кГц в кварцевом реакторе, схематически изображенном на рис. 1. Во избежание попадания в систему воздуха реактор и все коммуникации герметизировались. Источником ультразвука служил ультразвуковой диспергатор УЗДН-2Т. Объем раствора, подвергаемого ультразвуковому воздействию V = 30 мл.
Рис. 1.
Схема реакционного узла: 1 – волновод, 2 –шлиф, 3 – водяная “рубашка”, 4 – зона реакции, 5 – капилляр.
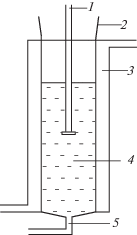
Подача газов осуществлялась через капилляр 5, а вывод производился через шлиф 2, герметично соединенный с отводящими коммуникациями.
В связи с тем, что процесс кавитации сопровождается выделением большого количества тепла, во избежание перегрева реактор охлаждался с помощью водяной “рубашки”. Эксперименты показали, что через ∼5 мин после начала воздействия ультразвуком температура раствора достигает 310–314 K и далее остается неизменной.
Метан, этилен и кислород поступали в систему непосредственно из баллонов. Чистота углеводородов составляла не менее 99.9%. Кислород содержал ∼3% азота. Расход газов регулировался вентилями с точностью подачи ±2%. Газы подавались в реактор со скоростью 8 мл/мин. Перед началом воздействия ультразвуком на раствор производилось насыщение дистиллированной воды углеводородом или углеводород-кислородной смесью путем барботажа непосредственно в реакторе в течение 60 мин. Специальными опытами было показано, что воспроизводимые результаты получаются при временах предварительного барботажа, превышающих 20 мин. Очевидно, за это время происходит насыщение раствора исходной реагирующей смесью, и устанавливается равновесие между жидкой и газовой фазами.
Проведены две серии экспериментов – в условиях, когда барботаж раствора реагентами производился в течение 60 мин до начала воздействия ультразвуком и прекращался при включении генератора ультразвука, а также когда барботаж раствора начинался за 60 мин до начала воздействия ультразвуком и продолжался до окончания процесса. Сравнение результатов, полученных в этих сериях, дает дополнительную информацию и позволяет установить различие в процессах при непрерывном расходе исходного реагента и при его восполнении за счет подачи новых порций.
При осуществлении химических процессов важно знать количество энергии, вводимой извне в реагирующую систему. Существуют различные способы оценки мощности, передаваемой источником ультразвука в раствор: термоэлектрические, оптические, калориметрические, химические и т.п. [1, 2, 19–25]. В данной работе использовался метод измерения амплитуды колебания торца излучающего элемента. С этой целью была установлена зависимость между током возбуждающей обмотки излучателя и амплитудой колебания волновода, погружаемого в раствор. Величину тока измеряли высокоточным микроамперметром М-130 с зеркальной световой шкалой, а амплитуду колебаний определяли с помощью микроскопа МБС-10, снабженного масштабной сеткой. Эксперименты показали, что существует линейная связь между током возбуждающей обмотки (I) и квадратом амплитуды (А) колебаний торца волновода. Полученная закономерность представлена на рис. 2. Наличие столь простой зависимости позволило измерять в относительных единицах излучаемую в раствор мощность непосредственно во время воздействия ультразвуком, поскольку известно [1, 26], что N = αA2, где N – излучаемая в раствор мощность, A – амплитуда колебаний излучателя, α – постоянный коэффициент.
Рис. 2.
Зависимость квадрата амплитуды колебаний торца волновода (А2) от тока обмотки возбуждения (I) излучателя.
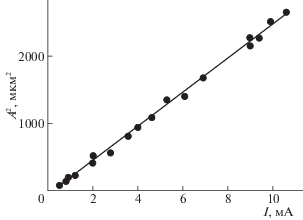
Воздействие ультразвуком на растворы производилось при различных амплитудах колебания торца волновода А = 6–30 мкм и частотах ультразвуковых колебаний ν = 22 кГц.
Анализ газообразных продуктов реакции проводился методом газовой хроматографии. Для определения этана, пропана, пропилена, диоксида углерода, метанола, этанола, ацетальдегида, оксида этилена, а также метана и этилена (в случае, когда они являлись продуктом реакции) использовалась хроматографическая колонка, заполненная полимерным сорбентом Полисорб-1 (l = 3 м, d = 3 мм, Ткол = 363 K, Q = 30 мл/мин). Проба на анализ отбиралась из раствора микрошприцом и в жидком виде вводилась в испаритель хроматографа, нагретый до 423 K. В качестве газа-носителя использовали гелий. Данная колонка позволяла также проводить качественный анализ исходного раствора на содержание кислорода после барботирования воды углеводородом. Водород, монооксид углерода и метан определялись в пробе, отобранной непосредственно из газовой фазы над раствором. Разделение осуществлялось с использованием колонки, заполненной молекулярным ситом 5 Å (l = 3 м, d = 3 мм, Ткол = 363 K, Q = 25 мл/мин). В этом случае газом-носителем был аргон. Детектором в обоих случаях служил катарометр.
Измерение концентрации формальдегида проводили с использованием хромотроповой кислоты на фотоэлектроколориметре КФК-2. С этой целью в заданный момент времени воздействие ультразвуком на раствор прекращалось, и содержимое реактора анализировалось на содержание формальдегида.
Эксперименты показали, что при окислении метана, этилена и их смесей образуются формальдегид, водород и незначительные количества монооксида углерода. При окислении этилена были обнаружены также следы ацетальдегида. Другие кислородсодержащие соединения (оксид этилена, спирты), а также углеводороды в условиях опыта обнаружены не были. Чувствительность хроматографического анализа метанола, ацетальдегида и оксида этилена составляет (1.2–1.4) × × 10–9 моль/мл. Порог определения углеводородов еще ниже. Учитывая изложенное, можно сделать вывод, что основным углеродсодержащим продуктом звукохимического превращения метана и этилена в водных растворах является формальдегид. В связи с этим за развитием процесса следили по количеству накапливающегося в растворе формальдегида.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
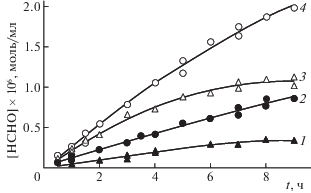
На рис. 3 приведены кинетические кривые накопления формальдегида при воздействии ультразвуком на водные растворы метана и этилена в отсутствие кислорода.
Рис. 3.
Кинетика накопления формальдегида при звукохимическом превращении метана (1, 2) и этилена (3, 4) в отсутствие кислорода; 1, 3 – продувка раствора углеводородом в течение 60 мин до начала воздействия ультразвуком; 2, 4 – то же с последующим барботажем в течение всего эксперимента.
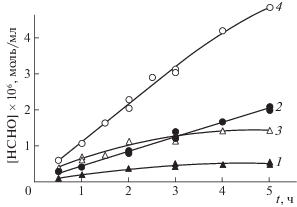
Аналогичным образом получены данные при использовании в качестве исходного реагента смесей метан–кислород или этилен–кислород. Кинетические кривые, полученные для соотношений CH4 : O2 = 1 : 1 и C2H4 : O2 = 1 : 1, представлены на рис. 4.
Рис. 4.
Кинетика накопления формальдегида при звукохимическом превращении смесей метан–кислород (1, 2) и этилен–кислород (3, 4); 1, 3 – продувка раствора реагирующей смесью в течение 60 мин до начала воздействия ультразвуком; 2, 4 – то же с последующим барботажем в течение всего эксперимента.
Эксперименты показали, что, если при воздействии ультразвуком на раствор не производится барботаж углеводородом или углеводород-кислородной смесью, то по ходу процесса наблюдается существенное уменьшение скорости накопления формальдегида. Возможной причиной уменьшения скорости может быть расход исходных реагентов. Как видно из рис. 3 и 4, во всех случаях накопление формальдегида с самого начала протекает с максимальной скоростью. Значения максимальных скоростей накопления формальдегида в зависимости от состава растворенного газа, рассчитанные на начальных стадиях процесса, приведены в табл. 1.
Таблица 1.
Значения максимальных скоростей накопления формальдегида (Wmax × 109, моль/(мл мин)) в зависимости от состава растворенного газа; А = 15 мкм, ν = 22 кГц
| Реагент | I | II |
|---|---|---|
| CH4 | 0.93 | 2.72 |
| C2H4 | 3.84 | 4.51 |
| C2H4 : CH4 = 1 : 1 | 2.96 | 4.15 |
| CH4 : O2 = 1 : 1 | 3.00 | 10.36 |
| C2H4 : O2 = 1 : 1 | 13.2 | 18.32 |
Из приведенных данных видно, что, при барботировании раствора реагентами во время воздействия ультразвуком, скорости накопления формальдегида значительно выше, чем в случае прекращения барботажа в момент включения ультразвука. Очевидно, что это объясняется тем, что кавитация приводит к интенсивной дегазации раствора и, следовательно, к уменьшению концентрации реагентов. В условиях, когда во время воздействия ультразвуком производится барботаж раствора реагентами, уменьшение их концентрации компенсируется подачей свежей порции. Кроме того, непрерывная подача свежего реагента компенсирует его расход в ходе процесса. Поэтому скорости в этом случае выше.
Интересным представляется тот факт, что формальдегид образуется, даже если в исходном растворе отсутствует молекулярный кислород. Действительно, барботирование в течение 60 мин дистиллированной воды чистым метаном или этиленом, которые растворяются в воде значительно лучше кислорода, практически полностью очищает воду. Хроматографический анализ получаемых растворов перед началом воздействия ультразвуком не обнаружил присутствия кислорода. Чувствительность хроматографического анализа позволяет определять количества кислорода меньшие, чем 10-9 моль/мл. Такие количества кислорода могут обеспечить лишь 0.1% формальдегида, накапливающегося в системе за время процесса. Очевидно, что в этом случае кислород, необходимый для окисления метана и этилена, отщепляется от молекулы воды. Тем не менее, введение кислорода в исходную смесь приводит к ускорению процесса образования формальдегида и увеличению его концентрации. В связи с этим было изучено влияние концентрации кислорода в исходной смеси на скорость накопления формальдегида. В этих экспериментах подача реагентов производилась барботажем газовой смеси непосредственно в реактор, заполненный дистилированной водой в течение 60 мин до начала воздействия ультразвуком. В момент включения ультразвука подача реагентов в реактор прекращалась. Результаты представлены на рис. 5.
Рис. 5.
Зависимости максимальной скорости накопления формальдегида от концентрации кислорода в подаваемых в реактор метан-кислородной (1) и этилен-кислородной (2) смесях; А = 15 мкм, ν = 22 кГц.
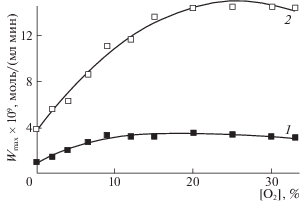
Из данных рис. 5 следует, что введение в исходную смесь молекулярного кислорода увеличивает скорость накопления формальдегида как при окислении метана, так и при окислении этилена. В случае метана наиболее сильное изменение WCH4 при увеличении содержания кислорода в исходной смеси наблюдается при [O2] ≤ 10%. Дальнейшее повышение концентрации кислорода мало влияет на скорость накопления формальдегида. При окислении этилена концентрация кислорода, выше которой скорость накопления формальдегида перестает расти, составляет ∼20%. Вероятно, характер наблюдаемой зависимости можно объяснить, если учесть различие в растворимостях реагентов. Согласно данным [27], растворимости кислорода, метана и этилена в воде составляют ∼1.3 × 10–6, 4.0 × 10–6 и 11.4 × × 10–6 моль/мл соответственно. Поскольку растворимость этилена значительно выше растворимости метана, то очевидно, что на его окисление требуется больше кислорода, чем на окисление метана. Поэтому предел по концентрации кислорода в случае этилена наблюдается при ее более высоких значениях (см. рис. 5).
Кавитация, как и любое изменение условий (в частности температуры, давления) изменяет растворимость газов. Поскольку процесс длится достаточно долгое время, то концентрации газов в воде достигают определенного значения, которое при неизменных условиях не меняется во времени. Строго говоря, концентрации газов в растворе в условиях кавитации не обязательно будут прямо пропорциональны значению их равновесной растворимости при нормальных условиях. Поэтому наблюдаемая в эксперименте корреляция объясняется различием растворимостей метана и этилена лишь в порядке предположения.
Следует особо отметить, что в исследуемой системе взаимодействие углеводорода с водой или кислородом – принципиально разные реакции с совершенно разной энергетикой. Если в отсутствие кислорода в исходной смеси процесс в целом можно описать гипотетическими брутто-реакциями:
Очевидно, что цепной процесс должен протекать значительно легче, чем и объясняется увеличение скорости накопления формальдегида при введении в исходную смесь молекулярного кислорода.
Следует особо подчеркнуть, что приводимые реакции носят предположительный характер, поскольку исследованный процесс, как и большинство звукохимических реакций, является совокупностью ряда сложных параллельных и последовательных физических и химических процессов [1, 26, 28]. Проблема осложняется тем, что в условиях кавитации затруднено определение точных параметров процесса, таких как температура, градиент температуры и давление в парогазовом пузырьке. Выяснение истинного механизма процесса требует постановки ряда специальных экспериментов. В частности, необходимо выяснить роль таких активных частиц, как ионы, радикалы, ион-радикалы, возбужденные частицы.
Таким образом, на основании полученных экспериментальных данных можно заключить, что основным продуктом звукохимического окисления метана, этилена и их смесей в водных растворах при частоте ультразвука ν = 22 кГц является формальдегид, который образуется, даже если в исходном растворе нет растворенного кислорода. Скорость накопления формальдегида зависит от мощности подаваемого ультразвукового излучения и количества введенного в систему молекулярного кислорода.
Список литературы
Маргулис М.А. Основы звукохимии. М.: Высшая школа, 1984. 272 с.
Suslick K.S., Didenko Yu., Fang M.M. et al // Phil. Trans. R. Soc. Lond. A. 1999. V. 357. P. 335.
Смородов Е.А., Галиахметов Р.Н., Ильгамов М.А. Физика и химия кавитации. Российская акад. наук, Уфимский науч. центр, Ин-т механики, 2008. 228 с.
Colmenares J.C., Chatel G. Sonochemistry. From Basic Principles to Innovative Applications. Springer, 2017. 281 p.
Bernard D., Primius B. // Ultrasonics Sonochemistry. 2008. V. 15. № 1. P. 78.
Воропаев С.А., Шкинев В.М., Днестровский А.Ю. и др. // Докл. РАН. 2012. Т. 446. № 4. С. 388.
Воропаев С.А., Днестровский А.Ю., Скоробогатский В.Н. и др. // Там же. 2014. Т. 459. № 2. С. 162.
Shaw S.J., Spelt P.D.M. // J. Fluid Mech. 2010. V. 646. P. 363. https://doi.org/10.1017/S0022112009993338
Нигматулин Р.И., Аганин А.А., Топорков Д.Ю., Ильгамов М.А. // Докл. РАН. 2014. Т. 458. № 3. С. 282.
Аганин А.А., Топорков Д.Ю. // Учен. зап. Казан. ун-та. Сер. Физ.-матем. науки. 2017. Т. 159. Кн. 3. С. 271.
Гейдон А., Герл И. Ударная труба в химической физике высоких температур. М.: Мир, 1966. 428 с.
Агафонов Г.Л., Тереза А.М. // Хим. физика. 2015. Т. 34. № 2. С. 49.
Davidson D.F., Oehlschlaeger M.A., Herbon J.T., Hanson R.K. // Proceedings of the Combustion Institute. 2002. V. 29. P. 1295.
Rickard M.J.A., Hall J.M., Petersen E.L. // Ibid. 2005. V. 30. P. 1915.
Penyazkov O.G., Ragotner K.A., Dean A.J., Varatharajan B. // Ibid. 2005. V. 30. P. 1941.
Маргулис М.А. // Журн. физ. химии. 2008. Т. 82. № 8. С. 1581. https://doi.org/10.1134/S004445370808030X
Margulis M.A. // Russ. J. Phys. Chem. A. 2008. V. 82. № 8. P. 1407.
Эльпинер И.Е., Сокольская А.В. // Журн. физ. химии. 1971. Т. 45. № 12. С. 3071.
Маргулис М.А. // Там же. 1976. Т. 50. С. 2531.
Маргулис М.А., Маргулис И.М. // Там же. 2003. Т. 77. № 7. С. 1318.
Margulis M.A., Margulis I.M. // Ultrasonics Sonochemistry. 2003. V. 10. P. 343.
Маргулис М.А., Маргулис И.М. // Акуст. журн. 2005. Т. 51. № 6. С. 802.
Suslick K.S., Hammerton D.A., Cline R.E. // J. Amer. Soc. 1986. V. 108. P. 5641.
Sumet Umchid, Kakanumporn Prasanpanich // Proceedings of the World Congress on Engineering. 2013. V. 2. WCE 2013. London, U.K.
Swamy K.M., Keil F.J. // Ultrasonics Sonochemistry. 2002. V. 9. № 6. P. 305.
Маргулис М.А. // Успехи физ. наук. 2000. Т. 43. № 3. С. 259.
Справочник химика. Том 2 (изд. 2). М.; Л.: Химия, 1964. 1168 с.
Маргулис М.А. // Химия высоких энергий. 2004. Т. 38. № 3. С. 163.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


