Журнал физической химии, 2020, T. 94, № 9, стр. 1367-1371
Коэффициенты активности в двойных системах, состоящих из бензола, дифенила и н-алканов
И. Г. Яковлев a, *, И. К. Гаркушин a, А. В. Колядо a
a Самарский государственный технический университет
Самара, Россия
* E-mail: yakovlev.ivan.g@gmail.com
Поступила в редакцию 14.10.2019
После доработки 14.10.2019
Принята к публикации 12.11.2019
Аннотация
Приведено сравнение теоретических расчетов и экспериментального изучения положения эвтектик в двухкомпонентных системах, состоящих из бензола, дифенила и н-алканов с числом атомов углерода от 12 до 17. Для систем дифенил–н-алкан (n = 12–17) и бензол–н-алкан (n = 12–17) приводятся данные по составу эвтектик, их температурам плавления, коэффициентам активности каждого компонента. Теоретическое исследование основывалось на методе Шредера–Ле Шателье и оригинальном методе UNIFAC, экспериментальные исследования проводили методом ДТА. Приведены отклонения данных эксперимента от расчетных для изученных систем. Построено графическое изменение коэффициентов активности бензола и н-гексадекана по методу UNIFAC и по данным эксперимента.
На предприятиях при синтезе различных материалов применяют высококипящие теплоносители. Для температур выше 200°С применяют теплоносители, состоящие из органических соединений. Например, дифенил, дифенилоксид, нафталин, глицерин и др., которые способны поддерживать температуру от 100 до 400°С [1]. Однако температура плавления таких веществ высока, вследствие чего возможна их кристаллизация в обогревательном контуре реакционных аппаратов. В случае проведения процесса при низких температурах окружающей среды в качестве теплоносителя применяют смеси из двух и более органических соединений. Например, широко применяется в химической промышленности теплоноситель динил (Даутерм А), представляющий собой эвтектическую смесь с содержанием 26.5 мас. % дифенила и 73.5 мас. % дифенилоксида [1]. Теплоноситель динил характеризуется температурой плавления равной 12.3°С, тогда как температура плавления составляет для дифенилоксида 26.84°С и дифенила 68.93°С.
Среди работ, описывающих подобные системы, можно отметить работы [2–21], но системы типа н-алкан–ароматический углеводород с двумя и более кольцами изучены сравнительно мало.
МЕТОДЫ ИССЛЕДОВАНИЯ И ОБЪЕКТЫ
Целью работы является систематизация и анализ данных по системам бензол–н-алкан и дифенил–н-алкан и, в связи с этим, работа формировалась на основе уже полученных экспериментальных данных. Экспериментальные данные были получены методом дифференциального термического анализа (ДТА) и более детально эксперименты по каждой системе описаны в работах [22] и [23].
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Согласно работам [22, 23] перед экспериментальными исследованиями проводили прогнозирование характеристик фазовых равновесий в исследуемых системах с помощью уравнения Шредера–Ле Шателье:
где xi – мольная доля компонента, ΔплHi – энтальпия плавления компонента, Дж/моль, ${{T}_{{{\text{пл}},{\text{\;}}i}}}$ – температура плавления чистого компонента, К; R – универсальная газовая постоянная, равна 8.314 кДж/(моль K).При расчете по уравнению Шредера–Ле Шателье раствор считали идеальным и поэтому коэффициенты активности компонентов принимали равными 1.
Данное уравнение описывает ход ликвидуса системы со стороны как первого, так и второго компонента. Пересечение кривых ликвидуса дает точку эвтектики. Для нахождения эвтектики необходимо решить систему, составленную из уравнений Шредера–Ле Шателье, относительно хi и Т:
(2)
$\left\{ \begin{gathered} \ln {{x}_{1}} = \frac{{{{\Delta }_{{{\text{пл}}}}}{{H}_{1}}\left( {{{T}_{{\text{e}}}} - {{T}_{{{\text{пл,\;1}}}}}} \right)}}{{R{{T}_{{{\text{пл,1}}}}}{{T}_{{\text{e}}}}}}, \hfill \\ \ln {{x}_{2}} = \frac{{{{\Delta }_{{{\text{пл}}}}}{{H}_{2}}({{T}_{{\text{e}}}} - {{T}_{{{\text{пл,}}i}}})}}{{R{{T}_{{{\text{пл,2}}}}}{{T}_{{\text{e}}}}}}, \hfill \\ 1 = {{x}_{1}} + {{x}_{2}}, \hfill \\ \end{gathered} \right.$Методика построения фазовой диаграммы с использованием уравнения Шредера–Ле Шателье приведена в работах [24, 25].
Для расчета коэффициентов активности компонентов систем в составе эвектики использовали модифицированное уравнение Шредера–Ле Шателье с введением в него коэффициента активности:
(3)
$\ln {{x}_{i}}{{\gamma }_{i}} = \frac{{{{\Delta }_{{{\text{пл}}}}}{{H}_{i}}({{T}_{{\text{e}}}} - {{T}_{{{\text{пл}},~i}}})}}{{R{{T}_{{{\text{пл}},~i}}}{{T}_{{\text{e}}}}}},$Теоретически коэффициент активности компонента определяли с помощью метода UNIFAC [26]. Метод UNIFAC основывается на уравнении:
где $\gamma _{i}^{C}$ – комбинаторная часть коэффициента активности, $\gamma _{i}^{R}$ – остаточная часть коэффициента активности. Подробный расчет комбинаторной части $\gamma _{i}^{C}$ и остаточной части $\gamma _{i}^{R}$ коэффициента активности приведен в [26].Экспериментальные значения коэффициентов активности рассчитывали исходя из экспериментальных данных по температурам ликвидусов изучаемых смесей. По этому методу коэффициент активности определялся на основании уравнения Шредера–Ле Шателье:
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На основании полученных результатов были составлены табл. 1 и 2, в которых приведены значения коэффициентов активности, а также характеристики эвтектик для каждой системы.
Таблица 1.
Коэффициенты активности компонентов в эвтектиках исследованных систем
| Система | Ароматический углеводород | н-Алкан | ||||
|---|---|---|---|---|---|---|
| Метод UNIFAC | Эксперимент | Отклонение от эксперимента, % | Метод UNIFAC | Эксперимент | Отклонение от эксперимента, % | |
| Системы с н-алканом с четным числом атомов углерода | ||||||
| С6Н6–н-С12Н26 | 0.923746 | 0.813751 | –13.52 | 0.884047 | 0.738305 | –19.74 |
| С6Н6–н-С14Н30 | 0.933755 | 0.881637 | –5.91 | 0.763558 | 0.561068 | –36.09 |
| С6Н6–н-С16Н34 | 0.951901 | 0.991796 | 4.02 | 0.607414 | 0.688872 | 11.82 |
| С12Н10–н-С12Н26 | 1.257062 | 0.886051 | –41.87 | 1.002031 | 0.987435 | –1.48 |
| С12Н10–н-С14Н30 | 1.177331 | 1.440509 | 18.27 | 1.003792 | 1.045274 | 3.97 |
| С12Н10–н-С16Н34 | 1.107323 | 1.907064 | 41.94 | 1.004388 | 0.873574 | –14.97 |
| Системы с н-алканом с нечетным числом атомов углерода | ||||||
| С6Н6–н-С13Н28 | 0.90802 | 0.888789 | –2.16 | 0.863235 | 1.037613 | 16.81 |
| С6Н6–н-С15Н32 | 0.918993 | 1.006826 | 8.72 | 0.745133 | 1.319398 | 43.52 |
| С6Н6–н-С17Н36 | 0.932071 | 0.973570 | 4.26 | 0.612315 | 2.186662 | 72.00 |
| С12Н10–н-С13Н28 | 1.222129 | 1.145539 | –6.69 | 1.002207 | 0.985128 | –1.73 |
| С12Н10–н-С15Н32 | 1.140993 | 1.773908 | 35.68 | 1.003561 | 0.938733 | –6.91 |
| С12Н10–н-С17Н36 | 1.084657 | 3.830232 | 71.68 | 0.833537 | 0.832207 | –0.16 |
Таблица 2.
Свойства эвтектик исследованных систем
| Система | Температура плавления, K | Содержание ароматического углеводорода, мол. доля [9, 10] | ||||
|---|---|---|---|---|---|---|
| Метод UNIFAC | Эксперимент | Отклонение от эксперимента, К | Метод UNIFAC | Эксперимент | Отклонение от эксперимента, мол. доли. | |
| Системы с н-алканом с четным числом атомов углерода | ||||||
| С6Н6–н-С12Н26 | 246.69 | 242.95 | –3.74 | 0.624 | 0.6587 | 0.0347 |
| С6Н6–н-С14Н30 | 256.19 | 252.65 | –3.54 | 0.738 | 0.7334 | –0.0046 |
| С6Н6–н-С16Н34 | 263.74 | 265.65 | 1.91 | 0.827 | 0.8205 | –0.0065 |
| С12Н10–н-С12Н26 | 261.71 | 260.95 | –0.76 | 0.105 | 0.131 | 0.026 |
| С12Н10–н-С14Н30 | 276.13 | 277.15 | 1.02 | 0.178 | 0.137 | –0.041 |
| С12Н10–н-С16Н34 | 287.29 | 287.25 | –0.04 | 0.26 | 0.14 | –0.12 |
| Системы с н-алканом с нечетным числом атомов углерода | ||||||
| С6Н6–н-С13Н28 | 246.25 | 247.85 | 1.6 | 0.629 | 0.6643 | 0.0353 |
| С6Н6–н-С15Н32 | 254.72 | 262.15 | 7.43 | 0.731 | 0.7615 | 0.0305 |
| С6Н6–н-С17Н36 | 260.71 | 269.95 | 9.24 | 0.802 | 0.8976 | 0.0956 |
| С12Н10–н-С13Н28 | 264.96 | 265.15 | 0.19 | 0.1222 | 0.117 | –0.0052 |
| С12Н10–н-С15Н32 | 278.38 | 279.35 | 0.97 | 0.2 | 0.119 | –0.081 |
| С12Н10–н-С17Н36 | 286.53 | 290.35 | 3.82 | 0.263 | 0.076 | –0.187 |
При анализе коэффициента активности ароматического углеводорода в исследованных системах заметно, что с увеличением числа атомов углерода в н-алкане в системах с бензолом коэффициент активности увеличивается по результатам расчетов методов UNIFAC. Коэффициент активности дифенила наоборот демонстрирует уменьшение значений по результатам метода UNIFAC. Коэффициенты активности н-алканов наоборот уменьшаются в системах с бензолом, но увеличиваются в системах с дифенилом. Исключением в данном случае является система С12Н10–н-С17Н36, где коэффициент активности резко снижается. Это может быть связано с близостью температуры плавления эвтектики к температуре полиморфного перехода н-гептадекана. Также можно заметить, что в системах дифенил-н-алкан, коэффициент активности у н-алканов при увеличении атомов углерода изменяется меньше всего, отличие в третьем знаке после запятой (не считая системы С12Н10–н-С17Н36).
Рассчитанные по экспериментальным данным коэффициенты активности имеют разнонаправленные тенденции. К примеру, в системах с н-С14Н30 коэффициент активности выбивается из общей тенденции: в системе с бензолом он ниже, в системе с дифенилом выше, чем можно было бы ожидать по результатам систем с н-С12Н26 и н-С16Н34. В системах с нечетным числом атомов углерода лишь значения в системе С6Н6–н-С15Н32 отличаются от ожидаемого значения по результатам систем с н-С13Н28 и н-С17Н36.
Таблица 1 показывает, что коэффициенты активности, полученные методом UNIFAC и коэффициенты активности, полученные по экспериментальным данным, сильно отличаются друг от друга. Процент отклонения метода UNIFAC от эксперимента составляет до 72% (для коэффициента активности н-алкана в системе С6Н6–н-С17Н36). Вместе с тем коэффициент активности н‑гептадекана в системе С12Н10–н-С17Н36 наоборот демонстрирует максимальное совпадение экспериментальных данных с методом UNIFAC – отклонение составляет 0.16%.
При анализе табл. 2 заметно, что во всех изученных системах отклонение температуры, рассчитанной методом UNIFAC от экспериментальной температуры составляет не более 9.24 K (система С6Н6–н-С17Н36), а отклонение содержания дифенила в составе эвтектики не превышает 0.187 мол. долей (система С12Н10–н-С17Н36). Такая значительная разница по содержанию дифенила в составе эвтектики вероятно связана с влиянием полиморфизма н-гептадекана, которое не учитывалось при расчете по методу UNIFAC. Вместе с тем минимальное отклонение составляет для температуры 0.04 K (система С12Н10–н-С16Н34), для содержания ароматического углеводорода в эвтектике 0.0046 мол. долей (С6Н6–н-С14Н30). Отклонения метода UNIFAC были ранее показаны в [24].
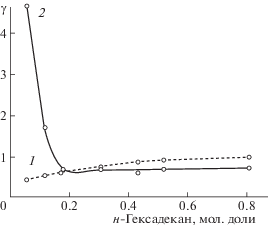
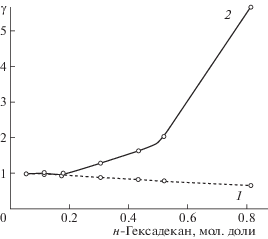
Распределение коэффициентов активности в диапазоне концентраций в отдельной системе показано на примере системы бензол–н-гексадекан. Как видно из табл. 3 и рис. 1 и 2, коэффициенты активности компонентов, рассчитанные по методу UNIFAC, увеличиваются с повышением содержания компонента в смеси. В то же время коэффициенты активности, рассчитанные на основе эксперимента, показывают обратную закономерность и увеличиваются с понижением содержания компонента. Более того, экспериментальные коэффициенты активности по своим значениям намного выше коэффициентов, полученных методом UNIFAC для смесей с малым содержанием одного из компонента.
Таблица 3.
Коэффициенты активности и температуры ликвидуса для системы бензол–н-гексадекан
| Содержа-ние н-гек-садекана, мол. доля | Температура ликвидуса, K | Коэффициенты активности | |||||||
|---|---|---|---|---|---|---|---|---|---|
| UNIFAC | Эксперимент | Отклонения от эксперимента | |||||||
| Экспе-римент | UNIFAC | Отклоне-ния от экспери-мента | н-Гекса-декан | Бензол | н-Гекса-декан | Бензол | н-Гекса-декан | Бензол | |
| 0.0564 | 274.4 | 274.3 | 0.1 | 0.4323 | 0.9931 | 4.6877 | 0.9938 | 4.2555 | 0.0007 |
| 0.1165 | 271.1 | 269.1 | 2.0 | 0.5270 | 0.9749 | 1.7113 | 1.0069 | 1.1843 | 0.0320 |
| 0.1730* | – | 263.7 | – | 0.6074 | 0.9519 | – | – | – | – |
| 0.1794** | 265.7 | – | – | – | – | 0.6889 | 0.9918 | – | – |
| 0.3054 | 271.4 | 272.7 | –1.3 | 0.7591 | 0.8889 | 0.6701 | 1.2870 | –0.0890 | 0.3981 |
| 0.4325 | 274.2 | 278.3 | –4.1 | 0.8601 | 0.8272 | 0.6016 | 1.6471 | –0.2585 | 0.8199 |
| 0.5180 | 278.0 | 281.2 | –3.2 | 0.9081 | 0.7877 | 0.6902 | 2.0575 | –0.2178 | 1.2698 |
| 0.8084 | 284.2 | 287.9 | –3.7 | 0.9893 | 0.6717 | 0.7295 | 5.6803 | –0.2597 | 5.0086 |
ВЫВОДЫ
1. Расчет оригинальным методом UNIFAC систем, состоящих из дифенила, бензола и н-алкана демонстрирует небольшие отклонения по температуре эвтектики (диапазон ошибки от 0.04 до 9.24 K), но показывает сравнительно большие отклонения по составу эвтектики (отклонение до 0.187 мол. долей). При использовании этого метода прогнозирования фазовых равновесий в аналогичных системах следует учитывать данное обстоятельство.
2. По приведенным системам можно сделать вывод, что погрешность оригинального метода UNIFAC от эксперимента не зависит от количества бензольных колец в ароматическом соединении, но возрастает в зависимости от числа атомов углерода в н-алкане в системах, включающих н-алкан нечетного ряда.
3. Значения коэффициентов активности компонентов в эвтектиках систем дифенил – н-алкан и бензол–н-алкан, рассчитанные методом UNIFAC и определенные на основе эксперимента, различны (отклонения расчетных данных от экспериментальных до 71.68%).
Список литературы
Чечеткин А.В. Высокотемпературные теплоносители. М.: Энергия, 1971. С. 496.
Lijiao Yu, Hong Dong, Chuan Wu, Yindi Zhang // J. Chem. Thermodynamics. 2014 . V. 72. P. 139.
Lisa C., Ungureanu M., Cosmaţchi P.C., Bolat G. // Thermochimica Acta. 2015. V. 617. P. 76.
Melvin D., Patterson D. Temperature dependence of excess enthalpies for systems containing normal hexadecane / Ed by D. Melvin, D. Patterson. J. Solut. Chem. 1979. V. 8. P. 573.
Rice P., Teja Amyn S. // J. Chem. and Eng. Data. 1980. V. 25. № 4. P. 346.
Sharma S., Makavana M. // Fluid Phase Equilibria. 2014. V. 375. P. 219.
Sheng Fang, Xiao-Bo Zuo, Xue-Jiao Xu, Da-Hai Ren // J. Chemical Thermodynamics. 2014. V. 68. P. 281.
Yindi Zhang, Hong Dong, Yan Yue, Chuan Wu // Ibid. 2013. V. 57. P. 114.
Domanska U., Morawski P. // Fluid Phase Equilibria. 2004. V. 218. P. 57. https://doi.org/10.1016/j.fluid.2003.11.017
Domanska U., Morawski P., Wierzbicki R. // Ibid. 2006. V. 242. P. 154–163. https://doi.org/10.1016/j.fluid.2006.02.001
Domanska U., Morawski P. // J. Chem. Eng. Data. 2005. V. 50. P. 1073–1082.
Aminabhavi T.M., Patil V.B., Aralaguppi M.I., Phayde H.T.S. // J. Chem. Eng. Data. 1996. V. 41. P. 521.
Ott J.B., Goates J.R. // J. Chem. Thermodynamics. 1983. V. 15. P. 267.
Goates J.R., Ott J.B., Moellmer J.F. // Ibid. 1977. V. 9. P. 249.
Iloukhani H., Rezaei-Sameti M. // J. Chem. Eng. Data. 2005. V. 50. P. 1928.
Letcher T.M. // J. Chem. Thermodynamics. 1975. V. 7. P. 205.
Letcher T.M., Spiteri W.L. // Ibid. 1979. V. 11. P. 435.
Ott J.B., Marsh K.N., Stokes R.H. // Ibid. 1980. V. 12. P. 1139.
Snow R.L., Ott J.B., Goates J.R. // Ibid. 1986. V. 18. P. 107.
Takigawa T., Ohba M., Ogawa H., Murakami S. // Fluid Phase Equilibria. V. 204. 2003. P. 119.
Tripathi N. // Int. J. Thermophysics. 2005. V. 26. № 3. https://doi.org/10.1007/s10765-005-5572-8
Копнина А.Ю. Фазовые равновесия в рядах двухкомпонентных систем с участием циклических, ароматических углеводородов и н-алканов: дис. … канд. хим. наук: 02.00.04. Самара, 2003. С. 106.
Яковлев И.Г. Физико-химический анализ систем с участием дифенила, дифенилоксида и некоторых н-алканов: дис. … канд. хим. наук: 02.00.04. Саратов, 2018. С. 156.
Гаркушин И.К., Дорохина Е.В., Колядо А.В. // Журнал “Бутлеровские сообщения”. 2009. Т. 16. Т. 3. С. 41.
Гаркушин И.К., Колядо А.В., Дорохина Е.В. Расчет и исследование фазовых равновесий в двойных системах из органических веществ. Екатеринбург: УрО РАН, 2011. С. 191.
Морачевский А.Г., Смирнова Н.А., Пиотровская Е.М. и др. Термодинамика равновесия жидкость–пар. Ленинград: Химия, 1989. С. 344.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии