Журнал физической химии, 2020, T. 94, № 8, стр. 1179-1184
Образование глицинатных комплексов железа(II) при различных ионных силах раствора
М. Рахимова a, *, Г. Б. Эшова a, Дж. А. Давлатшоева a, Л. В. Квятковская a, Ф. Мираминзода a
a Таджикский национальный университет
Душанбе, Таджикистан
* E-mail: muboshira09@mail.ru
Поступила в редакцию 23.09.2019
После доработки 04.12.2019
Принята к публикации 10.12.2019
Аннотация
Процессы комплексообразования в системе Fe(0)–Fe(II)–глицин–Na(H)ClO4–H2O при температуре 298.15 K, ионных силах раствора 0.1–1.0 (NaC104), СFe(II) = 1 × 10–3 и CHL = 3 × 10–3 моль/л в интервале pH 0.8–8.0 изучены методом окислительного потенциала Кларка–Никольского. Получены экспериментальные кривые зависимости ЭДС системы от концентрационных параметров: рН, pCFe(II), рСHL. Для расчета констант образования комплексов использован метод последовательного приближения теоретической и экспериментальной окислительной функций с применением программы Excel. Зависимость константы образования комплексов от ионной силы раствора рассчитана на основе теории Дебая–Хюккеля и по программе “SigmaPlot-10.0”. Установлено, что при возрастании ионной силы раствора значения констант образования формирующихся координационных соединений уменьшаются.
Координационные соединения переходных металлов обладают уникальными свойствами: биологической, каталитической, акустической активностями, поэтому широко применяются во многих областях науки, техники, промышленности, медицины, фармакологии, косметологии.
Глицин (аминоуксусная кислота) служит модельным объектом при изучении комплексообразования с 3d-переходными металлами, так как применяется в лечебных целях несколько десятилетий. Эта аминокислота входит в состав белков растительного и животного происхождения. В жидкостях и тканях может находиться в свободном состоянии. Глицин – составная часть некоторых биологически активных соединений: глутатиона, антибиотиков, нейропептидов, содержится в составе муреина клеточных стенок бактерий. Обычно входящие во внутреннюю сферу комплекса компоненты изменяют его химические свойства и биологическую активность, следовательно, становятся причиной появления других свойств и новых возможных аспектов применения.
Цель настоящей работы – изучение процессов комплексообразования в системе Fe(0)–Fe(II)–глицин–Na(H)ClO4–H2O при СFe(II) = 1 × × 10–3 моль/л и CHL = 3 × 10–3 моль/л в интервале pH 0.8–8.0, температуре 298.15 K и ионных силах раствора 0.1–1.0 моль/л. Закономерности зависимости констант устойчивости комплексов от ионной силы можно установить по изменению коэффициентов активности сосуществующих ионов в растворе [1].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
При проведении экспериментов использовали перхлорат железа(II), исходную концентрацию которого определяли бихроматометрическим методом [2, 3]. Концентрацию NaClO4 после предварительной очистки перекристаллизацией определяли весовым методом [4, 5]. Хлорную кислоту HClO4 марки “х. ч.” использовали без предварительной очистки. Концентрацию гидроксида натрия определяли методом прямого титрования 0.1 М раствором соляной кислоты HCl из фиксонала [6, 7].
Нами изучена гетерогенная система Fe(0)–Fe(II)–глицин–вода методом оксредметрии [8, 9], которая предусматривает снятие экспериментальных зависимостей электродвижущей силы (Е, мВ) от следующих концентрационных переменных рН(–lg h), pCFe(II)(–lg CFe(II)) и рСL(‒lg СНL), где h – активность ионов водорода, а СНL – концентрация глицина.
При выполнении экспериментов использовали специальную герметичную установку [9] с аэробными условиями в токе очищенного азота или аргона, что исключало окисление Fe(II) и образование железа(III), а также позволяло хорошо перемешивать рабочий раствор. Методика проведения эксперимента заключается в измерении ЭДС двух гальванических элементов I и II:
(I)
${\text{F}}{{{\text{e}}}^{0}}{\text{/исследуемый раствор//С}}{{{\text{l}}}^{--}},{\text{AgCl/Ag}},$(II)
$\begin{gathered} {\text{Ag}},{\text{AgCl/HCl/стекло/исследуемый }} \\ {\text{раствор//KCl/AgCl}},{\text{Ag}}. \\ \end{gathered} $ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее [10–12] были изучены процессы комплексообразования в системах Fe(II)–Fe(III)–глицин–Na(H)ClO4–H2O и Fe(0)–Fe(II)–глицин–Na(H)ClO4–H2O при температуре 298.16 K, ионных силах раствора 0.1–1.0 (NaC104) при различных концентрациях металла и лиганда в интервале pH 0.8–8.0 методом окислительного потенциала Кларка–Никольского.
Следует отметить, что использованный классический метод окислительного потенциала Кларка–Никольского является высокочувствительным, и малейшее изменение концентрации Fe(II) (часть катионов идет на образование комплексов) или его окисление и формирование Fe(III) сразу влияет на величины ЭДС или окислительного потенциала системы согласно уравнению Нернста.
Реакцию комплексообразования железа(II) со всеми формами глицина с учетом гидролиза можно представить уравнением:
(1)
$\begin{gathered} q{{[{\text{Fe}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{6}}]}^{{2 + }}} + l{{{\text{H}}}_{s}}{\text{L}} + k{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {{[{\text{F}}{{{\text{e}}}_{q}}{{({{{\text{H}}}_{s}}{\text{L}})}_{l}}{{({\text{OH}})}_{k}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{j}}]}^{{2q--k--l + s}}} + \\ + \;k{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{ + }} + l{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $Для определения предположительного состава координационных соединений, образующихся в исследуемой системе, а также значений базисных частиц (q, s, l, k), согласно теории метода оксредметрии, были получены экспериментальные зависимости ЭДС (Е, мВ) от рН раствора в интервале ионных сил 0.1–1.0 моль/л (рис. 1).
Рис. 1.
Зависимости ЭДС от рН в системе Fe(0)–Fe(II)–глицин–Na(H)ClO4–H2O при 298.16 K, СFe(II) = = 1 × 10–3 и CHL = 3 × 10–3 моль/л и различных значениях ионных сил раствора: 1 – 0.75, 2 – 0.25, 3 – 0.50, 4 – 0.10, 5 – 1.00 моль/л.
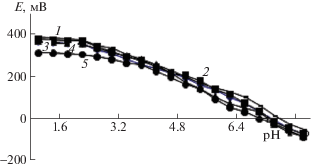
Вид полученных кривых свидетельствует о том, что в кислой области ЭДС не изменяется, следовательно, процесс комплексообразования железа начинается с рН > 2.0 и идет до 8.0. Концентрация комплексообразующих ионов глицина зависит от ионной силы раствора. Из рис. 1 следует, что при меньших ионных силах начало комплексообразования сдвигается в сторону увеличения рН.
Рассмотрим более подробно экспериментальную зависимость Е от рН при CFe(II) = 1 × 10–3, CGly = 3 × 10–3 и ионной силе 0.5 моль/л (рис. 2). Согласно теории метода оксредметрии, последовательное формирование линейных участков с тангенсами углов наклона равными: 0, –ν/2, –ν свидетельствует о ступенчатом комплексообразовании Fe(II). Зависимости Е–рН позволяют определить общее количество координированных лигандов вокруг центрального иона комплексообразователя.
Рис. 2.
Зависимость ЭДС от рН для системы Fe(0)–Fe(II)–глицин–Na(H)ClO4–H2O при CFe(II) = 1 × 10–3, CНL = 3 × 10–3 и I = 0. 5 моль/л.
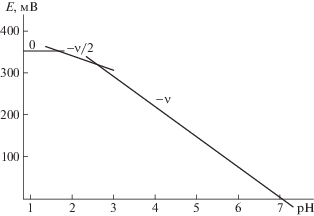
Анализ наклонов всех полученных экспериментальных кривых позволил составить матрицу значений угловых коэффициентов [13], с помощью которых определены предположительные составы образующихся координационных соединений (табл. 1).
Таблица 1.
Экспериментальные значения угловых коэффициентов зависимостей ЭДС от концентрационных переменных системы Fe(0)–Fe(II) – глицин–Na(H)ClO4–H2O при температуре 298.15 K, I = 0.50, СFe(II) = 1 × 10–3 и СНL = 3 × 10–3 моль/л
| Область существования комплексов по шкале рН | Зависимость ЭДС от концентрационных параметров | Предположительный состав комплексов | ||
|---|---|---|---|---|
| рH | рСFe(II) | pСL | ||
| 1.0–2.8 | 0 | – | – | [Fe(H2O)6]2+ |
| 1.0–3.4 | –ν/2 | –ν/2 | – | [Fe(OH)(H2O)5]+ |
| 1.0–4.2 | –ν/2 | –ν/2 | ν/2 | [FeHL(H2O)5]2+ |
| 1.2–6.2 | –ν | –ν/2 | ν | [Fe(HL)(OH)(H2O)4]+ |
| 2.2–4.8 | –ν | –ν/2 | – | [Fe(OH)2(H2O)4]0 |
| 2.8–8.2 | –ν | –ν/2 | ν | [Fe(HL)L-(H2O)4]+ |
Для расчета констант равновесия использована окислительная функция Юсупова [14]. По экспериментальным значениям ЭДС на ее зависимости от рН сначала рассчитаны величины экспериментальной окислительной функции ƒЭ по уравнению:
(2)
$f_{Э}^{0} = {{C}_{{\text{r}}}}{\text{/}}{{C}_{{\text{o}}}}\operatorname{e} хp(E - {{E}^{0}})n{\text{/}}\nu ,$(3)
$\begin{gathered} f_{{\text{т}}}^{0} = 1000{{h}^{3}}{\text{/}}\{ {{h}^{3}} + {{\beta }_{{1001}}}{{h}^{2}} + {{\beta }_{{1110}}}{{K}_{1}}{{C}_{{{\text{a1}}}}}{{h}^{2}} + \\ + \;{{\beta }_{{1111}}}{{K}_{1}}{{C}_{{{\text{a1}}}}}h + {{\beta }_{{1120}}}K_{1}^{2}{{K}_{2}}C_{{{\text{a1}}}}^{2} + {{\beta }_{{1002}}}h\} . \\ \end{gathered} $Рис. 3.
Зависимости логарифмических значений экспериментальной fэ (1) и теоретической fт (2) окислительных функций от рН для системы Fe(0)–Fe(II)–Gly при температуре 298.15 K, I = 0.5, CFe(II) = 1 × 10–3 и CGly = 3 × 10–3 моль/л.
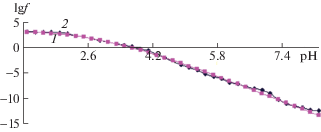
Как видно из рис. 3, кривые дали хорошее приближение при указанных в табл. 1 составах.
Были попытки осуществить приближение теоретической и экспериментальной окислительной функций без гидроксокомплексов [FeOH]+ и [Fe(OH)2]0. При этом получено слишком большое расхождение кривых, что, согласно теории метода [8, 9], свидетельствует о неправильно определенных составах комплексов. Кроме того, как показывают полученные нами данные из диаграмм их распределения (рис. 4) мольные доли или максимальные их степени накопления в системе составляют всего лишь ∼7.63% [FeOH]+ (кривая 2 рис. 4) и ∼3.99% для [Fe(OH)2]0 (кривая 5 рис. 4). Как было отмечено выше, метод Кларка–Никольского высокочувствительный, что позволило уловить такие незначительные изменения. При использовании других методов исследования мольная доля, составляющая 5–7%, обычно находится в пределах ошибки опыта.
Рис. 4.
Зависимости степени накопления комплексов (1 – [Fe(H2O)6]2+, 2 – [Fe(OH)(H2O)5]+, 3 – [FeHL(H2O)5]2+, 4 – [Fe(HL)(OH)(H2O)4]+, 5 – [Fe(OH)2(H2O)4]0, 6 – [Fe(HL)L–(H2O)4]+) от рН для системы Fe(II)–Glу–H2O при 298.15 K, I = 0.50, CFe(II) = 1 × 10–3, CGly = 3 × 10–3 моль/л.
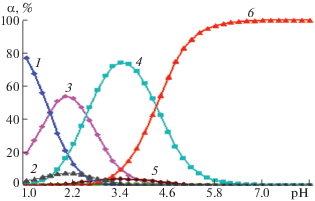
Аналогичные расчеты проведены при различных ионных силах раствора (табл. 2).
Таблица 2.
Значения констант устойчивости (lg βqslk) комплексов железа(II) системы Fe(0)–Fe(II)–глицин–Na(H)ClO4–H2O при температуре 298.15 K и различных ионных силах раствора (I, моль/л), СFe(II) = 1 × 10–3, СHL = 3 × 10–3 моль/л
| Комплекс | I = 0.10 | I = 0.25 | I = 0.50 | I = 0.75 | I = 1.00 |
|---|---|---|---|---|---|
| [FeHL(H2O)5]2+ | 3.50 ± 0.06 | 3.46 ± 0.05 | 3.32 ± 0.07 | 3.11 ± 0.05 | 2.90 ± 0.04 |
| [Fe(OH)(H2O)5]+ | –2.37 ± 0.08 | –2.39 ± 0.06 | –2.44 ± 0.05 | –2.47 ± 0.05 | –2.51 ± 0.04 |
| [Fe(OH)2(H2O)4]0 | –5.29 ± 0.08 | –5.33 ± 0.09 | –5.39 ± 0.06 | –5.42 ± 0.05 | –5.48 ± 0.05 |
| [Fe(HL)(OH)(H2O)4]+ | 0.97 ± 0.04 | 0.92 ± 0.05 | 0.80 ± 0.06 | 0.57 ± 0.07 | –0.01 ± 0.06 |
| [Fe(HL)L–(H2O)4]+ | 9.91 ± 0.05 | 10.96 ± 0.05 | 10.92 ± 0.05 | 10.71 ± 0.05 | 8.91 ± 0.04 |
Установлено, что константы протолитических равновесий лиганда изменяются в зависимости от количества фонового электролита, следовательно, ионной силы раствора. Это приводит к различным выходам протонированных форм глицина. При увеличении ионной силы от 0.1 до 1.0 моль/л логарифмы констант образования (lg βqslk) комплексов (табл. 2) постепенно уменьшаются, что связано с изменением коэффициентов активности ионов раствора [13].
Известно, что зависимость концентрационной константы равновесия координационных соединений от ионной силы раствора выражается по теории Дебая–Хюккеля [15] уравнением:
(4)
$\lg {{\beta }_{{\text{C}}}} = \lg {{\beta }_{0}} + \Delta {{z}^{2}}A\surd {\kern 1pt} I{\text{/}}(1 + Bа\surd {\kern 1pt} I) + bI,$Полученные прямые линии при экстраполяции на нулевое значение ионной силы дают отрезки на оси ординат, численно равные lg β0 (табл. 3). Угловой коэффициент полученных кривых позволил определить величину эмпирической константы b уравнения (4), которые приведены в табл. 3.
Таблица 3.
Величины термодинамической (lg β0) и эмпирической (b) констант для комплексов Fe(II) образующихся в системе: Fe(0)–Fe(II)–глицин–Na(H)ClO4–H2O при 298.15 K, СFe(III) = СFe(II) = 1 × 10–3 и CHL = 3 × 10–3 моль/л (I – значения, полученные экстраполяцией, II – расчет по программе “SigmaPlot-10.0”)
| Комплекс | lg β0(I) | lg β0(II) | b (I) | b (II) |
|---|---|---|---|---|
| [FeHL(H2O)5]2+ | 2.86 | 3.54 | –0.54 | –0.36 |
| [Fe(OH)(H2O)5]+ | –2.80 | –2.37 | –0.3 | –0.06 |
| [Fe(OH)2(H2O)4]0 | –5.56 | –5.29 | –0.28 | 0.03 |
| [Fe(HL)(OH)(H2O)4]+ | 0.60 | 0.88 | –0.6 | –1.61 |
| [Fe(HL)L–(H2O)4]+ | 10.02 | 9.31 | –0.06 | –8.18 |
В изученной системе рассчитанные величины эмпирической константы (b) принимают отрицательные значения для всех образующихся комплексов, и тогда уравнение (4) принимает вид:
(5)
$\lg {{\beta }_{{\text{C}}}} = \lg {{\beta }_{0}} + \Delta {{z}^{2}}A\surd {\kern 1pt} I{\text{/}}(1 + 1.6\surd {\kern 1pt} I)--bI.$(6)
$\begin{gathered} {{[{\text{FeHL}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{5}}]}^{{2 + }}}{\kern 1pt} :\;\;\lg {{\beta }_{C}} = 2.86 + \\ + \;3.05\surd {\kern 1pt} I{\text{/}}(1 + 1.6\surd {\kern 1pt} I)--0.54I, \\ \end{gathered} $(7)
$\begin{gathered} {{[{\text{Fe}}({\text{OH}}){{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{5}}]}^{ + }}{\kern 1pt} :\;\;\lg {{\beta }_{C}} = --2.8 + \\ + \;1.527\surd {\kern 1pt} I{\text{/}}(1 + 1.6\surd {\kern 1pt} I)--0.3I, \\ \end{gathered} $(8)
$\begin{gathered} {{[{\text{Fe}}{{({\text{OH}})}_{2}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{4}}]}^{0}}{\kern 1pt} :\;\;\lg {{\beta }_{C}} = --5.56 + \\ + \;1.018\surd {\kern 1pt} I{\text{/}}(1 + 1.6\surd {\kern 1pt} I)--0.28I, \\ \end{gathered} $(9)
$\begin{gathered} {{[{\text{Fe}}({\text{HL}})({\text{OH}}){{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{4}}]}^{ + }}{\kern 1pt} :\;\;\lg {{\beta }_{C}} = 0.6 + \\ + \;1.527\surd {\kern 1pt} I{\text{/}}(1 + 1.6\surd {\kern 1pt} I)--0.6I, \\ \end{gathered} $(10)
$\begin{gathered} {{[{\text{Fe}}({\text{HL}}){{{\text{L}}}^{--}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{4}}]}^{ + }}{\kern 1pt} :\;\;\lg {{\beta }_{C}} = 10.02 + \\ + \;3.05\surd {\kern 1pt} I{\text{/}}(1 + 1.6\surd {\kern 1pt} I)--0.06I. \\ \end{gathered} $Проведены расчеты и статистическая обработка констант по уравнению (11) с использованием программы “SigmaPlot-10.0” (рис. 5, табл. 3):
Рис. 5.
Зависимости констант образования комплексных соединений (1 – [FeHL(H2O)5]2+, 2 – [Fe(OH)(H2O)5]+, 3 – [Fe(OH)2(H2O)4]0, 4 – [Fe(HL)(OH)(H2O)4, 5 – [Fe(HL)L–(H2O)4]+ от ионной силы раствора (I, моль/л) в системе: Fe(0)–Fe(II)–глицин–Na(H)ClO4–H2O, температуре 298.15 K, СFe(II) = = 1 × 10–3 и CHL = 3 × 10–3 моль/л; расчет по программе “SigmaPlot-10.0”.
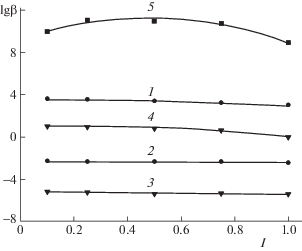
Значения логарифма термодинамических констант (lg β0) образующихся координационных соединений, полученных двумя методами (табл. 3), согласуются между собой. Значения эмпирической константы (b) уравнений (6)–(11) согласуются между собой в пределах ошибки метода расчета.
Константы образования координационных соединений, рассчитанные по экспериментальным данным, полученным методом итерации, и вычисленные с помощью соответствующих уравнений (6)–(10), а также с применением программы “SigmaPlot-10.0” (уравнение (11)) хорошо согласуются между собой (табл. 4), что свидетельствует о достоверности полученных результатов.
Таблица 4.
Значения концентрационных констант образования (lg βС) комплексов Fe(II) системы: Fe(0)–Fe(II)–глицин–Na(H)ClO4–H2O при 298.15 K, СFe(III) = СFe(II) = 1 × 10–3 и CHL = 3 × 10–3 моль/л (I – расчет по уравнениям (6)–(10); II – полученные экспериментально)
| I, моль/л | [FeHL(H2O)5]2+ | [Fe(OH)(H2O)5]+ | [Fe(OH)2(H2O)4]0 | [Fe(HL)(OH)(H2O)4]+ | [Fe(HL)L–(H2O)4]+ | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| I (6) | II | I (7) | II | I (8) | II | I (9) | II | I (10) | II | |
| 0.10 | 3.45 | 3.50 | –2.51 | –2.37 | –5.37 | –5.29 | 0.86 | 0.97 | 10.3 | 9.91 |
| 0.25 | 3.57 | 3.46 | –2.45 | –2.39 | –5.35 | –5.33 | 0.87 | 0.92 | 10.4 | 10.96 |
| 0.50 | 3.60 | 3.32 | –2.44 | –2.44 | –5.36 | –5.39 | 0.81 | 0.79 | 10.5 | 10.92 |
| 0.75 | 3.56 | 3.11 | –2.47 | –2.47 | –5.40 | –5.42 | 0.70 | 0.57 | 10.5 | 10.71 |
| 1.00 | 3.49 | 2.90 | –2.51 | –2.51 | –5.45 | –5.48 | 0.59 | –0.05 | 10.5 | 8.91 |
Список литературы
Бек М. Исследование комплексообразования новейшими методами. М.: Мир, 1989. 405 с.
Гиллебранд В.Ф. и др. Практическое руководство по неорганическому анализу. М.: Химия, 1966. 1111 с.
Пршибил Р. Комплексоны в химическом анализе. М.: Изд-во иностр. лит., 1960. С. 383–386.
Кольтгоф И.М. и др. Объемный анализ. М.: Госхимиздат, 1961. Т. 3. 840 с.
Шарло Г. Методы аналитической химии. Количественный анализ неорганических соединений. М.: Химия, 1965. 930 с.
Сусленникова В.М. Руководство к приготовлению титрованных растворов. Л.: Химия, 1968. С. 45–71.
Коростелев П.П. Приготовление растворов для химико-аналитических работ. М.: Изд-во АН СССР, 1962. С. 311.
Никольский Б.П. и др. Оксредметрия. Л.: Химия, 1975. 304 с.
Якубов Х.М. Применение оксредметрии к изучению комплексообразования. Душанбе: Дониш, 1966. 121 с.
Davlatshoeva J.A., Eshova G.B., Rahimova M.M. et al. // Amer. J. Chem. 2017. V. 7(2). P. 58.
Эшова Г.Б., Давлатшоева Дж.А., Рахимова М. и др. // Журн. неорган. химии. 2018. Т. 63. № 4. С. 525.
Эшова Г.Б., Давлатшоева Дж.А., Рахимова М. и др. // Там же. 2018. Т. 63. № 6. С. 736.
Эшова Г.Б., Давлатшоева Дж.А., Рахимова М., Квятковская Л.В. // Вестник ТНУ. Душанбе, 2016. 1/4(216). С. 235.
Пат. Республики Таджикистан № ТJ 295, (51) 7 G 01 N 27/26, С 25 В 3/12. Способ определения состава и констант образования координационных соединений / З.Н. Юсупов; заявитель и патентообладатель Таджикский государственный национальный университет. № 97000501; заявка от 16.12.1997. Бюлл. № 21. 2000. С. 8.
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высшая школа, 1982. 317 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


