Журнал физической химии, 2020, T. 94, № 8, стр. 1185-1194
Константы кислотности модельных соединений лигнина в электронно-возбужденном состоянии в смесях воды с N,N-диметилформамидом
М. В. Кузнецова a, Д. С. Косяков a, *, Н. С. Горбова a, b, К. Г. Боголицын a, b
a Северный (Арктический) федеральный университет имени М.В. Ломоносова
Архангельск, Россия
b Федеральный исследовательский центр комплексного изучения Арктики РАН
Архангельск, Россия
* E-mail: d.kosyakov@narfu.ru
Поступила в редакцию 10.09.2019
После доработки 10.09.2019
Принята к публикации 17.09.2019
Аннотация
Методом флуоресцентной спектроскопии с использованием цикла Ферстера определены константы кислотности ряда гваяцильных фенолов, моделирующих структурные фрагменты природных лигнинов, в электронно-возбужденном состоянии в смесях воды с N,N-диметилформамидом. Показано дифференцирующее действие апротонного растворителя на кислотность фенолов. Установлено, что значения рKа в возбужденном состоянии тесно связаны со свойствами пара-заместителей по отношению к фенольной гидроксильной группе. Наибольшую способность к кислотной ионизации при фотовозбуждении проявляют соединения, имеющие электроно-акцепторную карбонильную группу.
Лигнин является вторым по распространенности в природе биополимером (после целлюлозы) и составляет до трети биомассы растений. Он представляет собой продукт радикальной дегидрогенизационной ферментативной полимеризации трех мономерных ароматических спиртов (кониферилового, синапового и п-кумарового), образующих, соответственно, гваяцильные, сирингильные и п-гидроксифенильные фенилпропановые структурные фрагменты макромолекулы, соединенные различными типами связей [1]. В настоящее время лигнин рассматривается как один из наиболее перспективных возобновляемых источников ценных ароматических соединений и сырье для получения различных полимерных продуктов, сорбентов, лекарственных препаратов и пр.
Физико-химические свойства и реакционная способность биополимера в растворах в значительной степени определяются фенольными гидроксильными группами, способными к кислотной диссоциации с образованием фенолят-анионов и хинонметидных структур, играющих большую роль в химических превращениях лигнина [2]. Протолитические равновесия фенолов исключительно сильно зависят от природы растворителя вследствие различия в энергиях сольватации молекулярной и анионной форм. В наибольшей степени данный эффект проявляется при переходе от воды к высокоосновным апротонным растворителям (ДМСО, ДМФА, 1,4-диоксан, ацетон), демонстрирующим наибольшую растворяющую способность по отношению к лигнину [3, 4]. Так, известно, что увеличение доли апротонного растворителя на каждые десять процентов (мольн.) ведет возрастанию величин pKa структурных фрагментов лигнина на 0.10–0.31 единицы [5], при этом данная величина зависит от степени делокализации электронной плотности в фенолят-анионе [6].
Еще одним фактором, оказывающим сильное влияние на протолитические свойства фенолов, является переход в электронно-возбужденное состояние (ЭВС), который может осуществляться как под действием света, так и при протекании радикальных реакций [7]. Перераспределение электронной плотности в ЭВС как правило ведет к увеличению полярности молекулы и, соответственно, значительному снижению величин pKa. Так, закислением материала под действием света объясняется светостарение и пожелтение бумаги, содержащей остаточные количества лигнина [8, 9]. Явление автопротолиза в ЭВС лигнина, по-видимому, играет значительную роль и в современных масс-спектрометрических методах изучения структуры этого биополимера, использующих фотоионизацию лигнинных олигомеров при атмосферном давлении, сопровождающуюся переносом протона на молекулу апротонного растворителя [10].
Важнейшим методом изучения ЭВС лигнина и родственных ему фенолов является флуоресцентная спектроскопия [11, 12], поскольку квантовые выходы флуоресценции таких соединений достаточно велики, а длины волн поглощения и эмиссии излучения находятся в удобной для исследования области, не перекрываемой поглощением растворителя. Использование цикла Ферстера позволяет легко рассчитать величины показателей констант кислотности в ЭВС (${\text{p}}K_{{\text{a}}}^{*}$) на основе величин pKa в основном состоянии молекулы и значений стоксова сдвига. Применение данного подхода к модельным соединениям лигнина позволило ранее [13] определить, что величины констант кислотности гваяцильных фенолов в водном растворе при фотовозбуждении возрастают на 3–5 порядков, а величины ${\text{p}}K_{{\text{a}}}^{*}$ оказываются в диапазоне от 2.2 (для кониферилового альдегида) до 7.6 (для гваякола).
Сольватация молекул в ЭВС также оказывает значительное влияние на распределение электронной плотности и протолитические свойства, при этом, согласно принципу Франка-Кондона, составы сольватных оболочек в основном и возбужденном состояниях идентичны [14]. В целом, сольватационные процессы оказывают влияние на физические и химические свойства молекулы в возбужденном состоянии даже в большей степени, чем в основном [15]. Растворитель в значительной степени определяет и времена жизни ЭВС, которые зависят от колебательной и вращательной релаксации молекулы в пределах сольватной оболочки [16]. Несмотря на это, в литературе до сих пор отсутствуют данные о величинах констант кислотности лигнина в неводных и смешанных водно-органических растворителях, широко используемых в химии ароматического биополимера. На восполнение данного пробела направлено настоящее исследование, целью которого является изучение протолитических свойств наиболее важных гваяцильных фенолов, моделирующих структурные единицы макромолекул хвойных лигнинов, в смесях воды с N,N-диметилформамидом как одних из важнейших и наиболее доступных растворителей лигнина.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования
В качестве объектов исследования выбраны 2‑метоксифенол (гваякол) и шесть его производных отличающихся заместителем в пара-положении по отношению к фенольной гидроксильной группе (рис. 1): 1-(3-метокси-4-оксифенил)-пропен-2 (эвгенол), 1-(3-метокси-4-оксифенил)-пропен-1 (изоэвгенол), 3-метокси-4-оксибензальдегид (ванилин), 3-метокси-4-оксибензиловый спирт (ванилиновый спирт), 3-метокси-оксибензойная кислота (ванилиновая кислота), 3-метокси-4-оксиацетофенон (ацетованилон). Все модельные соединения использовались без дополнительной очистки в виде препаратов с содержанием основного вещества не менее 98% производства Sigma-Aldrich (США).
Для приготовления растворов исследуемых соединений использовали смеси особо чистой воды, полученной с помощью системы Milli-Q (Millipore, Франция), с ДМФА квалификации “для спектроскопии” (Lab-Scan, Польша), полученные весовым методом. При исследовании молекулярных и анионных форм фенолов создавали фоновые концентрации 0.02 моль/л соляной кислоты “ос. ч.” (НеваРеактив, Россия) и гидроксида тетраэтиламмония (Aldrich, Германия). Концентрацию фенолов в растворе (10–4–10–5 моль/л) подбирали таким образом, чтобы оптическая плотность не превышала 0.1, с целью избежания эффекта внутреннего фильтра. Перед записью спектров растворы предварительно барботировали высокочистым аргоном (99.998%) для удаления растворенного кислорода.
Флуоресцентная спектроскопия
Спектры возбуждения и эмиссии растворов фенолов записывали во флуориметрических кварцевых односантиметровых кюветах QS 10 (Hellma, Германия), термостатированных при температуре 25 ± 0.2°С, на флуоресцентном спектрометре Fluorolog-3 (Horiba, Франция), оснащенном двойными монохроматорами в каналах возбуждения и эмиссии и ксеноновой лампой высокого давления мощностью 450 Вт в качестве источника возбуждения. Для регистрации сигнала использовали детектор FL-1073 на основе фотоумножителя R928P, работающий в режиме счета фотонов при комнатной температуре. Управление спектрометром и сбор данных осуществляли с помощью программного обеспечения FluorEssence (Horiba, Франция), а обработку данных с использованием программного пакета Origin 8.0 (OriginLab, США). Длина волны возбуждающего излучения соответствовала положению максимума поглощения исследуемого соединения. Положение максимума эмиссии определяли с точностью 0.1 нм после сглаживания спектрального пика флуоресценции по Голею-Савицкому. Ширину щелей монохроматоров возбуждения и эмиссии и время интегрирования сигнала подбирали для каждого фенольного соединения для достижения оптимального уровня сигнала (∼106 cps). В большинстве экспериментов спектральные ширины щелей составляли 3–5 нм.
Определение констант кислотности и дипольных моментов
Для расчета констант кислотности модельных фенолов в возбужденном состоянии использовали термодинамический цикл Ферстера, на основе которого для температуры T выводится известное уравнение [17]:
(1)
${\text{p}}K_{{\text{a}}}^{*} = {\text{p}}{{K}_{{\text{a}}}} + \frac{{{{N}_{{\text{a}}}}h}}{{2.303RT}}({{\nu }_{{0 - 0({{{\text{A}}}^{ - }})}}} - {{\nu }_{{0 - 0({\text{HA}})}}}),$При температуре 298 K и использовании волновых чисел ${{\tilde {\nu }}_{{0 - 0({{{\text{А}}}^{ - }})}}}$ и ${{\tilde {\nu }}_{{0 - 0({\text{НА}})}}}~$ уравнение (1) преобразуется к виду:
(2)
${\text{p}}K_{{\text{a}}}^{*} = {\text{p}}{{K}_{{\text{a}}}} + 2.095 \times {{10}^{{ - 3}}}({{\tilde {\nu }}_{{0 - 0({{{\text{А}}}^{ - }})}}} - {{\tilde {\nu }}_{{0 - 0({\text{НА}})}}}).$(3)
${{\tilde {\nu }}_{{0 - 0}}} = \frac{{\tilde {\nu }_{{{\text{abs}}}}^{{{\text{max}}}} + \tilde {\nu }_{{{\text{em}}}}^{{{\text{max}}}}}}{2}.$В расчетах по уравнениям (2) и (3) использовали опубликованные ранее величины pKa модельных соединений лигнина [5, 18] и данные по положению полос поглощения нейтральных молекул и соответствующих анионов [3] в смесях воды с ДМФА.
Для оценки величин дипольных моментов в возбужденном состоянии применяли сольватохромный подход, основанный на линейной корреляции между волновыми числами максимумов поглощения и флуоресценции и функцией полярности растворителя [19]. В качестве последней использовали нормализованную энергию Димрота−Райхардта ($E_{T}^{N}$), учитывающую как полярность/поляризуемость среды, так и ее способность к донорно-акцепторным взаимодействиям с растворенным веществом. Величины данного параметра определяются по данным о положении полосы поглощения реперного сольватохромного индикатора (бетаина Райхардта [20]) в соответствующем растворителе и для системы вода–ДМФА доступны в литературе [5].
В соответствии с моделью, предложенной Райхардтом [21] и развитой Рави с соавт. [22], линейная корреляция имеет вид уравнения
(4)
$\tilde {\nu }_{{{\text{abs}}}}^{{{\text{max}}}} - \tilde {\nu }_{{{\text{em}}}}^{{{\text{max}}}} = sE_{T}^{N} + {\text{const,}}$(5)
$s = 11~307.6\left[ {{{{\left( {\frac{{\Delta \mu }}{{\Delta {{\mu }_{{\text{B}}}}}}} \right)}}^{2}}{{{\left( {\frac{{{{a}_{{\text{B}}}}}}{{{{a}_{0}}}}} \right)}}^{3}}} \right],$Изменение дипольного момента можно выразить уравнением (6):
(6)
${{\mu }_{g}} = {{\mu }_{e}} - \sqrt {\frac{{81s}}{{11307.6{{{\left( {\frac{{6.2}}{{{{a}_{0}}}}} \right)}}^{3}}}}} .$Дипольные моменты исследуемых соединений в основном состоянии рассчитывали с использованием полуэмпирического метода AM1, при помощи программы МОРАС ChemOffice Ultra Version 6.0 (CambridgeSoft Corp., США) [19, 24]
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Спектры флуоресценции гваяцильных фенолов в системе вода–ДМФА
Исследованные фенолы обладают достаточно интенсивной флуоресценцией в видимой и УФ-области спектра, позволяющей регистрировать спектры возбуждения и эмиссии с приемлемым соотношением сигнал/шум. Как и в случае спектров поглощения, кислотная ионизация фенолов приводит к батохромному сдвигу максимумов флуоресценции, который сильно зависит от природы пара-заместителя в гваяцильном ядре – его величина варьируется от ∼40 нм для изоэвгенола, обладающего сопряженной с ядром двойной связью, до ∼5 нм в случае эвгенола и ванилина (табл. 1). Полосы эмиссии представляют зеркальное отображение полос в спектрах возбуждения, отличаясь несколько большей полушириной и потерей вибрационной структуры (рис. 2). Такое поведение подразумевает тождественность колебательной структуры основного и синглетного возбужденного электронных состояний молекулы [25], что имеет большое значение для точного определения энергии 0–0-перехода с использованием уравнения (3).
Таблица 1.
Спектральные данные положения максимумов полос поглощения ($\tilde {\nu }_{{{\text{abs}}}}^{{\max }}$), максимумов полос флуоресценции ($\tilde {\nu }_{{{\text{em}}}}^{{\max }}$) и положения волнового перехода ($\tilde {\nu }_{{{\text{0}} - {\text{0}}}}^{{}}$) соответствующих форм фенолов
| Х, мол. доли | $\tilde {\nu }_{{{\text{abs}}}}^{{\max }}$, см−1 | $\tilde {\nu }_{{{\text{em}}}}^{{\max }}$, см−1 | $\tilde {\nu }_{{{\text{0}} - {\text{0}}}}^{{}}$, см−1 | |||
|---|---|---|---|---|---|---|
| АН | А− | АН | А– | А– | АН | |
| Гваякол | ||||||
| 0 | 36 483 | 34 674 | 32 852 | 29 464 | 34 668 | 32 069 |
| 0.027 | 36 390 | 34 602 | 32 776 | 294 46 | 34 583 | 32 024 |
| 0.058 | 36 337 | 34 507 | 32 563 | 30 312 | 34 450 | 32 410 |
| 0.096 | 36 284 | 34 400 | 32 841 | 30 276 | 34 563 | 32 338 |
| 0.141 | 36 232 | 34 294 | 32 520 | 303 67 | 34 376 | 32 331 |
| 0.198 | 361 79 | 34 223 | 32 680 | 306 00 | 34 430 | 32 412 |
| 0.270 | 36 127 | 34 083 | 32 573 | 30 618 | 34 350 | 32 351 |
| 0.365 | 36 075 | 33 944 | 32 658 | 30 139 | 343 67 | 32 042 |
| 0.497 | 36 023 | 336 70 | 32 573 | 29 516 | 34 298 | 31 593 |
| 0.689 | 36 010 | 33 036 | 32 468 | 29 438 | 34 239 | 31 237 |
| 1.00 | 35 958 | 32 000 | 32 808 | 30 395 | 34 383 | 31 198 |
| Эвгенол | ||||||
| 0 | 35 765 | 33 887 | 31 953 | 31 287 | 33 859 | 32 587 |
| 0.027 | 35 689 | 33 807 | 31 989 | 31 458 | 33 839 | 32 633 |
| 0.058 | 35 638 | 33 715 | 31 939 | 31 526 | 33 789 | 32 621 |
| 0.096 | 35 600 | 33 636 | 32 155 | 31 944 | 33 878 | 32 790 |
| 0.141 | 35 549 | 33 512 | 32 071 | 31 683 | 33 810 | 32 598 |
| 0.198 | 35 499 | 33 422 | 32 028 | 31 434 | 33 764 | 32 428 |
| 0.270 | 35 448 | 33 300 | 32 011 | 31 275 | 33 730 | 32 288 |
| 0.365 | 35 411 | 33 069 | 31 895 | 310 52 | 33 653 | 32 061 |
| 0.497 | 35 361 | 32 873 | 32 036 | 31 086 | 33 699 | 31 980 |
| 0.689 | 35 323 | 32 552 | 31 965 | 31 310 | 33 644 | 31 931 |
| 1.00 | 35 311 | 31 447 | 31 961 | 31 513 | 33 636 | 314 80 |
| Изоэвгенол | ||||||
| 0 | 38 835 | 35 587 | 28 944 | 33 890 | 30 910 | 31 232 |
| 0.027 | 38 670 | 35 386 | 29 087 | 33 879 | 30 921 | 32 136 |
| 0.058 | 38 551 | 35 236 | 29 104 | 33 828 | 30 700 | 32 058 |
| 0.096 | 38 447 | 35 063 | 29 231 | 33 839 | 30 607 | 31 934 |
| 0.141 | 38 402 | 34 892 | 29 002 | 33 702 | 30 439 | 31 968 |
| 0.198 | 38 241 | 34 722 | 29 146 | 33 694 | 30 352 | 31 721 |
| 0.270 | 37 922 | 34 483 | 29 129 | 33 526 | 30 236 | 31 311 |
| 0.365 | 37 636 | 34 247 | 29 104 | 33 370 | 29 974 | 30 212 |
| 0.497 | 37 411 | 33 582 | 29 044 | 33 228 | 29 622 | 29 743 |
| 0.689 | 37 286 | 33 356 | 28 986 | 33 136 | 29 388 | 29 458 |
| 1.00 | 37 147 | 32 342 | 28 986 | 33 067 | 28 706 | 28 791 |
| Ванилин | ||||||
| 0 | 32 404 | 28 769 | 23 764 | 24 189 | 28 084 | 26 479 |
| 0.027 | 32 268 | 28 547 | 23 781 | 24 009 | 28 133 | 26 224 |
| 0.058 | 32 206 | 28 433 | 24 272 | 24 679 | 28 239 | 26 556 |
| 0.096 | 32 175 | 28 329 | 24 254 | 24 564 | 28 215 | 26 447 |
| 0.141 | 32 134 | 28 241 | 24 379 | 24 655 | 28 257 | 26 448 |
| 0.198 | 32 134 | 28 177 | 24 967 | 24 777 | 28 551 | 26 477 |
| 0.270 | 32 134 | 28 121 | 25 025 | 24 888 | 28 580 | 26 505 |
| 0.365 | 32 216 | 28 043 | 25 291 | 24 931 | 28 754 | 26 487 |
| 0.497 | 32 279 | 27 988 | 25 031 | 24 814 | 28 655 | 26 401 |
| 0.689 | 32 362 | 27 886 | 25 974 | 25 063 | 29 168 | 26 475 |
| 1.00 | 32 478 | 27 594 | 25 316 | 24 900 | 28 897 | 26 247 |
| Ванилиновый спирт | ||||||
| 0 | 35 958 | 34 223 | 32 185 | 31 142 | 34 072 | 32 683 |
| 0.027 | 35 881 | 34 153 | 32 247 | 31 230 | 34 064 | 32 692 |
| 0.058 | 35 829 | 34 072 | 32 175 | 31 192 | 34 002 | 32 632 |
| 0.096 | 35 778 | 33 990 | 32 031 | 31 486 | 33 905 | 32 738 |
| 0.141 | 35 714 | 33 898 | 32 103 | 31 566 | 33 909 | 32 732 |
| 0.198 | 35 676 | 33 761 | 32 123 | 31 437 | 33 900 | 32 599 |
| 0.270 | 35 625 | 33 636 | 32 062 | 31 616 | 33 844 | 32 626 |
| 0.365 | 35 562 | 33 443 | 32 051 | 31 056 | 33 807 | 32 168 |
| 0.497 | 35 524 | 33 300 | 32 123 | 31 575 | 33 824 | 31 662 |
| 0.689 | 35 486 | 32 862 | 32 062 | 31 756 | 33 774 | 30 762 |
| 1.00 | 35 474 | 32 248 | 31 270 | 31 299 | 33 348 | 29 686 |
| Ванилиновая кислота | ||||||
| 0 | 34 294 | 33 512 | 28 209 | 28 225 | 31 252 | 30 869 |
| 0.027 | 34 200 | 33 501 | 28 177 | 28 321 | 31 189 | 30 911 |
| 0.058 | 34 165 | 33 501 | 28 653 | 28 265 | 31 409 | 30 883 |
| 0.096 | 34 153 | 33 501 | 28 769 | 28 329 | 31 461 | 30 915 |
| 0.141 | 34 165 | 33 523 | 28 877 | 28 377 | 31 521 | 30 950 |
| 0.198 | 34 176 | 33 557 | 29 265 | 27 964 | 31 721 | 30 761 |
| 0.270 | 34 211 | 33 591 | 29 300 | 28 580 | 31 756 | 31 086 |
| 0.365 | 34 247 | 33 636 | 29 621 | 28 662 | 31 934 | 31 149 |
| 0.497 | 34 329 | 33 738 | 29 869 | 28 777 | 32 099 | 31 258 |
| 0.689 | 34 412 | 33 875 | 30 211 | 28 952 | 32 312 | 31 414 |
| 1.00 | 34 495 | 34 746 | 30 572 | 28 686 | 32 534 | 31 716 |
| Ацетованилон | ||||||
| 0 | 33 025 | 29 223 | 24 600 | 24 172 | 28 813 | 26 698 |
| 0.027 | 32 808 | 28 960 | 24 863 | 24 528 | 28 836 | 26 744 |
| 0.058 | 32 744 | 28 852 | 25 088 | 24 528 | 28 916 | 26 690 |
| 0.096 | 32 690 | 28 810 | 25 221 | 24 564 | 28 956 | 26 687 |
| 0.141 | 32 669 | 28 744 | 25 342 | 24 832 | 29 006 | 26 788 |
| 0.198 | 32 690 | 28 964 | 25 660 | 24 938 | 29 175 | 26 816 |
| 0.270 | 32 701 | 28 604 | 26 123 | 24 975 | 29 412 | 26 790 |
| 0.365 | 32 765 | 28 539 | 26 171 | 25 031 | 29 468 | 26 785 |
| 0.497 | 32 830 | 28 393 | 26 385 | 25 094 | 29 608 | 26 744 |
| 0.689 | 32 938 | 28 273 | 26 042 | 25 278 | 29 490 | 26 776 |
| 1.00 | 33 179 | 27 601 | 26 455 | 25 082 | 29 817 | 26 342 |
Рис. 2.
Нормализованные спектры возбуждения и эмиссии растворов ацетованилона (а) и ванилиновой кислоты (б).
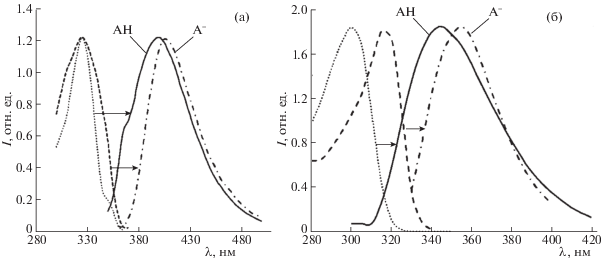
Влияние состава растворителя на спектры флуоресценции определяется разностью энергий сольватации основного и возбужденного состояний и носит сложный характер вследствие одновременного действия таких факторов как диэлектрическая проницаемость среды, способность растворителя к образованию водородных связей с растворенным веществом, явление избирательной сольватации и формирование в сольватных оболочках хромофоров и флуорофоров комплексов компонентов бинарного растворителя различного состава. В случае гваякола и эвгенола положение полос флуоресценции практически не зависит от состава растворителя как для молекулярной, так и для анионной форм. При увеличении доли ДМФА максимум флуоресценции ванилина, ацетованилона и ванилиновой кислоты претерпевает гипсохромный сдвиг, в то время как для ванилинового спирта, имеющего алифатическую гидроксильную группу, способную вступать в донорно-акцепторные взаимодействия, характерен батохромный сдвиг.
Зависимости величин стоксова сдвига от энергии Димрота−Райхардта как обобщенного параметра полярности смешанного растворителя могут быть с удовлетворительной точностью описаны линейной функцией в соответствии с уравнением (4). Полученные величины угловых коэффициентов s позволили оценить изменение полярности нейтральных молекул исследуемых фенолов и соответствующих анионов при переходе в ЭВС (табл. 2). Полученные значения дипольных моментов для ЭВС оказываются в 1.2–3 раза выше по сравнению с основным состоянием для обеих форм фенолов, участвующих в кислотно-основных равновесиях. Наблюдаемое перераспределение электронной плотности при фотовозбуждении должно неизбежно приводить к значительному изменению протолитических свойств исследуемых соединений.
Таблица 2.
Коэффициенты уравнения (4) зависимости стоксова сдвига от энергии Димрота−Райхардта и дипольные моменты ионизированной и неионизированной форм гваяцильных фенолов в основном и возбужденном состояниях
| Фенол | S | const | μ | |||
|---|---|---|---|---|---|---|
| АН | А− | AH | А– | АН | А– | |
| Гваякол | 386 | 2602 | 3300 | 2544 | 2.11/3.86* | 3.05/7.58* |
| Эвгенол | 666 | 1325 | 3116 | 1166 | 2.52/4.81* | 6.04/9.27* |
| Изоэвгенол | 2287 | 2008 | 7631 | 7580 | 2.22/6.47* | 5.00/8.98* |
| Ванилин | 2853 | 2747 | 5839 | 1895 | 2.94/7.69* | 3.23/7.89* |
| Ванилиновый спирт | 401 | 1703 | 3343 | 1393 | 2.81/3.50* | 4.59/7.17* |
| Ванилиновая кислота | 2934 | 472 | 3230 | 4807 | 5.55/10.4* | 2.74/4.67* |
| Ацетованилон | 2696 | 2766 | 5600 | 2182 | 4.70/9.31* | 3.12/7.79* |
Кислотность гваяцильных фенолов в электронно-возбужденном состоянии
Результаты расчета величин ${\text{p}}K_{{\text{a}}}^{*}$ по уравнению (2) показывают значительное возрастание констант кислотности исследуемых соединений при переходе в ЭВС, достигающее 9 порядков (табл. 3). В наибольшей степени данный эффект выражен для гваякола и изоэвгенола в чистом ДМФА, показатели констант кислотности которых изменяются с 18.55 и 18.34 до 11.88 и 8.81 ед. соответственно.
Таблица 3.
Константы кислотности модельных соединений лигнина в основном (рKа) [5, 13] и возбужденном (${\text{p}}K_{{\text{a}}}^{*}$) состояниях в смесях воды с N,N-диметилформамидом
| XДМФА | Гваякол | Эвгенол | Изоэвгенол | Ванилин | Ванилиновый спирт | Ванилиновая кислота | Ацетованилон | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| рKа | ${\text{p}}K_{{\text{a}}}^{*}$ | рKа | ${\text{p}}K_{{\text{a}}}^{*}$ | рKа | ${\text{p}}K_{{\text{a}}}^{*}$ | рKа | ${\text{p}}K_{{\text{a}}}^{*}$ | рKа | ${\text{p}}K_{{\text{a}}}^{*}$ | рKа | ${\text{p}}K_{{\text{a}}}^{*}$ | рKа | ${\text{p}}K_{{\text{a}}}^{*}$ | |
| 0 | 10.04 | 4.60 | 10.15 | 7.48 | 10.11 | 3.67 | 7.40 | 4.03 | 9.80 | 6.88 | 9.40 | 8.60 | 7.90 | 3.46 |
| 0.027 | 10.35 | 4.99 | 10.53 | 8.00 | 10.41 | 6.26 | 7.54 | 3.87 | 10.17 | 7.29 | 9.63 | 9.05 | 8.34 | 3.95 |
| 0.058 | 10.57 | 6.30 | 10.79 | 8.34 | 10.64 | 6.41 | 7.71 | 4.18 | 10.42 | 7.54 | 10.01 | 8.91 | 8.51 | 3.84 |
| 0.096 | 10.89 | 6.23 | 11.08 | 8.80 | 10.92 | 6.63 | 7.90 | 4.19 | 10.73 | 8.28 | 10.43 | 9.28 | 8.70 | 3.94 |
| 0.141 | 11.26 | 6.97 | 11.44 | 8.89 | 11.28 | 7.05 | 8.15 | 4.35 | 11.10 | 8.63 | 10.74 | 9.54 | 8.94 | 4.28 |
| 0.198 | 11.79 | 7.56 | 11.89 | 9.09 | 11.75 | 6.99 | 8.44 | 4.09 | 11.57 | 8.84 | 11.25 | 9.23 | 9.25 | 4.30 |
| 0.270 | 12.47 | 8.28 | 12.57 | 9.54 | 12.34 | 6.94 | 8.83 | 4.47 | 12.16 | 9.60 | 11.69 | 10.28 | 9.63 | 4.12 |
| 0.365 | 13.25 | 8.38 | 13.37 | 10.03 | 13.12 | 6.01 | 9.33 | 4.57 | 12.93 | 9.66 | 12.45 | 10.80 | 10.15 | 4.52 |
| 0.497 | 14.33 | 8.66 | 14.59 | 10.98 | 14.20 | 6.29 | 10.02 | 5.29 | 14.01 | 11.10 | 13.36 | 11.59 | 10.80 | 4.79 |
| 0.689 | 15.96 | 9.67 | 16.20 | 12.60 | 15.78 | 7.21 | 11.04 | 5.38 | 15.58 | 12.50 | 14.85 | 12.96 | 11.93 | 6.23 |
| 1.00 | 18.55 | 11.88 | 18.81 | 14.28 | 18.34 | 8.81 | 12.68 | 7.12 | 18.12 | 14.76 | 17.26 | 15.54 | 13.68 | 6.38 |
Как и в случае основного состояния, существенное влияние на протолитические свойства фенолов в ЭВС оказывает природа заместителя в пара-положении по отношению к фенольной гидроксильной группе, что согласуется с данными работы [26]. Так, соединения, имеющие в структуре электроноакцепторную карбонильную группу, сопряженную с ароматическим ядром (ванилин, ацетованилон) демонстрируют большую способность к кислотной ионизации, благодаря увеличению стабильности феноксид-аниона за счет перераспределения электронной плотности. В то же время, ванилиновый спирт, содержащий электронодонорный заместитель, показывает уменьшение кислотных свойств, по сравнению с гваяколом, не имеющим заместителя в пара-положении. Несмотря на это, в целом для исследуемых соединений в ЭВС не наблюдается соблюдения уравнения Гаммета, постулирующего линейную зависимость величин показателей констант кислотности от σ-констант заместителей. Например, при фотовозбуждении наблюдается инверсия кислотности ванилина и ацетованилона, а изоэвгенол, являющийся в основном состоянии на два порядка более слабой кислотой, занимает промежуточное положение между упомянутыми фенолами.
С увеличением содержания органического растворителя наблюдается снижение кислотности исследуемых фенолов в возбужденном состоянии, характерное и для основного состояния [19]. При этом зависимости ${\text{p}}K_{{\text{a}}}^{*}$ от мольной доли апротонного растворителя (x) близки к линейным (рис. 3) и могут быть описаны с коэффициентами корреляции (r2) более 0.9 (табл. 4) уравнением вида:
где ${\text{p}}K{{_{{\text{a}}}^{*}}^{{\text{w}}}}$ – значение константы кислотности в электронно-возбужденном состоянии в водной среде.Рис. 3.
Зависимости констант кислотности модельных соединений лигнина в возбужденном состоянии от мольной доли N,N-диметилформамида. 1 – ванилиновая кислота, 2 – ванилиновый спирт, 3 – эвгенол, 4 – гваякол, 5 – изоэвгенол, 6 – ванилин, 7 – ацетованилон.
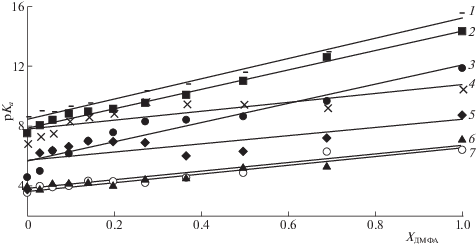
Таблица 4.
Эмпирические константы уравнения (7) зависимости константы кислотности фенолов в возбужденном состоянии в смеси воды и ДМФА от мольной доли апротонного растворителя
| Соединение | ${\text{p}}K_{{\text{a}}}^{{\text{w}}}$ | k | r2 |
|---|---|---|---|
| Гваякол | 5.64 | 6.45 | 0.918 |
| Эвгенол | 7.89 | 6.59 | 0.991 |
| Ванилин | 3.77 | 3.15 | 0.901 |
| Ванилиновый спирт | 7.24 | 7.60 | 0.989 |
| Ванилиновая кислота | 8.51 | 6.73 | 0.985 |
| Ацетованилон | 3.79 | 2.93 | 0.912 |
| Изоэвгенол | 3.81 | 5.57 | 0.990 |
Величина углового коэффициента k, характеризующая чувствительность протолитических равновесий к изменению состава растворителя, в целом коррелируют с величинами pKa производных гваякола. Наибольшее значение k характерно для фенолов с большим значением константы кислотности в возбужденном состоянии – ванилинового спирта, ванилиновой кислоты и эвгенола. Это связано с тем, что как константы кислотности, так и эффекты среды в протолитических равновесиях определяются степенью делокализации электронной плотности в фенолят-анионе, максимальной для структур с электроноакцепторными заместителями.
Заметное отклонение зависимостей, представленных на рис. 2, от линейности свидетельствует о проявлении эффектов избирательной сольватации частиц – участников протолитических равновесий компонентами бинарного растворителя. При этом выраженная S-образность кривых свидетельствует в пользу образования и преобладания в сольватных оболочках (в определенной области составов растворителя) комплексов вода–ДМФА, обладающих высокой сольватирующей способностью по отношению к исследуемым соединениям. В данном отношении, поведение гваяцильных фенолов в ЭВС практически не отличается от основного электронного состояния [3] вследствие сохранения при фотовозбуждении исходных сольватных оболочек молекул в соответствии с принципом Франка−Кондона.
Если, как показано выше, величины констант кислотности производных гваякола в основном и электронно-возбужденном состояниях слабо коррелируют друг с другом, то взаимосвязь значений ${\text{p}}K_{{\text{a}}}^{*}$ в смешанном растворителе (${\text{p}}K{{_{{\text{a}}}^{*}}^{{\text{s}}}}$) и в водной среде (${\text{p}}K{{_{{\text{a}}}^{*}}^{{\text{w}}}}$) прослеживается весьма отчетливо и может быть описана линейной функцией (табл. 5):
(8)
${\text{p}}K{{_{{\text{a}}}^{*}}^{{\text{s}}}} = m{\text{p}}K{{_{{\text{a}}}^{*}}^{{\text{w}}}} + d.$Таблица 5.
Эмпирические константы уравнения (8) зависимость констант кислотности фенольной гидроксильной группы модельных соединений лигнина в смесях воды с N,N-диметилформамидом от констант кислотности в воде
| Х, мол. доли | m | d | r |
|---|---|---|---|
| 0.027 | 1.05 | 0.10 | 0.990 |
| 0.058 | 1.02 | 0.52 | 0.937 |
| 0.096 | 1.12 | 0.16 | 0.949 |
| 0.141 | 1.09 | 0.65 | 0.913 |
| 0.198 | 1.05 | 0.98 | 0.834 |
| 0.270 | 1.17 | 0.88 | 0.834 |
| 0.365 | 1.19 | 1.07 | 0.856 |
| 0.497 | 1.32 | 1.11 | 0.878 |
| 0.689 | 1.43 | 1.66 | 0.851 |
| 1.00 | 1.69 | 1.87 | 0.856 |
Таким образом, полученные результаты показывают, что в среде ДМФА и его бинарных смесей с водой кислотность родственных лигнину фенолов резко возрастает при фотовозбуждении, что связано со значительным перераспределением электронной плотности и возрастанием дипольных моментов молекулярной и анионной форм в электронно-возбужденных состояниях. Переход от воды к апротонному растворителю с одной стороны, ведет к возрастанию величин показателей констант кислотности в электронно-возбужденных состояниях, а, с другой стороны, приводит к дифференцированию силы кислот и возрастанию влияния фотовозбуждения на константы кислотности производных гваякола. Отмеченные эффекты могут быть использованы для направленного регулирования реакционной способности различных структурных фрагментов макромолекул лигнина в процессах его химической модификации.
Работа выполнена при финансовой поддержке РНФ (грант № 18-73-10138) с использованием оборудования Центра коллективного пользования научным оборудованием “Арктика” Северного (Арктического) федерального университета имени М.В. Ломоносова.
Список литературы
Heitner C., Dimmel D., Smidt J.A. Lignin and Lignans: Advances in Chemistry. Boca Ration: CRC Press, 2010. 629 p.
Боголицын К.Г., Лунин В.В., Косяков Д.С., Карманов А.П. и др. Физическая химия лигнина. М.: Академкнига, 2010. 492 с.
Косяков Д.С., Горбова Н.С., Боголицын К.Г., Гусаков Л.В. // Журн. физ. химии. 2007. Т. 81. № 7. С. 1227–1232.
Freitas A.A., Silva C.P., Silva G.T.M. et al. // Photochem. Photobiol. 2018. V. 94(6). P. 1086–1091. https://doi.org/10.1111/php.12944
Боголицын К.Г., Горбова Н.С., Косяков Д.С. // Журн. физ. химии. 2003. Т. 77. № 4. С. 667–671.
Yang L., Niu J., Zhan Y. et al. // Chin. J. Chem. 2017. V. 36(1). P. 42–46. https://doi.org/10.1002/cjoc.201700534
Cilento G., Adam W.// Free Radical Biol. Med. 1995. Vol. 19. № 1. P. 103−114. https://doi.org/10.1016/0891-5849(95)00002-F
Liukko S., Yasapuro V., Liitia T. // Holzforschung. 2007. V. 61. P. 509–515. https://doi.org/10.1515/HF.2007.107
Jaeger C., Nourmamode A., Castellan A. // Holzforschung. 1993. V. 47. P. 375–390. https://doi.org/10.1515/hfsg.1993.47.5.375
Kosyakov D.S., Ul’yanovskii N.V., Anikeenko E.A., Gorbova N.S. // Rapid Commun. Mass Spectrom. 2016. V. 30. P. 2099–2108. https://doi.org/10.1002/rcm.7686
Radotić K., Kalauzi A., Djikanović D. et al. // J. Photochem. Photobiol. B. 2006. V. 83. P. 1–10. https://doi.org/10.1016/j.jphotobiol.2005.12.001
Albinsson B., Shiming L., Lundquist K., Stomberg R. // J. Mol. Struc. 1999. V. 508. P. 19. https://doi.org/10.1016/S0022-2860(98)009132
Горбова Н.С., Косяков Д.С., Боголицын К.Г. // ИВУЗ “Лесной журнал”. 2010. № 2. С. 129.
Klessinger M., Michl J. Excited states and photochemistry of organic molecules. VCH publishers, 1995. 537 p.
Lakowich J.R. Principles of fluorescence spectroscopy. New York: Kluwer. 1999, 698 p.
Wang Q., Niu Y., Wang R. et al. // Chem. Asian J. 2018. V. 13. P. 1735–1743. https://doi.org/10.1002/asia.201800457
Förster T. // Zeitschrift für Electrochemie. 1950. Bd. 54. № 1. S. 42–46. https://doi.org/10.1002/bbpc.19500540111
Горбова Н.С. Кислотно-основные свойства родственных лигнину фенолов в системе вода-апротонный растворитель: Дис. … к.х.н. Архангельск, 2002. 120 с.
Manohara S.R., Kumar V.U., Shivakumariaiah, Gerward L. // J. Mol. Liq. 2013. V. 181. P. 97–104. https://doi.org/10.1016/j.molliq.2013.02.018
Reichardt C. Solvents and solvent effects in organic chemistry. Weinheim: Wiley-VCH, 2011. 629 p.
Reichardt C. // Chem. Rev. 1994. V. 94. P. 2319–2358. https://doi.org/10.1021/cr00032a005
Ravi M., Soujanya T., Samanta A., Radhakrishnan T.P. // J. Chem. Soc. Faraday Trans. 1995. V. 91. P. 2739–2742. https://doi.org/10.1039/FT9959102739
Thiare D.D., Khnote A., Diop A. et al. // J. Mol. Liq. 2015. V. 211. P. 640–646. https://doi.org/10.1016/j.molliq.2015.07.071
Szczepanik B. // J. Mol. Struct. 2015. V. 1099. P. 209–214. https://doi.org/10.1016/j.molstruc.2015.05.062
Valeur B. Molecular fluorescence. Principles and application. Weinheim: Wiley-VCH Verlag, 2002. 381 p.
Tetteh S., Zugle R., Prosper Kwaku Adotey J., Quashie A. // J. Spectroscopy. 2018. V. 2018. Article ID 4193657. P. 1. DOI: 1155/2018/4193657
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии