Журнал физической химии, 2020, T. 94, № 8, стр. 1174-1178
Фазовые диграммы системы дифенилоксид–н-гексадекан
И. Г. Яковлев a, *, И. К. Гаркушин a, А. В. Колядо a
a Самарский государственный технический университет
Самара, Россия
* E-mail: yakovlev.ivan.g@gmail.com
Поступила в редакцию 10.09.2019
После доработки 23.10.2019
Принята к публикации 12.11.2019
Аннотация
Рассмотрены теоретическое и экспериментальное изучение фазовых равновесий “жидкость–твердое” в двухкомпонентной системе дифенилоксид–н-гексадекан. По результатам исследований выявлено, что данная система является эвтектической. Для теоретического исследования системы были выбраны два метода: Шредера–Ле Шателье и оригинальный UNIFAC. Экспериментальные исследования проводились с помощью метода дифференциального термического анализа на аппарате DSC. Результаты теоретических и экспериментальных исследований представлены в виде Т–х диаграммы системы. Теоретические и экспериментальные данные были сравнены между собой и в работе дана оценка и рекомендации о применении каждого расчетного метода. Экспериментально определены координаты эвтектики: температура плавления и состав. Для эвтектического расплава были экспериментально определены и приведены в работе: значения энтальпии плавления, плотности при 25°С, кинематической вязкости в диапазоне температур от 25 до 50°С, температура вспышки в открытом тигле, температура кипения и показатель преломления в диапазоне температур от 25 до 40°С. Расплав эвтектического состава может быть применен в промышленности в качестве теплоносителя.
На производстве при синтезе различных материалов применяют высококипящие теплоносители. Для температур выше 200°С применяют теплоносители, состоящие из органических соединений; например, дифенил, дифенилоксид, нафталин, глицерин и др., которые способны поддерживать температуру от 100 до 400°С [1]. Однако температура плавления таких веществ высока, вследствие чего возможна их кристаллизация в обогревательном контуре реакционных аппаратов. В случае проведения процесса при низких температурах окружающей среды в качестве теплоносителя применяют смеси из двух и более органических соединений. Например, широко применяется в химической промышленности теплоноситель динил (Даутерм А), представляющий собой смесь эвтектического типа с содержанием 26.5 мас. % дифенила и 73.5 мас. % дифенилоксида [2]. Теплоноситель динил характеризуется температурой плавления равной 12.3°С, тогда как температура плавления составляет для дифенилоксида 26.84°С и для дифенила 68.93°С.
Поиск новых составов теплоносителя с оптимальными свойствами является актуальной задачей для современного производства. Целью данной работы является теоретическое и экспериментальное изучение фазовых равновесий в системе дифенилоксид–н-гексадекан и определение свойств эвтектического сплава для применения в качестве теплоносителя.
Среди работ, описывающих подобные системы, можно отметить работы [3–7], но системы типа н-алкан–ароматический углеводород с двумя и более кольцами изучены сравнительно мало. Некоторые исследования систем типа дифенилоксид–н-алкан представлены в работах [8–10].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Построение ликвидуса системы проведено двумя методами – Шредера–Ле Шателье [11] и UNIFAC [12]. Экспериментальные исследования проводили с использованием дифференциального сканирующего калориметра теплового потока (микрокалориметр DSC-500) [13, 14], термостатирование холодных спаев осуществляли с помощью ультратермостата U-10. Точность измерения температуры составляла ±0.25°C. Регистрацию тепловых эффектов осуществляли с помощью ПЭВМ с программным обеспечением DSC Tools 2.0 [15]. Исследования проводили в диапазоне температур от –40 до 80°С, используя в качестве охлаждающего агента сухой лед. Образцы нагревали со скоростью 4 K/мин. Постоянная скорость нагрева обеспечивалась с помощью программатора, встроенного в микрокалориметр. Данная скорость была подобрана экспериментально. Более низкая скорость приводит к затрудненной регистрации термических эффектов, трудно различить термический эффект и шум. Более высокая скорость затрудняет регистрацию тепловых эффектов тоже, поскольку высока вероятность не зарегистрировать какой-либо тепловой эффект из-за его совмещения c близким по температуре. Перед началом работы проверяли точность калибровки по реперным веществам [16]. Масса исследуемых образцов составляла от 10 до 15 мг. В качестве эталона, не имеющего фазового перехода в изучаемом диапазоне температур, использовали пустой алюминиевый тигель. Температуру плавления определяли с помощью максимума на графике первой производной, взятой от экспериментального пика на кривой ДТА, отвечающей плавлению образца [16]. Максимум на первой производной соответствует точке на эндотермическом пике, через которую в программе DSC Tools 2.0 проводится касательная к стороне экспериментального пика. Данная функция реализована в соответствии с рекомендациями ICTAС. Энтальпию плавления определяли по площади пика под кривой ДТА.
Образцы для исследования готовили гравиметрически, добавляя каждый компонент в точно известном количестве. Экспериментальные составы готовили на основании данных, полученных расчетными методами (уравнение Шредера–Ле Шателье, оригинальный метод UNIFAC). Точность взвешивания составляла 2 × 10-4 г (весы AND HR-300, Япония).
Определение показателей преломления расплавов эвтектической смеси проводили с использованием рефрактометра Аббе марки ИРФ-454 Б2М. Исследования проводили в температурном диапазоне от 25 до 40°С. С помощью жидкостного термостата U10 поддерживали постоянную температуру в призменных блоках с точностью ±0.1°С. Показатель преломления устанавливали с погрешностью 2 × 10–4 [17].
Определение остальных изученных свойств эвтектики (плотность при 25°С, зависимость кинематической вязкости от температуры, температура кипения, температура вспышки в открытом тигле) подробно описаны в работе [16].
Для исследования использовали н-гексадекан (Новочеркасский завод синтетических продуктов, Россия) и дифенилоксид [(Ph)2] CAS 101-84-8 (“Универхим”, Россия) с содержанием основного вещества 99.0 мас. %. Вещества использовали без предварительной очистки.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Первый этап – прогнозирование характеристик фазовых равновесий в исследуемых системах, осуществлялся с помощью уравнения Шредера–Ле Шателье:
где xi – мольная доля компонента, ΔплHi – энтальпия плавления компонента, Дж/моль, ${{T}_{{{\text{пл}},i}}}$ – температура плавления чистого компонента, K; R – универсальная газовая постоянная, равна 8.314 кДж/(моль К). Энтальпия плавления по справочным данным составляет для дифенилоксида 22.63 кДж/моль (133.1 кДж/кг), для н-гексадекана 53.37 кДж/моль (235.76 кДж/кг) [18].При расчете по уравнению Шредера–Ле Шателье раствор считали идеальным и поэтому коэффициенты активности компонентов принимали равными 1.
Данное уравнение описывает ход ликвидуса системы со стороны как первого, так и второго компонента. Пересечение кривых ликвидуса дает точку эвтектики. Для нахождения эвтектики необходимо решить систему, составленную из уравнений Шредера–Ле Шателье, относительно хi и Т:
(2)
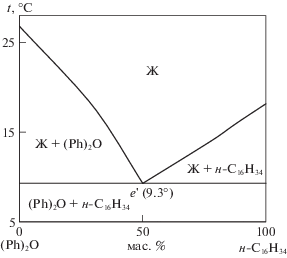
$\left\{ \begin{gathered} \ln {{x}_{1}} = \frac{{{{\Delta }_{{{\text{пл}}}}}{{H}_{1}}\left( {{{T}_{{\text{e}}}} - {{T}_{{{\text{пл,1}}}}}} \right)}}{{R{{T}_{{{\text{пл,1}}}}}{{T}_{{\text{e}}}}}}, \hfill \\ \ln {{x}_{2}} = \frac{{{{\Delta }_{{{\text{пл}}}}}{{H}_{2}}\left( {{{T}_{{\text{e}}}} - {{T}_{{{\text{пл}},~2}}}} \right)}}{{R{{T}_{{{\text{пл}},~2}}}{{T}_{{\text{e}}}}}}, \hfill \\ 1 = {{x}_{1}} + {{x}_{2}}, \hfill \\ \end{gathered} \right.$Методика построения фазовой диаграммы с использованием уравнения Шредера–Ле Шателье приведена в работах [11, 19]. Т–х-диаграмма системы приведена на рис. 1.
Расчетное значение координат эвтектики: температура плавления 9.3°С при содержании компонентов 43.0 мол. % (49.9 мас. %) дифенилоксида и 57.0 мол. % (50.1 мас. %) н-гексадекана.
Для уточнения данных использовали модифицированное уравнение Шредера–Ле Шателье с введением в него коэффициента активности:
(3)
$\ln {{x}_{i}}{{\gamma }_{i}} = \frac{{{{\Delta }_{{{\text{пл}}}}}{{H}_{i}}({{T}_{{\text{e}}}} - {{T}_{{{\text{пл}},~i}}})}}{{R{{T}_{{{\text{пл}},~i}}}{{T}_{{\text{e}}}}}},$Коэффициент активности компонента определяли с помощью метода UNIFAC [12]:
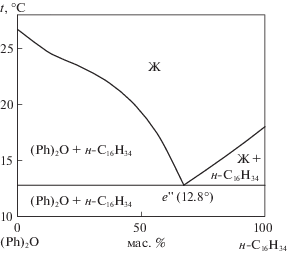
где $\gamma _{i}^{C}$ – комбинаторная часть коэффициента активности, $\gamma _{i}^{R}$ – остаточная часть коэффициента активности. Подробный расчет комбинаторной части $\gamma _{i}^{C}$ и остаточной части $\gamma _{i}^{R}$ коэффициента активности приведен в [12].Т–х-диаграмма, построенная по приведенному методу, представлена на рис. 2. Температура плавления эвтектической смеси из 39.4 мол. % (33.0 мас. %) дифенилоксида и 60.6 мол. % (67.0 мас. %) составляет 12.8°С.
В работах [12] продемонстрирована хорошая сходимость данного метода с экспериментальными данными при изучении систем с н-алканами, в связи с чем, данный метод был выбран для уточнения расчета, но вместе с тем было также показано его возможное отклонение [11].
Результаты экспериментального исследования фазовых равновесий в системе дифенилоксид–н-гексадекан частично опубликованы в [20], а полные данные приведены в настоящей работе.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
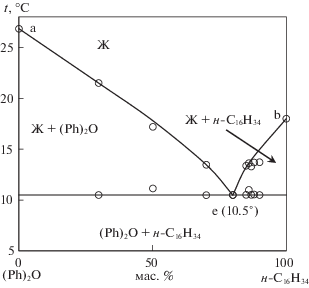
По виду фазовой диаграммы, построенной теоретически, установлено, что данная система относится к системам эвтектического типа. Анализ термограмм расчетных эвтектических составов выявил отклонение данных составов от эвтектических, т.е. показал наличие двух термоэффектов, поэтому были исследованы ДТА девять смесей, по данным которых построена Т–х диаграмма изученной системы (рис. 3), определена температура плавления эвтектического сплава Te = 10.5°C при содержании компонентов в эвтектике (Ph)2O – 20.0 мас. % (24.9 мол. %) и н-С16Н34 – 80.0 мас. % (75.1 мол. %).
Для оценки возможности применения как теплоносителя были изучены относительная плотность при 25°C (819.1 кг/м3), кинематическая вязкость (ν) в диапазоне температур от 25 до 50°C, показатель преломления (D) от 25 до 40°С, энтальпия плавления (198, кДж/кг), температура вспышки в открытом тигле (103.0°С) и температура кипения (278.2°С). Величины приведены в табл. 1. Температура вспышки в открытом тигле была установлена для оценки противопожарной безопасности сплава эвтектического состава.
Таблица 1.
Зависимость кинематической вязкости от температуры в системе дифенилоксид–н-гексадекан
| Т, °С | ν, мм2/с | D |
|---|---|---|
| 25.00 ± 0.01 | 3.29 ± 0.01 | 1.4515 ± 0.0001 |
| 30.00 ± 0.01 | 3.16 ± 0.01 | 1.4495 ± 0.0001 |
| 35.00 ± 0.01 | 2.78 ± 0.01 | 1.4475 ± 0.0001 |
| 40.00 ± 0.01 | 2.55 ± 0.01 | 1.4460 ± 0.0001 |
| 45.00 ± 0.01 | 2.32 ± 0.01 | |
| 50.00 ± 0.01 | 2.14 ± 0.01 |
Для каждого элемента фазовой диаграммы (рис. 3) характерны следующие фазовые реакции:
линия ae: Ж ⇆ (Ph)2О (моновариантное равновесие),
точка e: Ж ⇆ (Ph)2О + н-C16H34 (нонвариантное равновесие),
линия eb: Ж ⇆ н-C16H34 (моновариантное равновесие).
Cравнение экспериментальных и теоретических данных по координатам эвтектики приведено в табл. 2.
Таблица 2.
Сравнение параметров эвтектического сплава
| Метод | Содержание компонентов | Температура эвтектики | |||
|---|---|---|---|---|---|
| Значение, мас. % | Среднее отклонение от эксперимента, % | Значение, K | Отклонение от эксперимента, % | ||
| н-С16Н34 | (Ph)2O | ||||
| Эксперимент | 80.0 | 20.0 | – | 283.65 | – |
| Шредер–Ле Шателье | 50.1 | 49.9 | 29.90 | 287.56 | 1.38 |
| UNIFAC | 67.2 | 32.8 | 16.00 | 287.87 | 1.49 |
Отклонения расчетных данных состава эвтектики и температуры плавления идеальной системы от экспериментальных данных свидетельствуют о наличии в системе межмолекулярного взаимодействия. Данные взаимодействия, как видно, не всегда учитываются даже с помощью коэффициентов активности, вычисленных по параметрам группового взаимодействия, на которых основан метод UNIFAC. В связи с этим для исследования физико-химических свойств использовали эвтектический сплав экспериментального состава.
ВЫВОДЫ
1. Расчет ликвидуса системы дифенилоксид–н-гексадекан проведен методами Шредера–Ле Шателье и UNIFAC. Расчетные фазовые диаграммы не совпадают с экспериментальной и среднее отклонение содержания компонентов в эвтектике составляет для метода Шредера–Ле Шателье 29.90% и для метода UNIFAC 14.95%. Очевидно, что метод UNIFAC более перспективен для расчета равновесия фаз “жидкость–твердое тело” и который был использован для планирования эксперимента.
2. Экспериментально было установлено содержание компонентов и температура двойной эвтектики. Для расплава эвтектической смеси изучены кинематическая вязкость в диапазоне температур от 25 до 50°C и показатель преломления в диапазоне температур от 25 до 40°C. В указанном интервале температур кинематическая вязкость изменяется в диапазоне значений от 2.14 до 3.29 (±0.01) мм2/с. Показатель преломления в изученном температурном диапазоне изменяется от 1.4515 до 1.4460 (±0.0001). Измерены для эвтектического состава удельная энтальпия плавления, температура вспышки в открытом тигле (103°С) и температура кипения (278.2°С).
3. Изученный сплав не относится к легковоспламеняющимся жидкостям, но относится к горючим. Температура вспышки в открытом тигле составляет 106°С, но применять в качестве теплоносителя данный состав в жидком состоянии возможно в диапазоне от 10 до 270°С при условии герметичной аппаратуры обогревательного контура.
Список литературы
Каган С.З., Чечеткин А.В. Органические высокотемпературные теплоносители и их применение в промышленности. М.: Гос. науч.-технич. изд. химич. литер., 1951. С. 172.
Чечеткин А.В. Высокотемпературные теплоносители. М.: Энергия, 1971. С. 496.
Sheng Fang, Xiao-Bo Zuo, Xue-Jiao Xu, Da-Hai Ren // The Journal of Chemical Thermodynamics. 2014. V. 68. P. 281.
Sharma S., Makavana M. // Fluid Phase Equilibria. 2014 . V. 375. P. 219.
Rice P., Teja Amyn S. // J. Chem. and Eng. Data. 1980. V. 25. № 4. P. 346.
Lijiao Yu, Hong Dong, Chuan Wu, Yindi Zhang // The Journal of Chemical Thermodynamics. 2014. V. 72. P. 139.
Yindi Zhang, Hong Dong, Yan Yue, Chuan Wu // Ibid. 2013 . V. 57. P. 114.
Garkushin I.K., Kolyado A.V., Yakovlev I.G. // Russian Journal of Physical Chemistry A. 2016. V. 90. № 8. P. 1574.
Yakovlev I.G., Garkushin I.K., Kolyado A.V. // Ibid. 2017. V. 91. № 6. P. 1146.
Яковлев И.Г., Гаркушин И.К., Колядо А.В. // Журн. физ. химии. 2017. Т. 91. 9. С. 1491.
Гаркушин И.К., Дорохина Е.В., Колядо А.В. // Журн. “Бутлеровские сообщения”. 2009. Т. 16. № 3. С. 41–46.
Морачевский А.Г., Смирнова Н.А., Пиотровская Е.М. и др. Термодинамика равновесия жидкость–пар. Л.: Химия, 1989. 344 с.
Мощенский Ю.В. // Приборы и техника эксперимента. 2003 . Т. 6. С. 143.
Микрокалориметр ДСК: Метод. указ. к лаб. работе. Самара: Самар. гос. техн. ун-т, 2004. С. 19.
Федотов С.В., Мощенский Ю.В. Интерфейсное программное обеспечение DSC Tool: Руководство пользователя. Самара: СамГТУ, 2004. С. 23.
Yakovlev I.G., Garkushin I.K., Kolyado A.V. // J. of thermal analysis and calorimetry. 2018. V. 131. № 1. P. 455.
ГОСТ 18995.2-73 Продукты химические жидкие. Метод определения показателя преломления. М.: ИПК Издательство стандартов, 2009. С. 2.
Татевский В.М. Физико-химические свойства индивидуальных углеводородов. М.: Гостоптехиздат, 1960. С. 413.
Гаркушин И.К., Колядо А.В., Дорохина Е.В. Расчет и исследование фазовых равновесий в двойных системах из органических веществ. Екатеринбург: УрО РАН, 2011. С. 191.
Гаркушин И.К., Колядо А.В., Яковлев И.Г. // Теоретические и прикладные вопросы образования и науки. Материалы Международной научно-практической конф. Тамбов: б.н., 2014. С. 186.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии