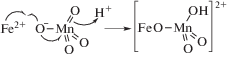Журнал физической химии, 2020, T. 94, № 8, стр. 1195-1201
Физико-химические свойства конденсированных продуктов взаимодействия катионов железа(II) с перманганат-ионами
Ю. Г. Хабаров a, *, В. А. Вешняков a, Е. А. Скрипников a, Д. Г. Чухчин a, А. В. Малков b, Г. В. Панкина c
a Северный (Арктический) федеральный университет имени М.В. Ломоносова
163002 Архангельск, Россия
b Российская академия наук, Федеральный исследовательский центр комплексного изучения Арктики им. академика Н.П. Лаверова
163002 Архангельск, Россия
c Московский государственный университет имени М.В. Ломоносова
119991 Москва, Россия
* E-mail: khabarov.yu@mail.ru
Поступила в редакцию 11.09.2019
После доработки 11.09.2019
Принята к публикации 17.09.2019
Аннотация
На основе парциального окисления катионов железа(II) перманганатом калия получены конденсированные продукты и изучены их физико-химические свойства. Максимальной относительной магнитной восприимчивостью обладают образцы, полученные при мольном соотношении перманганата калия к железу(II) близком к стехиометрическому для получения магнетита. Показано, что начальная скорость формирования относительной магнитной восприимчивости в интервале 30–70°С находится в линейной зависимости от обратной термодинамической температуры. Седиментация синтезируемых продуктов в условиях воздействия внешнего магнитного поля завершается в течение 1–1.5 мин. С помощью дифрактометрии установлено, что при мольном соотношении KMnO4 : Fe(II) 0.08–0.18 образуются кристаллические магнетитные образцы. Результаты магнитной гранулометрии показали, что они обладают суперпарамагнитными свойствами. В условиях статической сорбции хромат ионов степень их извлечения составила 98.7%.
Магнетит Fe3O4 и ферриты ряда металлов состава MFe2O4 являются магнитоактивными соединениями, их широкое практическое применение обусловливает постоянный интерес к их исследованию. В кристаллической структуре магнетита катионы железа(II) и часть катионов железа(III) расположены в чередующихся кристаллографических слоях. Так как магнитные моменты катионов железа(III) компенсированы, то общая намагниченность определяется параллельным упорядочиванием спинов катионов железа(II). Конденсационный метод является основным при синтезе магнитоактивных соединений магнетитного типа. Для синтеза магнетита часто используют метод, основанный на конденсации щелочным реагентом раствора солей железа(II) и железа(III), взятых в соотношении 1 : 2 [1–3]. Факторами, которые влияют на характеристики синтезируемого магнетита являются вид соли железа, соотношение Fe(II)/Fe(III) [4], температура проведения реакции [5, 6], рН [7, 8], тип основания и скорость перемешивания [9], а также присутствие модификаторов [6]. Магнетит можно синтезировать с помощью методов, в которых используются только соли железа(II). Такой подход требует окисления части катионов железа(II). В качестве окислителя может быть использован нитрит натрия [8], хромат калия [10].
Практическое значение двойных оксидов железа и марганца определяется тем, что атомы металлов в них могут находиться в степени окисления +2 и +3, а атомы марганца – также в степени окисления +4. Смешанные оксиды железа и марганца служат катализаторами окисления органических соединений [11–15], разложения озона [16], катализаторами механо-химических реакций [17], окисления при удалении оксидов азота из воздушной среды [18]. Их можно применять в импульсных источниках кислорода [19] и в качестве одного из реагентов при термохимическом производстве водорода [20, 21]. Смешанные оксиды являются электродами для суперконденсаторов [22] и литий-ионных источников тока [23], магнитными материалами [24], сорбентами для удаления арсенитов и селенитов из водных растворов [25, 26], их можно использовать в качестве твердофазного экстрагента при электрохимическом определении Hg(II) [27], адсорбентов [28–30].
Смешанные оксиды железа и марганца могут быть получены с помощью спекания [19, 21], гидротермических методов [16, 26], ультразвуковой обработки растворов [31], осаждения из растворов [25], микроэмульсий [32], электрохимически на поверхности электрода [22], технологией единственного геля [24] и другими методами [33].
Цель настоящего исследования состояла в изучении физико-химических свойств конденсированных продуктов, образующихся в результате окислительно-восстановительной реакции катионов железа(II) с перманганат ионами, а также оценке их сорбционных свойств по отношению к высокотоксичным хромат-анионам.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. При выполнении экспериментов использовали 20% раствор аммиака, раствор сульфата железа(II) 32.0 г/л с добавлением 0.37 моль H2SO4/1 моль Fe(II) для подавления гидролиза, раствор перманганата калия концентрацией 870 мг/л.
Синтез. В пробирку вносили 1 мл раствора сульфата железа(II) (11.7 мг Fe(II)) и заданный объем раствора перманганата калия. После перемешивания приливали 1 мл 20% раствора аммиака. Объем раствора при перемешивании доводили до 25 мл дистиллированной водой. Конденсацию проводили при комнатной температуре или в термостате Lauda Alpha A12 при 30, 40, 50, 60 и 70°C. Через определенные промежутки времени измеряли объем осадка (V, мл) и регистрировали показания установки, смонтированной на основе электронных аналитических весов, и рассчитывали относительную магнитную восприимчивость (ОМВ, г/г Fe) [34].
Синтез препаратов для изучения фазового состава и магнитных свойств проводили при 20 и 100°С, мольное соотношение перманганата калия к железу(II) изменяли от 0.08 до 0.32. Первоначально смешивали 100 мл раствора, приготовленного из 5 г гептагидрата сульфата железа(II) и 1 мл концентрированной серной кислоты, и 100 мл раствора, содержащего заданную навеску перманганата калия. Затем добавляли 18 мл 20% водного раствора аммиака, продолжительность конденсации составляла 30 мин. Выделившийся осадок продукта конденсации отделяли от раствора, промывали на центрифуге и сушили в вакуум-эксикаторе до постоянной массы.
Магнитная гранулометрия. Магнитные характеристики измеряли с помощью метода магнитной гранулометрии, который позволяет исследовать химические превращения в условиях in situ [35]. Выделенные твердые образцы в количестве 20 мг загружали в измерительную ячейку вибрационного магнитометра, представляющую собой проточный кварцевый микрореактор, и проводили измерения удельной намагниченности (σ) в зависимости от величины магнитного поля H (полевые зависимости) в атмосфере аргона. Затем с помощью специального программного обеспечения на основе полевых зависимостей определяли магнитные характеристики образцов при 20°С.
Дифрактометрия. Фазовый состав порошков выделенных продуктов был проанализирован на рентгеновском дифрактометре Shimadzu XRD-7000 S. Дифрактограмму пробы записывали в стандартном держателе с вращением 30 об./мин. Оптическая схема гониометра – θ–θ, детектор сцинтилляционный с монохроматором. Параметры работы рентгеновской трубки: ускоряющее напряжение 40 кВ, ток 30 мА, материал мишени – Cu. Диапазон сканирования 2θ 10–95°, скорость сканирования 1 град/мин, шаг 0.02°.
Сканирующая электронная микроскопия. Микрофотографии образцов получали на сканирующем электронном микроскопе (SEM) Sigma VP ZEISS (ускоряющее напряжение 10 кВ, детектор InLens). Для определения элементного состава использовали энергодисперсионный спектрометр Oxford 80 mm2 (ускоряющее напряжение 20 кВ).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для синтеза магнетита из соли железа(II) необходимо окислить 2/3 катионов железа(II). В качестве окислителя может быть использован перманганат калия. Ионы марганца в зависимости от начальной степени окисления и рН раствора участвуют в окислительно-восстановительных превращениях с переносом различного числа электронов (табл. 1) [1].
Таблица 1.
Характеристика редокс свойств перманганат иона
| Окислительно-восстановительная реакция | n | Еo, B |
|---|---|---|
| ${\text{MnO}}_{4}^{ - }$ + 4H+ = MnO2 + 2H2O | 3 | +1.695 |
| ${\text{MnO}}_{4}^{ - }$ + 8H+ = Mn2+ + 4H2O | 5 | +1.51 |
| ${\text{MnO}}_{4}^{{2 - }}$ + 2H2O = MnO2 + 4OH– | 2 | +0.60 |
| ${\text{MnO}}_{4}^{ - }$ + 2H2O = MnO2 + 4OH– | 3 | +0.588 |
| ${\text{MnO}}_{4}^{ - }$ = ${\text{MnO}}_{4}^{{2 - }}$ | 1 | +0.564 |
| Mn2+ = Mn | 2 | –1.18 |
Если в кислой среде перманганат ион выступает в качестве пятиэлектронного окислителя, то для достижения соотношения Fe(II)/Fe(III) 1 : 2 расход перманганата калия при окислении должен составлять 1 моль на 7.5 молей железа(II). Химические процессы, которые протекают в условиях синтеза можно представить следующим образом. В кислой среде происходит парциальное окисления катионов железа(II):
Перенос одного электрона в кислой среде можно представить следующим уравнением:
При добавлении в реакционную смесь щелочного реагента первоначально выделяется гидроксидный комплекс железа:
В дальнейшем за счет дегидратации комплекса происходит ферритизация с образованием магнетитной фазы:
В условиях конденсации выделяется гидроксид марганца(II), который также осаждается и входит в состав магнитоактивного соединения.
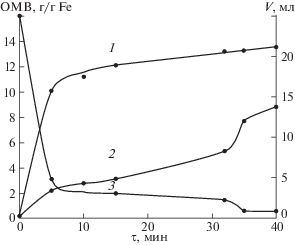
Первоначально были выполнены эксперименты с мольным соотношением перманганат иона и железа(II) равным 0.13. В кислой среде окислительно-восстановительная реакция происходит мгновенно. Конденсацию проводили в естественных условиях и на неодимовом магните. Процесс конденсации контролировали, измеряя ОМВ, а седиментацию – по величине объема осадка. Полученные результаты приведены на рис. 1. Скорость седиментации значительно снижается через 5 мин после начала конденсации, а ОМВ продолжает увеличиваться с течением времени. Измеряемая величина ОМВ зависит от двух составляющих. С одной стороны в зоне действия постоянного магнита измерительной установки с течением времени оказывается все большее количество осадка комплекса (концентрирование). С другой стороны в твердой фазе происходит формирование магнитоактивной фазы (химический процесс). Разделить эти два процесса затруднительно. После быстрой стадии седиментации, которая протекает в течение первых 5–8 мин, объем осадка изменяется медленно. На этой стадии основным является процесс формирования магнитоактивной фазы (рис. 1). В случае проведения конденсации в естественных условиях на 31 мин реакционная пробирка была поставлена на неодимовый магнит. Это привело к некоторому уменьшению объема осадка (кривая 3, рис. 1) продукта конденсации и значительному увеличению ОМВ (кривая 2, рис. 1). При конденсации на неодимовом магните седиментация прошла в течение 1–1.5 мин (на рис. 1 кривая не показана, так как она сливается с осями), т.е. вклад ее в измеряемую величину ОМВ минимален. В обоих случаях пробирки выдерживали в течение 48 ч на неодимовом магните, их ОМВ оказались одинаковыми.
Рис. 1.
Динамика формирования ОМВ при конденсации на неодимовом магните (1) и в естественных условиях (2) и динамика седиментации (3).
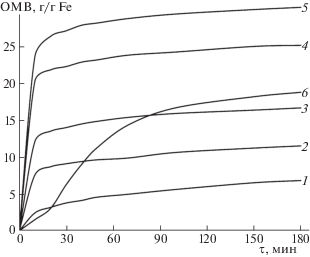
Для уменьшения влияния седиментации, дальнейшие эксперименты были выполнены таким образом, что после добавления конденсирующего реагента объем реакционной смеси не доводили до 25 мл и пробирку выдерживали на неодимовом магните в течение 1.5 мин. За это время в большинстве случаев происходила быстрая седиментация. Полученные зависимости ОМВ от продолжительности конденсации однотипны (рис. 2). В течение 10–15 мин ОМВ быстро возрастет, после чего скорость процесса значительно снижается. Некоторое отличие выявлено в эксперименте с максимальным расходом перманганата калия. На кинетической кривой быстрое возрастание ОМВ происходит после индукционного периода. Это, вероятно, можно объяснить тем, что седиментация на неодимовом магните происходила медленно. Постепенное возрастание ОМВ наблюдалось в течение 48 ч. В итоге величины максимальной ОМВ образцов, синтезированных при мольном соотношении перманганата калия и сульфата железа(II) 0.13 и 0.16 достигли практически одинаковой величины 30.3 ± 0.9 г/г Fe.
Рис. 2.
Динамика формирования магнитной активности при мольном соотношении KMnO4:Fe(II) 0.05(1), 0.08(2), 0.11(3), 0.13(4), 0.16(5), 0.18(6).
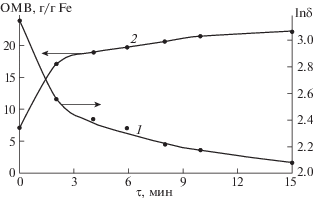
Влияние температуры. Конденсацию проводили при температурах 30, 40, 50, 60 и 70°С после 1.5 мин выдерживания на неодимовом магните при комнатной температуре, мольное соотношение перманганата калия к железу(II) было 0.13. ОМВ продукта увеличивается с течением времени с уменьшающейся скоростью (рис. 3). Для описания кинетики формирования ОМВ были использованы кинетические уравнения для реакции первого и второго порядка. Пример полулогарифмической анаморфозы кинетической кривой при 50°С свидетельствует о том, что процесс не может быть описан с удовлетворительной точностью уравнением кинетики реакции первого порядка ln(ОМВпр – ОМВi). Аналогичные результаты получены и при использовании зависимости 1/ОМВ.
Рис. 3.
Зависимости ОМВ и ln(ОМВпр–ОМВi) от продолжительности конденсации при 50°С, ОМВпр – предельное значение ОМВ.
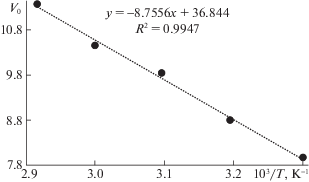
В дальнейшем была рассчитана начальная скорость конденсации, которая увеличивается с ростом температуры. Зависимость начальной скорости формирования ОМВ от обратной термодинамической температуры представляет полином первой степени (рис. 4).
Рис. 4.
Зависимость начальной скорости формирования ОМВ (Vo) от обратной термодинамической температуры (103/T).
Магнитные характеристики. С помощью метода магнитной гранулометрии определены магнитные характеристики тех продуктов, которые синтезированы при мольном соотношении перманганата калия к железу(II) 0.08–0.18 (табл. 2). Оказалось, что они относятся к суперпарамагнитным веществам. Температура конденсации мало влияет на магнитные характеристики продуктов конденсации, которые значительно зависят от мольного соотношения KMnO4 : Fe(II).
Таблица 2.
Магнитные характеристики продуктов реакции
| Образец | Мольное соотношение KMnO4 : Fe(II) | t, °C | Js, emu/g | Jr, emu/g | Hc, Oe | Доля суперпара-магнитных частиц |
|---|---|---|---|---|---|---|
| 1 | 0.08 | 20 | 130 | 1 | 0 | 0.985 |
| 2 | 0.08 | 100 | 141 | 0 | 0 | 1.00 |
| 3 | 0.13 | 100 | 81.3 | 1 | 2 | 0.975 |
| 4 | 0.18 | 100 | 38.2 | 1 | 1 | 0.948 |
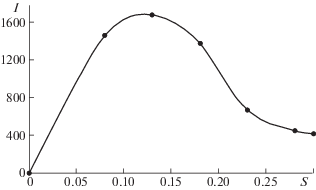
Фазовый состав. Рентгеновские дифрактограммы продуктов конденсации приведены на рис. 5. На дифрактограммах продуктов конденсации, синтезированных при мольном соотношении перманганата калия к железу(II) 0.08–0.18 имеются четко выраженные рефлексы, что свидетельствует о кристаллической структуре. Сравнение экспериментальных дифрактограмм с приведенными в базе данных PDF-2 (Powder Diffraction File™ PDF-2 Release 2010, International Centre for Diffraction Data) показало, что в образцах продуктов присутствует магнетит (Fe3O4). Продукты конденсации, синтезированные при больших расходах перманганата калия, обладают аморфной структурой. Интенсивность рефлекса при 2Θ = 35.6° зависит от мольного соотношения и имеет максимальные величины у образцов, синтезированных при расходе перманганата калия близком к теоретическому для образования магнетита (рис. 6).
Рис. 5.
Дифрактограммы продуктов, синтезированных при мольном соотношении KMnO4 : Fe(II) 0.08 (1, 2), 0.13 (3), 0.18 (4), 0.23 (5), 0.27 (6), 0.32 (7). 1 – образец конденсирован при 20°С, 2–7 при 100°С.
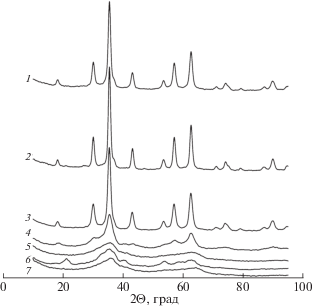
Рис. 6.
Интенсивность сигнала дифрактограммы при 2Θ = 35.6° (I) от мольного соотношения KMnO4 : Fe(II) (S).
Морфология и состав. Морфология и состав продукта реакции изучена с помощью сканирующей электронной микроскопии. Состав выделенных продуктов приведен в табл. 3. Увеличение содержание марганца в продуктах конденсации соответствует увеличению расхода перманганата калия на проведение реакции. Отклонение суммарного содержания элементов от 100% объясняется тем, что в составе определены небольшие количества других элементов, суммарное содержание которых не превышает 1–1.5%.
Таблица 3.
Элементный состав синтезированных продуктов
| Образец | Содержание элемента, % | ||
|---|---|---|---|
| Fe | Mn | O | |
| 2 | 51.5 ± 2.1 | 5.5 ± 0.2 | 42.4 ± 2.3 |
| 3 | 52.5 ± 1.7 | 9.6 ± 0.4 | 37.4 ± 2.2 |
| 4 | 45.2 ± 8.5 | 11.4 ± 2.3 | 42.2 ± 10.8 |
| 5 | 38.1 ± 3.7 | 12.5 ± 1.4 | 43.4 ± 10.2 |
| 6 | 32.4 ± 4.6 | 13.8 ± 7.1 | 48 ± 2.1 |
| 7 | 34 ± 6.9 | 13.1 ± 2.5 | 52.6 ± 9.6 |
Микрофотографии продуктов реакции приведены на рис. 7. Образец 1 состоит из бесформенных структур, образованных нанокристаллами размером 10–20 нм (рис. 7б). В образце 6 имеются шарообразные структуры размером 150–200 нм, окруженные бесформенной аморфной массой.
Рис. 7.
Микрофотографии образцов 1 (a, б) и 6 (в, г). Масштабная линейка a, в – 1 мкм, б, г – 100 нм.

Сорбция. Для оценки возможности использования продукта, синтезированного при мольном соотношении перманганата калия к железу(II) 0.08 в статических условиях была проведена сорбция хромат ионов. Для этого навеску продукта заливали заданным объемом раствора хромата калия концентрацией 0.199 г/л. Полученную смесь выдерживали в течение 48 ч при периодическом перемешивании. После завершения опыта осадок отделяли с помощью магнитной сепарации. Объем фугата доводили до 25 мл дистиллированной водой и определяли оптическую плотность при 375 нм на фотометре “Эксперт 03” в кюветах с толщиной рабочего слоя 50 мм. Оптическая плотность раствора после сорбции составила 0.013, в контрольном опыте у исходного раствора она была 1.043. Таким образом, в условиях статической сорбции степень извлечения хромат ионов составила 98.7 (коэффициент вариации 0.3%, повторность опытов 4).
Таким образом, проведено изучение физико-химических свойств конденсированных продуктов взаимодействия катионов железа(II) с перманганат-ионами. В зависимости от мольного соотношения катионов железа(II) с перманганат-ионами образуются продукты, различающиеся по кристалличности, фазовому составу и магнитным свойствам. При парциальном окислении 2/3 катионов железа(II) в ходе конденсации образуется продукт, обладающий суперпарамагнитными свойствами, хорошо извлекающий из водных растворов хромат-ионы.
Работа выполнена с использованием оборудования Центра коллективного пользования научным оборудованием Арктика Северного (Арктического) федерального университета.
Список литературы
Lopez J.A., González F., Bonilla F.A. et al. // Rev. Latinoam. Metalurg. Mater. 2010. V. 30. № 1. P. 60.
Sun X., Sun K., Liang Y. // Micro & Nano Lett. 2015. V. 10. № 2. P. 99.https://doi.org/10.1049/mnl.2014.0344
Hariani P.L., Faizal M., Marsi R. et al. // Int. J. Environ. Sci. Devel. 2013. V. 4. № 3. P. 336.https://doi.org/10.7763/IJESD.2013.V4. 366
Hyeon T. // Chem. Commun. 2003. № 8. P. 927.https://doi.org/10.1039/B207789B
Ditsch A., Laibinis P.E., Wang D.I.C. et al. // Langmuir. 2005. V. 21. № 13. P. 6006. https://doi.org/10.1021/la047057+
Hosseini-Monfared H., Parchegani F., Alavi S. // J. Colloid Interface Sci. 2015. V. 437. № 1. P. 1.https://doi.org/10.1016/j.jcis.2014.08.056
Massart R. // IEEE Trans. Magn. 1981. V. 17. № 2. P. 1247. https://doi.org/10.1109/TMAG.1981.1061188
Nedkov I., Merodiiska T., Kolev S. et al. // Monatsh. Chem. 2002. V. 133. № 6. P. 823.https://doi.org/10.1007/s007060200054
Субботин К.А., Михайличенко А.И., Нефедова Н.В. // Журн. прикл. химии. 2000. Т. 73. № 10. С. 1591.
Хабаров Ю.Г., Кузяков Н.Ю., Вешняков В.А. и др. // Журн. неорган. химии. 2017. Т. 62. № 2. С. 239.
Durán F.G., Barbero B.P., Cadús L.E. et al. // Appl. Catal. B: Environ. 2009. V. 92. № 1–2. P. 194–201.https://doi.org/10.1016/j.apcatb.2009.07.010
Nicolae S., Neaţu F., Florea M. // Comptes Rendus Chimie. 2018. V. 21. № 3–4. P. 354.https://doi.org/10.1016/j.crci.2017.06.005
Mungse P., Saravanan G., Rayalu S. et al. // Energy Technology. 2015. V. 3. № 8. P. 856.https://doi.org/10.1002/ente.201500035
Zhu J., Baig S.A., Sheng T. et al. // J. Hazard. Mater. 2015. V. 286. P. 220.https://doi.org/10.1016/j.jhazmat.2015.01.004
Chen J., Chen X., Xu W. et al. // Chem. Eng. J. 2017. V. 330. P. 281.https://doi.org/10.1016/j.cej.2017.07.147
Lian Z., Ma J., He H. // Catal. Commun. 2015. V. 59. P. 156.https://doi.org/10.1016/j.catcom.2014.10.005
Barroso Quiroga M.M., Barbero B.P., Cadus L.E. // Appl. Catal. A: General. 2014. V. 474. P. 26.https://doi.org/10.1016/j.apcata.2013.09.001
Qi G., Yang R.T. // Appl. Catal. B: Env. 2003. V. 44. № 3. P. 217.https://doi.org/10.1016/S0926-3373(03)00100-0
Shafiefarhood A., Stewart A., Li F. // Fuel. 2015. V. 139. P. 1.https://doi.org/10.1016/j.fuel.2014.08.014
Kuklo L.I., Belyaninova S.I., Ermakov S.S. et al. // Appl. Phys. A. 2006. V. 82. № 4. P. 599.https://doi.org/10.1007/s00339-005-3401-3
Kreider P.B., Funke H.H., Cuche K. et al. // Int. J. Hydrogen Energy. 2011. V. 36. P. 7028.https://doi.org/10.1016/j.ijhydene.2011.03.003
Lee M.-T., Chang J.-K., Hsieh Y.-T. et al. // J. Power Sources. 2008. V. 185. № 2. P. 1550.https://doi.org/10.1016/j.jpowsour.2008.09.007
Zhang Z., Ji Y., Li J. et al. // ACS Appl. Mater. Interfaces. 2015. V. 7. № 11. P. 6300.https://doi.org/10.1021/acsami.5b00617
Long J.W., Logan M.S., Carpenter E.E. et al. // J. NonCryst. Solids. 2004. V. 350. P. 182.https://doi.org/10.1016/j.jnoncrysol.2004.06.036
Zhang G., Liu F., Liu H. et al. // Environ. Sci. Technol. 2014. V. 48. № 17. P. 10316.https://doi.org/10.1021/es501527c
Szlachta M., Gerda V., Chubar N. // J. Colloid Interface Sci. 2012. V. 365. № 1. P. 213.https://doi.org/10.1016/j.jcis.2011.09.023
Fayazi M., Taher M.A., Afzali D. et al. // Sens. Actuators B Chem. 2016. V. 228. P. 1.https://doi.org/10.1016/j.snb.2015.12.107
Luo X., Wang C., Luo S. et al. // Chem. Eng. J. 2012. V. 187. P. 45.https://doi.org/10.1016/j.cej.2012.01.073
Buccolieri A., Serra A., Maruccio G. et al. // J. Anal. Methods Chem. 2017. V. 2017. Article ID 9476065.https://doi.org/10.1155/2017/9476065
Warner C.L., Chouyyok W., Mackie K.E. et al. // Langmuir. 2012. V. 28. № 8. P. 3931.https://doi.org/10.1021/la2042235
Lai J., Shafi K., Ulman A. et al. // J. Phys. Chem. B. 2004. V. 108, № 39. P. 14876.https://doi.org/10.1021/jp049913w
Herranz T., Rojas S., Ojeda M. et al. // Chem. Mater. 2006. V. 18. № 9. P. 2364.https://doi.org/10.1021/cm052568i
Kuklo L.I., Belyaninova S.I., Ermakov S.S. et al. // Nanotechnologies in Russia. 2016. V. 11. № 3–4. P. 137. https://doi.org/10.1134/S1995078016020105
Хабаров Ю.Г., Бабкин И.М., Вешняков В.А. // Журн. прикл. хим. 2012. Т. 85. № 6. С. 900.
Чернавский П.А., Панкина Г.В., Лунин В.В. // Успехи химии. 2011. Т. 80. № 6. С. 605.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии