Вестник Военного инновационного технополиса «ЭРА», 2023, T. 4, № 2, стр. 136-145
Обогащенные тромбоцитарной плазмой альгинатные скаффолды и гипокcически активированные фибробласты в терапии хронических раневых дефектов кожи
Е. В. Соловьева 1, *, О. И. Кляйн 1, К. А. Дариенко 1, А. А. Алексеев 2, А. А. Пантелеев 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Национальный медицинский исследовательский центр хирургии им. А.В. Вишневского
Москва, Россия
* E-mail: Solovyova_EV@nrcki.ru
Поступила в редакцию 06.07.2023
После доработки 06.07.2023
Принята к публикации 05.10.2023
Аннотация
Лечение хронических диабетических ран представляет серьезную клиническую проблему, биоинженерный подход к решению которой представляет несомненный интерес. Используются для этих целей фибробласты, функциональная роль которых в ранозаживлении заключается как в синтезе белков внеклеточного матрикса, так и в синтезе факторов роста, в том числе проангиогенных. Отсутствие HLA-DR – одного из главных белков комплекса гистосовместимости класса MHC-II – обеспечивает им существенное преимущество перед другими типами клеток. С учетом гипоксической, HIF1α-опосредованной, активации экспрессии генов, кодирующих участвующие в ранозаживлении белки, представляется эффективным использование иммобилизованных на биополимерных скаффолдах гипокси-активированных фибробластов для лечения ран, в том числе хронических. На основе альгината натрия создан ряд скаффолдов, содержащих обогащенную тромбоцитарными ростовыми факторами плазму (SA-PRP) и антибактериальные средства, а также проведено исследование возможности HIF1α-опосредованной активации регенераторного потенциала фибробластов человека при гипоксии.
ВВЕДЕНИЕ
Разработка комплексных биоинженерных подходов к лечению длительно незаживающих кожных ран, зачастую связанных с хроническими системными заболеваниями, такими как диабет, остается актуальной проблемой современной биомедицины.
Заживление ран по своей природе является ответом на воспаление, которое следует после травмы или развития дегенеративного процесса в кожных покровах. Оно обеспечивается за счет клеточной миграции и пролиферации, синтеза внеклеточного матрикса (ЕСМ) (фиброгенеза, обеспечиваемого фибробластами дермы), эпителизации (закрытие раны в результате деления и миграции кератиноцитов) и ремоделирования ткани (также в результате активности фибробластов). Фибробласты, являясь основным источником белков ЕСМ, в основном коллагена, эластина и фибронектина, быстро перемещаются в раневую область и обеспечивают процесс фибро- и ангиогенеза, синтезируя не только Vegf-α, но и другие проангиогенные факторы, основными среди которых являются FGF, TGF-β, HGF [1, 2].
Хроническое течение ран, в частности диабетических, по мнению многих исследователей, связано с измененной продукцией белков ECM дермальными фибробластами (DF) [3, 4]. Показано, что DF, полученные от пациентов с диабетическими язвами (диабетическая стопа), характеризуются снижением скорости пролиферации [5–7], снижением скорости синтеза коллагена [4] и увеличением производства металлопротеиназ [3].
В области повреждения тканей дегрануляция тромбоцитов белками, такими как тромбин, сопровождается высвобождением различных факторов, включая трансформирующие факторы роста α и β (TGF-α, TGF-β), фибриноген, тромбоцитарный фактор роста (PDGF), эпидермальный фактор роста (EGF), фактор роста эндотелия сосудов (VEGF), а также биологически активные вещества (тромбопластин, тромбоспондин, факторы свертывания, кальций, серотонин, гистамин, гидролитические ферменты), участвующие в процессах ранозаживления [8–10]. Показано, что плазма, обогащенная тромбоцитами (PRP), отличается от плазмы, обедненной тромбоцитами (PLP), по содержанию TGF-β и PDGF [11]. Действуя локально, PDGF улучшает регенерацию дермы за счет стимуляции синтеза коллагена фибробластами [12]. Кроме того, PDGF индуцирует экспрессию TGF-β, который, способствуя клеточной дифференцировке и пролиферации, обеспечивает ранозаживление [13]. Исследования показали, что применение гелей, содержащих PDGF, приводит к репарации ранее незаживающих ран. Так, в экспериментальной группе пациентов полная эпителизация была отмечена в 81% ран по сравнению с 15% в контрольной группе. При этом таких побочных эффектов, как чрезмерное рубцевание, злокачественная трансформация или чрезмерный рост соединительной ткани, выявлено не было [14]. Обработка ран PRP также способствовала ускоренной дифференцировке кератиноцитов и формированию соединительной ткани с организованными коллагеновыми волокнами [11].
Известно, что условия гипоксии могут стимулировать экспрессию генов, кодирующих участвующие в ранозаживлении белки [15]. В связи с этим представляется перспективным использование гипокси-активированных DF, иммобилизованных на биополимерных скаффолдах, для лечения ран, в том числе хронических.
В настоящей работе представлен комплексный биотехнологический подход к решению проблемы заживления хронических диабетических и ожоговых ран, объединяющий использование комбинированных скаффолдов (содержащих ростовые факторы тромбоцитов и антибактериальные препараты) с использованием активированных гипоксией DF человека, для которых характерно HIF-1α-опосредованное повышение уровня выработки проангиогенных ростовых факторов (Vegf-α).
МАТЕРИАЛЫ И МЕТОДЫ
Все среды для культивирования клеток и их компоненты приобретены в Thermo Fisher Scientific (USA): среда DMEM/F12 (#11 320 033), среда K-SFM (#10 724), ростовые факторы для K-SFM (K-SFM supplements #37 000-015), коллагеназа I типа (#17 018-029), 0.05%-ный трипсин/ЭДТА (#15 400-054), FBS (#SV30 160.03), антибиотики (#15 140-122), среда Immu-mount (#9 990 402). Первичные антитела, используемые для иммунофлуоресцентного анализа, Hif-1α (#ab2185), phd1 (#86 980), phd3 (#88 582), CD31 (#ab28 364) и CD34 (#аb185 732) приобретены в AbCam (Cambridge, USA), вторичные антитела Alexa594 (#711-586-152), Alexa488 (#711-546-152), Alexa488 (#715-546-150) получены из Jackson ImmunoResearch Europe Ltd (Cambridge House, UK). Глицин (CAS #56-40-6), BSA (CAS #9048-46-8), параформальдегид (CAS #P6148), трипсин (#85450C), альгинат натрия (SA) (CAS #9005-38-3), BaCl2 (CAS #10361-37-2) получены из Sigma Aldrich (USA). Richard-Allan Scientific™ Neg-50™ (ThermoFisher Scientific™, USA), CVR Mount (#05-CVR500, BioOptica, Italy).
Первичная культура фибробластов кожи (sFb) была получена из биопсийного образца кожи здоровой 46-летней женщины, перенесшей пластическую операцию. После удаления подкожной жировой клетчатки для отделения дермы от эпидермиса образец инкубировали в 0.25%-ном растворе трипсина при 4°С в течение ночи. После отделения эпидермиса дермальную часть кожи измельчали ножницами и подвергали ферментативному расщеплению 1%-ным раствором коллагеназы I типа 30 мин при 37°С. Выделенные клетки культивировали в стандартных условиях, используя среду DMEM/F12 с добавлением 10% FBS и антибиотиков, после удаления коллагеназы. Для выделения кератиноцитов эпидермис измельчали ножницами и подвергали ферментативному расщеплению в 0.05%-ном растворе трипсина в течение 5 мин при 37°С, после чего трипсин удаляли и клетки культивировали в стандартных условиях, используя бессывороточную среду K-SFM. Смену сред для фибробластов и кератиноцитов проводили каждые 2–3 дня. Пассирование культуры фибробластов проводили при достижении 90%, а кератиноцитов – 70% конфлюэнтности, используя 0.05%-ный раствор трипсина/ЭДТА. Для проведения экспериментов клеточную суспензию sFb (2 × 105 кл/см2) высевали на покровные стекла (d = 2.5 см). Подсчет клеток проводили в камере Горяева. Иммобилизованные на стеклах клетки культивировали в условиях “нормоксии” (21% О2, 5% СO2, 94% N2) и в условиях “гипоксии” (1% O2, 5% СO2, 94% N2) в гипоксической камере собственной разработки (патент RU2626526C1).
Фибробласты, иммобилизованные на стеклах, фиксировали в течение 15 мин в 4%-ном растворе параформальдегида и промывали PBS. Пермеабилизацию клеточных мембран проводили 0.25%-ным раствором Triton X-100. Неспецифическое связывание блокировали 1%-ным раствором бычьего сывороточного альбумина (BSA) в 0.3 M растворе глицина в фосфатном буфере (PBS). Используя влажные камеры, герметизированные парафильмом, клетки инкубировали с первичными антителами в блокирующем растворе в течение ночи при 4°С. Первичные антитела отмывали в PBS и инкубировали в течение 1.5 ч с вторичными антителами, конъюгированными с флуорохромом Alexa488 или Alexa594 в разведении 1:900 при комнатной температуре (КT). Заключали клетки под стекло в среде Immu-mount (#9 990 402, Thermo Scientific). Результаты оценивали при помощи флуоресцентного микроскопа (Axiovert 40 CFL, Carl Zeiss) и программного обеспечения AxioVisionTM software (Carl Zeiss Microimaging GmbH). Иммунофлуоресцентную окраску криосрезов образцов скаффолдов проводили после подкожной имплантации на CD31 (#ab28 364) и CD34(#аb185 732) (Abcam).
Для оценки биосовместимости полученных скаффолдов на их поверхность высевали ~5–104 sFb или 105PKC (первичные кератиноциты человека), после чего добавляли соответствующую клеткам культуральную среду (смотри выше). Клеточную жизнеспособность оценивали с помощью флуоресцеиндиацетата (FDA) спустя 24 ч после начала культивирования в стандартных условиях СО2-инкубатора. Визуализацию клеток проводили при помощи флуоресцентного микроскопа Zeiss Imager D2 и AxioVisionTM, используя программное обеспечение (Carl Zeiss M-icroimaging GmbH). Для обработки изображений использовали программу ImageJ (ImageJ). Все экспериментальные процедуры на животных были проведены с одобрения комитета по этике НИЦ “Курчатовский институт”. Для оценки способности васкуляризации каждый тип губчатого скаффолда (d = 7 мм, h = 1.3 мм) был имплантирован подкожно через небольшой разрез в межлопаточной области мыши линии C57BL/6. Спустя 10 дней скаффолды извлекали, фиксировали параформальдегидом, обезвоживали в 30%-ном растворе сахарозы и замораживали в криосерде Richard-Allan Scientific™ Neg-50™ (ThermoFisher Sci™). Срезы толщиной 20 мкм изготавливали на криотоме Thermo Scientific Microm HM525, окрашивали гематоксилином, эозином и использовали для иммуногистохимического окрашивания на CD31 и CD34. Процедуру окраски проводили аналогично описанной выше, заключение материала осуществляли в растворе CVR Mount (BioOptica). Визуализацию образцов проводили под флуоресцентным микроскопом Axiovert 40CFL, используя программное обеспечение AxioVisionTM (Carl Zeiss Microimaging GmbH). Количественную оценку ангиогенеза проводили путем подсчета окрашенных событий на мм2 в 25 полях зрения, используя программное обеспечение Adobe Creative Suite CS2). Эксперименты по ранозаживлению проводили на мышах линии SCID в возрасте 10–12 нед под наркозом (0.005 мг рометара и 0.04 мг золетила на грамм веса тела животного). С помощью хирургических ножниц в области лопаток выполнялась рана диаметром ~9 мм, которую закрывали губчатым скаффолдом разного состава. После чего скаффолд фиксировали медицинской липкой лентой. Цифровое изображение раны использовали для расчета площади ее закрытия с помощью программного обеспечения ImageJ.
PRP получали из крови здорового добровольца по протоколу [16] c небольшими модификациями. Стабилизированную с использованием ЭДТА кровь центрифугировали при 100 g в течение 10 мин для осаждения эритроцитов, после чего отбирали плазму и центрифугировали вновь при 250 g в течение 10 мин для осаждения тромбоцитов. Из ~32 мл крови получали 6 мл PRP и 12 мл PLP.
Пористые губчатые PRP-альгинатные скаффолды, содержащие 90% SA, 5% PRP/PLP, 5% FG и 100% CL, были получены методом лиофилизации водного раствора SA, содержащего PRP/PLP (5% об./об.). Процесс приготовления включал в себя:
– приготовление и смешивание (800 rpm, КТ, 20 мин) рабочих растворов: SA (2%-ный водный раствор), CL (1%-ный раствор в 0.1 М уксусной кислоте), лаурил сульфат натрия (ПАВ, 10%), хлорид бария (0.5 М водно-спиртовой раствор (30:70)), PRP/PLP;
– желирование;
– ступенчатое охлаждение от +20°С до –47°С;
– лиофилизацию образцов с помощь вакуумной сушки FreeZone 4.5 LABCONCO;
– сшивку SA-PRP/PLP-скаффолдов двухвалентными ионами (ВаСl2/CaCl2) в течение 10 мин при КT и удаление сшивающего агента. Образцы скаффолдов из коллагена сшивали 1%-ным глутаровым альдегидом.
Для создания SA-PRP-пленок использовали суспензию 2%-ного водного раствора SA, в которую добавляли PRP до конечной концентрации 1, 3, 5, 11, 22, 50%. Приготовленную суспензию помещали в культуральный планшет из расчета 500 мкл/лунку 24-луночного планшета, после чего высушивали в течение 6 ч при 37°С. Полученные пленки сшивали 6%-ным раствором B-aCl2/CaCl2 в течение 15 мин при КТ. Полученные пленки отмывали от сшивающих растворов в дН2О, после чего использовали в экспериментах.
Для создания SA-PRP-микросфер использовали суспензию 1%-ного водного раствора SA и PRP в соотношении 4:1, 2:1. Приготовленную суспензию с помощью инсулинового шприца с иглой размером 30G (0.30 × 8 мм) капельным образом наносили на поверхность сшивающего раствора (6% BaCl2/CaCl2). Для получения микросфер, содержащих антибиотики, в 1%-ный водный раствор SA добавляли гентамицин (GM), ванкомицин (VM), линкомицин (LM), сефотаксим (CT) до конечной концентрации 10, 50 и 100 мкг/мл. Полученные микросферы отмывали от сшивающих растворов в дН2О, после чего хранили в 70%-ном этаноле до момента использования.
Статистический анализ проводили, используя непараметрический критерий Манна–Уитни (OriginPro 8.0; MA, USA). Величина p < 0.05 рассматривалась как соответствующая статистически значимой разнице между рассматриваемыми параметрами.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Композитные скаффолды на основе полисахаридов природного происхождения находят все большее распространение в биоинженерии и регенеративной медицине. Среди этой группы соединений альгинат натрия (SA), полисахарид, получаемый из бурых водорослей, занимает особое место в силу своих уникальных свойств, позволяющих производить материалы различной структуры и композиционного состава, включая пленки, гидрогели, пены, губки, нановолокна, сетки, микросферы [18–21]. Для решения проблемы заживления хронических ран разработали методики получения и использования PRP-содержащих скаффолдов различной структуры и свойств (губки, пленки и микросферы) на основе SA.
Использование плазмы, обогащенной факторами роста и цитокинами тромбоцитов (PRP), для регенерации покровов имеет сорокалетнюю историю. Первоначально PRP широко использовалась только в составе гелевых скаффолдов, стимулируя не только ангиогенез, дифференцировку и пролиферацию кератиноцитов, но и формирование соединительной ткани с организованными коллагеновыми волокнами [11–14]. Использование богатой тромбоцитами плазмы охватывает различные области дерматологии от лечения хронических язв до трихологии из-за ее роли в заживлении ран. Существует большое разнообразие описанных протоколов стандартизации и подготовки PRP, выбранный нами позволяет выделять наибольшее количество тромбоцитов (1–2 × 108) из 1 мл крови [16, 17].
Были получены пленочные альгинатные скаффолды с содержанием PRP от 5 до 22% и исследовано возможное влияние PRP на пролиферацию клеток кожи человека – sFb и PKC. При культивировании в течение двух дней было отмечено, что скорость пролиферации фибробластов увеличивалась в 1.2–1.5 раза в зависимости от содержания в пленке PRP, практически не влияя при этом на пролиферацию кератиноцитов. Увеличение содержания PRP до 50% резко снижало (2–2.5 раза) адгезивные свойства альгинатной пленки для фибробластов, сохраняя при этом адгезию для кератиноцитов. Кроме того, высокое содержание PRP вызывало появление у кератиноцитов морфологических признаков, характерных для дифференцировки.
На основе использования оригинальной методики получили ряд комбинированных, обогащенных тромбоцитарной фракцией плазмы крови человека, биосовместимых с основными клеточными элементами губчатых скаффолдов на основе SA с заданными физико-химическими свойствами (пористостью 93–97% и стабильностью в культуре до 30 дней) (рис. 1в).
Рис. 1.
Функциональные свойства композитных SA/PRP-скаффолдов: а – биосовместимость губчатых комбинированных скаффолдов с sFb (SA/PLP/FG – альгинат натрия, обедненная тромбоцитами плазма, фибриноген; SA/PRP/FG – альгинат натрия, обогащенная тромбоцитами плазма, фибриноген; SA/PRP – альгинат натрия, обогащенная тромбоцитами плазма; GL – коллаген); б – количественная оценка биосовместимости с использованием программы Image G; в – васкуляризация губчатых комбинированных скаффолдов после 10-дневного подкожного имплантирования мышам линии SCID: фазовый контраст (FC); гистологическая окраска (гематоксилином и эозином); (иммуногистохимическое окрашивание на маркеры ангиогенеза CD31 и CD34); г – внешний вид васкуляризованного подкожного SA-PRP-импланта; д – количественная оценка ангиогенеза при помощи программы Image J; е – SA-PRP-микросферы; ж – количественная оценка диаметра микросфер разного состава.
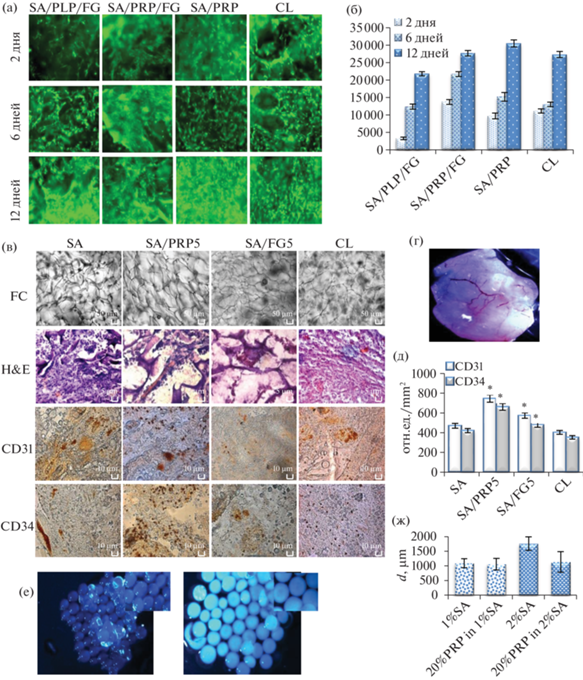
Сравнение полученных скаффолдов с коллагеновыми показало, что добавление 5% PRP к SA способствует как усилению адгезивных свойств матрикса, так и увеличению пролиферативной активности sFb (рис. 1а, 1б). Сочетание PRP c FG ускоряло образование клеточных пластов, формируя многоуровневые клеточные структуры. Полученные на основе SA губчатые материалы обладают прочностью и биорезорбируемостью, сравнимой с коллагеном. Полученные результаты по васкуляризации матриксов при подкожном имплантировании мышам линии SCID демонстрируют их относительное преимущество перед классическим коллагеном.
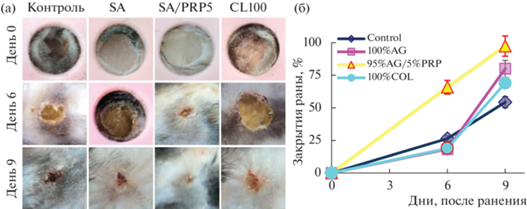
В целом результаты по ранозаживлению демонстрируют эффективность использования 5% PRP в составе альгинатного губчатого скаффолда для ранозаживления у мышей линии SCID, показывая пятикратное превосходство (96%-ная заживляемость) на шестой день после ранения по сравнению с коллагеновым скаффолдом (19%-ная заживляемость) (рис. 2).
Рис. 2.
Ранозаживление у мышей линии SCID. Внешний вид раны в ходе ранозаживления (а). Количественная оценка ранозаживления при помощи программного обеспечения Image J (б).
Большинство хронических ран инфицируется несколькими видами бактерий, синергический эффект влияния которых часто приводит к тому, что ранее не вирулентные виды становятся вирулентными, существенно осложняя ранозаживление. Исследования бактериального состава ран при хроническом течении ранозаживления показали, что основными бактериальными штаммами являются Staphylococcus, Pseudomonas, Peptoniphilus, Enterobacter, Stenotrophomonas, Finegoldia и Serratia [22]. Известно, что бактерии в хронических ранах образуют биопленки, которые препятствуют заживлению. В биопленке бактерии растут медленно из-за недостатка питательных веществ, что приводит к появлению у них множественной лекарственной устойчивости (multidrug resistance) [22, 23]. Для создания скаффолдов, обладающих способностью медленно высвобождать биологически-активные вещества (антимикробные средства, ростовые факторы), разработали процедуру получения микросфер, содержащих как ростовые факторы PRP, так и антибиотики. Использование PRP в твердом 3D-носителе (в составе микросфер) представляет собой инновационный подход, который может быть использован в лечении хронических повреждений кожи и при создании биоинженерных эквивалентов. Разработанная нами технология позволила получить различные комбинированные микросферические формы SA (~1 мкм в диаметре) с различным содержанием PRP и антибиотиков (рис. 1е, 1ж), при этом содержание PRP выше 40% нарушало формирование микросфер. Таким образом, содержание PRP в диапазоне 35–40% является оптимальной нагрузкой действующего вещества при использовании альгинатных микросфер в биоинженерии.
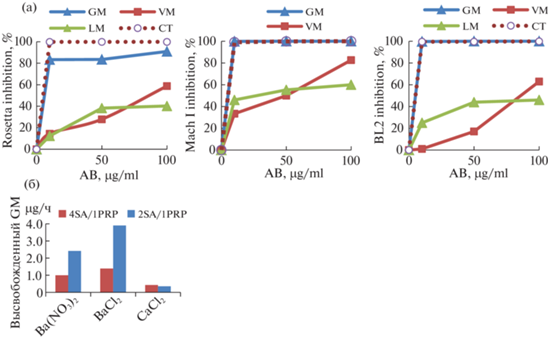
Получены микросферы на основе альгината натрия, тромбоцитарно-обогащенной плазмы и антибиотиков широкого спектра действия в концентрациях 10, 50 и 100 мкг/мл (GM – гентамицин, VM – ванкомицин, LM – линкомицин, CT – сефотаксим). Преимущества GM перед другими аминогликозидами (канамицин, неомицин) – его активность в отношении синегнойной палочки и микроорганизмов группы Serratia–Klebsiella–Enterobacter, более быстрое бактерицидное действие и редкое развитие устойчивых к GM штаммов. Цефотаксим – полусинтетический антибиотик широкого спектра действия группы цефалоспоринов, подавляющий, как и GM, рост грамположительных и грамотрицательных бактерий. Линкомицин – антибиотик группы линкозамидов, активен преимущественно в отношении аэробных грамположительных бактерий. Ванкомицин – обычно используется при лечении серьезных, угрожающих жизни, инфекций, в частности сложных инфекций кожных покровов. Антибактериальная активность сшитых барием S-A‑PRP (2:1) микросфер, оцененная по подавлению роста бактериальных штаммов Е. сoli при культивировании 24 ч в среде LB, показала, что гентамицин в концентрации 10 мкг/мл и выше обладает бактериостатическим действием в отношении всех представленных штаммов Е. сoli (Rosetta, MachI, BL2), подавляя бактериальный рост на 100% (рис. 3). Сефотаксим в концентрации 10 мкг/мл и выше обладает бактериостатическим действием в отношении штаммов MachI, BL2 Е. сoli (рис. 3). Микросферы с ванкомицином и линкомицином уступают по бактериостатической активности гентомициновым и цефотаксиновым микросферам, осуществляя подавление роста бактерий на 60% в максимальной концентрации 100 мкг/мл (рис. 3). Для заживления хронической раны после определения бактериального состава и устойчивости его к антибиотикам возможно изготовление PRP-SA-микросфер с тем антибиотиком, к которому не будет резистентности. Для использования микросфер необходимо предусмотреть использование покровного материала, который будет фиксировать микросферы в ране.
Рис. 3.
Подавление роста бактериальных штаммов Е. сoli при культивировании в течение 24 ч в среде LB (а). Зависимость скорости высвобождения гентамицина из комбинированных SA-PL-микросфер от используемых сшивающих ионов и процентного содержания плазмы (б).
Хронические язвы дибетической природы в отличие от острых ран характеризуются хроническим воспалением, высокой бактериальной инфицированностью и дисбалансом между уровнем протеиназ и их ингибиторов [24]. Процент населения, страдающего диабетом второго типа, по прогнозам, к 2040 г. увеличится до 10.4% [25]. Высокий уровень глюкозы в крови, возникающий из-за дисфункции поджелудочной железы, обусловливает развитие полиорганопатий, из которых комбинация венозной недостаточности и периферических нейропатий приводит к потере чувствительности и развитию хронически инфицированного поражения – диабетической язвы стопы, что в 40–70% случаев ведет за собой ампутацию нижних конечностей [26, 27].
К системным факторам, влияющим на скорость регенерации кожных покровов, особенно у диабетических больных, наряду с возрастными и алиментарными относят ангиопатию и дисфункцию как кератиноцитов, так и фибробластов [28].
Фибробласты являются неоднородной и динамической клеточной популяцией. Кроме того, ткани человека значительно различаются по типам составляющих их фибробластов. Дерма кожи содержит несколько субпопуляций фибробластов с уникальными морфологическими и физиологическими свойствами [29–31]. В зависимости от их расположения в дерме фибробласты экспрессируют разное количество мРНК коллагена I и III типов. Фибробласты глубоких слоев дермы вырабатывают меньше mРНК-коллагеназы, чем фибробласты поверхностных слоев [32, 33]. Фибробласты весьма пластичны по своей природе. Например, они способны к изменению своего клеточного профиля. Наиболее ярким примером этой способности является их переход в миофибробласты, что происходит в процессе ранозаживления. Кроме того, клетки мезенхимального происхождения, включая адипоциты и перициты, способны де-дифференцироваться в фибробласты [34–36]. Даже клетки эндотелиального и эпителиального происхождения способны принимать фенотип фибробластов, что является основным фактором в этиологии послераневого фиброза [37].
Внеклеточные компоненты дермы кожи, секретируемые в основном фибробластами, могут быть разделены на волокнообразующие и неволокнообразующие структурные молекулы, а также матричные белки, которые модифицируют взаимодействие клеток с ЕСМ и могут отсутствовать в норме и экспрессироваться только при ранозаживлении [38]. В дерме кожи наиболее распространенным волокнообразующим белком является коллаген, который составляет до 77% сухого веса кожи [39]. В процессе ранозаживления большинство белков ECM синтезируется фибробластами, нормальное функционирование которых нарушается при развитии патологических процессов [40, 41]. Патофизиологические процессы, ответственные за аномальное заживление ран у пациентов с диабетом, характеризуются снижением уровня экспрессии факторов роста, чрезмерно активной воспалительной реакцией и ангиопатиями [42–45]. Причиной многих патологических состояний кожи, в частности задержки и хронизации процесса ранозаживления, часто является опосредуемое ишемией (гипоксией) воспаление. С другой стороны, воспалительные состояния сами могут провоцировать тканевую гипоксию и/или стабилизацию и активацию гипокси-зависимых факторов транскрипции, в частности фактора HIF1 [46, 47]. Процесс заживления контролируется несколькими сигнальными путями, регулирующими в клетках экспрессию множества генов: факторов роста, цитокинов, хемокинов, матриксных металлопротеиназ и внеклеточных макромолекул [48, 49]. При гипоксии, сопровождающей ранозаживление (в силу повреждения сосудов и высокой потребности клеток в кислороде), запускаются механизмы, индуцирующие транскрипцию генов, участвующих в адаптации клеток к кислородной недостаточности. Одним из ключевых регуляторов адаптации является транскрипционный фактор H-IF‑1α, стабилизация которого при гипоксии приводит к активации генов, ответственных за клеточный метаболизм (Glut-1, Glut-3, Eno-1, Hk-1, Hk-2, G3pd, Lep, Ldha и т.д.), а также ангиогенез и эритропоэз (VEGF, VEGFR2, EG-VEGF, TGF-b3, EGF, Epo, End1, eNos, Nos2, Et1 и т.д. ). Его активность обусловливает усиление генерации анаэробной АТФ через гликолиз, увеличение подачи кислорода к тканям через ангиогенез и повышение оксигенации крови через эритропоэз [46, 47]. В присутствии кислорода HIF-1α подвергается гидроксилированию пролилгидроксилазами и убиквитинизируется, после чего разрушается протеасомами, так и не попадая в ядро. HIF-1α накапливается, когда клетки подвергаются воздействию гипоксии, протеасомных ингибиторов, переходных металлов (например, кобальта), хелаторов железа или восстановителей.
Роль HIF-1 в ранозаживлении при диабете заключается в контроле структуры ECM дермы кожи и подкожных тканей, а также в инициировании биохимических и биомеханических взаимодействий, необходимых для клеточной адгезии, миграции, пролиферации, дифференцировки и выживаемости. ECM, в свою очередь, направляет клеточную организацию через рецепторное межклеточное взаимодействие, активируя сигнальные пути физиологических ответов.
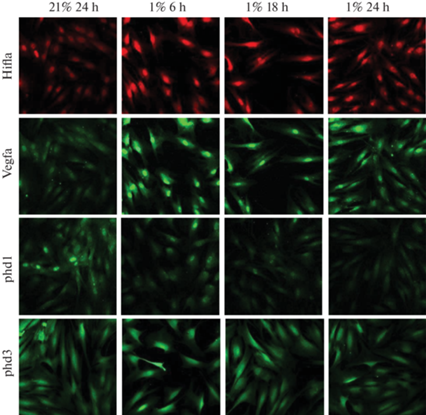
Исследовали возможность использования модуляции активности HIF-каскада гипоксией (1% O2) для моделирования синтеза белков, участвующих в процессе ранозаживления и ангиогенеза в первичных фибробластах кожи человека (sFb). Было отмечено повышенное содержание Vegf-α (основной мишени активности HIF-1α) уже после 6-часовой гипоксической индукции, при этом выявлена ядерная локализация фактора HIF-1a, показывающая его стабилизацию и активацию (рис. 4). При этом было показано отсутствие влияния гипоксии (1% О2) на уровень экспрессии Рhd3 и выраженное времязависимое ингибирование Рhd1 в sFb (рис. 4).
Рис. 4.
Влияние гипоксии (1% О2) на содержание белков HIF1α,Vegfα, phd1, 3 в фибробластах кожи человека (sFb).
Высокий уровень экспрессии транскрипционного фактора HIF-1α и, следовательно, индукция транскрипции генов-мишеней регулируется путем гидроксилирования субъединиц HIF-1α семейством пролилгидроксилаз – Рhd 1, 2, 3, кодируемых соответственно генами Egln2, 1, 3 [47, 48]. Все Рhd-изоферменты принадлежат к суперсемейству Fe- и 2-оксоглутарат-зависимых диоксигеназ, что позволяет рассматривать Рhd в качестве клеточных сенсоров кислорода. Рядом исследований показано, что гипоксия влияет как на экспрессию, так и на активность пролилгидроксилаз [49]. Несмотря на то что Рhd экспрессируются во всех клетках, известно, что внутриклеточная локализация и степень экспрессии различных Рhd варьируют в зависимости от вида ткани и степени гипоксии. Так, отмечается, что в сердечной мышце в большей степени экспрессируется Egln1, а в семенниках – Egln3 [50].
При этом Рhd1 имеет преимущественно ядерную локализацию, Рhd2 обнаруживается в цитоплазме, а Рhd3 как в ядре, так и в цитоплазме, и ни одна из гидроксилаз не меняет своей локализации при гипоксии [51]. Кроме того, все HIF-1α-пролилгидроксилазы ингибировали накопление HIF-1α в ядре при гипоксии. Гипоксическую (1% О2 24 ч) индукцию наблюдали только в случае генов Egln1 и Egln3 [51]. Хотя все HIF-1α-пролилгидроксилазы представлены во всех тканях организма, несовместимым с жизнью является только отсутствие или нокдаун гена Egln1, кодирующего пролилгидроксилазу Рhd2 [49]. Остается до конца невыясненным, влияет ли гипоксия на экспрессию и активность пролилгидроксилаз независимо от клеточной специализации и опосредованно ли это влияние HIF-1-транскрипционным комплексом. В дополнение к Рhd-обусловленным изменениям в стабильности HIF-1α в настоящее время есть доказательства, что Рhd-гидроксилирование может влиять на активность других белков и на белок-белковые взаимодействия [52]. Каталитическая активность Рphd может быть фармакологически подавлена ингибиторами пролилгидроксилаз (роксадустат (FG-4592), диметилоксалилглицин (DMOG), тилдигидроксибензоат (EDHB) [53, 54].
Оценка внутриклеточной локализации пролилгидроксилаз в фибробластах кожи человека при нормоксии показала, что Рhd1 имеет преимущественно ядерную, Рhd2 – цитоплазматическую, а Рhd3 – как ядерную, так и цитоплазматическую локализации (рис. 5б).
ЗАКЛЮЧЕНИЕ
Таким образом, показана возможность получения активированных гипоксией фибробластов, характеризующихся сниженным содержанием Рhd1 (способствующим стабилизации HIF-1α) и, соответственно, повышенным содержанием Vegf-α (способствующему росту сосудов). Также разработана и протестирована методология получения антибактериальных SA-PRP-скаффолдов. Использование этих двух подходов в терапии раневых (ожоговых) и хронических язвенных дефектов кожи может представлять несомненный практический интерес.
Список литературы
Newman A., Nakatsu M., Chou W. et al. // Mol. Biol. Cell. 2011. V. 22 (20). P. 3791.
Olczyk P., Mencner L., Komosinska-Vassev K. // Biomed. Res. Int. 2014. V. 2014. P. 747584.
Wall S., Sampson M., Levell N., Murphy G. // Br. J. Dermatol. 2003. V. 149 (1). P. 13.
Wan R. et al. // Wound Repair Regen. 2021. V. 29 (4). P. 573.
Hehenberger K., Heilborn J., Brismar K., Hansson A. // Wound Repair Regen. 1998. V. 6 (2). P. 135.
Loots M., Lamme E., Mekkes J. et al. // Dermatol Res. 1999. V. 291 (2–3). P. 93.
Lobmann R. et al. // Diabetologia. 2002. V. 45. P. 1011.
Assoian R., Komoriya A., Meyers C. et al. // J. Biol. Chem. 1983. V. 258. P. 7155.
Pierce G. et al. // J. Cell. Biol. 1989. V. 109. P. 429.
Harrison P., Cramer E. // Blood Rev. 1993. V. 7. P. 52.
Carter C., Jolly D., Worden C. et al. // Exp. Mol. Pathol. 2003.V. 74 (3). P. 244.
Ross R. // Ann. Rev. Med. 1987. V. 38. P. 71.
Choi Y., Fuchs E. // Cell. Regul. 1990. V. 1. P. 791.
Knighton D. et al. // Surg. Gynecol. Obstet. 1990. V. 170. P. 56.
Steinbrech D. et al. // J. Surg. Res. 1999. V. 84 (2). P. 127.
Landesberg R., Roy M., Glickman R. // J. Oral Maxillofac. Surg. 2000. V. 58. P. 297.
Dhurat R., Sukesh M. // J. Cutan. Aesthet. Surg. 2014. V. 7 (4). P. 189.
Hill D. et al. // Mol. Cancer Ther. 2015. V. 14 (11). P. 2665.
Frígols B. et al. // PloS One. 2019. V. 14. P. 1.
Rahmati M., Alipanahi Z., Mozafari M. // Curr. Pharm. Des. 2019. V. 25 (11). P. 1335.
Wróblewska-Krepsztul J., Rydzkowski T., Michalska-Pożoga I., Thakur V. // Nanomaterials. 2019. V. 9 (404). P. 2.
Rahim K. et al. // Microb. Ecol. 2017. V. 73 (3). P. 710.
Kane D. // J. Wound. Regen. 2007. V. 78. P. 123.
Tomic-Canic M., Agren M., Alvarez O. // The epidermis in wound healing. Boca Raton, FL: CRC Press, 2003. P. 25.
International Diabetes Federation. IDF Diabetes Atlas, 7th ed. 2015. IDF: Brussels, Belgium.
Alexiadou K., Doupis J. // Diabetes Ther. 2012. V. 3 (1). P. 4.
Uckay I., Gariani K., Pataky Z., Lipsky B. // Obes. Metab. 2014. V. 16. P. 305.
Guo S., Dipietro L. // J. Dent. Res. 2010. V. 89. P. 219.
Sorrell J., Caplan A. // J. Cell. Sci. 2004. V. 117. P. 667.
Sorrell J., Baber M., Caplan A. // Cell. Tissue Res. 2007. V. 327. P. 499.
Nolte S., Xu W., Rennekampff H., Rodemann H. // Cells Tissues Organs. 2008. V. 187. P. 165.
Ali-Bahar M., Bauer B., Tredget E.E., Ghahary A. // Exp. Eye Res. 2012. V. 95. P. 35.
Lee J., Ko M., Kay E. // Exp. Eye Res. 2012. V. 95. P. 35.
Tholpady S. et al. // Ann. Plast. Surg. 2005. V. 54. P. 651.
Matsumoto et al. // J. Cell. Physiol. 2008. V. 215. P. 210.
Schrimpf C., Duffield J. // Curr. Opin. Nephrol. Hypertens. 2011. V. 20. P. 297.
Piera-Velazquez S., Li Z., Jimenez S. // Am. J. Pathol 2011. V. 179. P. 1074.
Ja¨rvela¨inen H., Sainio A., Koulu M. et al. // Pharmacol. Rev. 2009. V. 61. P. 198.
Weinstein G., Boucek.R. // J. Invest. Dermatol. 1960. V. 35. P. 227.
Bainbridge P. // J. Wound Care. 2013. V. 22. P. 407.
Maione A. et al. // Wound Repair Regen. 2016. V. 24 (4). P. 630.
Falanga V. // Lancet. 2005. V. 366. P. 1736.
Blakytny R., Jude E. // Diabet. Med. 2006. V. 23. P. 594.
Brooke G. et al. // Semin. Cell. Dev. Biol. 2007. V. 18. P. 846.
Chen K. et al. // FASEB J. 2011. V. 25 (5). P. 1718.
Zhang H. et al. // Cancer Cell. 2007. V. 11. P. 407.
Semenza G. // Blood. 2009. V. 114. P. 2015.
Kaelin W., Ratclie P. // Mol. Cell. 2008. V. 30. P. 393.
Wong B., Kuchnio A., Bruning U., Carmeliet P. // Trends Biochem. Sci. 2013. V. 38. P. 3.
Lieb M. et al. // Biochem. Cell Biol. 2002. V. 80. P. 421.
Metzen E. et al. // J. Cell Sci. 2003. V. 116 (7). P. 1319.
Strowitzki M., Cummins E., Taylor C. // Cells 2019. V. 8 (5). P. 384.
Chen N. et al. // Nephrol. Dial. Transplant. 2017. V. 32. P. 1373.
Fraisl P., Aragonés J., Carmeliet P. // Nat. Rev. Drug. Discov. 2009. V. 8. P. 139.
Дополнительные материалы отсутствуют.
Инструменты
Вестник Военного инновационного технополиса «ЭРА»


