Радиационная биология. Радиоэкология, 2022, T. 62, № 6, стр. 602-614
ЦИТОТОКСИЧЕСКИЕ И ФОТОСЕНСИБИЛИЗИРУЮЩИЕ СВОЙСТВА ЭКСТРАКТОВ ИЗ ЛИШАЙНИКОВ В ОТНОШЕНИИ ЛИНИИ ОПУХОЛЕВЫХ КЛЕТОК ЧЕЛОВЕКА (MCF-7)
М. В. Матвеенков 1, *, О. М. Храмченкова 2
1 Институт радиобиологии НАН Беларуси
Гомель, Беларусь
2 Гомельский государственный университет имени Франциска Скорины
Гомель, Беларусь
* E-mail: matvey.matveenkov@mail.ru
Поступила в редакцию 21.02.2022
После доработки 17.08.2022
Принята к публикации 07.09.2022
- EDN: BNALCA
- DOI: 10.31857/S0869803122060078
Аннотация
Исследовали способность 35 экстрактов из пяти видов лишайников к коррекции жизнеспособности линии карциномы человека MCF-7. Проанализировали кривые выживаемости клеток в условиях культивирования с градиентом концентраций экстрактов. Оценивали выживаемость предварительно обработанных экстрактами клеток, при облучении в градиенте доз ультрафиолетового излучения. Выраженный цитотоксический эффект (IC50 < 30 мкг/мл) выявлен у 11 экстрактов: ацетоновый, гексановый, хлороформный, этилацетатный из вида Cladonia arbusucla; ацетоновый и гексановый из Evernia prunastri; ацетоновый и этанольный экстракт из Hypogymnia physodes; хлороформный из вида Ramalina pollinaria; хлороформный и этилацетатный из Xanthoria parietina. Показана способность экстрактов из лишайников усиливать повреждающее действие субтоксичных доз ультрафиолета вплоть до полного подавления жизнеспособности клеток. Выделена группа экстрактов, оказывающая достаточно сильный и концентрационно-зависимый фотосенсибилизирующий эффект: ацетоновые, бензольные, гексановые и этилацетатные экстракты из Hypogymnia physodes, Evernia prunastri и Ramalina pollinaria – максимальный эффект которых проявился в концентрации 10 мкг/мл. Аналогичные экстракты из Cladonia arbuscula и Xanthoria parietina оказались способны проявлять максимальное усиление повреждающего действия ультрафиолетового излучения при концентрации 2.5 мкг/мл и выше. На протяжении всего градиента доз облучения большинство экстрактов демонстрирует характерную динамику изменений фоточувствительности клеток, повышая ее уже при самых малых экспериментальных дозах облучения.
Использование экстрактов и отдельно выделенных метаболитов из лишайников является перспективным направлением в области модификации негативных эффектов избыточного воздействия ультрафиолетового (УФ) излучения на клетки кожи человека. Данное направление основывается на результатах исследования собственной устойчивости представителей лихенофлоры к избыточной инсоляции [1–3], а также на исследовании спектральных свойств и структурных особенностей ряда полифункциональных ароматических соединений (депсиды, депсидоны, дибензофураны), имеющих характерные фотопоглотительные функциональные группы [4, 5]. Последующие работы демонстрируют способность извлеченных из лишайников веществ снижать непосредственно дозы эритемного (УФ-Б) и длинноволнового (УФ-А) ультрафиолета, а также проявлять фотозащитные биологические эффекты в отношении клеток человека (антиоксидантные, антиапоптотические, противовоспалительные и т.д.) [6–8]. Несмотря на общий “фотозащитный тренд” работ, существуют немногочисленные данные, прямо или косвенно указывающие на способность некоторых вторичных метаболитов из лишайников усиливать повреждающее действие ультрафиолета в отношении клеток кожи человека [9–11].
Имея научные данные, предполагающие возможность веществ из лишайников усиливать фотоповреждение нормальных клеток человека, представляется важной количественная оценка подобных эффектов в отношении опухолевых клеток. Работы подобного рода в научной литературе до сих пор не представлены. Оценка кратности усиления токсического действия ультрафиолета экстрактами из лишайников может являться теоретическим обоснованием возможности их использования в целях управляемой коррекции жизнеспособности опухолевых клеток. In vitro скрининг позволяет получить достаточно обширное представление о фотомодифицирующем действии экстрактов, в зависимости от условий их получения и применения, что может способствовать решению задач практического использования лишайниковой биомассы.
Работа посвящена количественной оценке цитотоксических и фотомодифицирующих характеристик различных фракций веществ, выделенных из пяти распространенных видов лишайников Юго-Востока Беларуси – Cladonia arbusucla, Evernia prunastri, Hypogymnia physodes, Ramalina pollinaria, Xanthoria parietina – в отношении линии опухолевых клеток человека MCF-7.
МАТЕРИАЛЫ И МЕТОДИКА
Получение экстрактов лишайников. Биомассу лишайников Cladonia arbuscula (Wallr.) Flot., Evernia prunastri (L.) Ach., Hypogymnia physodes (L.) Nyl., Ramalina pollinaria (Westr.) Ach. и Xanthoria parietina (L.) Th. Fr. отбирали в пригородных лесах г. Гомель, на типичных для каждого вида субстратах. Талломы высушивали до воздушно-сухого состояния, измельчали. Навески измельченной биомассы экстрагировали ацетоном, бензолом, гексаном, метанолом, хлороформом, этанолом и этилацетатом в аппарате Сокслета. Растворитель удаляли с помощью ротационного испарителя. Полученные сухие экстракты хранили в сухом темном месте при температуре –18°С.
Подготовка опухолевых клеточных линий. Использовали культуру опухолевых клеток аденокарциномы молочной железы человека MCF-7. Культура клеток была получена в НИЛ проблем терморегуляции кафедры физиологии человека и животных Белорусского государственного университета. Режим культивирования стандартный: 37°C, 90% влажности воздуха с 5%-ным содержанием СО2, коэффициент субкультивирования 1/5. Состав среды: DMEM/F-12, 11039 GIBCO; 100 ед/мл пенициллин; 100 мкг/мл стрептомицин; 0.25 мкг/мл амфотерицин-В; 10% инактивированной эмбриональной телячьей сыворотки, HiCloneInc.
Инкубация клеток с экстрактами. Культуру клеток преинкубировали в 96 луночных планшетах до достижения фазы экспоненциального роста. Затем вносили в лунки планшета раствор сухого экстракта в диметилсульфоксиде (ДМСО), серийно разведенный в питательной среде, в диапазоне концентраций 200–0.78 (мкг/мл). Наивысшая концентрация ДМСО составила не более 1% от объема инкубационной среды. По прошествии 48 ч оценивали жизнеспособность клеток по методу, описанному ниже. Подробно схема инкубации описана в статье [12].
Для определения модификации фототоксических эффектов, после периода преинкубации в планшете культуру клеток пошагово экспонировали в каждом ряду лунок планшета заданное время на поверхности стеклянного УФ-фильтра системы гель-документации Chemidoc (Biorad), предварительно добавив в питательную среду растворы экстрактов лишайников в концентрациях 2.5, 5.0 и 10.0 мкг/мл. Использовали параметры и схему облучения, описанные в статье [13]. Жизнеспособность клеток определяли по методу, описанному ниже.
Жизнеспособность клеточных популяций в эксперименте определяли с помощью МТТ-теста, определяющего метаболическую активность клеток – тест на скорость восстановления 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромида (MTT, M5655, Sigma) [14].
Анализ выживаемости клеток в экспериментальных условиях проводили с помощью аппроксимации полученных зависимостей “доза–эффект” или “концентрация–эффект” уравнением Хилла с вариабельным коэффициентом наклона. Для статистической проверки гипотез о различии действия отдельных экстрактов, сравнивали параметры экспериментальных кривых выживаемости клеток сопоставлением регрессионных моделей на вложенность методом F-теста [15]. Анализ результатов исследования производили с помощью программных продуктов Graph Pad Prism (Version 8.01) и Microsoft Excel.
РЕЗУЛЬТАТЫ
Оценивали способность 35 экстрактов, полученных из пяти различных видов лишайников, подавлять жизнеспособность опухолевой линии клеток эпителиального происхождения MCF-7. Для этого строили кривые выживаемости клеток и оценивали ее аналитический параметр – концентрацию половинного ингибирования жизнеспособности клеток (IC50, мкг/мл). Для выявления диапазона эффекта, на основании кривой выживаемости, также определяли суб- и летальные концентрации (IC10 и IC90 соответственно). Наблюдаются определенные различия в цитотоксическом эффекте экстрактов, полученных с использованием различных типов растворителей внутри одного вида. Для экстрактов из вида Cladonia arbuscula можно составить следующий ряд убывания цитотоксичности: ацетон > хлороформ > этилацетат > гексан > метанол > бензол > > этанол. Для вида Evernia prunastri: ацетон > гексан > хлороформ > бензол > этилацетат > этанол > > метанол. Для вида Hypogymnia physodes: ацетон > > этанол > хлороформ > гексан > этилацетат > > бензол > метанол. Для вида Ramalina pollinaria: хлороформ > бензол > гексан > этилацетат > ацетон > этанол > метанол. Для вида Xanthoria parietina: хлороформ > этилацетат > бензол > гексан > > этанол > метанол (табл. 1).
Таблица 1.
Различные аналитические величины цитотоксического эффекта экстрактов из лишайников в линии MCF-7, оцененные с помощью МТТ-теста после 48 ч инкубации Table 1. Various analytical values of the cytotoxic effect of lichen extracts in the MCF-7 line, assessed using the MTT test after 48 hours of incubation
| Экстракты | IC10, мкг/мл | IC50, мкг/мл | IC90, мкг/мл | |
|---|---|---|---|---|
| Cladonia arbuscula | ацетон | <1 | 4.18 ± 0.46 | 5.89 |
| бензол | <1 | 54.35 ± 7.28 | 155.30 | |
| гексан | 7.24 | 24.46 ± 1.57 | 79.47 | |
| метанол | 6.89 | 46.92 ± 8.20 | >200 | |
| хлороформ | 1.66 | 9.50 ± 0.63 | >200 | |
| этанол | <1 | 59.67 ± 12.45 | 45.04 | |
| этилацетат | 2.75 | 14.81 ± 1.11 | >200 | |
| Evernia prunastri | ацетон | <1 | 5.62 ± 1.08 | 11.71 |
| бензол | <1 | 51.36 ± 3.73 | 93.74 | |
| гексан | 14.26 | 29.71 ± 1.97 | 59.88 | |
| метанол | 25.39 | 102.40 ± 46.99 | >200 | |
| хлороформ | 7.2 | 45.07 ± 8.97 | 92.34 | |
| этанол | <1 | 64.13 ± 8.23 | >200 | |
| этилацетат | 22.86 | 57.72 ± 4.80 | 87.68 | |
| Hypogimnia physodes | ацетон | 1.97 | 4.08 ± 0.79 | 5.67 |
| бензол | <1 | 37.55 ± 3.73 | 99.20 | |
| гексан | 17.47 | 35.08 ± 2.66 | 68.36 | |
| метанол | 33.79 | 70.84 ± 4.40 | 136.3 | |
| хлороформ | 9.09 | 32.77 ± 3.55 | 121.00 | |
| этанол | 4.67 | 7.07 ± 0.34 | 8.37 | |
| этилацетат | 9.02 | 36.60 ± 3.53 | 150.30 | |
| Ramalina pollinaria | ацетон | 21.89 | 49.92 ± 4.15 | 77.14 |
| бензол | 1.12 | 34.19 ± 3.433 | 91.47 | |
| гексан | 17.29 | 37.64 ± 2.72 | 79.78 | |
| метанол | 36.01 | 71.97 ± 8.44 | 136.40 | |
| хлороформ | <1 | 10.40 ± 1.096 | 29.85 | |
| этанол | 11.44 | 58.46 ± 6.48 | 156.20 | |
| этилацетат | <1 | 45.96 ± 8.041 | 117.10 | |
| Xanthoria parietina | ацетон | 49.04 | 102.20 ± 9.35 | >200 |
| бензол | 5.31 | 30.66 ± 4.62 | >200 | |
| гексан | 22.58 | 69.95 ± 8.44 | >200 | |
| метанол | 19.41 | 108.60 ± 26.29 | >200 | |
| хлороформ | <1 | 14.21 ± 2.96 | 80.79 | |
| этанол | 23.85 | 81.98 ± 9.95 | >200 | |
| этилацетат | <1 | 20.05 ± 2.96 | 55.67 | |
Сравнение IC50 экстрактов с критериальным значением (IC50 < 30 мкг/мл), рекомендованным Национальным институтом рака США (NCI) [16], позволило разделить экстракты на токсичные и нетоксичные. К токсичным относятся следующие экстракты: ацетоновый, гексановый, хлороформный, этилацетатный из вида Cladonia arbusucla; ацетоновый и гексановый из Evernia prunastri; ацетоновый и этанольный экстракт из Hypogymnia physodes; хлороформный из вида Ramalina pollinaria; хлороформный и этилацетатный из Xanthoria parietina (табл. 1).
Определение показателя 10%-ного ингибирования клеток позволило выделить следующие извлечения, как наиболее активные: все экстракты из Cladonia arbuscula; ацетоновый, бензольный, хлороформный и этанольный из Evernia prunastri; ацетоновый, бензольный и этанольный из Hypogymnia physodes; бензольный, хлороформный и этилацетатный из Ramalina pollinaria и Xanthoria parietina. Примечательно наличие цитотоксической активности при внесении в питательную среду низких концентраций следующих экстрактов: бензольного, метанольного и этанольного из Cladonia arbuscula; а также хлороформного из Evernia prunastri – так как в целом они не проявляют выраженного токсического эффекта.
Анализировали эффективность экстрактов в подавлении 90%-ной жизнеспособности опухолевых клеток. Ацетоновые экстракты из Cladonia arbuscula, Evernia prunastri, Hypogymnia physodes, а также этанольный из Hypogymnia physodes проявили хорошие цитотоксические свойства, демонстрируя полу- и летальные эффекты при узком и сравнительно небольшом диапазоне концентраций. Некоторые экстракты, будучи высокотоксичными по формальному критерию, подавляли 90% жизнеспособности клеток при сравнительно высоких концентрациях: хлороформный и этилацетатный из Hypogymnia physodes. Выделен ряд экстрактов, не способных оказывать данного эффекта в пределах используемого диапазона концентраций: метанольный, хлороформный и этилацетатный из Cladonia arbuscula; метанольный и этанольный из Evernia prunastri; все кроме хлороформного и этилацетатного из Xanthoria parietina (табл. 1).
Подбор фотомодифицирующих концентраций экстрактов исходил из задачи выбрать диапазон с отсутствующим собственно токсическим эффектом – до 10% ингибирования. Полученные данные демонстрируют большую вариабельность такого диапазона для большинства экстрактов (табл. 1). Были выбраны следующие концентрации – 2.5, 5 и 10 мкг/мл – по критерию отсутствия выраженных токсических свойств в большинстве случаев.
Для оценки фотомодифицирующего действия веществ из лишайников культуры клеток облучали градиентом доз УФ-излучения в присутствии экстрактов выбранных концентраций, после чего на основании аппроксимации кривых “доза–эффект” определяли величину ID50. Для построения контрольных кривых выживаемости использовались аналогичные дозы УФ без внесения экстрактов в питательную среду. Для определения вклада антиоксидантной и прооксидантной активности экстрактов лишайников в их модифицирующее действие использовалось построение аналогичных зависимостей, с предварительным внесением классического модельного антиоксиданта Тролокс и фотосенсибилизатора Эозин Б. Полученные полуэффективные дозы в дальнейшем служили для определения фактора фотосенсибилизации (ФФ):
Некоторые экстракты проявили способность усиливать токсическое действие даже самых малых доз УФ в эксперименте, вплоть до гибели всех клеток в лунке. В данном случае сложно оценить реальную полулетальную дозу излучения для опытной группы, поэтому ее принимали за теоретически минимальную – 0.0232 мДж/см2.
Анализ полученной величины позволил количественно определить их фотосенсибилизирующие свойства (рис. 1).
Рис. 1.
Величины фотосенсибилизирующего фактора экстрактов из лишайников в отношении линии карциномы человека MCF-7. Знаком (*) отмечены величины факторов, полученные при соотнесении достоверно различающегося параметра (ID50) контрольной и опытной кривых выживаемости клеток при p < 0.05. Линиями соединены величины факторов, достоверно различающихся по аналогичному критерию и полученные при изменении концентрации экстракта.
Fig. 1. The values of the photosensitizing factor of lichen extracts in relation to the human carcinoma line MCF-7. The sign (*) marks the values of the factors obtained by correlating significantly different parameters of the control and experimental cell survival curves at p <0.05. The values of factors that differ significantly according to a similar criterion and obtained by changing the concentration of the extract, connected by lines.
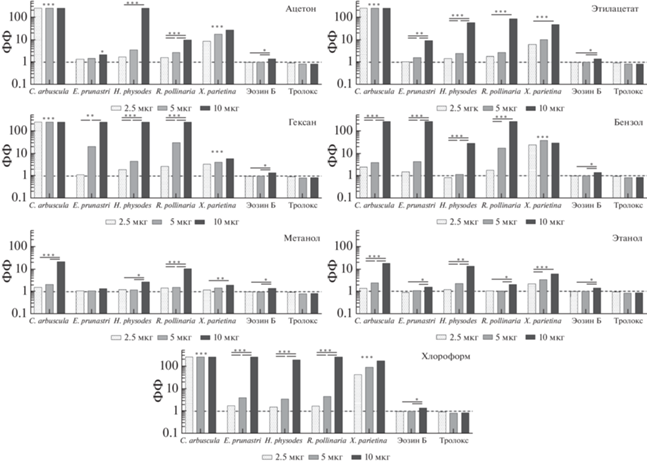
Наиболее слабым сенсибилизирующим действием обладали экстракты, выделенные из биомассы лишайника при помощи метанола и этанола. В концентрации 2.5 мкг/мл ряд извлечений данной группы: метанольные из Evernia prunastri, Hypogymnia physodes и Xanthoria parietina, а также этанольные из Evernia prunastri и Ramalina pollinaria – не способны оказывать какого-либо достоверного эффекта, либо же проявляют сравнительно слабый эффект: ФФ = 1.35–2.24 – у метанольных из Ramalina pollinaria и Cladonia arbuscula, а также этанольных из Cladonia arbuscula и Xanthoria parietina. Двух- и четырехкратное увеличение концентрации экстрактов позволяет выявить усиление их фотосенсибилизационных свойств. Минимальный эффект у метанольного экстракта из Ramalina pollinaria в концентрации 5 мкг/мл (ФФ = 1.56), максимальный – у метанольного из Cladonia arbuscula в концентрации 10 мкг/мл (ФФ = 22.31).
Наиболее выраженным усилением фоточувствительности клеток обладала следующая группа экстрактов: ацетоновые, этилацетатные, гексановые, бензольные и хлороформные , выделенные из пяти исследуемых видов лишайников. Для экстрактов, выделенных из видов Evernia prunastri, Hypogymnia physodes, Ramalina pollinaria, характерно концентрационно-зависимое увеличение их фотосенсибилизирующих свойств. В концентрации 2.5 мкг/мл наблюдается слабый фотозащитный эффект (ФФ = 0.82 у бензольного экстракта из Hypogymnia physodes), либо усиление действия УФ в 2.83 раза – гексановый из Ramalina pollinaria. В концентрации 5 мкг/мл экстракты усиливают летальное действие излучения вплоть до 31.17 раза – гексановый из Ramalina pollinaria. Дальнейшее увеличение концентрации перечисленных экстрактов способствует усилению повреждающих свойств УФ-излучения от 2.15 (ацетоновый из Evernia prunastri) до 254.31 раза (гексановый и ацетоновый из Hypogymnia physodes; гексановые, бензольные и хлороформные из Evernia prunastri и Ramalina pollinaria). Исключением являются экстракты из Cladonia arbuscula и Xanthoria parietina. Первые способны, независимо от концентрации, полностью подавлять жизнеспособность клеток при их облучении в самых малых дозах УФ-излучения (усиление эффекта в 254.31 раза). Экстракты из Xanthoria parietina обладают менее выраженными, но достаточно сильными фотосенсибилизирующими свойствами, усиливая действие УФ-излучения на клетки в 3.5–172.5 раза, при этом наблюдаемый эффект также не зависит от применяемых концентраций.
Таким образом, все исследуемые извлечения в той или иной мере продемонстрировали способность усиливать повреждающее действие УФ в отношении эпидермоидной опухолевой культуры MCF-7. Полученные эффекты почти всегда количественно превышают эффект модельного фотосенсибилизатора – Эозина Б. Внесение Тролокса, в качестве модельного антиоксиданта, не оказало никакого значимого или достоверного эффекта на изучаемую культуру.
Фотосенсибилизирующее воздействие предлучевой обработки клеток экстрактами в концентрации (2.5, 5.0 и 10.0 мкг/мл) не одинаково на протяжении всего диапазона экспериментальных доз излучения.
Применение ацетоновых, бензольных, гексановых, этилацетатных и хлороформных экстрактов пяти изучаемых видов лишайников демонстрирует схожую динамику усиления повреждающего действия УФ-излучения. В концентрации 2.5 мкг/мл данная группа извлечений характеризуется небольшим снижением жизнеспособности клеток уже при самых малых экспериментальных дозах облучения, с дальнейшим переходом в экспоненциальную фазу их ингибирования. Экстракты как бы “сокращают” субтоксичную фазу низких доз УФ: от 0.464 до 2 мДж/см2. Исключением является действие этилацетатного экстракта из Evernia prunastri и гексанового из Hypogymnia physodes. Последний характеризуется небольшим фотозащитным действием в отношении клеток на протяжении всего градиента доз облучения. Стоит отметить характерный для данной группы экстрактов слабый фотопротекторный эффект в области высоких доз УФ от 10 до 200 мДж/см2 (рис. 2–4).
Рис. 2.
Динамика фотосенсибилизирующих свойств ацетоновых и этилацетатных экстрактов из лишайников в широком диапазоне доз УФ.
Fig. 2. Dynamics of photosensitizing properties of acetone and ethyl acetate extracts from lichens in a wide range of UV.
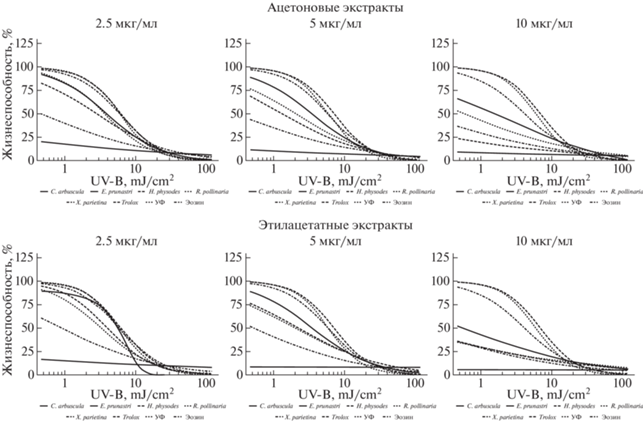
Рис. 3.
Динамика фотосенсибилизирующих свойств гексановых и бензольных экстрактов из лишайников в широком диапазоне доз УФ.
Fig. 3. Dynamics of photosensitizing properties of hexane and benzene extracts from lichens in a wide range of UV doses.
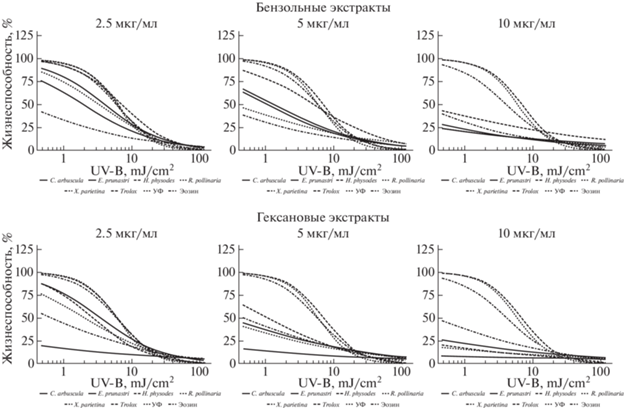
Рис. 4.
Динамика фотосенсибилизирующих свойств хлороформных экстрактов из лишайников в широком диапазоне доз УФ.
Fig. 4. Dynamics of photosensitizing properties of chloroform extracts from lichens in a wide range of UV doses.
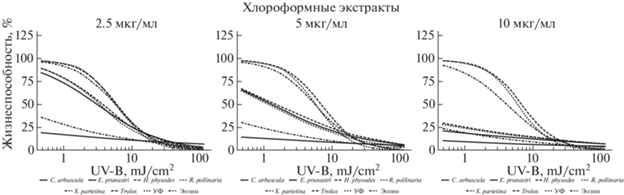
Дальнейшее двух- и четырехкратное увеличение концентрации экстракта в питательной среде снижает значение жизнеспособности клеток уже в самой маленькой дозе облучения, а последующая экспонента ингибирования имеет более крутой наклон – клетки раньше испытывают летальное воздействие излучения (рис. 2–4).
Экстракты из Cladonia arbuscula и Xanthoria parietina проявляют максимально фотосенсибилизирующий эффект в концентрации 2.5 мкг/мл. Дальнейшее ее увеличение существенным образом не меняет динамику воздействия УФ на клетки (рис. 2–4).
Метанольные и этанольные экстракты не проявляют какой-либо видимой модификации в концентрации 2.5 мкг/мл, исключение составляют лишь этанольные экстракты из Hypogymnia physodes, Cladonia arbuscula и Xanthoria parietina. Увеличение концентрации до 5 мкг/мл приводит к сокращению субтоксичной фазы в случае этанольных экстрактов из Evernia prunastri и Ramalina pollinaria, а также увеличению фотосенсибилизирующей активности в области малых экспериментальных доз у веществ из видов: Cladonia arbuscula, Xanthoria parietina и Ramalina pollinaria – в случае метанольных экстрактов. Дальнейшее увеличение концентрации до 10 мкг/мл обусловливает усиление фотосенсибилизирующей активности экстрактов в области малых доз излучения (клетки сразу переходят в фазу экспоненциального ингибирования), как и в случае уже ранее описанных извлечений (рис. 5).
Рис. 5.
Динамика фотосенсибилизирующих свойств метанольных и этанольных экстрактов из лишайников в широком диапазоне доз УФ.
Fig. 5. Dynamics of photosensitizing properties of methanol and ethanol extracts from lichens in a wide range of UV doses.
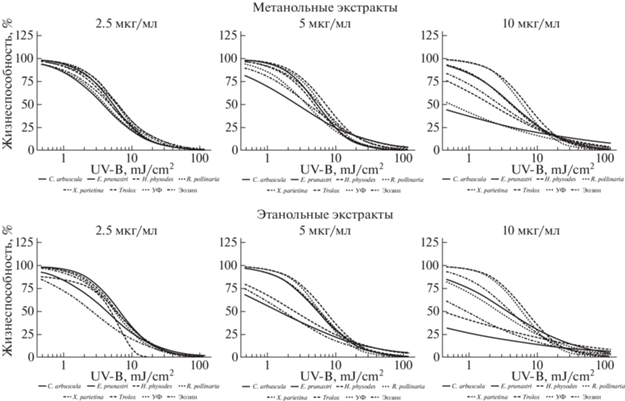
Наблюдаются количественные различия в фотосенсибилизирующей активности экстрактов, извлеченных из одного вида лишайника различными растворителями.
В концентрации 10 мкг/мл различается действие ацетоновых и этилацетатных экстрактов. Для первых характерно наличие следующего ряда убывания их активности: Evernia prunastri > Ramalina pollinaria > Xanthoria parietina > Hypogymnia physodes > Cladonia arbuscula. Напротив, этилацетатные экстракты из Evernia prunastri, Ramalina pollinaria, Hypogymnia physodes и Xanthoria parietina в той же концентрации имеют практически одинаковую активность (рис. 2). В случае извлечения веществ из лишайника Hypogymnia physodes гексаном наблюдается усиливающийся от концентрации фотосенсибилизирующий эффект, в случае с бензолом – слабый фотозащитный эффект при концентрации 2.5 мкг/мл, переходящий в фотосенсибилизацию по мере увеличения концентрации экстракта (рис. 3). Касательно извлечений из других видов лишайников – можно сказать о выраженной однородности фотосенсибилизирующего действия бензольных экстрактов, в сравнении с гексановыми. Хлороформные экстракты демонстрируют примерно схожую активность при получении их из разных видов лишайников и внесении разных концентраций (рис. 4). Интересно отсутствие сенсибилизирующих эффектов у этанольного экстракта из Hypogymnia physodes в дозах облучения до 3 мДж/см2, и появление их в области высоких доз. Это же касается и фотозащитной активности метанольного экстракта того же вида. Действие метанольного экстракта из Evernia prunastri в концентрации 10 мкг/мл почти идентично таковому у модельного вещества – Эозина Б, из чего может следовать одинаковость механизма их результирующего действия (рис. 5).
Таким образом, анализ динамики сенсибилизирующей активности экстрактов показал характерный паттерн действия всех исследованных субстанций – высокая активность в области низких доз излучения, переходящая в фазу экспоненциального ингибирования клеток, вплоть до 10 мДж/см2, за которым следует очень слабый защитный эффект. Варьирование применяемых концентраций экстрактов количественно модифицирует начало фазы снижения жизнеспособности. Применяемые для получения растворители также меняют количественные различия в фотосенсибилизирующей активности веществ. В каких-то случаях получается гетерогенный набор субстанций с четко выраженным убыванием активности, например, ацетоновые экстракты. В других – извлеченные вещества из различных лишайников ведут себя практически одинаково, например, в случае хлороформных экстрактов.
ОБСУЖДЕНИЕ
Описание цитотоксического эффекта экстрактов позволяет сделать заключение о его неоднородности как в случае извлечения веществ из различных видов лишайника, так и в случае применения различных типов растворителей в пределах одного вида. Подобного рода различия описаны в литературе, для активностей веществ из родственных видов лихенобиоты, в отношении аналогичной взятой к исследованию и другим типам культур клеток [17–19]. Описанные различия могут объясняться разным химическим составом экстрактов, так как используемые для их получения растворители имеют различную химическую природу (полярные протонные и апротонные, неполярные).
Также известно определенное сродство идентифицированных лишайниковых метаболитов к растворителям различной природы [2, 4]. У принятых к исследованию видов наиболее активными являются вещества, излеченные неполярными (хлороформ, бензол, гексан) или полярными апротонными (ацетон, этилацетат) растворителями. Наименьшую активность проявляют вещества, имеющие сродство к полярными протонным растворителям (этанол, метанол). Более того, принимая во внимание гетерогенность качественного и количественного химического состава извлечений из биомассы лишайников, можно предположить изменение их соотношения по мере разведения экстракта в питательной среде. В области малых концентраций будут присутствовать лишь основные компоненты экстракта, а при повышении его концентрации – вероятно появление минорных компонентов. Данные соображения могут подкрепляться наличием большой разницы между концентрациями 10, 50 и 90% ингибирования жизнеспособности экстрактами: бензольным, метанольным и этанольным из Cladonia arbuscula, хлороформными из Evernia prunastri и Hypogymnia physodes, а также этилацетатным из Hypogymnia physodes – вероятно, связанное с особенностями взаимодействия комплекса веществ в результирующем биологическом эффекте.
Для лишайников характерно наличие специфических для определенного вида вторичных метаболитов или их наборов. В научной литературе существуют работы, описывающие цитотоксическую активность основных компонентов лишайников и механизмы реализации данных эффектов, в отношении определенных культур опухолевых клеток. Так, охарактеризованы цитотоксические свойства усниновой кислоты, являющейся основным метаболитом видов Evernia prunastri, Hypogymnia physodes и Ramalina pollinaria. Данное соединение способно подавлять жизнеспособность различных культур злокачественных опухолей человека: FemX (меланома), LS174 (карцинома толстой кишки), A2780 (карцинома яичника), MCF-7 (аденокарциномы молочной железы), HT-29 (аденокарцинома кишечника), HL-60 (промиелоцитарный лейкоз), Jukart (лимфоцитарная лейкемия), A-549 (карцинома легкого), DU145 (карцинома простаты), K-562 (миелогенный лейкоз), U-251 (глиобластома) – IC50 = 17.4–199.2 мкМ [20–25]. Описан ее цитостатический эффект, реализующийся посредством накопления клеток в G2/M-фазе [20], или, по другим данным, в S-фазе [21]. Данные эффекты теоретически подтверждаются установленными для усниновой кислоты механизмами модификации циклинов и ингибирования циклин-зависимых киназ [22]. При высоких концентрациях действие усниновой кислоты на клетки может носить прямой цитотоксический характер [23, 24]. Исследована связь ее цитотоксических свойств с повышением уровня экспрессии в клетках проапоптотического белка BAX и регуляторных белков p53, p38; снижением уровня антиапоптотического белка BCL2; увеличением деполяризации митохондриальной мембраны [25].
Цитотоксическое действие в отношении культур FemX (меланома человека), LS174 (карцинома толстой кишки человека) установлено для атранорина, эверновой, физодовой и фумарпротоцетраровой кислот, являющимися основными компонентами видов Evernia prunastri и Hypogymnia physodes. Данные соединения способны подавлять жизнеспособность опухолевых культур на 50% при концентрациях от 55 до 121 мкмоль/л. Авторы также показывают появление клеток в суб-G1 фазе клеточного цикла, при инкубировании их с полулетальными концентрациям упомянутых веществ, что может говорить об их проапоптотических свойствах [26, 27]. Особый интерес представляет известный на данный момент набор метаболитов лишайника Hypogymnia physodes [27], цитотоксическое воздействие которого на клетки HCT-116 (карцинома толстой кишки человека) характеризуется проявлением существенной доли некротических клеток (до 32%) [28]. Отчасти это может объясняться мембранотропным эффектом атранорина и физодовой кислоты в отношении клеток A375 (меланома человека) [29]. Основной метаболит Xanthoria parietina париетин не проявил выраженных цитотоксических или цитостатических свойств [21, 25]. По-видимому, характер воздействия набора вторичных метаболитов данного вида специфичен для исследуемой культуры.
Антиопухолевые свойства вторичных метаболитов из лишайников не исчерпываются данными скрининга in vitro. Существуют работы, показывающие профилактическое действие экстракта из Usnea longissima в отношении вызванных экспериментально аденокарцином в тканях пищевода и желудка крыс [30]. Выделенная из того же вида дифрактоевая кислота способна индуцировать гибель асцитной карционмы Эрлиха у мышей [31]. Норстиктовая кислота из Usnea strigosa подавляла рост опухоли в модели самок бестимусных голых мышей с раком молочной железы [32]. Известна противоопухолевая активность усниновой кислоты и ее производных (а также атранорина) в модели ксенотрансплантированных опухолей человека (Bcap-37, MCF-7, H22, BGC823, 4T1) бестимусным голым мышам [33–38].
Данные по фотосенсибилизирующей активности демонстрируют как общие закономерности в фотомодифицирующем эффекте экстрактов, так и присущие некоторым субстанциям отличия. Общим для всех экстрактов является наличие у них почти исключительно фотосенсибилизирующего эффекта. Ранее нами были проведены аналогичные исследования на линии стабильных кератиноцитов человека, где такие же извлечения в аналогичных условиях проявляли способность как усиливать, так и снижать токсическое действие ультрафиолета. Были выявлены фотозащитные эффекты обработки кератиноцитов экстрактами: этанольным из Cladonia arbusucla, этанольным и ацетоновым из Ramalina pollinaria, а также с метанольными из видов Evernia prunastri, Hypogymnia physodes, Ramalina pollinaria и Xanthoria parietina. Фотосенсибилизирующей активностью обладали экстракты: бензольные и хлороформные из Cladonia arbusucla, Evernia prunastri, Hypogymnia physodes; бензольные и этилацетатные из Evernia prunastri и Cladonia arbusucla; гексановый из Cladonia arbusucla; этанольный из Hypogymnia physodes; а также все из Xanthoria parietina, кроме метанольного. Также была выявлена группа экстрактов модификаторов облучения: ацетоновый из Cladonia arbusucla, гексановый из Evernia prunastri, бензольный и гексановый из Hypogymnia physodes, хлороформный из Ramalina pollinaria, изменяющих свои свойства с протекторных на сенсибилизационные по мере увеличения используемой концентрации [13, 39–42].
Данный феномен очень интересен сам по себе, и в особой степени интересен в контексте современных представлений о способности ряда соединений, в том числе характерных для лишайников фенолов и их производных с пара- и ортопозицией гидроксильных групп, проявлять хемосенсибилизирующие свойства посредством модуляции редокс-сигнальной системы Keap1/Nrf2/ARE [43]. Регуляция данной системы имеет четко выраженную концентрационную зависимость и опухолеспецифичность. Иначе говоря, концентрации электрофильных антиоксидантов, способные вызывать прямой или опосредованный цитопротекторный эффект в нормальных клетках, будут вызывать обратно противоположные эффекты в клетках злокачественно перерожденных. Также в пользу данной гипотезы говорит характерное для большинства экстрактов воздействие на нормальные клетки: фотосенсибилизирующие свойства в концентрации 10 мкг/мл и фотопротекторные – в более низких, в то время как опухолевые клетки зачастую испытывают сенсибилизирующее воздействие уже при использовании низких концентраций экстракта.
Количественные различия в фотосенсибилизирующем действии различных экстрактов и применяемых концентраций также могут быть объяснены разностью качественного и химического состава применяемых субстанций. Концентрационно-зависимые изменения зачастую носят характер усиления повреждающего клетки действия УФ-излучения. Примечательно наличие аналогичной с цитотоксическим действием тенденции к усилению фотосенсибилизации у экстрактов, полученных растворителями неполярной или полярной апротонной природы. Принимая во внимание факт применения субтоксичных концентраций, можно предположить некого рода “активацию” цитотоксических свойств нетоксичных веществ, выделенных подобного рода растворителями.
Таким образом, экстракты способны снижать жизнеспособность злокачественных клеток как посредством собственной цитотоксичности веществ, входящих в их состав, так и посредством усиления повреждающего действия УФ-излучения. Полученные данные интересны с точки зрения практической возможности использования талломов лишайников в качестве биоресурса веществ с противоопухолевой активностью. Выявленные эффекты соотносятся с современными представлениями о механизмах и способах снижения жизнеспособности злокачественных клеток.
ЗАКЛЮЧЕНИЕ
Показана способность экстрактов из распространенных видов лишайников Беларуси проявлять цитотоксическую активность в отношении линии опухолевых клеток MCF-7. По общепринятым критериям (IC50 < 30 мкг/мл), к цитотоксичным можно отнести ацетоновый, гексановый, хлороформный, этилацетатный из вида Cladonia arbusucla; ацетоновый и гексановый из Evernia prunastri; ацетоновый и этанольный экстракт из Hypogymnia physodes; хлороформный из вида Ramalina pollinaria; хлороформный и этилацетатный из Xanthoria parietina.
Все принятые к исследованию экстракты продемонстрировали разную фотосенсибилизирующую активность в отношении линии карциномы человека. Наиболее сильную сенсибилизирующую активность проявила группа экстрактов: ацетоновые, этилацетатные, гексановые, бензольные и хлороформные – выделенные из пяти исследуемых видов лишайников, способные уменьшать полулетальную дозу УФ в 2.83–254.31 раза. Из них у экстрактов видов Ramalina pollinaria, Hypogymnia physodes и Evernia prunastri – выраженное концентрационно-зависимое увеличение фотосенсибилизирующей активности. У экстрактов из видов Cladonia arbuscula и Xanthoria parietina максимальный фотосенсибилизирующий эффект проявляется при концентрации 2.5 мкг/мл и достоверно не изменяется при ее увеличении. Метанольные и этанольные экстракты проявили более слабую активность, усиливая воздействие излучения на клетки до 22.31 раза. Почти все экстракты демонстрируют схожую активность на протяжении градиента доз, начиная усиливать действие УФ при самых низких экспериментальных дозах излучения.
Список литературы
Solhaug K.A., Gauslaa Y., Nybakken L. et al. UV-induction of sun-screening pigments in lichens // New Phytologist. 2003. V. 158. № 1. P. 91–100. https://doi.org/10.1046/j.1469-8137.2003.00708.x
Elix J.A. A catalogue of standardized chromatographic data and biosynthetic relationships for lichen substances. Canberra: The Author, 2014. 323 p.
Rubio C., Fernández E. Effects of solar UV-B radiation in the accumulation of rhizocarpic acid in a lichen species from alpine zones of Chile // Boletín de la Sociedad Chilena de Química. 2002. V. 47. № 1. P. 67–72. https://doi.org/10.4067/S0366-16442002000100012
Huneck S., Yoshimura I. Identification of lichen substances. Berlin; Heidelberg: Springer, 1996. 493 p.
Nguyen K.H., Chollet-Krugler M., Gouault N. UV-protectant metabolites from lichens and their symbiotic partners // Nat. Prod. Rep. 2013. V. 30. № 12. P. 1490–1508. https://doi.org/10.1039/C3NP70064J
Radice M., Manfredini S., Ziosi P. Herbal extracts, lichens and biomolecules as natural photo-protection alternatives to synthetic UV filters. A systematic review // Fitoterapia. 2016. V. 114. P. 144–162. https://doi.org/10.1016/j.fitote.2016.09.003
Rancan F., Rosan S., Boehm K., Protection against UVB irradiation by natural filters extracted from lichens // J. Photochemistry and Photobiology. 2002. Vol. 68 (2–3). P. 133–139. https://doi.org/10.1016/S1011-1344(02)00362-7
Ranković B. Lichen secondary metabolites: bioactive properties and pharmaceutical potential. New York, Cham: Springer International Publishing, 2015. 202 p.
Rojas J.L., Díaz-Santos M., Valencia-Islas N.A. Metabo-lites with antioxidant and photo-protective properties from Usnea roccellina Motyka, a lichen from Colombian Andes // Pharm. Biosci. J. 2015. P. 18–26. https://doi.org/10.20510/ukjpb/3/i4/89454
Boehm F., Clarke K., Edge R. Lichens Photophysical studies of potential new sunscreens // J. Photochem. Photobiol. B: Biology. 2009. V. 95. № 1. P. 40–45. https://doi.org/10.1016/j.jphotobiol.2008.12.008
Varol M., Tay T., Candan M. Evaluation of the sunscreen lichen substances usnic acid and atranorin // Biocell. 2015. V. 39. № 1. P. 25–31.
Храмченкова О.М., Матвеенков М.В. Цитотоксическая активность экстрактов из четырех видов лишайников в отношении культур опухолевых клеток // Журн. Белорусского гос. ун-та. Экология. 2018. № 2. С. 88–98. [Khramchenkova O.M., Matveyenkau M.V. Tsitotoksicheskaya aktivnost’ ekstraktov chetyrekh vidov lishaynikov v otnoshenii kul’tur opukholevykh kletok // Zhurnal Belorusskogo gosudarstvennogo universiteta. Ekologiya. 2018. № 2. P. 88–98. (In Russ.)]
Храмченкова О.М., Матвеенков М.В. Фотозащитная активность экстрактов из пяти видов лишайников в отношении кератиноцитов человека (HaCАT) // Журн. Белорусского гос. ун-та. Экология. 2018. № 4. С. 52–62. [Khramchenkova O.M., Matveyenkau M.V. Fotozashchitnaya aktivnost’ ekstraktov pyati vidov lishaynikov v otnoshenii keratinotsitov cheloveka (HaCAT) // Zhurnal Belorusskogo gosudarstvennogo universiteta. Ekologiya. 2018. № 4. P. 52–62. (In Russ.)]
Meerloo J.V., Kaspers G.J., Cloos J. Cell sensitivity assays: the MTT assay // Cancer Cell Culture. Methods in Molecular Biology (Methods and Protocols) / Ed. I. Cree. Totowa, 2011. Ch. 20. P. 237–245. https://doi.org/10.1007/978-1-61779-080-5_20
Motulsky H. Fitting models to biological data using linear and nonlinear regression: a practical guide to curve fitting. Christopoulos Oxford University Press, 2004. 351 p.
Mitrović T., Stamenković S., Cvetković V. Antioxidant, antimicrobial and antiproliferative activities of five lichen species // Int. J. Mol. Sci. 2011. V. 12. № 8. P. 5428–5448. https://doi.org/10.3390/ijms12085428
Bézivin C., Tomasi S., Lohézic-Le Dévéhat F., Boustie J. Cytotoxic activity of some lichen extracts on murine and human cancer cell lines // Phytomedicine. 2003. V. 10. № 6–7. P. 499–503. https://doi.org/10.1078/094471103322331458
Studzińska-Sroka E., Piotrowska H., Kucińska M. Cytotoxic activity of physodic acid and acetone extract from Hypogymnia physodes against breast cancer cell lines // Pharmaceut. Biol. 2016. V. 54. № 11. P. 2480–2485. https://doi.org/10.3109/13880209.2016.1160936
Stanojković T. Investigations of lichen secondary metabolites with potential anticancer activity // Lichen secondary metabolites: bioactive properties and pharmaceutical potential / Ed. B. Ranković. Heidelberg; New York; London: Springer, 2015; P. 127–146.
Manojlović N., Ranković B., Kosanić M. Chemical composition of three Parmelia lichens and antioxidant, antimicrobial and cytotoxic activities of some their major metabolites // Phytomedicine. 2012. V. 19. № 13. P. 1166–1172. https://doi.org/10.1016/j.phymed.2012.07.012
Bačkorová M., Bačkor M., Mikeš J. Variable responses of different human cancer cells to the lichen compounds parietin, atranorin, usnic acid and gyrophoric acid // Toxicology in Vitro. 2011. V. 25 № 1. P. 37–44. https://doi.org/10.1016/j.tiv.2010.09.004
Singh N., Nambiar D., Kale R.K. Usnic acid inhibits growth and induces cell cycle arrest and apoptosis in human lung carcinoma A549 cells // Nutrition and Cancer. 2013. V. № 65. P. 36–43. https://doi.org/10.1080/01635581.2013.785007
Bézivin C., Tomasi S., Rouaud I. Cytotoxic activity of compounds from the lichen: Cladonia convolute // Planta Medica. 2004. № 70. P. 874–877. https://doi.org/10.1055/s-2004-827240
Zugic A., Jeremic I., Isakovic A. Evaluation of anticancer and antioxidant activity of a commercially available CO2 supercritical extract of old man’s beard (Usnea barbata) // PLoS One. 2016. V. 11. E. 0146342. https://doi.org/10.1371/journal.pone.0146342
Bačkorová M., Jendželovský R., Kello M. Lichen secondary metabolites are responsible for induction of apoptosis in HT-29 and A2780 human cancer cell lines // Toxicology in Vitro. 2012. V. 26. № 3. 462–468. https://doi.org/10.1016/j.tiv.2012.01.017
Kosanić M., Ranković B., Stanojković T. Cladonia lichens and their major metabolites as possible natural antioxidant, antimicrobial and anticancer agents // LWT-Food Science and Technology. 2014. V. 59. № 1. P. 518–525. https://doi.org/10.1016/j.lwt.2014.04.047
Kosanić M., Manojlović N., Janković S. Evernia prunastri and Pseudoevernia furfuraceae lichens and their major metabolites as antioxidant, antimicrobial and anticancer agents // Food and Chemical Toxicology. 2013. V. 53. P. 112–118. https://doi.org/10.1016/j.fct.2012.11.034
Mitrović T., Stamenković S., Cvetković V. Antioxidant, antimicrobial and antiproliferative activities of five lichen species // Int. J. Mol. Sci. 2011. V. 12 № 8. P. 5428–5448. https://doi.org/10.3390/ijms12085428
Cardile V., Graziano A.C.E., Avola R. Potential anticancer activity of lichen secondary metabolite physodic acid // Chem.-Biol. Interact. 2017. V. 263 P. 36–45. https://doi.org/10.1016/j.cbi.2016.12.007
Mammadov R., Suleyman B., Altuner D. Effect of ethyl acetate extract of usnea longissima on esophagogastric adenocarcinoma in rats //Acta Cir Bras. 2019. V. 34. № 3. P. e201900305. https://doi.org/10.1590/s0102-865020190030000005
Karagoz I., Ozaslan M., Guler I. In vivo antitumoral effect of diffractaic acid from lichen metabolites on Swiss albino mice with Ehrlich Ascites Carcinoma: an experimental study // Int. J. Pharmacol. 2014. V. 10. № 6. P. 307–314. https://doi.org/10.3923/ijp.2014.307.314
Ebrahim H.Y., Elsayed H.E., Mohyeldin M.M. Norstictic acid inhibits breast cancer cell proliferation, migration, invasion, and in vivo invasive growth through targeting C-Met // Phytother. Res. 2016. V. 30. № 4. P. 557–566. https://doi.org/10.1002/ptr.5551
Song Y., Dai F., Zhai D. Usnic acid inhibits breast tumor angiogenesis and growth by suppressing VEGFR2-mediated AKT and ERK1/2 signaling pathways //Angiogenesis. 2012. V. 15. № 3. P. 421–432. https://doi.org/10.1007/s10456-012-9270-4
Zuo S.T., Wang L.P., Zhang Y. Usnic acid induces apoptosis via an ROS-dependent mitochondrial pathway in human breast cancer cells in vitro and in vivo // RSC Adv. 2015. V. 5. № 1. P. 153–162. https://doi.org/10.1039/C4RA12340A
Su Z.Q., Liu Y.H., Guo H.Z. Effect-enhancing and toxi-city-reducing activity of usnic acid in ascitic tumor-bearing mice treated with bleomycin // Int. Immunopharmacol. 2017. V. 46. P. 146–155. https://doi.org/10.1016/j.intimp.2017.03.004
Yang Y., Bae W.K., Lee J.Y. Potassium usnate, a water-soluble usnic acid salt, shows enhanced bioavailability and inhibits invasion and metastasis in colorectal cancer // Scientific Rep. 2018. V. 8. № 1. P. 1–11. https://doi.org/10.1038/s41598-018-34709-9
Solár P., Hrčková G., Koptašíková L. Murine breast carcinoma 4T1 cells are more sensitive to atranorin than normal epithelial NMuMG cells in vitro: Anticancer and hepatoprotective effects of atranorin in vivo // Chem.-Biol. Interact. 2016. V. 250. P. 27–37. https://doi.org/10.1016/j.cbi.2016.03.012
Zhou R., Yang Y., Park S.Y. The lichen secondary metabolite atranorin suppresses lung cancer cell motility and tumorigenesis // Scientific Rep. 2017. V. 7. № 1. P. 1–13. https://doi.org/10.1038/s41598-017-08225-1
Храмченкова О.М., Матвеенков М.В. Фотозащитная активность экстрактов из пяти видов лишайников в отношении кератиноцитов человека (HaCАT) // Журн. Белорусского гос. ун-та. Экология. 2018. № 4. С. 52–62. [Khramchenkova O.M., Matveyenkau M.V. Fotozashchitnaya aktivnost’ ekstraktov iz pyati vidov lishajnikov v otnoshenii keratinocitov cheloveka (HaCAT) // Zhurnal Belorusskogo gosudarstvennogo universiteta. Ekologiya. 2018. № 4. S. 52–62. (In Russ.)]
Храмченкова О.М., Матвеенков М.В. Цитотоксические и фотомодифицирующие свойства метанольных и ацетоновых экстрактов пяти видов лишайников // Изв. Гомельского гос. ун-та имени Ф. Скорины. 2020. № 6. С. 92. [Khramchenkova O.M., Matveyenkau M.V. Tsitotoksicheskiye i fotomodifitsiruyushchiye svoystva metanol’nykh i atsetonovykh ekstraktov pyati vidov lishaynikov // Izvestiya Gomel’skogo gosudarstvennogo universiteta imeni F. Skoriny. 2020. № 6. P. 92–98. (In Russ.)]
Храмченкова О.М., Матвеенков М.В. Хлороформные и этилацетатные экстракты пяти видов лишайников: Фотозащитные, цитотоксические и фотомодифицирующие свойства // Изв. Гомельского гос. ун-та имени Ф. Скорины. 2021. № 3. С. 75–80. [Khramchenkova O.M., Matveyenkau M.V. Khloroformnyye i etilatsetatnyye ekstrakty pyati vidov lishaynikov: fotozashchitnyye, tsitotoksicheskiye i fotomodifitsiruyushchiye svoystva // Izvestiya Gomel’skogo gosudarstvennogo universiteta imeni F. Skoriny. 2021. № 3. P. 75–80. (In Russ.)]
Храмченкова О.М., Матвеенков М.В. Фотозащитные, цитотоксические и фотомодифицирующие свойства неполярных фракций биомассы лишайников в отношении культуры кератиноцитов человека (HaCAT) // Журн. Белорусского гос. ун-та. Экология. 2021. № 2. С. 29–35. [Khramchenkova O.M., Matveyenkau M.V. Fotozashchitnyye, tsitotoksicheskiye i fotomodifitsiruyushchiye svoystva nepolyarnykh fraktsiy biomassy lishaynikov v otnoshenii kul’tury keratinotsitov cheloveka (HaCAT) // Zhurnal Belorusskogo gosudarstvennogo universiteta. Ekologiya 2021. № 2. P. 29–35. (In Russ.)]
Мартинович Г.Г., Мартинович И.В., Вчерашняя А.В. Хемосенсибилизация опухолевых клеток фенольными антиоксидантами: роль фактора транскрипции Nrf2 // Биофизика. 2020. Т. 65. № 6. С. 1081–1092. [Martinovich G.G., Martinovich I.V., Vcherashnyaya A.V. Khemosensibilizatsiya Opukholevykh Kletok Fenol’nymi Antioksidantami: Rol’ Faktora Transkriptsii Nrf2 // Biofizika. 2020. V. 65. № 6. P. 1081–1092. (In Russ.)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


