Радиационная биология. Радиоэкология, 2022, T. 62, № 6, стр. 591-601
СОСТАВ МИКРОЯДЕР В Т-ЛИМФОЦИТАХ У ЖЕНЩИН, ПОДВЕРГШИХСЯ ХРОНИЧЕСКОМУ РАДИАЦИОННОМУ ВОЗДЕЙСТВИЮ
1 Уральский научно-практический центр радиационной медицины
Федерального медико-биологического агентства России
Челябинск, Россия
2 Челябинский государственный университет
Челябинск, Россия
* E-mail: akhmadullina.yul@yandex.ru
Поступила в редакцию 30.05.2022
После доработки 31.08.2022
Принята к публикации 07.09.2022
- EDN: IDCYPV
- DOI: 10.31857/S0869803122060030
Аннотация
Изучали хромосомный состав микроядер Т-лимфоцитов периферической крови у женщин, подвергшихся хроническому радиационному воздействию в результате проживания в прибрежных селах р. Теча на Южном Урале (кумулятивные дозы на красный костный мозг были в диапазоне 0.73–1.93 Гр, возраст женщин 73–82 года). В качестве метода использовали микроядерный тест с цитохалазиновым блоком и мультицветным окрашиванием препаратов для идентификации каждой хромосомы (метод mFISH). У облученных женщин в среднем выше число хромосом, попавших в микроядро, чем в группе сравнения (р = 0.001). В группе облученных женщин и в группе сравнения наблюдается не равновероятное попадание хромосом в микроядра. Наибольшее количество микроядер являются моноцветными, т.е. образованы из материала одной хромосомы. В 44–55% моноцветные микроядра образованы Х-хромосомой, в 4–7% – 16-хромосомой. В изучаемых группах в многоцветных микроядрах чаще встречаются 2, 4, 10, 16 и X хромосомы. У облученных женщин в моноцветных микроядрах 2-хромосома встречается статистически значимо выше, чем в группе сравнения (р = 0.001); в многоцветных микроядрах статистически значимо выше встречаются 6, 17 и 18 хромосомы (р = 0.0036, р = 0.023, р = 0.02 соответственно).
Хроническое низкоинтенсивное радиационное воздействие является сопутствующим фактором для контингентов людей, которые длительное время проживали или проживают на радиоактивно-загрязненных территориях, на территориях с повышенным естественным радиационным фоном, для профессионалов в области ядерной энергетики и некоторых отраслей медицины. Кроме этого, в современном мире отмечена тенденция к повышению числа диагностических медицинских процедур для населения, связанных с использованием ионизирующих излучений. В связи с этим возникают вопросы, каким образом влияет низкоинтенсивное хроническое облучение на здоровье людей, какие процессы в организме являются критическими при воздействии малых доз.
Результаты многолетних эпидемиологических исследований населения, проживавшего в прибрежных селах р. Теча, свидетельствуют о повышении радиационного риска лейкозов и солидных опухолей [1, 2], что говорит о радиационно-индуцированных мутационных изменениях в клетках этих людей. В ФГБУН УНПЦ РМ (г. Челябинск) многочисленные исследования направлены на изучение влияния хронического радиационного воздействия низкой интенсивности на геном клеток. Так, было показано, что в отдаленные сроки после облучения наблюдались повышенная частота мутаций TCR [3], повышенная частота стабильных и нестабильных хромосомных аберраций [4, 5], имелись особенности в длине теломер различных хромосом [6] и особенности в транскрипционной активности генов на основе количественных измерений мРНК [7]. Полную картину того, какое место занимает радиационный фактор в реализации отдаленных последствий хронического облучения и каким образом он влияют на судьбу клеток и тканей, еще предстоит выяснить.
Например, если в клетках образуется повышенное количество нестабильных хромосомных аберраций, то мы можем предполагать, что и количество микроядер должно увеличиваться за счет элиминации этих повреждений, но это не подтверждается результатами наших исследований [8]. Так, частота клеток с микроядрами у облученных лиц повышена относительно контроля только у женщин, с накопленной дозой на красный костный мозг (ККМ) от 0.1 до 0.49 Гр. В то время, как частоты нестабильных хромосомных аберраций повышены в группе облученных лиц, имеется зависимость от кумулятивной дозы на ККМ. Поэтому закономерно появляются вопросы о том, что попадает в микроядра, элиминируются ли поврежденные участки генома посредством микроядер, каковы последствия попадания хроматина в микроядра у лиц, подвергшихся хроническому радиационному воздействию.
Если раньше микроядра считались простым маркером разного уровня повреждений ядерного генома и сигналом клетки на элиминацию, то в настоящее время представление о микроядерном процессе в соматических клетках человека намного расширилось. Во-первых, клетки с микроядрами могут продолжать функционировать (в микроядре возможна транскрипция, репликация ДНК и восстановление повреждений ДНК), клетки с микроядрами могут проходить клеточный цикл [9]. Во-вторых, большую роль в стабильности микроядра отводят образованию вокруг них ядерной мембраны, ее устойчивости. Разрыв мембраны микроядра останавливает его функции и приводит к анеуплоидии, повреждению ДНК и активации врожденных иммунных и клеточных путей элиминации клетки. Считается, что повреждение ДНК микроядер приводит к хроматрипсису и катаэгису, которые вызывают хромосомные перестройки и гипермутации соответственно [10–12].
В настоящее время все большее внимание уделяется составу микроядер, поскольку имеются сведения, что состав микроядер связан с устойчивостью микроядра и ядерного генома [9, 13]. Кроме этого, изучение состава микроядер у хронически облученных лиц позволит расширить знания о механизмах влияния на геном ионизирующих излучений малой интенсивности, а также фундаментальные свойства генома при воздействии повреждающих факторов.
В связи с вышеизложенным, целью работы стало изучение состава микроядер в Т-лимфоцитах периферической крови людей в отдаленные сроки хронического радиационного воздействия.
МАТЕРИАЛЫ И МЕТОДИКА
Характеристика обследованных лиц
В работе изучали хромосомный состав микроядер Т-лимфоцитов у женщин, подвергшихся хроническому радиационному воздействию в результате проживания в прибрежных селах р. Теча на Южном Урале.
Хроническое облучение жителей началось более 60 лет назад и было сочетанным – внешнее γ-воздействие и внутреннее, за счет поступления 89, 90Sr в организм. Мощность дозы облучения в динамике имела тенденцию к снижению, особенно после 1956 г., когда прекратились массированные сбросы радионуклидов в речную систему. Поглощенная доза облучения ККМ в основном была сформирована к 1961 г. В 1996 г. мощность дозы облучения ККМ не превышала 1 мГр/год [14].
Критическим органом при таком радиационном воздействии был ККМ, который подвергался β-облучению. В настоящее время популяция пострадавших жителей сел верховьев р. Теча достигла возраста старше 60 лет, что позволяет проводить исследования с учетом возрастных изменений в клетках иммунной системы.
Изучение хромосомного состава микроядер проводилось у шести женщин в возрасте от 73 до 82 лет, подвергшихся хроническому радиационному воздействию с кумулятивными дозами на ККМ в диапазоне от 0.73 до 1.93 Гр. Поскольку подобное исследование выполняется в ФГБУН УНПЦ РМ (г. Челябинск) впервые и является пилотным, мы посчитали правильным сначала включить в группу облученных лиц с высокими дозами на ККМ, при которых цитогенетические нарушения обнаруживаются с высокой вероятностью, а также ограничить группу по половой принадлежности.
В группу сравнения вошли восемь женщин в возрасте 63 лет–71 года, кумулятивная доза облучения на ККМ которых не превышала 0.07 Гр за весь период жизни (табл. 1).
Таблица 1.
Характеристика обследованных лиц Table 1. Characteristics of the examined individuals
| Группа | Облученные женщины | Группа сравнения | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Донор | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| Возраст, лет | 73 | 74 | 76 | 79 | 79 | 82 | 63 | 65 | 70 | 66 | 67 | 71 | 63 | 63 |
| Доза на ККМ, Гр | 1.93 | 1.41 | 1.11 | 0.81 | 0.73 | 0.83 | 0.01 | 0 | 0 | 0.006 | 0 | 0.0018 | 0.01 | 0.03 |
По литературным данным и по результатам собственных исследований частота лимфоцитов с микроядрами у женщин достигает максимальных значений к 60–69 годам и не увеличивается в более старших возрастных группах [15]. Следовательно, мы предполагаем, что возрастная специфика образования микроядер в группе облученных женщин и в группе сравнения будет схожа.
Из исследования исключали лиц, родившихся после 1960 г., а также лиц, у которых имелись в анамнезе аутоиммунные, онкологические, хронические воспалительные заболевания в фазе обострения, лица, принимающие цитостатики, антибиотики, а также те, кто проходил диагностическое облучение в течение предшествующих 6 мес. до момента взятия образца крови, не были включены в выборку.
Информация о выборке, состоянии здоровья облученных лиц была предоставлена отделом “База данных – Человек” ФГБУН УНПЦ РМ. Индивидуальные дозы облучения на ККМ были рассчитаны по TRDS-2016 в биофизической лаборатории УНПЦ РМ. Данные о наличии онкопатологии в анамнезе обследуемых лиц были предоставлены эпидемиологической лабораторией ФГБУН УНПЦ РМ [16].
В соответствии с действующими международными нормами (Хельсинкская декларация 1964 г.) и с разрешения этического комитета УНПЦ РМ у всех пациентов, участвующих в цитогенетических исследованиях, было получено информированное согласие на забор образцов крови и на дальнейшие исследования.
Микроядерный тест
Культивирование Т-лимфоцитов периферической крови доноров проводили с использованием стандартного протокола для микроядерного теста с цитохалазином Б [17]. Протокол методики подробно описан в наших предыдущих публикациях [8, 15]. Флуоресцентную гибридизацию in situ (FISH) проводили с зондами для мультицветной окраски на все хромосомы (24-цветное окрашивание, mFISH), производство Metasystems (Германия). Флуоресцентное окрашивание проводили в соответствии с протоколом производителя, который обязательно включает денатурацию ДНК на препарате и зонда, гибридизацию в течение суток при 37° С, затем проводили постгибридизационную отмывку несвязанных зондов. Препараты ополаскивали в дистиллированной воде и сушили на воздухе. Для контр-окрашивания на препарат наносили 15 мкл DAPI antifade (Metasystems, Германия). Затем препарат накрывали покровным стеклом и хранили при –20°С.
Анализ флуоресцентно окрашенных препаратов проводили с помощью флуоресцентного микроскопа AxioImager Z2 (Zeiss, Германия) с фильтрами для распознавания флюоресцентной окраски, а также с программным модулем Isis Metasystems для обработки флуоресцентных изображений. Программа Isis позволяет присвоить цвет каждой хромосоме и при обработке микроядра цветовым пятнам автоматически присваивается номер хромосомы. Анализ микроядер, окрашенных методом mFish, предполагает, что мы идентифицировали материал определенной хромосомы, а не исключительно всю хромосому. То есть в данном исследовании мы не можем знать, содержатся ли в микроядрах целые хромосомы или их фрагменты.
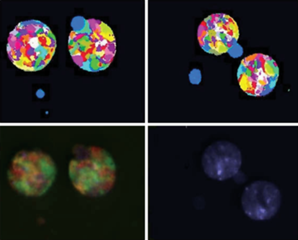
Использовались критерии подсчета двуядерных лимфоцитов с микроядрами, подробно описанные в публикациях M. Fenech [18]. В этом исследовании анализировали все двуядерные лимфоциты на цитогенетическом препарате. При анализе состава микроядер учитывалось количество цветовых сигналов (цветовых пятен), которые находились в микроядре, а также идентифицировался материал каждой хромосомы, попавшей в микроядро. Микроядра, в которых идентифицирован один цветовой сигнал, мы называем моноцветным, а те, в которых содержится два и более сигнала, – многоцветные микроядра (рис. 1).
Рис. 1.
Изображения мультицветно окрашенных двуядерных лимфоцитов с микроядрами (а – моноцветные микроядра, b – многоцветные микроядра).
Fig. 1. The image of multicolor stained binuclear lymphocytes with micronuclei (а – mono-colored micronuclei, b – multicolored micronuclei).

Статистический анализ
В работе оценивали частоту микроядер на 1000 просчитанных двуядерных клеток.
При изучении количественного состава микроядер оценивали число цветовых сигналов в микроядрах, среднее число цветовых сигналов на одно микроядро и частоту микроядер в зависимости от количества цветовых сигналов в их составе.
При изучении качественного состава микроядер оценивали частоту микроядер с материалом определенной хромосомы относительно общего количества микроядер, а также вклад определенных хромосом в образование моно- и многоцветных микроядер относительно общего количества сигналов хромосом.
Статистический анализ проводили с помощью критерия χ2. Различия считали статистически значимыми при р < 0.05.
Для исследования равновероятного попадания той или иной хромосомы в микроядро использовался критерий χ2, для определения статистической значимости отдельных частот пользовались методом остатков Хабермана.
Статистическую обработку данных проводили с помощью пакета программ Microsoft Excel 2010, Past 4.03.
РЕЗУЛЬТАТЫ
Как видно из табл. 2, частота микроядер (на 1000 просчитанных лимфоцитов) варьирует от 9.3 до 44.2‰. У облученных женщин частота микроядер в среднем составила 26.5 ± 4.8‰, у женщин из группы сравнения 25.4 ± 2.4‰.
Таблица 2.
Характеристика клеток с микроядрами у обследованных лиц Table 2. Characteristics of the cells with micronuclei in the examined individuals
| Группа | Донор | Число двуядерных лимфоцитов | Число микроядер | Частота микро-ядер, ‰ | Число сигналов от хромосом в микроядрах | Частота сигналов на 1 микроядро |
|---|---|---|---|---|---|---|
| Облученные женщины | 1 | 1540 | 68 | 44.2 | 196 | 2.9 |
| 2 | 1618 | 51 | 31.5 | 116 | 2.3 | |
| 3 | 2469 | 20 | 8.1 | 60 | 3.0 | |
| 4 | 1100 | 33 | 30.0 | 118 | 3.6 | |
| 5 | 1500 | 30 | 20.0 | 92 | 3.1 | |
| 6 | 3000 | 70 | 23.3 | 115 | 1.6 | |
| Группа сравнения | 7 | 3500 | 80 | 22.9 | 126 | 1.6 |
| 8 | 2804 | 78 | 27.8 | 115 | 1.5 | |
| 9 | 844 | 20 | 23.7 | 31 | 1.6 | |
| 10 | 2339 | 59 | 25.2 | 82 | 1.4 | |
| 11 | 1700 | 46 | 27.1 | 55 | 1.2 | |
| 12 | 1300 | 37 | 28.5 | 49 | 1.3 | |
| 13 | 2785 | 100 | 35.9 | 121 | 1.2 | |
| 14 | 4689 | 56 | 11.9 | 88 | 1.6 |
При изучении числа цветовых сигналов хромосом в микроядрах облученных женщин было выявлено, что их количество варьировало от 1.6 до 3.6 на микроядро, а в группе сравнения 1.2–1.6 на микроядро. В среднем число цветовых сигналов на микроядро в группе облученных женщин составило 2.75 ± 0.29, а в группе сравнения статистически значимо ниже 1.42 ± 0.06, р = 0.001.
Таким образом, у облученных женщин в среднем в микроядро попадает в 2 раза больше хромосом, чем у женщин в группе сравнения, несмотря на то, что средние частоты микроядер на 1000 просчитанных лимфоцитов у них не отличаются.
В табл. 3 представлено распределение микроядер в зависимости от числа цветовых сигналов. Видно, что частота микроядер в зависимости от количества цветовых сигналов в них экспоненциально убывает. В группе облученных женщин встречаются микроядра, содержащие от 1 до 16 хромосомных сигналов, в группе сравнения максимальное число сигналов составило 9 на микроядро. Как в группе облученных женщин, так и в группе сравнения наибольшее число составили моноцветные микроядра, т.е. содержащие сигнал одной хромосомы. В группе облученных женщин моноцветные микроядра составили 62.1%, что ниже, чем в группе сравнения – 79.4%, р = 0.0182. Двухцветные микроядра в обследуемых группах составили 12.5% у облученных женщин и 12.8% в группе сравнения. Трехцветные микроядра в группе облученных женщин составили 4.8%, а в группе сравнения – 2.7%. Остальных многоцветных микроядер в группе облученных женщин – 20.6%, а в группе сравнения – 5.1%, р = 0.0017. Таким образом, в обследуемых группах наибольшее число микроядер состоит из материала одной хромосомы, при этом в группе облученных женщин чаще, чем в группе сравнения встречаются микроядра, состоящие из материала большего количества хромосом.
Таблица 3.
Распределение микроядер по количеству цветовых сигналов, % Table 3. Distribution of micronuclei by the number of color signals, %
| Число цветовых сигналов | Облученные лица | Группа сравнения |
|---|---|---|
| 1 | 62.1 | 79.4 |
| 2 | 12.5 | 12.8 |
| 3 | 4.8 | 2.7 |
| 4 | 3.7 | 1.7 |
| 5 | 2.9 | 1.5 |
| 6 | 3.3 | 1.1 |
| 7 | 2.6 | 0.4 |
| 8 | 0.7 | 0.2 |
| 9 | 2.6 | 0.2 |
| 10 | 1.1 | – |
| 11 | 1.5 | – |
| 13 | 1.1 | – |
| 14 | 0.7 | – |
| 16 | 0.4 | – |
В табл. 4 представлена частота микроядер, содержащих цветовой сигнал от определенной хромосомы. У облученных женщин наиболее часто встречаются микроядра с 2-, 6-, 16-, 18-хромосомами при сравнении с группой сравнения.
Таблица 4.
Количество микроядер, содержащих сигнал от определенной хромосомы, % Table 4. The percentage of micronuclei containing the signal from a particular chromosome, %
| № хромо-сомы | Облученные лица | Группа сравнения | Статистическая значимость |
|---|---|---|---|
| 1 | 8.1 | 3.6 | χ2 = 2.406 р = 0.021 |
| 2 | 24.3 | 9.9 | χ2 = 8.182 р = 0.0067 |
| 3 | 6.3 | 2.9 | χ2 = 2.084 р = 0.2716 |
| 4 | 13.6 | 6.1 | χ2 = 2.853 р = 0.145 |
| 5 | 6.3 | 2.1 | χ2 = 2.084 р = 0.280 |
| 6 | 9.6 | 1.1 | χ2 = 6.740 р = 0.0175 |
| 7 | 8.1 | 3.8 | χ2 = 2.406 р = 0.207 |
| 8 | 4.8 | 4.2 | χ2 = 0 р = 1 |
| 9 | 8.5 | 4.6 | χ2 = 1.419 р = 0.3757 |
| 10 | 15.4 | 6.3 | χ2 = 4.315 р = 0.0629 |
| 11 | 7.4 | 2.3 | χ2 = 2.91 р = 0.1644 |
| 12 | 7.4 | 3.8 | χ2 = 1.685 р = 0.337 |
| 13 | 7.4 | 5.7 | χ2 = 0.355 р = 0.765 |
| 14 | 5.1 | 3.2 | χ2 = 0.521 р = 0.721 |
| 15 | 4.8 | 3.4 | χ2 = 0.148 р = 1 |
| 16 | 21.7 | 8.6 | χ2 = 6.828 р = 0.0154 |
| 17 | 9.2 | 2.1 | χ2 = 4.716 р = 0.0584 |
| 18 | 11.4 | 2.7 | χ2 = 6.669 р = 0.019 |
| 19 | 8.1 | 3.8 | χ2 = 2.406 р = 0.2095 |
| 20 | 9.6 | 5.3 | χ2 = 1.229 р = 0.4098 |
| 21 | 8.5 | 3.8 | χ2 = 2.406 р = 0.2075 |
| 22 | 10.7 | 3.6 | χ2 = 4.03 р = 0.0828 |
| Х | 40.4 | 47.5 | χ2 = 1.0047 р = 0.388 |
Для исследования равновероятного попадания той или иной хромосомы в микроядро использовался критерий χ2: для группы облученных женщин χ2 (22) составил 363.92; р = 0.001, для группы сравнения χ2 (22) составил 1538.2; р = 0.0001. Это говорит о том, что хромосомы попадали в микроядра не равновероятно. Для определения статистической значимости отдельных частот пользовались методом остатков Хабермана (табл. 5). Таким образом, распределение статистически значимо отличается от ожидаемого в большую (полужирный шрифт) или меньшую (выделено курсивом) сторону в числе данных хромосом. Видно, что в обеих группах чаще встречаются микроядра со 2-, 16- и Х-хромосомой. Причем на микроядра с Х-хромосомой приходится 40.4% всех микроядер в группе облученных лиц и 47.5% в группе сравнения (табл. 4).
Таблица 5.
Равновероятность попадания хромосом в микроядра Table 5. Equal probability of chromosome occurring in a micronucleus
| № хромосомы | Группа облученных женщин | Группа сравнения | ||
|---|---|---|---|---|
| значение остатка (отклонение) | p-значение | значение остатка (отклонение) | p-значение | |
| 1 | –1.5771 | 0.114773 | –2.3296 | 0.019827 |
| 2 | 6.779 | 1.21E-11 | 3.4944 | 0.000475 |
| 3 | –2.5267 | 0.011514 | –2.912 | 0.003591 |
| 4 | 1.2716 | 0.203515 | 0 | 1 |
| 5 | –2.5267 | 0.011514 | –3.6886 | 0.000225 |
| 6 | –0.81745 | 0.413671 | –4.6593 | 3.17E-06 |
| 7 | –1.5771 | 0.114773 | –2.1355 | 0.03272 |
| 8 | –3.2863 | 0.001015 | –1.7472 | 0.080603 |
| 9 | –1.3872 | 0.165381 | –1.359 | 0.174147 |
| 10 | 2.2211 | 0.026344 | 0.19414 | 0.846066 |
| 11 | –1.9569 | 0.050359 | –3.4944 | 0.000475 |
| 12 | –1.9569 | 0.050359 | –2.1355 | 0.03272 |
| 13 | –1.9569 | 0.050359 | –0.38827 | 0.697816 |
| 14 | –3.0964 | 0.001959 | –2.7179 | 0.00657 |
| 15 | –3.2863 | 0.001015 | –2.5238 | 0.011609 |
| 16 | 5.4497 | 5.05E-08 | 2.3296 | 0.019827 |
| 17 | –1.0074 | 0.313743 | –3.6886 | 0.000225 |
| 18 | 0.13211 | 0.894897 | –3.1062 | 0.001895 |
| 19 | –1.5771 | 0.114773 | –2.1355 | 0.03272 |
| 20 | –0.81745 | 0.413671 | –0.77654 | 0.43743 |
| 21 | –1.3872 | 0.165381 | –2.1355 | 0.03272 |
| 22 | –0.24771 | 0.804359 | –2.3296 | 0.019827 |
| Х | 15.135 | 0.000000 | 38.245 | 0.000000 |
Далее нами была оценена специфика попадания материала различных хромосом в одноцветные и многоцветные микроядра.
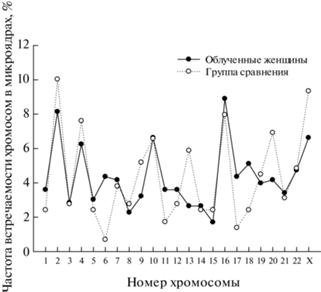
Из рис. 2 видно, что частоты микроядер с одной хромосомой в составе симметричны между облученными женщинами и группой сравнения. Наибольшая частота одноцветных микроядер состоит из материала Х- и 16- хромосом. В группе облученных женщин повышена частота одноцветных микроядер, содержащих материал 2-хромосомы (χ2 = 13.18, р = 0.001). В микроядрах, образованных несколькими хромосомами, имеются как симметричные, так и несимметричные точки (рис. 3). Так, видно, что в образовании многоцветных микроядер часто принимают участие 2-, 4-, 10-, 16- и X-хромосомы. При этом у облученных женщин помимо перечисленных в многоцветных микроядрах наиболее часто встречается 6-, 17- и 18-хромосомы (р = 0.0036, р = 0.023, р = 0.02 соответственно), а в группе сравнения – 13-хромосома (р = 0.021).
Рис. 2.
Частота встречаемости хромосом в моноцветных микроядрах.
Fig. 2. Frequency of chromosome occurrence in mono-colored micronuclei.
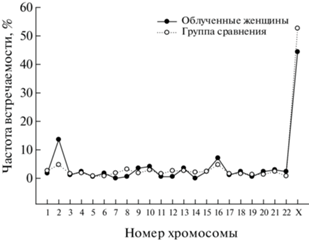
Рис. 3.
Частота встречаемости хромосом в многоцветных микроядрах.
Fig. 3. Frequency of chromosome occurrence in multicolored micronuclei.
Таким образом, у обследуемых групп хромосомы распределяются в микроядра не равновероятно. В обследуемых группах 40–47.5% микроядер содержат материал Х-хромосомы. В группе облученных женщин одноцветные микроядра чаще состоят из материала 2-хромосомы, чем в группе сравнения, а в многоцветных микроядрах чаще встречается материал 6-, 17- и 18-хромосомы.
ОБСУЖДЕНИЕ
Хроническое облучение, воздействуя на предшественников Т-лимфоцитов в ККМ, могло приводить к мутационным изменениям, а также к радиационно-индуцированной нестабильности генома, феномен которой заключается в увеличении уровня мутаций у потомков облученных клеток. Например, результатом таких изменений являются хромосомные аберрации (транслокации, дицентрические хромосомы), которые регистрируются в отдаленные сроки после начала хронического облучения [4, 5, 19]. В результате многолетних исследований частоты клеток с микроядрами у хронически облученных лиц получились неоднозначные результаты [8]. В целом в выборке облученных лиц (доза на ККМ 0.001–4 Гр) частота микроядер не отличалась от группы сравнения, но у постнатально облученных женщин (доза на ККМ 0.1–0.49 Гр) частота микроядер была несколько выше (р = 0.04), в то время как у мужчин такого эффекта не наблюдалось. Таким образом, в полной мере не ясна картина цитогенетических событий и их судьба для клетки или ткани, в которой они образуются. С одной стороны, хромосомные аберрации (в том числе и нестабильные) могут не элиминироваться из ядра посредством микроядер, а с другой стороны, микроядра образуются не только из хромосом, подвергшихся фрагментации и обменным процессам, но и из-за особенностей процессов сегрегации при делении клетки. Исследование состава микроядер дополняют понимание происходящих процессов в ядерном геноме в отдаленные сроки после хронического радиационного облучения.
В группе облученных женщин микроядра в среднем состоят из большего количества хромосом, чем в группе сравнения. У облученных женщин на одно микроядро приходится 2.75 ± 0.29 хромосомных сигналов, а в группе сравнения в два раза ниже – 1.42 ± 0.06 хромосомных сигнала на микроядро (р = 0.001). При этом средняя частота микроядер на 1000 просчитанных двуядерных лимфоцитов у женщин двух групп не отличается.
При изучении распределения микроядер по количеству хромосом в их составе выяснилось, что в обеих группах частота микроядер в зависимости от числа хромосомных сигналов в них экспоненциально убывает. Наибольшее число микроядер представлено одним цветом – значит, содержит в своем составе материал одной хромосомы (62.1% у облученных женщин и 79.4% в группе сравнения).
У облученных женщин статистически значимо выше количество многоцветных микроядер, р = = 0.0001. Возможно, эти результаты указывают на высокую интенсивность обменных процессов между хромосомами (скорее всего преимущественно хроматидного типа) у облученных лиц и элиминацию этих повреждений посредством микроядер. Обращает на себя внимание наличие микроядер с очень большим количеством хромосом (или их участков) – несколько микроядер облученных лиц состоят из 10–16 сигналов хромосом. Что является причиной появления таких микроядер – не ясно. Скорее всего механизм образования таких микроядер отличается от классических, хорошо описанных в литературе.
В литературе исследования с мультицветным окрашиванием микроядер немногочисленны. Результаты [20, 21] показали, что до 57–98% спонтанных микроядер являются моноцветными. При in vitro облучении культуры лимфоцитов возрастает количество многоцветных микроядер с ростом дозы γ-облучения (1–10 Гр), число цветов возрастало до шести на микроядро.
При изучении качественного состава микроядер было обнаружено, что материал от хромосом попадает в них неравновероятно. В обеих группах в микроядрах отклоняются от равновероятного распределения в большую сторону 2-, 16- и Х-хромосомы. Причем частота микроядер с материалом Х-хромосомы в группе облученных женщин достигает 40.4 и 47.5% в группе сравнения. При сравнении частот микроядер, содержащих материал определенных хромосом, было выявлено, что у облученных женщин наиболее часто встречаются микроядра с 2-, 6-, 16-, 18-хромосомами по сравнению с группой сравнения.
Также мы изучили вклад отдельных хромосом в образование моно- и многоцветных микроядер. Участие хромосом в образовании микроядер у обеих исследуемых групп схоже. Так, наибольшее количество моноцветных микроядер состоит из материала Х-хромосомы: в 44% случаев в группе облученных женщин и в 52% в группе сравнения. Также выделяется 16-хромосома, частота встречаемости которой в моноцветных микроядрах 7% в группе облученных женщин и 4.8% в группе сравнения. Обращает на себя внимание то, что в группе облученных лиц в моноцветных микроядрах материал 2-хромосомы чаще встречается, чем в группе сравнения (13.6% против 4.8%, р = 0.001).
При изучении многоцветных микроядер также имеется общая картина относительно участия хромосом в их образовании: 2-, 4-, 10-, 16- и X-хромосомы наиболее часто встречаются в многоцветных микроядрах обеих групп. При этом у облученных женщин дополнительно к перечисленным в многоцветных микроядра часто попадают 6-, 17- и 18-хромосомы, а в группе сравнения 13-хромосома.
В нашем исследовании не применялись центромерные зонды, поэтому при интерпретации результатов мы не можем знать, содержат ли микроядра целые хромосомы или их участки. По литературным данным, в моноцветные микроядра чаще попадают неправильно сегрегированные хромосомы, что в конечном итоге может приводить к анеуплоидии. В анеуплоидии большое значение имеют нарушения функций центромерной области хромосом [22, 23]. Секвенирование всего генома и картирование центромер в сочетании с цитогенетическим анализом показали, что межхромосомная гетерогенность центромерных особенностей влияет на точность сегрегации хромосом. Авторы делают вывод, что правильная сегрегация для большинства хромосом человека смещена в пользу центромер с высоким содержанием ДНК-зависимых центромерных компонентов (CENP A, CENP B и др). Эти межхромосомные различия в организации центромеры могут привести к неслучайной анеуплоидии. Как и в нашей работе, многие исследователи сообщали, что довольно часто микроядра содержат Х-хромосому. По оценкам авторов [21, 24–27] частота микроядер с Х-хромосомой может колебаться от 3 до 80%, а также зависит от пола и возраста доноров. К молекулярным механизмам включения Х-хромосомы в микроядро принято относить нарушение ее сегрегации в процессе клеточного деления из-за ее гетерохроматизации. В нашей работе интересным показалось наблюдение того, что Х-хромосома включалась в некоторые микроядра посредством образования ядерных выпячиваний (рис. 4).
Также в литературе показано, что 16-хромосома может включаться в микроядра с повышенной частотой и причинами этого являются конституционные гетерохроматиновые области в ее составе, которые могут повреждаться и препятствовать нормальной сегрегации. Кроме 16-хромосомы, высокий процент конституционного гетерохроматина имеется на 1-, 9- и 19-хромосоме, однако в нашей работе мы не показали включение их в микроядра с повышенной частотой. В работах, в которых показаны повышенные частоты микроядер с хромосомами, содержащие высокий процент гетерохроматина, как правило, исследуется влияние химических веществ, нарушающих работу белков веретена деления [28–33]. Возможно, в нашей работе мы имеем дело с возрастной спецификой включения 16-хромосомы в микроядра.
Что касается 2-хромосомы, то в литературе мы не встретили однозначного результата, похожего на наш, но тем не менее есть работы, в которых указывается повышенная склонность 2-хромосомы включаться в микроядра у отдельных индивидуумов [34] или совместно с другими хромосомами по общим критериям (например, усталость когезии 1- и 2-хромосомы) [35]. Также есть результаты, показывающие большую радиочувствительность 2-хромосомы по сравнению с 1- по критерию участия их в обменных процессах [36]. Результаты показали, что 2-хромосома более склонна к образованию дицентриков и ацентрических фрагментов.
Таким образом, результаты нашей работы показали, что в группе облученных женщин наиболее часто встречаются многоцветные микроядра, что может косвенно указывать на повышенную частоту хромосомных повреждений и их элиминацию из ядерного генома в микроядра. Механизмы образования микроядер схожи в группе облученных женщин и в группе сравнения, но тем не менее у облученных женщин имеются особенности в образовании моно- и многоцветных микроядер. Работа будет продолжена, планируется расширить выборку, в том числе включить в нее мужчин, а также использовать центромерные зонды для идентификации кластогенных и анеугенных повреждений.
ВЫВОДЫ
1. В группе облученных женщин и в группе сравнения имеются общие черты в образовании микроядер. Наблюдается не равновероятное попадание хромосом в микроядра. Наибольшее количество микроядер образовано материалом одной хромосомы. В 44–52% моноцветные микроядра образованы материалом Х-хромосомы, в 4–7% материалом 16-хромосомы. В многоцветных микроядрах чаще встречаются 2-, 4-, 10-, 16- и X-хромосомы.
2. У облученных женщин (дозы на ККМ 0.73–1.93 Гр) в среднем выше число хромосомных сигналов на одно микроядро, чем в группе сравнения (р = 0.001). Это обусловлено тем, что у них выше частота встречаемости многоцветных микроядер. У облученных женщин в моноцветных микроядрах материал 2-хромосомы встречается статистически значимо выше, чем в группе сравнения (р = 0.001). В многоцветных микроядрах статистически значимо выше встречается материал 6, 17- и 18-хромосом (р = 0.0036, р = 0.023, р = 0.02 соответственно).
Список литературы
Крестинина Л.Ю., Силкин С.С., Микрюкова Л.Д. и др. Риск заболеваемости солидными злокачественными новообразованиями в Уральской когорте аварийно-облученного населения: 1956–2017 // Радиац. гигиена. 2020. Т. 13. № 3. С. 6–17. [Krestinina L.Yu., Silkin S.S., Mikryukova L.D. et al. Solid cancer incidence risk in in the Ural cohort of the accidentally exposed population: 1956–2017 // Radiatsionnaya Gygiena = Radiation Hygiene. 2020. V. 13. № 3. Р. 6–17. (In Russ.)] https://doi.org/10.21514/1998-426X-2020-13-3-6-17
Krestinina L., Davis F., Schonfeld S. et al. Leukaemia incidence in the Techa River Cohort: 1953–2007 // Br. J. Cancer. 2013. V. 109. P. 2886–2893. https://doi.org/10.1038/bjc.2013.614
Веремеева Г.А., Блинова Е.А., Аклеев А.В., Маркина Т.Н. Блок клеточного цикла и активность апоптоза лимфоцитов периферической крови (ЛПК), частота мутаций в генах TCR в отдаленные сроки у людей, подвергшихся хроническому радиационному воздействию // Вопр. радиац. безопасности. 2011. № 1 (61). С. 41–49. [Veremeeva G.A., Blinova E.A., Akleev A.V., Markina T.N. Arrest cell cycle and apoptosis activity of periphery blood lymphocytes, long-term level mutation in gene TCR after protracted radiation exposure in humans // Voprosy radiacionnoj bezopasnosti. 2011. № 1 (61). Р. 41–49. (In Russ.)]
Vozilova A.V., Shagina N.B., Degteva M.O. et al. FISH analysis of translocations induced by chronic exposure to Sr radioisotopes: second set of analysis of the Techa River Cohort // Radiat. Prot. Dosim. 2014. V. 159. № 1–4. P. 34–37. https://doi.org/10.1093/rpd/ncu131
Vozilova A.V., Shagina N.B., Degteva M.O., Akleyev A.V. Chronic radioisotope effects on residents of the Techa River (Russia) region: cytogenetic analysis more than 50 years after onset of exposure // Mutat. Res. 2013. V. 756. № 1–2. P. 115–118. https://doi.org/10.1016/j.mrgentox.2013.05.016
Возилова А.В., Кривощапова Я.В. Изучение зависимости длины теломер от возраста человека // Достижения радиобиологии – медицине: Мат. Междунар. науч.-практ. конф. 2018. С. 72–74. [Vozilova A.V., Krivoshchapova Ya.V. Izuchenie zavisimosti dliny telomer ot vozrasta cheloveka // Dostizheniya radiobiologii – medicine: Materialy Mezhdunarodnoj nauchno-prakticheskoj konferencii. 2018. P. 72–74. (In Russ.)]
Никифоров В.С., Блинова Е.А., Котикова А.И., Аклеев А.В. Транскрипционная активность генов репарации, апоптоза и клеточного цикла (TP53, MDM2, ATM, BAX, BCL-2,CDKN1A, OGG1, XPC, PADI4, MAPK8, NF-KB1, STAT3, GATA3) у хронически облученных людей с различной интенсивностью апоптоза лимфоцитов периферической крови // Вавиловский журн. генетики и селекции. 2022. Т. 26. № 1. С. 50–58. [Nikiforov V.S., Blinova E.A., Kotikova A.I., Akleev A.V. Transcriptional activity of repair, apoptosis and cell cycle genes (TP53, MDM2, ATM, BAX, BCL-2, CDKN1A, OGG1, XPC, PADI4, MAPK8, NF-KB1, STAT3, GATA3) in chronically exposed persons with different intensity of apoptosis of peripheral blood lymphocytes // Vavilovskii Zhurnal Genet Selektsii. 2022. V. 26. № 1. P. 50–58. (In Russ.)] https://doi.org/10.18699/VJGB-22-08
Ахмадуллина Ю.Р., Возилова А.В., Аклеев А.В. Исследование повреждений ДНК лимфоцитов периферической крови методом микроядерного теста у жителей прибрежных сел реки Течи, подвергшихся хроническому облучению внутриутробно и постнатально // Генетика. 2020. Т. 56. № 4. С. 463–470. [Akhmadullina Y.R., Vozilova A.V., Akleyev A.V. Study of the DNA damage in Peripheral Blood Lymphocytes Using Micronucleus Test in Residents of the Techa riverside villages who were chronically exposed in utero and postnatally // Rus. J. Genetics. 2020. V. 56. № 4. P. 481–487. (In Russ.)]https://doi.org/10.31857/S0016675820040025
Mammel A.E., Huang H.Z., Gunn A.L. et al. Chromosome length and gene density contribute to micronuclear membrane stability // Life Sci Alliance. 2021. V. 5. № 2. https://doi.org/10.26508/lsa.202101210
Zhang C.Z., Spektor A., Cornils H. et al. Chromothripsis from DNA damage in micronuclei // Nature. 2015. V. 522. № 7555. P. 179–184. https://doi.org/10.1038/nature14493
Mackenzie K.J., Carroll P., Martin C.A. et al. cGAS surveillance of micronuclei links genome instability to innate immunity // Nature. 2017. V. 548. № 7668. P. 461–465. https://doi.org/10.1038/nature23449
Krupina K., Goginashvili A., Cleveland D.W. Causes and consequences of micronuclei // Curr. Opin. Cell Biol. 2021. V. 70. P. 91–99. https://doi.org/10.1016/j.ceb.2021.01.004
Soto M., García-Santisteban I., Krenning L. et al. Chromosomes trapped in micronuclei are liable to segregation errors // J. Cell Sci. 2018. V. 1 31. № 13. P. jcs214742. https://doi.org/10.1242/jcs.214742
Медико-биологические и экологические последствия радиоактивного загрязнения реки Теча / Под ред. А.В. Аклеева, М.Ф. Киселева. М.: Медбиоэкстрем, 2001. 532 с. [Mediko-biologicheskie i ekologicheskie posledstviya radioaktivnogo zagryazneniya reki Techa / Pod red. A.V. Akleeva, M.F. Kiseleva. M.: Medbioekstrem, 2001. 532 s (In Russ.)]
Ахмадуллина Ю.Р. Изучение возрастной зависимости спонтанной частоты лимфоцитов с микроядрами у жителей Южного Урала // Соц.-экол. технологии. 2021. Т. 11. № 2. С. 230–245. [Ahmadullina Yu.R. Study of the age dependence of the spontaneous frequency of lymphocytes with micronuclei in residents of the South Urals. // Socialno-ecolo-gicheskie Technologii. 2021. V. 11. № 2. P. 230–245 (In Russ.)] https://doi.org/10.31862/2500-2961-2021-11-2-230-245
Старцев Н.В., Шишкина Е.А., Блинова Е.А., Аклеев А.В. Справочно-информационный комплекс REGISTR Уральского научно-практического центра радиационной медицины ФМБА России // Мед. радиология и радиац. безопасность. 2022. Т. 67. № 1. С. 46–53. [Startsev N.V., Shishkina E.A., Blinova E.A., Akleev A.V. Reference and information complex REGISTR of the Urals research center for radiation medicine of the FMBA of Russia // Мedical Radiology and Radiation Safety. 2022. Т. 67. № 1. P. 46–53 (In Russ.)] https://doi.org/10.12737/1024-6177-2022-67-1-46-53
Fenech M. Cytokinesis-block micronucleus cytome assay // Nature Protocols. 2007. V. 2. № 5. P. 1084–1104. https://doi.org/10.1038/nprot.2007.77
Fenech M., Chang W.P., Kirsch-Volders M. et al. HUMN project: detailed description of the scoring criteria for the cytokinesis-block micronucleus assay using isolated human lymphocyte cultures // Mutat. Res. 2003. V. 10. № 534. № 1–2. P. 65–75. https://doi.org/10.1016/s1383-5718(02)00249-8
Толстых Е.И., Возилова А.В., Дегтева М.О., Аклеев А.В. Концепция Т-клеточного рода как основа для анализа результатов цитогенетических исследований при локальном облучении костного мозга // Радиац. биология. Радиоэкология. 2020. Т. 60. № 1. С. 12–25. [Tolstykh E.I., Vozilova A.V., Degteva M.O., Akleyev A.V. Concept of T-cell genus as the basis for the analysis of FISH results after local bone marrow exposure // Radiation biology. Radioecology. 2020. V. 60. № 1. P. 12–25. (In Russ)] https://doi.org/10.31857/S0869803120010142
Balajee A.S., Bertucci A., Taveras M., Brenner D.J. Multicolour FISH analysis of ionising radiation induced micronucleus formation in human lymphocytes // Mutagenesis. 2014. V. 29. № 6. P. 447–455. https://doi.org/10.1093/mutage/geu041
Leach N.T., Jackson-Cook C. The application of spectral karyotyping (SKY) and fluorescent in situ hybri-dization (FISH) technology to determine the chromosomal content(s) of micronuclei // Mutat. Res. 2001 V. 495. № 1–2. P. 11–19. https://doi.org/10.1016/s1383-5718(01)00194-2
Dumont M., Gamba R., Gestraud P. et al. Human chromosome-specific aneuploidy is influenced by DNA-dependent centromeric features. // EMBO J. 2020. V. 39. P. e102924. https://doi.org/10.15252/embj.2019102924
Giunta S., Hervé S., White R.R. et al. CENP-A chromatin prevents replication stress at centromeres to avoid structural aneuploidy // Nat. Acad. Sci. 2021. V. 118. №. 10. e2015634118. https://doi.org/10.1073/pnas.2015634118
Guttenbach M., Koschorz B., Bernthaler U. et al. Sex chromosome loss and aging: in situ hybridization stu-dies on human interphase nuclei // Am. J. Hum. Genet. 1995. V. 57. № 5. P. 1143–1150.
Guttenbach M., Schakowski R., Schmid M. Aneuploidy and ageing: sex chromosome exclusion into micronuclei // Hum. Genet. 1994. V. 94. № 3. P. 295–298. https://doi.org/10.1007/BF00208287
Hovhannisyan G.G. Fluorescence in situ hybridization in combination with the comet assay and micronucleus test in genetic toxicology // Mol. Cytogenet. 2010. V. 3. № 17. https://doi.org/10.1186/1755-8166-3-17
Catalan J., Falck G.C., Norppa H. The X chromosome frequently lags behind in female lymphocyte anaphase // Am. J. Hum. Genet. 2000. V. 66. № 2. P. 687–691. https://doi.org/10.1086/302769
Hovhannisyan G., Aroutiounian R., Liehr T. Chromosomal composition of micronuclei in human leukocytes exposed to mitomycin C // J. HistochemCytochem. 2012. V. 60. № 4. P. 316–322. https://doi.org/10.1369/0022155412436587
Fauth E., Scherthan H., Zankl H. Chromosome pain-ting reveals specific patterns of chromosome occurrence in mitomycin C- and diethylstilboestrol-induced micronuclei // Mutagenesis. 2000. V. 15. № 6. P. 459–467. https://doi.org/10.1093/mutage/15.6.459
Fauth E., Zankl H. Comparison of spontaneous and idoxuridine-induced micronuclei by chromosome painting // Mutat. Res. 1999. V. 440. № 2. P. 147–156. https://doi.org/10.1016/s1383-5718(99)00021-2
Fauth E., Scherthan H., Zankl H. Frequencies of occurrence of all human chromosomes in micronuclei from normal and 5-azacytidine-treated lymphocytes as revealed by chromosome painting // Mutagenesis. 1998. V. 13. № 3. P. 235–241. https://doi.org/10.1093/mutage/13.3.235
Guttenbach M., Schmid M. Exclusion of specific human chromosomes into micronuclei by 5-azacytidine treatment of lymphocyte cultures // Exp. Cell Res. 1994. V. 211. № 1. P. 127–132. https://doi.org/10.1006/excr.1994.1068
Guo X., Ni J., Liang Z. et al. The molecular origins and pathophysiological consequences of micronuclei: New insights into an age-old problem // Mutat. Res. Rev. Mutat. Res. 2019. № 779. P. 1–35. https://doi.org/10.1016/j.mrrev.2018.11.001
Peace B.E., Livingston G., Silberstein E.B., Loper J.C. A case of elevated spontaneous micronucleus frequency derived from chromosome 2 // Mutat. Res. 1999. V. 430. № 1. P. 109–119. https://doi.org/10.1016/s0027-5107(99)00171-2
Non-random Mis-segregation of Human Chromosomes // Cell Rep. 2018. V. 23. № 11. P. 3366–3380. https://doi.org/10.1016/j.celrep.2018.05.047
Pathak R., Ramakumar A., Subramanian U., Prasanna P.G. Differential radio-sensitivities of human chromosomes 1 and 2 in one donor in interphase- and metaphase-spreads after 60Co gamma-irradiation // BMC Med. Phys. 2009. V. 9. № 6. https://doi.org/10.1186/1756-6649-9-6
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология