Радиационная биология. Радиоэкология, 2021, T. 61, № 2, стр. 144-150
Цитостатические и радиомодифицирующие эффекты D-глюкозамина на клетках человека в культуре
Н. Я. Гильяно 1, *, М. М. Дуботолова 1, Л. А. Носкин 1, Л. В. Коневега 1, С. И. Степанов 1, Ф. М. Ибатуллин 1
1 Петербургский институт ядерной физики им. Б.П. Константинова, НИЦ “Курчатовский институт”
Гатчина, Россия
* E-mail: gilyano_nj@pnpi.nrcki.ru
Поступила в редакцию 29.01.2020
После доработки 14.12.2020
Принята к публикации 16.12.2020
Аннотация
На трех линиях клеток человека исследовали роль цитостатического фактора в цитотоксическом эффекте γ-облучения до и после обработки клеток ингибитором гликолиза D-глюкозамином (GlcN). Показано, что обработка клеток GlcN приводила к аккумуляции клеток в G1-фазе клеточного цикла. Предрадиационная обработка клеток GlcN приводит к значительному (более чем в 2 раза) увеличению доли апоптотически гибнущих опухолевых клеток (линий HeLa G 63, Hep G2) по сравнению с раздельным воздействием, чего не наблюдается для неопухолевых клеток (ECV 304). GlcN индуцировал селективно направленную радиосенсибилизацию опухолевых клеток. Синергетический эффект регистрировался через 48 ч после облучения. Предполагается, что GlcN ингибирует АТФ зависимые пострадиационные репарационные процессы.
D-глюкозамин, природный аминосахар, является важной компонентой гликопротеинов, протеогликанов и глюкозоаминогликанов. Показана его антиоксидантная и антивоспалительная способность. Молекулярный механизм противовоспалительного действия D-глюкозамина состоит в ингибировании транслокации внутрь клеточного ядра транскрипционного фактора NF-κВ посредством связывания с рецептором CD44. Взаимодействуя с белком CD44, D-глюкозамин активирует внутриклеточные сигнальные процессы и влияет на синтез других белков протеома [1, 2]. Более полувека назад была показана противоопухолевая активность D-глюкозамина [3]. Показана токсичность D-глюкозамина для нескольких малигнантных клеточных линий и in vivo опухолей при концентрациях, имеющих малый эффект на нормальные клетки [4–6]. Известно, что D-глюкозамин ингибирует гликолиз, снижая активность гексокиназы. Показано, что ингибиторы гликолиза нарушают прогрессию клеток по циклу, аккумулируя их либо в G1, либо в G2/М фазах клеточного цикла [6–8]. Регуляция клеточного цикла является важным фактором, модифицирующим радиочувствительность клеток. Блокирование прогрессии клеток по циклу способствует частичной синхронизации их и последующее облучение может привести к увеличению цитотоксического эффекта ионизирующего излучения.
Радиомодифицирующий эффект ингибиторов гликолиза интенсивно исследуется как in vitro, так и in vivo, но в основном это касается 2-дезокси-D-глюкозы (2-DG) [7, 9, 10]. Показано, что 2-DG селективно усиливает радиационно-индуцированные повреждения в опухолевых клетках, не влияя на нормальные клетки [10, 11]. Исследований, оценивающих влияние нетоксичных концентраций GlcN на радиочувствительность опухолевых клеток, в доступных нам источниках информации не обнаружено.
Ранее нами была показана повышенная чувствительность клеток карциномы шейки матки (линия HeLa G63) к двум аналогам глюкозы D-глюкозамину и 2-DG при концентрациях (1.5; 3; 5; 10 ммоль/л), нетоксичных для эндотелиоцитов (линия ECV 304). Оба аналога со сходным механизмом действия при этих концентрациях включали в клетках различные чек-пойнты: GlcN блокировал клетки в G1-фазе, а 2-DG – в G2/M. При сочетанной обработке клеток GlcN и 2-DG регистрировали большую гибель опухолевых клеток, чем при раздельном воздействии. Предполагается, что синергетический эффект при сочетанной обработке является результатом блокирования пролиферации сразу в двух точках клеточного цикла [6].
Цель работы заключалась в оценке цитостатического и радиомодифицирующего действия GlcN при облучении трех клеточных линий человека γ-квантами 60Со.
МАТЕРИАЛЫ И МЕТОДИКА
Работа выполнена на клетках карциномы шейки матки (линия HeLa G 63), гепатокарциномы (линия Hep G2) и на эндотелиоцитах (линия ECV 304) человека. В клетках линии Hep G2 отсутствует активность NAPRT (NA-фофорибозил трансфераза). Клетки культивировали в среде Игла с добавлением 10%-ной эмбриональной сыворотки и гентамицина (50 мкг/мл) (“БиолоТ”).
Клетки выращивали в пенициллиновых флаконах с покровными стеклами, что позволяло одновременно проводить морфологический и цитометрический анализ одной и той же популяции клеток. В работе использованы гидрохлорид D-глюкозамина и 2-дезокси-D-глюкоза (“Sigma”). Для обработки клеток готовили 1-молярные растворы (моль/л) этих агентов в питательной среде, из которых затем готовили растворы исследуемых концентраций (3 и 10 ммоль/л). Обработку клеток проводили в течение 24 ч до облучения γ-квантами 60Cо. Цитометрический и морфологический анализы эффективности обработки клеток растворами ингибиторов гликолиза и γ-квантами 60Cо проводили через 48 ч.
Облучение клеток γ-квантами 60Cо проводили на установке “Исследователь” ПИЯФ им. Б.П. Константинова при мощности дозы 7 Гр/мин. Минимальная доза, технически достижимая на данной установке при проведении экспериментов, была 6.7 Гр (спуск-подъем образца 57 с; погрешность в определении дозы в пределах 10–15%). Дозовые характеристики установки проверяются ежегодно службой дозиметрии ПИЯФ им. Б.П. Константинова с использованием ферросульфатного метода, последнее измерение проводили за неделю до облучения.
Клетки, выращенные на покровных стеклах, фиксировали 96%-ным этанолом, затем окрашивали ацетоорсеином и учитывали морфологические изменения, такие как фрагментация ядер, наличие микроядер, вакуолизация цитоплазмы с помощью светового микроскопа “Motic” (Китай) или прижизненно окрашивали DAPI или Hoechst 33242 и анализировали на флуоресцентном микроскопе EVOS (Thermo Fisher Scientific, США). Для каждого образца анализировали не менее 1000 клеток. Для проточно-цитометрического анализа, проведенного на двух цитометрах (FACS, США, и экспериментальном приборе, созданном в лаборатории медицинской биофизики ПИЯФ им. Б.П. Константинова), клетки, выросшие на поверхности флаконов, снимали раствором Версена (“Биолот”). Клеточную суспензию центрифугировали, осадок суспендировали в растворе, содержащем 0.1% бромистого этидия и оценивали распределение клеток по содержанию ДНК, которое позволяет проследить как за прогрессией клеток по циклу: 2с – G1-фаза; 3c – S-фаза; 4c – G2/M-фазы, так и оценить цитотоксичность препаратов, анализируя долю клеток с содержанием ДНК меньше диплоидного (<2с или sub-G1-популяцию), возникающую в результате фрагментации ядра в процессе апоптотической гибели клеток [12].
Статистическую обработку результатов проводили в программе Microsoft Excel 2010 (Microsoft Corporation, США). Эксперимент повторяли не менее 3 раз. В каждом образце анализировали не менее 20 тыс. клеток. Каждая точка представляет среднее арифметическое значение 3–5 повторов (%) ± стандартное отклонение (М ± σ). Сравнение средних значений проводили с помощью t-критерия Стьюдента. Статистически значимыми принимали отличия при р ≤ 0.05.
РЕЗУЛЬТАТЫ
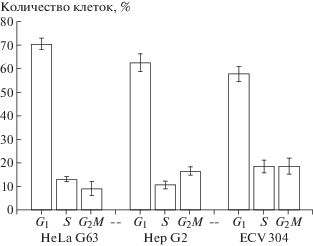
На рис. 1 представлены результаты 24-часовой обработки клеток 3 ммоль/л GlcN и видно накопление клеток в G1-фазе клеточного цикла в большей степени при обработке клеток карциномы HeLa G 63 и Hep G2 (70%) и в меньшей клеток ECV 304 (60%). Эти результаты подтверждают данные других исследователей [8] и наши ранее полученные данные, из которых следовало, что GlcN при этой концентрации (3 ммоль/л) блокирует прогрессию клеток по циклу, что и приводило к аккумуляции клеток в G1-фазе, в отличие от второго ингибитора гликолиза 2-DG, обработка которым приводила к аккумуляции клеток в G2/M-фазах клеточного цикла [6, 13].
Рис. 1.
Распределение клеток HeLa G63, Hep G2, ECV 304 по фазам клеточного цикла после 24-часовой обработки их 3 ммоль/л раствором GlcH.
Fig. 1. The distribution of HeLa G63, Hep G2, ECV 304 cells according to the phases of the cell cycle after 24 hours of processing them with 3 mmol/l GlcH.
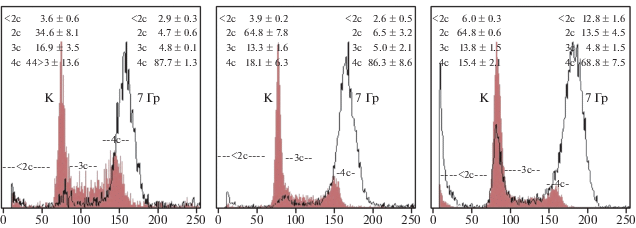
На рис. 2 представлены гистограммы одного из трех экспериментов по оценке влияния γ-квантов, испускаемых при распаде 60Со, на изменения в распределении клеток по содержанию ДНК через 24 ч после облучения. На гистограммах также приведены средние значения этого распределения по трем независимым экспериментам для клеток линии Hep G2 и по пяти независимым экспериментам для клеток HeLa G63 и ECV 304. Из гистограмм видно, что облучение клеток 60Сo в дозе 7 Гр приводило к аккумуляции клеток в G2/M [4с = 75–88%] фазах клеточного цикла вне зависимости от типа клеток. При этом доля клеток с содержанием ДНК <2с (клетки с фрагментированными ядрами) увеличивалась незначительно (в пределах 1%) при фиксации клеток через 24 ч после облучения, что может свидетельствовать о том, что этого времени недостаточно для реализации программы радиационно-индуцированного апоптоза. Следует отметить, что клетки линии Hep G2 оказались более чувствительны к действию ионизирующего излучения, поскольку уровень клеток с содержанием ДНК <2с увеличивался вдвое с 6% без облучения до 12.8% после облучения по сравнению с необлученным контролем.
Рис. 2.
Гистограммы распределения клеток по содержанию ДНК до и после облучения γ-квантами 60Со в дозе 7 Гр одного из пяти экспериментов. Заштрихованная гистограмма – без облучения, не заштрихованная – через 24 ч после облучения γ-квантами 60Со в дозе 7 Гр.
Fig. 2. Histograms of the distribution of cells by DNA content before and after irradiation with γ-quantum of 60Co rays at a dose of 7 Gy of one of 5 experiments. The shaded histogram – without irradiation, not shaded – 24 hours after irradiation with γ-quantum of 60Co at a dose of 7 Gy.
При увеличении временного интервала между облучением и фиксацией клеток до 48 ч распределение клеток по содержанию ДНК существенно отличается от фиксации клеток через 24 ч. Результаты представлены на рис. 3, из которого видно, что острое облучение γ-квантами 60Со в дозе 7 Гр с последующей 48-часовой инкубацией клеток приводило к снижению доли клеток, аккумулированных в G2/M (4с), по сравнению с фиксацией через 24 ч после облучения и увеличению доли клеток с содержанием ДНК <2с во всех линиях. Быстрее всех выходили из блока G2/M клетки линии Hep G2, а медленнее клетки линии ECV 304, у которых даже после 48 ч после облучения 67% клеток находились в G2/M-фазах.
Рис. 3.
Распределение клеток по фазам клеточного цикла через 48 ч после облучения γ-квантами 60Со в дозе 7 Гр и обработки 3 ммоль/л GlcH.
Fig. 3. Distribution of cells according to the phases of the cell cycle 48 hours after irradiation with γ-quantum of 60Co at a dose of 7 Gy and treatment with a 3 mmol/l GlcH.
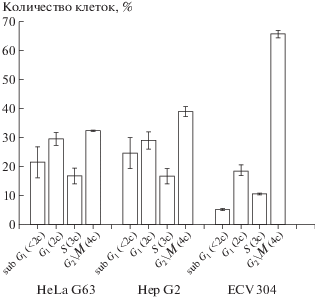
Предрадиационная инкубация клеток HeLa G63 с GlcN в концентрации 3 ммоль/л приводила к существенному увеличению доли клеток с содержанием ДНК <2с (в 7 раз по сравнению с облучением без GlcN и в 3 раза по сравнению с GlcN без облучения), т.е. предобработка клеток GlcN более чем в 2 раза увеличивала долю клеток с содержанием ДНК <2с. Вдвое снижалась доля клеток, заблокированных в G2/M (4с) 61.7 ± 1.9% только при облучении и 32.3 ± 0.4% при (GlcN + + облучение). Очевидно, что в апоптоз уходят клетки заблокированные в фазах G2/M (4с).
Для клеток линии Hep G2 предрадиационная инкубация с GlcN привела к увеличению доли клеток с содержанием ДНК <2с вдвое 24.6 ± 3.8% по сравнению с GlcN 10.3 ± 1.9% и втрое по сравнению с облучением 7.6 ± 0.5%. Коэффициент синергизма для линии Hep G2, рассчитанный как отношение величины доли клеток с содержанием ДНК <2с при сочетанном воздействии к сумме величин при раздельном воздействии, был 1.37. Существенно снижалась доля клеток как в G1-фазе, так и в G2/M, что позволяет предположить, что фракция погибающих клеток увеличилась за счет клеток из этих фаз клеточного цикла.
Для клеток линии ECV 304 увеличение временного интервала между облучением и фиксацией клеток также привело к снижению доли клеток, заблокированных в G2/M, с 87.7 ± 1.3% через 24 ч до 67.4 ± 3.1% через 48 ч после облучения. Однако, в отличие от клеток HeLa G63 и Hep G2, предрадиационная инкубация клеток ECV 304 с 3 ммоль/л GlcN существенно не изменила распределения клеток по фазам цикла. Так, клеток в G1-фазе было 19.2 ± 1.8% без обработки GlcN и 18.6 ± 2.0% при облучении с GlcN. Клеток в G2/M-фазах было 67.4 ± 3.1% без обработки раствором GlcN и 65.6 ± 1.2% при облучении после обработки. При этом доля клеток с содержанием ДНК <2с при облучении клеток ECV 304 обработанных раствором GlcN увеличивалась до 5.2 ± 0.4% по сравнению с контролем 1.4 ± 0.9%, но практически не отличалось от раздельной обработки клеток GlcN 5.0 ± 3.2% и облучением 4.4 ± 1.9%. Коэффициент синергизма для эндотелиоцитов, рассчитанный как отношение величины доли клеток с содержанием ДНК <2с при сочетанном воздействии к сумме величин при раздельном воздействии, был 0.89. Очевидно, что клетки линии ECV 304 более устойчивы к индуцированной GlcN радиосенсибилизации по сравнению с клетками гепатокарциномы (Hep G2) и карциномы шейки матки (HeLa G63).
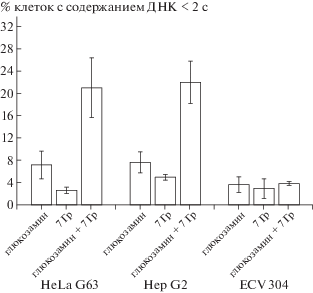
На рис. 4 представлены результаты экспериментов по оценке уровня клеток с содержанием ДНК <2c (апоптотически гибнущих клеток) после раздельной и сочетанной обработки клеток 10 ммоль/л GlcN и γ-квантами 60Со в дозе 7 Гр. Из диаграмм видно, что радиочувствительность клеточных линий, оцененная по уровню популяции клеток с содержанием ДНК <2с, для клеток линии HeLa G63 и ECV 304 была примерно одинаковой, что подтверждает ранее опубликованные данные, в которых радиочувствительность этих клеточных линий оценивалась нами по уровню радиационно-индуцированных хромосомных повреждений [14]. Сравнительный анализ индукции апоптотической гибели клеток при раздельном и сочетанном воздействии GlcN и γ-квантами 60Со выявил бóльшую чувствительность клеток линии HeLa G63 и Hep G2 к обработке GlcN, чем клетки линии ECV 304. Сочетанное воздействие GlcN и γ-квантов 60Со вдвое и втрое увеличивало эффективность по сравнению с раздельными обработками клеток карциномы линии HeLa G63 и Hep G2. Иными словами, для этих клеток регистрируется существенный синергетический эффект, чего не наблюдается для линии ECV 304. При этом стоит отметить, что GlcN не только увеличивает эффективность облучения γ-квантами 60Со, но сам проявляет селективную цитотоксичность в отношении опухолевых клеток.
Рис. 4.
Уровень клеток с содержанием ДНК <2c после раздельной и сочетанной обработки клеток 10 ммоль/л GlcH и облучения γ-квантами 60Со в дозе 7 Гр.
Fig. 4. The level of cells with DNA content <2c after separate and combined treatment of cells with 10 mmol/l GlcH and irradiated with γ-quantum of 60Co at a dose of 7 Gy.
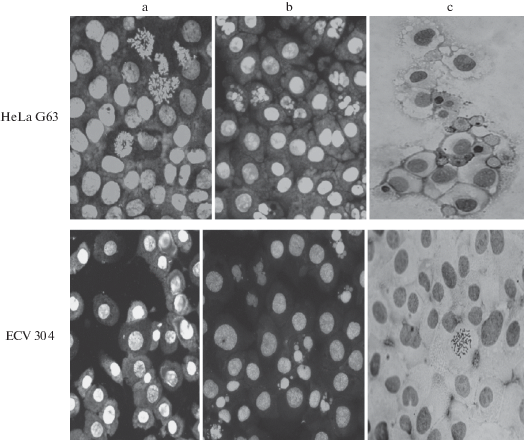
Результаты цитометрического анализа подтверждаются морфологическим анализом состава клеточной популяции до и после сочетанного воздействия GlcN и γ-квантами 60Со, представленного на рис. 5. На фотографиях отчетливо видны различия между клетками HeLa G63 и ECV 304. Так, для клеток HeLa G63 регистрируется значительное увеличение апоптотической гибели клеток при сочетанном воздействии через 48 ч после облучения. При этом кроме фрагментации ядерного материала хорошо видна вакуолизация цитоплазмы и нарушения целостности клеточных мембран. Для клеток ECV 304 наглядно проявляется образование микроядер разных размеров, которые при цитометрическом анализе выявляются как клетки с содержанием ДНК <2c и нет фрагментации ядерного материала, характерного для апоптотической гибели клеток.
Рис. 5.
Морфологические изменения клеток HeLa G 63 (верхняя панель) и ECV 304 (нижняя панель), обработанных 10 ммоль/л раствором GlcHCl и облученных γ-квантами 60Со в дозе 7 Гр: а – без обработки, b – через 48 ч, c – через 72 ч после обработки.
Fig. 5. Morphological changes of HeLa G 63 cells (upper panel) and ECV 304 (lower panel) treated with 10 mmol/l GlcN and irradiated with γ-quantum of 60Co at a dose of 7 Gy: a – without treatment, b – 48 hours after treatment, c – 72 hours after treatment.
ОБСУЖДЕНИЕ
Регуляция клеточного цикла является важным фактором, модифицирующим радиочувствительность клеток. Показана различная радиочувствительность клеток, облученных в различных фазах клеточного цикла. Меньшую радиочувствительность проявляют клетки в S-фазе, бóльшую – в G2/М и G1-фазах. Повышенная зависимость опухолевых клеток от глюкозы, в силу их метаболической особенности, позволяет использовать аналоги глюкозы в качестве ингибиторов клеточной пролиферации для селективной синхронизации клеточной популяции. Выявленные нами ранее различия в блокировании пролиферации в двух фазах клеточного цикла двумя аналогами глюкозы – 2-DG и GlcN, а также синергетический эффект при сочетанном воздействии этих агентов, позволили нам предположить, что цитостатический эффект играет важную роль в цитотоксичности ингибиторов гликолиза. GlcN в используемых нами концентрациях нетоксичен для нормальных клеток [6]. Показано, что низкие концентрации GlcN подавляют активность гена STAT3, стимулирующего пролиферацию и выживаемость опухолевых клеток [15]. Ионизирующее излучение действует эффективнее на активно пролиферирующие клетки, блокируя в основном переход из G2/М-фазы. При сочетанном воздействии GlcN и γ-квантами блокирование клеток происходит сразу в двух точках клеточного цикла: G1 и G2-фазах, преодолеть которые при дефиците АТФ опухолевым клеткам значительно труднее. Второй аналог глюкозы 2-дезокси-D-глюкоза (2-DG) блокирует пролиферацию в G2-фазе клеточного цикла [13] и селективно усиливает радиационно-индуцированные повреждения в опухолевых клетках, не влияя на нормальные клетки. При этом радиосенсибилизирующий эффект 2-DG небольшой [16]. По-видимому, цитостатический эффект 2-DG (блокирование клеток в G2/М) нивелируется более мощным блокированием клеток в этих же фазах ионизирующим излучением [11]. Кроме того, 2-DG индуцирует модификации радиационного ответа, которые прямо не коррелируют с изменениями уровня АТФ. Очевидно, что взаимосвязь энергетического метаболизма и радиобиологических ответов является очень сложной по своей природе и требует дальнейших исследований. Известно, что глюкозамин также ингибирует N-гликозилирование, которое коррелирует с глюкозамин-индуцированной цитотоксичностью. Предполагается, что глобальное ингибирование N-гликозилирования белков может быть основным механизмом, лежащим в основе мультиплетных биохимических и клеточных эффектов глюкозамина [17]. Результаты систематического анализа молекулярных механизмов воздействия глюкозамина и результаты протеомных исследований эффектов глюкозамина показали, что глюкозамин не взаимодействует ни с геномной ДНК, ни с РНК транскриптома, а продукты биотрансформации глюкозамина являются просто отдельными метаболитами из метаболома. Фармакологические эффекты глюкозамина опосредуются исключительно взаимодействием с определенными белками протеома.
ЗАКЛЮЧЕНИЕ
Таким образом, обработка клеток ингибитором гликолиза D-глюкозамином нарушает прогрессию клеток по циклу, синхронизируя их в G1-фазе клеточного цикла, что приводит к апоптотической гибели опухолевых клеток (HeLa G 63; Hep G2), и последующее облучение γ-квантами в дозе 7 Гр приводит к значительному увеличению апоптоза по сравнению с раздельным воздействием каждого из этих агентов, чего не наблюдается для неопухолевых клеток (ECV 304). Таким образом, очевидна селективно-направленная радиосенсибилизация опухолевых клеток, индуцированная D-глюкозамином. При этом стоит отметить, что глюкозамин не только увеличивает эффективность облучения γ-квантами, но сам проявляет селективную цитотоксичность в отношении опухолевых клеток. Поскольку проявление эффекта регистрируется не сразу, а через 48 ч и позже, то можно предположить, что D-глюкозамин ингибирует АТФ-зависимые пострадиационные репарационные процессы.
Список литературы
Oh H.J., Lee J.S., Song D.K., et al. D-glucosamine inhibits proliferation of human cancer cells through inhibition of p70S6K // Biochem. Biophys. Res. Commun. 2007. V. 360. № 4. P. 840–845.
Dalirfardouei R., Kafrimi G., Jamialahmadi K. Molecular mechanisms and biomedical applications of glucosamine as a potential multifunctional therapeutic agent // Life Sci. 2016. V. 152. P. 21–29.
Quastel J.H., Cantero A. Inhibition of tumor growth by D-glucosamine // Nature. 1953. V. 171. P. 252–254.
Zhang L., Liu W.S., Han B.Q., et al. Antitumor activities of D-glucosamine and its derivatives // J. Zhejiang University. Sci. B. 2006. V. 7. P. 608–614.
Jung C.-W., Jo J.-R., Lee S.-H. et al. Anti-cancer pro-perties of glucosamine-hydrochloride in YD-8 human oral cancer cells: Induction of the caspase-dependent apoptosis and down-regulation of HIF-1alpha // Toxicol. In Vitro. 2012. V. 26. P. 42–50.
Гильяно Н.Я., Носкин Л.А., Журишкина Е.В. и др. Комбинация низких доз глюкозамина и 2-DG усиливает цитотоксический эффект в опухолевых клетках человека в культуре // Патол. физиология и эксперим. терапия. 2019. Т. 63. № 2. С. 41–49. [Giliano N.Ya., Noskin L.A., Zhurishkina E.V., et al. The combination of low doses of glucosamine and 2-DG enhances the cytotoxic effect in human tumor cells in culture // Pathological physiology and experimental therapy. 2019. V. 63. № 2. P. 41–49. (In Russian)
Varshney R., Dwarakanath B., Jain V. Radiosensitization by 6-aminonicotinamide and 2-deoxy-D-glucose in human cancer cells // Int. J. Radiat. Biol. 2005. V. 81. № 5. P. 397–408.
Wang L.S., Chen S.J., Zhang J.F., et al. Anti-proliferative potential of Glucosamine in renal cancer cells via inducing cell cycle arrest at G0/G1 phase // BMC Urol. 2017. V. 17. № 1. P. 1–10.
Dwarkanath B.S., Zolzer F., Chandana S. et al. Heterogeneity in 2-deoxy-D-glucose-induced modifications in energetics and radiation responses of human tumor cell lines // Int. J. Radiat. Oncol. Biol. Phys. 2001. V. 50. № 4. P. 1051–61.
Singh D., Banerji A.K., Dwarakanath B.S. et al. Optimizing cancer radiotherapy with 2-deoxy-D-glucose dose escalation studies in patients with glioblastoma multiforme // Strahlenther Onkol. 2005. V. 181. № 8. P. 507–514.
Prasanna V.K., Venkataramana N.K., Dwarakanath B.S., Santhosh V. // J. Cancer Res. Ther. 2009. Suppl. 1. P. S44–47.
Watson J.V. Flow Cytometry Data Analysis: Basic Concepts and Statistics. Cambridge University Press, 2005.
Гильяно Н.Я., Бондарев Г.Н., Коневега Л.В. и др. Возможные механизмы селективного действия ингибиторов гликолиза на эндотелиоциты и клетки карциномы человека // Патол. физиология и эксперим. терапия. 2014. Т. 58. № 4. [Giliano N.Ya., Bondarev G.N., Konevega L.V., et al. Possible mechanisms for the selective action of glycolysis inhibitors on endotheliocytes and human carcinoma cells // Pathological physiology and experimental therapy. 2014. V. 58. № 4. (In Russian)]
Гильяно Н.Я., Бондарев Г.Н., Коневега Л.В. и др. Модификация клеточной радиочувствительности ингибиторами NO-синтазы // Радиац. биология. Радиоэкология. 2005. Т. 45. № 1. С. 63–70. [Giliano N.Ya., Bondarev G.N., Konevega L.V. et al. Modification of cellular radiosensitivity by NO synthase inhibitors // Radiation Biology. Radioecology. 2005. V. 45. № 1. S. 63–70. (In Russian)]
Chesnokov V., Sun Ch., Itakura K. Glucosamine suppresses proliferation of human prostate carcinoma DU145 cells through inhibition of STAT3 signaling // Cancer Cell Int. 2009. V. 9. C. 25.
Islamian J.P., Aghaee F., Farajollahi A., et al. Combined Treatment with 2-Deoxy-D-Glucose and Doxorubicin Enhances the in Vitro Efficiency of Breast Cancer Radiotherapy // Asian Pac. J. Cancer Prev. 2015. V. 16. № 18. P. 8431–8438.
Chesnokov V., Gong B., Sun C., Itakura K. Anti-cancer activity of glucosamine through inhibition of N-linked glycosylation // Cancer Cell Int. 2014. V. 14. № 45. C. 1–10.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


