Радиационная биология. Радиоэкология, 2021, T. 61, № 2, стр. 151-157
Сравнительная эффективность сингенных культивированных мезенхимальных стволовых клеток (ММСК) и свежевыделенных клеток стромально-васкулярной фракции (СВФ) жировой ткани при лечении тяжелых местных лучевых поражений в эксперименте
Ю. Б. Дешевой 1, *, В. Г. Лебедев 1, Т. А. Насонова 1, О. А. Добрынина 1, А. В. Лырщикова 1, Т. А. Астрелина 1, Б. Б. Мороз 1
1 Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
Москва, Россия
* E-mail: iury.deshevoi@yandex.ru
Поступила в редакцию 07.07.2020
После доработки 03.12.2020
Принята к публикации 16.12.2020
Аннотация
Сравнивали в одних и тех же экспериментах эффективность культивированных ММСК и свежевыделенных клеток СВФ жировой ткани при лечении тяжелых местных лучевых поражений. Крыс инбредной линии Wistar-Kyoto подвергали локальному воздействию рентгеновского излучения в области спины в дозе 110 Гр (напряжение на трубке 30 кВ, сила тока 6.1 мА, фильтр 0.1 мм Al; мощность дозы 20.0 Гр/мин). Облучение приводило к развитию тяжелых поражений кожи с длительно (до 3.5–4.0 мес.) незаживающими лучевыми язвами без критической лучевой нагрузки на подлежащие ткани. Проведено три эксперимента. Трансплантации ММСК проводили во всех опытах двукратно на 27-е и 34-е сутки после облучения. Клетки СВФ в двух опытах вводили двукратно (на 14-е и 26-е сутки или на 27-е и 34-е сутки), а в третьем – трехкратно на 21-е, 35-е и 42-е сутки поcле облучения. Суспензию ММСК или клеток СВФ в 1 мл стерильного раствора Хенкса вводили под кожу в пять точек вокруг зоны поражения, отступив 5 мм от края язвы. Число трансплантированных ММСК и клеток СВФ при одном введении составляло 1.5–2.8 × 106 и 2.5–2.7 × 106 соответственно. Клеточная терапия снижала тяжесть течения местных лучевых поражений и ускоряла скорость заживления лучевых язв. Лечебная эффективность ММСК и клеток СВФ в наших экспериментах была примерно одинакова.
Местные лучевые поражения кожи и подлежащих тканей являются одним из наиболее распространенных видов радиационных повреждений у человека. Консервативные способы лечения тяжелых местных лучевых поражений, незаживающих хронических лучевых язв часто малоэффективны [1–3]. Поэтому в настоящее время активно разрабатываются и применяются методы клеточной терапии этой патологии. При трансплантации определенных клеток появляется возможность возмещения пораженных клонов специализированных клеток в поврежденных органах и увеличения пула функционирующих клеток, а также активизации в сохранившихся клетках собственного резерва пролиферации и стимуляции регенерации тканей.
Мезенхимальные стволовые клетки (ММСК) костного мозга применяются в эксперименте и клинике для лечения различных заболеваний, в том числе для терапии лучевых ожогов [4–16]. Эффект ММСК, в основном, связан с их влиянием на трофику пораженной ткани и с выделением целого ряда цитокинов и ростовых факторов, влияющих на регенераторные процессы [4–6, 17].
В настоящее время подкожная жировая ткань является альтернативным (костному мозгу и пуповинной крови) источником получения ММСК для аутологичных трансплантаций в клинике. Это связано с простым способом получения подкожного жира у человека и более высоким (на один-два порядка) содержанием ММСК в строме этой ткани по сравнению с костным мозгом. При этом функционально ММСК жира не отличается от ММСК костного мозга [17–23]. Поэтому ММСК жировой ткани могут применяться для трансплантаций как в виде популяции культивированных клеток, так и в виде свежевыделенных клеток стромально-васкулярной фракции (СВФ). Предполагается, что клетки СВФ будут даже более эффективными при трансплантациях по сравнению с культивированными ММСК, что может быть обусловлено возможностями кооперативного взаимодействия клеток, входящих в состав СВФ [21].
Целью работы было сравнение в одних и тех же экспериментах лечебной эффективности культивированных мезенхимальных стволовых клеток и свежевыделенных клеток стромально-васкулярной фракции жировой ткани для совершенствования метода клеточной терапии тяжелых местных лучевых поражений.
МАТЕРИАЛЫ И МЕТОДИКА
Опыты были проведены на крысах самцах инбредной линии Wistar-Kyoto массой тела 250–280 г, полученных из питомника ФИБХ РАН (г. Пущино). Процедуры и манипуляции с животными проводили в соответствии с “Правилами лабораторной практики в Российской Федерации”, утвержденными приказом Министерства здравоохранения РФ № 267 от 19.06.2003 г.
Предварительно фиксированных крыс подвергали локальному воздействию (подвздошно-поясничная область спины) рентгеновского излучения на установке ЛНК-268 (РАП 100-10) в дозе 110 Гр (напряжение на трубке 30 кВ, сила тока 6.1 мА, фильтр 0.1 мм Al). Мощность дозы составляла 18.0–20.0 Гр/мин. Поверхность кожи животных облучали на площади 8.5 см2. Радиационное воздействие приводило к развитию тяжелых поражений кожи с длительно (до 3.5–4.0 мес.) незаживающими лучевыми язвами, причем без критической лучевой нагрузки на подлежащие ткани [24].
Для получения клеток СВФ подкожную жировую ткань извлекали из брюшной и паховой областей у наркотизированных интактных крыс, которые не использовались в дальнейших опытах. Далее в стерильных условиях жировую ткань механически измельчали ножницами и обрабатывали коллагеназой IA для растворения коллагеновых волокон и освобождения клеток из окружающей ткани. После последующего центрифугирования выделяли клетки СВФ [25, 26], которые сразу же использовали для трансплантации без какой-либо дополнительной обработки или высаживали их в культуральные флаконы для получения ММСК и наработки их in vitro.
Проведено морфологическое исследование выделенных клеток стромально-васкулярной фракции, окрашенных по методу Паппенгейма. Процентное соотношение клеток в мазках было следующим – различные популяции стромальных клеток – 31.6% и ядросодержащие клетки крови – 68.4%.
Для получения популяции ММСК клетки СВФ сразу после их выделения суспендировали в полной культуральной среде Iscov’MDM+ Glutamax + Hepes (Sigma, США), содержащей 15% эмбриональной сыворотки крупного рогатого скота (“HyClone”, США), гентамицин 50.0 мг/л, амфотерицин Б 2.5 мг/л и высаживали в культуральные пластиковые флаконы (Corning). Культивирование проводили в CO2 инкубаторе (Sanyo, Япония). Клетки формировали на дне флакона монослой и имели фибробластоподобную морфологию. Для трансплантаций использовали ММСК третьего-четвертого пассажей при 80–90%-ной конфлюентности клеток на дне флакона.
Суспензию ММСК или свежевыделенных клеток СВФ в 1 мл стерильного раствора Хенкса (без ионов Ca и Mg) вводили облученным крысам под кожу в пять точек (по 0.2 мл на точку) вокруг лучевой язвы, отступив 5–7 мм от края очага. Контрольным животным, подвергшимся радиационному воздействию, по той же схеме вводили раствор Хенкса. Во всех опытах в каждой группе было от 8 до 14 крыс. Длительность наблюдения за облученными животными составляла 15 нед.
Считается, что для достижения лечебного эффекта (при местном введении) мелким лабораторным животным достаточно ввести 1.0–3.0 × 106 ММСК [27]. В наших различных экспериментах число введенных ММСК отличалось между собой (но в “лечебном” диапазоне), что будет описано в каждом конкретном случае.
Свежевыделенные клетки СВФ трансплантировали во всех опытах в количестве от 2.5 × 106 до 3.0 × 106 на животное. В экспериментах на крысах для получения лечебного эффекта обычно вводят (при различных способах их применения) от 1.0–4.0 × 106 клеток СВФ [28–30].
Тяжесть течения лучевого поражения и эффективность клеточной терапии оценивали еженедельно в динамике по изменению клинической картины и скорости заживления лучевых язв. Площади лучевых язв вычисляли по их цифровым фотографиям при помощи компьютерной программы AutoCad 14.
Полученный цифровой материал обрабатывали методом вариационной статистики с вычислением средней и стандартной ошибки (M ± m). Статистическую значимость различий оценивали по t-критерию Стьюдента.
РЕЗУЛЬТАТЫ
Клиническая картина радиационного поражения кожи развивалась постепенно: через 7–10 дней после облучения наблюдалось развитие сухого дерматита, который к 13–16-м суткам переходил во влажный с десквамацией и микроязвлениями эпидермиса. Этот процесс нарастал и к 20–24-м суткам происходило формирование лучевой язвы (в центре зоны локального облучения), покрытой струпом. Морфологические исследования показали, что в этот период некроз охватывает все слои кожи. В дальнейшем наблюдали постепенное заживление язвы, проявляющееся снижением воспалительных явлений в ране, ее краевой эпителизацией, сокращением размера язвы и заживлением с образованием атрофического рубца.
Ранее нами [31] было показано, что ММСК наиболее эффективны при лечении тяжелых лучевых поражений кожи у крыс при условии их двукратной трансплантации в период, когда лучевая язва уже сформирована и в ране начинают преобладать процессы регенерации. Определено, что наиболее оптимальными сроками для трансплантации ММСК были 27-е и 34-е сутки после облучения. Поэтому в наших экспериментах оценивалась лечебная эффективность разных схем введения клеток СВФ (более раннее – 14-е и 26-е сутки, одновременное – 27-е и 34-е сутки, а также более длительное и позднее – трехкратное на 20-е, 34-е и 41-е сутки) по сравнению со стандартной схемой применения ММСК на 27-е и 34-е сутки после облучения.
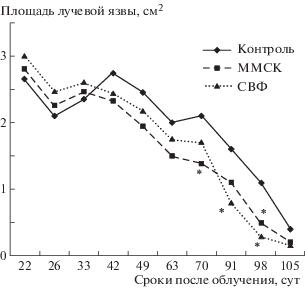
На рис. 1 представлены результаты эксперимента, где изучали эффекты более раннего двукратного введения клеток СВФ (на 14-е и 26-е сутки) по сравнению со стандартной двукратной трансплантацией ММСК (на 27-е и 34-е сутки). Показано, что введение ММСК стимулировало заживление лучевых язв. Так, в период с 49-х по 105-е сутки после облучения площадь язв у леченых животных была на 21–52% меньше, чем у облученного контроля. Введение клеток СВФ на 14-е и 26-е сутки также оказывало лечебное действие. Динамика заживления лучевых язв у животных с трансплантированными СВФ в целом была близка к таковой при введении ММСК. Однако до 70-х суток она несколько отставала, а к 90-м суткам даже опережала скорость заживления у животных с трансплантированными ММСК.
Рис. 1.
Динамика заживления лучевых язв кожи у крыс после локального облучения в условиях трансплантации ММСК жировой ткани на 27-е и 34-е сутки или клеток СВФ на 14-е и 26-е сутки после воздействия радиации. Примечание. В каждой группе по 9 крыс. Введение ММСК: на 27-е сутки ввели 1.9 × 106 клеток, на 34-е сутки – 1.5 × 106 клеток; введение СВФ: на 14-е и 26-е сутки ввели 2.5 × 106–3.0 × 106 клеток. *Значимые различия (р < 0.05) по сравнению с облученным контролем .
Fig. 1. Dynamics of healing of skin ulcers in rats after local radiation in the conditions of transplantation of MMSC adipose tissue on the 27th and 34th day or SVF cells on the 14th and 26th after exposure to radiation. Note. There are 9 rats in each group. Introduction of MMSC: on 27 days introduced 1.9 × 106 cells, on 34 days introduced 1.5 × 106 cells; introduction of SVF: on the 14th and 26th day injected 2.5 × 106–3.0 × 106 cells. * Significant differences (p < 0.05) compared to irradiated control.
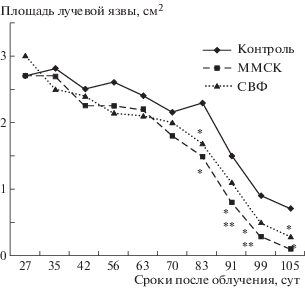
Лечебная эффективность клеток СВФ при двукратном их введении в оптимальные для проявления эффекта ММСК (27-е и 34-е сутки) сроки была меньше, чем при трансплантации ММСК (рис. 2). Так, в период с 83 по 105 дней площадь лучевых язв у крыс с введением СВФ оказалась на 9–33% больше, чем у животных, леченных ММСК. Причем на 91–99-е сутки эта разница была статистически значимой.
Рис. 2.
Изменения площади лучевых язв у крыс после локального воздействия рентгеновского излучения в дозе 110 Гр и трансплантации ММСК или клеток СВФ на 27-е и 34-е сутки после облучения. Примечание. В каждой группе по 14 животных. Введение ММСК: на 27-е сутки ввели 2.6 × 106 клеток, на 34-е сутки – 2.9 × 106 клеток; введение СВФ: на 27-е и 34-е сутки вводили 2.5 × 106–3.0 × 106 клеток. * Значимые отличия (р < 0.05) от облученного контроля; ** значимые отличия (р < 0.05) от группы СВФ.
Fig. 2. Changes in the area of radiation ulcers in rats after local exposure to X-rays at a dose of 110 Gr and transplantation of MMSC or SVF cells on the 27th and 34th day after radiation. Note. There are 14 animals in each group. Introduction of MMSC: on 27 days, 2.6 × 106 cells were introduced and 2.9 × 106 cells were injected for 34 days; introduction of SVF: on 27 and 34 days injected 2.5 × 106–3.0 × 106 cells. * Significant differences (p < 0.05) from irradiated control; **significant differences (p < 0.05) from the SVF group.
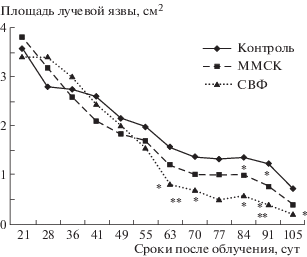
Более сильную терапевтическую активность клеток СВФ по сравнению с введением ММСК выявили в условиях трехкратной трансплантации на 20-е, 34-е и 41-е сутки после облучения. В период с 63-е по 91-е сутки площадь лучевых язв у этих животных была на 22–39% меньше по сравнению с таковой в группе крыс с трансплантированными ММСК. На 63-е и 91-е сутки эта разница была значимой (рис. 3).
Рис. 3.
Изменения площади лучевых язв кожи у крыс после трехкратного введения клеток СВФ на 21-е, 35-е и 42-е сутки или двукратной трансплантации ММСК на 27-е и 34-е сутки после локального воздействия рентгеновского излучения в дозе 110 Гр. Примечание. В каждой группе по 8 крыс. Введение ММСК: на 27-е сутки ввели 1.8 × 106 клеток, на 34-е сутки – 1.9 × 106 клеток. Введение СВФ: на 21-е, 35-е и 42-е сутки вводили по 2.5 × 106–3.0 × 106 клеток. * Значимые отличия (р < 0.05) от облученного контроля; ** значимые различия (р < 0.05) от группы ММСК.
Fig. 3. Changes in the area of skin ulcers in rats after the three-fold introduction of SVF cells on 21, 35 and 42 days or a double transplantation of MMSC on 27 and 34 days after local X-ray radiation at a dose of 110 Gy. Note. There are eight rats in each group. Introduction of MMSC – on 27 days introduced 1.8 × 106 cells, on 34 days – introduced 1.9 × 106 cells. Introduction of SVF – on 21, 35 and 42 days injected on 2.5 × 106– 3.0 × 106 cells. * Significant difference (p < 0.05) from irradiated control; ** reliable differences (p < 0.05) from the MMSC group.
ОБСУЖДЕНИЕ
Представленные данные показывают, что сингенные свежевыделенные клетки стромально-васкулярной фракции жировой ткани при лечении тяжелых местных лучевых поражений могут быть не менее эффективны, чем сингенные культивированные ММСК. Причем, какие клеточные композиции (СВФ или ММСК) более активны при данной патологии, сказать трудно. Наши результаты близки к данным, полученным в работах [32, 33], где в аутологичных (для клеток СВФ) условиях сравнивали лечебную эффективность клеток аутологичных СВФ и ММСК (аутологичных или аллогенных) при различной патологии (не лучевой природы), и были сделаны выводы об их близкой эффективности.
Результаты наших исследований подтверждают данные о возможности применения свежевыделенных клеток СВФ и культивированных ММСК жировой ткани при лечении лучевых поражений кожи [34–39].
Для выяснения возможных механизмов лечебного действия клеток СВФ и культивированных ММСК на лучевые поражения кожи необходимо охарактеризовать их клеточный состав и функциональные возможности.
В состав свежевыделенной СВФ человека входят клетки кроветворного ряда: среди них стволовые и клетки предшественники – 0.1%, гранулоциты 10–15%, лимфоциты 10–15%, моноциты 5–15%. Кроме клеток крови в состав СВФ входят 10–20% эндотелиальных клеток и их предшественников, 15–30% различных популяций стромальных клеток и 10–20% перицитов. Считается, что число ММСК (по тесту – КОЕ-Ф) среди клеток СВФ примерно 1–10% [20. 21] .
В процессе культивирования популяция ММСК становится близкой по составу и несет на своей поверхности маркеры стромальных клеток – CD13, CD73 и CD90 (при снижении экспрессии CD34). Тем не менее, считается, что функционально эти клетки неоднородны и содержат не только стволовые и коммитированные клетки предшественники, но и более дифференцированные стромальные клетки. Количество именно стволовых клеток (по тесту КОЕ-Ф) составляет лишь 5–30% [18–23].
Несмотря на различие в клеточном составе культивируемых ММСК и клеток СВФ, они способны действовать на одни и те же процессы в пораженной радиацией коже. Клетки после трансплантации модулируют иммунные процессы и снижают воспалительные явления в ране [18–23]. Способствуя неоангиогенезу, они улучшают трофику пораженных тканей [18–23, 40]. Трансплантированные ММСК дифференцируются в фибробласты [40], которые активно участвуют в регенераторных процессах. Все это приводит к активизации заживления лучевых язв и их эпителизации. Причем задействуются близкие механизмы влияния: через выработку целого ряда цитокинов и ростовых факторов (IL1, IL6, IL8, IL10, PGE2 TGF-B, HGF, VEGF, KGF, IGF, PDGF-AA, EGF, BDNF, Angiopoetin 1 и др.). Кроме того, имеет место возмещение погибших клеток за счет как самих трансплантированных клеток, так и их дифференцированных потомков [18–23, 40].
ЗАКЛЮЧЕНИЕ
Полученные результаты показывают, что как сингенные культивированные ММСК, так и сингенные свежевыделенные клетки стромально-васкулярной фракции жировой ткани могут с успехом применяться при лечении тяжелых местных лучевых поражений. Лечебная эффективность ММСК и клеток СВФ в наших экспериментах была примерно одинакова.
Список литературы
Радиационная медицина. Руководство для врачей-исследователей и организаторов здравоохранения / Под ред. Л.А. Ильина. Т. 2. М.: ИздАТ, 2001. 432 с. [Radiation medicine: A guide for medical researchers and health care organizers / Ed. L.A. Ilyin. V. 2. M.: Izdat, 2001. 432 p. (In Russian)]
Бушманов А.Ю., Надежина Н.М., Нугис В.Ю. и др. Местные лучевые поражения кожи человека: возможности биологической индикации дозы (аналитический обзор) // Мед. радиология и радиац. безопасность. 2005. Т. 50. № 1. С. 37–47. [Bushmanov A.J., Nadezhina N.M., Nugis V.Yu. et al. Local radiation damage of human skin: possible biological indication of dose (analytical review) // Medical radiology and radiation safety. 2005. V. 50. № 1. Р. 37–47. (In Russian)]
Надежина Н.М., Филин С.В., Сачков А.В. и др. Острые местные лучевые поражения и их последствия (нештатная ситуация при дефектоскопических работах) // Медицина труда и пром. экология. 2004. № 3. С. 40–43. [Nadezhina N.M., Filin S.V., Sachkov A.V. et al. Acute local radiation and their consegutnces (contingency in flaw inspection) / Occupational Medicine and Industrial Ecology. 2004. № 3. P. 40–43. (In Russian)]
Tuan R.S., Boland G., Tuli R. Adult mesenchymal stem cells and cell-based tissue engineering // Arthritis Res. Ther. 2003. V. 5. № 1. P. 32–45.
Онищенко Н.А. Клеточные технологии и современная медицина // Патол. физиология и эксперим. терапия. 2004. № 4. С. 2–11. [Onishhenko N.A. Cellular technology and modern medicine // Pathology Physiology and Experimental Therapy. 2004. № 4. P. 2–11. (In Russian)]
Isakson M., de Blacam C., Whelan D. et al. Mesenchymal stem cells and cutaneous wound healing: current evidence and future potential. Review article // Hundawi publishing corporation. Stem Cells International. V. 2015. Article ID 831095, 12 p.https://doi.org/10.1155/2015/831095
Brower J., Blumberg S., Carroll E. et al. Mesenchymal stem cell therapy and delivery systems in nonhealing wounds // Adv. Skin Wound Care. 2011. Nov. V. 24. № 11. P. 524–532.
Мороз Б.Б., Онищенко Н.А., Лебедев В.Г. и др. Влияние мультипотентных мезенхимальных стромальных клеток костного мозга на течение местных лучевых поражений у крыс после локального β-облучения // Радиац. биология. Радиоэкология. 2009. Т. 49. № 6. С. 688–693. [Moroz B.B., Onischenko N.A., Lebedev V.G. et al. Influence of multipotent mesenchymal stromal cells of bone marrow on process the local radiation injury in rats after local β-irradiation // Radiation Biology. Radioecology. 2009. V. 49. № 6. P. 688–693. (In Russian)]
Котенко К.В., Мороз Б.Б., Надежина Н.М. и др. Трансплантация мезенхимальных клеток при лечении лучевых поражений кожи // Патол. физиология и эксперим. терапия. 2011. № 1. С. 2–7. [Kotenko K.V., Moroz B.B., Nadejina N.M. et al. Mesenchymal stem cells transplantation in the treatment of radiation skin lesions // Pathological physiology and experimental therapy. 2011. № 1. P. 2–7. (In Russian)]
Котенко К.В., Еремин И.И., Мороз Б.Б. и др. Клеточные технологии в лечении радиационных ожогов: Опыт ФМБЦ им. А.И. Бурназяна // Клеточная трансплантология и тканевая инженерия. 2012. Т. 7. № 2. С. 97–102. [Kotenko K.V., Eremin I.I., Moroz B.B. et al. Cell technologies in the treatment of radiation burns: experience Burnasyan Federal Medical Biophysical Centre // Cell transplantology and tissue engineering. 2012. V. 7. P. 97–102. (In Russian)]
Akito S., Akino K., Hiruno A. et al. Proposed regeneration therapy for cutaneous radiation injuries // Acta Med. Nagasak. 2006. V. 51. № 4. P. 50–55.
François S., Bensidhoum M., Mouiseddine M. et al. Local irradiation not only induces homing of human me-senchymal stem cells at exposed sites but promotes their widespread engraftment to multiple organs: a study of their quantitative distribution after irradiation damage // Stem Cells. 2006. V. 24. № 4. P. 1020–1029.
François S., Mouiseddine M., Mathieu N. et al. Human mesenchymal stem cells favour healing of the cutaneous radiation syndrome in a xenogenic transplant mo-del // Ann. Hematol. 2007. V. 86. № 1. P. 1–8.
Mehannil S.S., Ibrahim N.F., Hassan A.R. et al. New Approach of Bone Marrow-Derived Mesenchymal Stem Cells and Human Amniotic Epithelial Cells Applications in Accelerating Wound Healing of Irradiated Albino Rat // Int. J. Stem Cells. 2013. V. 6. № 1. P. 45–54.
Lataillade J.J., Doucet C., Bey E. et al. New approach to radiation burn treatment by dosimetry-guided surgery combined with autologous mesenchymal stem cell therapy // Regen. Med. 2007. V. 2. P. 785–794.
Коноплянников А.Г., Колесникова А.И., Саенко А.С. и др. Кондиционная среда, обладающая лечебным эффектом: Патент РФ № 2292212, январь, 2007. [Konopljannikov A.G., Kolesnikova A.I., Saenko A.S. et al. Conditions medium with therapeutic effect. Patent RU № 2292212, january 2007. (In Russian)]
Schafer R., Spohn G., Baer P. Mesenchymal stem/stromal cell in regenerative medicine: can preconditioning strategies improve therapeutic efficacy? // Transfusion medicine and hemotherapy. 2016. V. 43. P. 256–267.
Терских В.В., Киселева Е.В. Биологические особенности и терапевтический потенциал стромальных клеток жировой ткани. Обзор // Пластическая хирургия и косметология. 2010. № 4. С. 613–621. [Terskikh V.V., Kiseleva E.V. Biological peculiarities and therapeutic potential of stromal cells of adipose tissue. Review // Plastic surgery and cosmetology. 2010. V. 4. P. 613–621. (In Russian)]
Gir Ph., Oni G., Brown S.A. et al. Human adipose stem cells: Current clinical applications // Plast. Reconst. surg. 2012; 129:1277–1290.
Веремеев А.В., Болгарин Р.Н. Петкова М.А. и др. Стромально-васкулярная фракция жировой ткани как альтернативный источник клеточного материала для регенеративной медицины // Гены & Клетки. 2016. Т. 11. № 1. С. 35–42. [Veremeyev A.V., Bulgarin R.N. Petkova M.A. et al. Stromal-vascular fraction of adipose tissue as an alternative source of cellular material for regenerative medicine // Genes & Cells. 2016. Т. 11. № 1. P. 35–42. (In Russian)]
Bourin P., Bunnell B.A., Casteilla L. et al. Stromal cells from the adipose tissue-derived stromal vascular fraction and cultured expanded adipose tissue-derived stromal/stem cells: A joint statement of the International Federation for adipose therapeutics and the International Society for cellular therapy (ISCT) // Cytothe-rapy. 2013. V. 15. P. 641–648.
Bora P., Majumdar A. Adipose tissue-derived stromal vascular fraction in regenerative medicine: a brief review and translation // Stem Cell Res. Therap. 2017. V. 8. P. 145. https://doi.org/10.1186/s13287-017-0598-y
Seo Y., Shin T.H, Kim H.S. Current strategies to enhance adipose stem cell function: an update // Int. J. Molec. Sci. 2019. V. 20. P. 3827. https://doi.org/10.3390/ijms
Котенко К.В., Мороз Б.Б., Насонова Т.А. и др. Экспериментальная модель тяжелых местных лучевых поражений кожи после действия рентгеновского излучения // Патол. физиология и эксперим. терапия. 2013. № 4. С. 121–123. [Kotenko K.V., Moroz B.B., Nasonova T.A. et al. Experimental model of severe local radiation injuries of the skin after x-rays // Pathological physiology and experimental therapy. 2013. № 4. P. 121–123. (In Russian)]
Bognest A.C., Shandadfar A., Brinchmann J.E. et al. Isolation of stromal stem cells from human adipose tissue // Meth. Mol. Biol. 2006. V. 325. P. 35–46.
Bunnell B.A., Flaat M., Gagliard Ch. et al. Adipose-derived stem cells: isolation, expansion and differentiation // Methods. 2008. V. 45. № 2. P. 115–120.
Isakson M., de Blacam C., Whelan D. et al. Mesenchymal stem cells and cutaneous wound healing: current evidence and future potential. Review article // Hundawi publishing corporation. Stem Cells International. V. 2015. Article ID 831095. 12 p. https://doi.org/10.1155/2015/831095
Benfar M., Javanmardi S., Sarrafzadeh-Rezaei F. Comparative study on functional effects allotransplantation of bone marrow stromal cells and adipose derived stromal vascular fraction on tendon repair: a biomechanical study in rabbits // Cell J. 2014. Fall. V. 16. № 3. P. 263–270.
Semon J.A., Maness C., Zhang X. Comparison of human adult stem cells from adipose tissue and bone marrow in the treatment of experimental autoimmune encephalomyelitis // Stem Cell Res. Ther. 2014. V. 5. № 1. P. 2.
Zhou L., Song K., Xu L. et al. Protective effects of uncultured adipose-derived stromal vascular fraction on testicular injury induced by torsion-detorsion in rats // Stem Cells Translat. Medi. 2019. V. 8. P. 383–391.
Дешевой Ю.Б., Насонова Т.А., Добрынина О.А. и др. Опыт применения сингенных мультипотентных мезенхимальных стволовых клеток (ММСК) жировой ткани для лечения тяжелых радиационных поражений кожи в различные сроки после облучения в эксперименте // Радиац. биология. Радиоэкология. 2020. Т. 60. № 1. С. 24–31. [Deshevoi Yu.B., Nasonova T.A., Dobrynina O.A. et al. Experience of application of syngeneic multipotent mesenchymal stem cells (MMSC) adipose tissue for treatment of severe radiationskin lesions at various intervals after exposure in the experiment // Radiation Biology. Radioecology. 2020. V. 60. № 1. P. 24–31. (In Russian)]
Marx C., Silveira M.D., Selbach I. et al. Acupoint injection of autologous stromal vascular fraction and allogeneic adipose- derived stem cells to treat hip dysplasia in dogs. // Stem Cells Int. 2014. V. 2014. Article ID 391274. 6 p.
You D., Jang M.J., Kim B.H. et al. Comparative study of autologous stromal vascular fraction and adipose-derived stem cells for erectile function recovery in rat model of cavernous nerve injury // Stem Cells Translat. Med. 2015. V. 4. P. 351–358.
Rigotti G., Marchi A., Galie M. et al. Clinical treatment of radiotherapy tissue damage by lipoaspirate transplant: a healing process mediated by adipose tissue-derived adult stem cells // Plast. Reconstr. Surg. 2007. V. 119. № 5. P. 1409–1422.
Riccodono D., Agay D., Scherthan H. et al. Application adipose-derived stem cells in treatment of cutaneous radiation syndrome // Health Phys. 2012. V. 103. № 2. P. 120–126.
Akita S., Yoshimoto H., Ohtsuru A. et al. Autologous adi-pose-derived regenerative cells are effective for chronic intractable radiation injuries // Radiat. Prot. Dosim. 2012. V. 151. № 4. P. 656–660.
Forcheron F., Agay D., Scherthan H. et al. Autologous adipose-derived stem cells favour healing in minipig model treatment of cutaneous radiation syndrome // PLOS One. 2012. V. 7. № 2. e 31694.
Sheng-Ping H., Chun-Hsiang H., Jia-Fwu Sh. et al. Promotion of wound healing using adipose-derived stem cells in radiation ulcer of a rat model // J. Biomed. Sci. 2013. V. 20. № 1. P. 51–61.
Lipi Shukla, Wayne A. Morrison, Ramin Shayan. Adipose-derived stem cells in radiotherapy injury: a new frontier // Front. Surg. Reconstruct. Plastic Surg. January 2015. V. 2. Article 1. P. 1–12.
Yaojiong Wu M.D., Liwen Cheng, Paul G. Scott et al. Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis // Stem Cells. 2007. V. 25. Issue 10. P. 2648–2659.
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


