Радиационная биология. Радиоэкология, 2021, T. 61, № 2, стр. 133-143
Риск заболеваемости артериальной гипертензией в когорте работников ПО “Маяк”, подвергшихся хроническому облучению
Т. В. Азизова 1, *, К. В. Брикс 1, М. В. Банникова 1, Е. С. Григорьева 1
1 Южно-Уральский институт биофизики
Озёрск, Россия
* E-mail: clinic@subi.su
Поступила в редакцию 21.06.2020
После доработки 08.12.2020
Принята к публикации 16.12.2020
Аннотация
Дана оценка риска заболеваемости артериальной гипертензией (АГ, 401–404 коды МКБ-9 или I10–I13 коды МКБ-10) в когорте работников, подвергшихся хроническому облучению. Риск заболеваемости АГ изучен в когорте работников предприятия атомной промышленности производственного объединения (ПО) “Маяк” (22 377 человек), подвергшихся хроническому внешнему воздействию γ-излучения и/или внутреннему облучению (α-частицы). Средняя суммарная поглощенная в печени доза внешнего облучения у мужчин составила 0.45 ± 0.65 Гр и у женщин – 0.37 ± 0.56 Гр, а средняя суммарная поглощенная в печени доза внутреннего облучения (α-частицы) – 0.23 ± 0.65 Гр и 0.44 ± 1.93 Гр соответственно. Анализ включал расчет избыточного относительного риска на единицу дозы (ИОР/Гр) с помощью Пуассоновской регрессии. Зависимость избыточного относительного риска (ИОР; ERR – Excess relative risk), т.е. относительный риск (ОР; RR – Relative risk) минус 1, от дозы внешнего или внутреннего облучения с поправкой на нерадиационные факторы (пол, достигнутый возраст, календарный период, статус курения, статус употребления алкоголя) имела вид линейного тренда. В изучаемой когорте работников на конец периода наблюдения верифицировано 8425 случаев АГ: 5745 (68.2%) у мужчин и 2680 (31.8%) у женщин. Установлена статистически значимая линейная зависимость заболеваемости АГ от суммарной поглощенной в печени дозы внешнего облучения; ИОР/Гр = 0.14 (95%-ный ДИ 0.09; 0.20). Не выявлено статистически значимой сопряженности заболеваемости АГ от суммарной поглощенной в печени дозы внутреннего воздействия α-излучения; ИОР/Гр = –0.01 (95%-ный ДИ n/a; 0.05). Риск заболеваемости АГ в изучаемой когорте работников был выше такового в японской когорте лиц, выживших после атомной бомбардировки (AHS), но ниже, чем в когорте ликвидаторов последствий радиационной аварии на Чернобыльской атомной электростанции.
Болезни системы кровообращения (БСК, класс VII МКБ-9 или класс IX МКБ-10) являются основной причиной смертности населения в мире. Класс БСК включает в себя различные группы заболеваний: ревматические болезни; болезни, характеризующиеся повышенным артериальным давлением (артериальная гипертензия (АГ)); ишемическая болезнь сердца (ИБС); цереброваскулярные заболевания (ЦВЗ); болезни артерий и др. [1]. В последние десятилетия появляется все больше доказательств связи облучения и смертности от БСК в целом, а также отдельных групп заболеваний (и смертности от них) [2–11]. Однако информация о заболеваемости АГ и смертности от нее весьма ограничена. При этом данные об этих рисках в когортах лиц, подвергшихся хроническому облучению с низкой мощностью дозы, отсутствуют. Поэтому целью настоящего исследования была оценка риска заболеваемости АГ (401–404 коды МКБ-9 или I10–I13 коды МКБ-10) в когорте работников, подвергшихся профессиональному хроническому облучению с низкой мощностью дозы.
МАТЕРИАЛЫ И МЕТОДИКА
Изучаемая когорта
Настоящее исследование является ретроспективным когортным исследованием. Изучаемая когорта включала всех работников ПО “Маяк” (первого в России крупного предприятия атомной промышленности, расположенного на Южном Урале, вблизи г. Озёрск), нанятых на один из основных заводов (реакторы, радиохимический или плутониевый) в период 1948–1982 гг., независимо от пола, возраста, образования, национальной принадлежности, профессии, продолжительности работы и других характеристик (22 377 работников).
Период наблюдения за когортой начинался от даты найма на один из основных заводов и продолжался до даты первого из следующих событий: даты установления диагноза АГ; даты смерти; 31 декабря 2013 г. для тех, кто был жив в это время; даты “последней медицинской информации” для работников с неизвестным жизненным статусом и мигрантов (работников, выехавших из г. Озерск на другое постоянное место жительства).
Все работники изучаемой когорты проходили обязательные медицинские обследования, которые включали: осмотр врачей-специалистов (терапевт, невролог, хирург, дерматолог, офтальмолог, отоларинголог, эндокринолог и другие врачи по медицинским показаниям), общий анализ крови, общий анализ мочи, биохимические анализы крови и другие исследования (флюорография или рентгенография, электрокардиография, спирометрия, ультразвуковые методы обследования и другие по медицинским показаниям). Медицинские осмотры проводились каждые 3 мес. в период 1948–1953 гг., каждые 6 мес. в период 1951–1960 гг., и затем ежегодно в течение всего периода наблюдения. Кроме того, каждые 5 лет работники ПО “Маяк” в обязательном порядке проходили медицинские обследования в условиях специализированного стационара. Артериальное давление измерялось во время описанных выше регулярных медицинских осмотров в положении сидя стандартным методом аускультации с использованием ртутного сфигмоманометра.
В табл. 1 представлена подробная характеристика изучаемой когорты. Преобладающее большинство (более 80%) работников приняты на предприятие в возрасте моложе 30 лет. На конец периода наблюдения большинство работников (58%) были в возрасте моложе 50 лет. Около половины работников изучаемой когорты (47%) работали на ПО “Маяк” более 10 лет.
Таблица 1.
Характеристика изучаемой когорты работников ПО “Маяк” Table 1. Characteristics of the study Mayak PA worker cohort
| Распределение работников в зависимости от возраста на момент найма | ||||||
|---|---|---|---|---|---|---|
| Возраст на момент найма, лет | Мужчины | Женщины | Оба пола | |||
| число | % | число | % | число | % | |
| <20 | 5854 | 36.33 | 895 | 16.38 | 6749 | 31.28 |
| 20–24 | 5502 | 34.14 | 1911 | 34.97 | 7413 | 34.35 |
| 25–29 | 2217 | 13.76 | 966 | 17.68 | 3183 | 14.75 |
| 30–34 | 1007 | 6.25 | 605 | 11.07 | 1612 | 7.47 |
| 35–39 | 748 | 4.64 | 590 | 10.80 | 1338 | 6.20 |
| ≥40 | 786 | 4.88 | 497 | 9.10 | 1283 | 5.95 |
| Всего | 16 114 | 100.00 | 5464 | 100.00 | 21 578 | 100.00 |
| Распределение работников в зависимости от достигнутого возраста на конец периода наблюдения | ||||||
| Возраст на момент выхода из исследования, лет | Мужчины | Женщины | Оба пола | |||
| число | % | число | % | число | % | |
| <40 | 7553 | 46.87 | 1698 | 31.08 | 9251 | 42.87 |
| 40–49 | 2471 | 15.33 | 829 | 15.17 | 3300 | 15.29 |
| 50–59 | 2968 | 18.42 | 1174 | 21.49 | 4142 | 19.20 |
| 60–69 | 2110 | 13.09 | 1046 | 19.14 | 3156 | 14.63 |
| ≥70 | 1012 | 6.28 | 717 | 13.12 | 1729 | 8.01 |
| Всего | 16 114 | 100.00 | 5464 | 100.00 | 21 578 | 100.00 |
| Распределение работников в зависимости от продолжительности работы | ||||||
| Продолжительность работы, лет | Мужчины | Женщины | Оба пола | |||
| число | % | число | % | число | % | |
| <1 | 1145 | 7.11 | 300 | 5.49 | 1445 | 6.70 |
| 1–10 | 7451 | 46.24 | 2483 | 45.44 | 9934 | 46.04 |
| >10 | 7518 | 46.66 | 2681 | 49.07 | 10 199 | 47.27 |
| Всего | 16 114 | 100.00 | 5464 | 100.00 | 21 578 | 100.00 |
| Распределение работников с АГ в зависимости от пола и достигнутого возраста на дату впервые установленного диагноза | ||||||
| Достигнутый возраст, лет | Мужчины | Женщины | Оба пола | |||
| число | % | число | % | число | % | |
| <40 | 1579 | 27.49 | 241 | 9.00 | 1820 | 21.60 |
| 40–49 | 1434 | 24.96 | 565 | 21.08 | 1999 | 23.73 |
| 50–59 | 1356 | 23.60 | 763 | 28.47 | 2119 | 25.15 |
| 60–69 | 1002 | 17.44 | 739 | 27.57 | 1741 | 20.67 |
| ≥70 | 374 | 6.51 | 372 | 13.88 | 746 | 8.85 |
| Всего | 5745 | 100.00 | 2680 | 100.00 | 8425 | 100.00 |
Жизненный статус на конец периода наблюдения известен у 95% членов когорты; из них 62% умерли, а 38% живы. Средний возраст на момент смерти у мужчин составил 61.5 ± 13.6 (среднее ± ± стандартное отклонение) лет, и у женщин – 70.5 ± 12.4 лет; а средний возраст живых на конец периода наблюдения – 68.5 ± 10.4 лет и 76.6 ± 9.8 лет соответственно.
Источником информации о заболеваниях служили архивные и текущие медицинские карты, истории болезни. При сборе информации о смерти были использованы протоколы патологоанатомического исследования и акты судебно-медицинской экспертизы, медицинские свидетельства о смерти.
В настоящем исследовании АГ – это синдром повышения систолического артериального давления (САД) ≥ 140 мм рт.ст. и/или диастолического артериального давления (ДАД) ≥ 90 мм рт.ст. Случаи АГ у работников изучаемой когорты были идентифицированы на основе медико-дозиметрической базы данных “Клиника” [12]. Были проведены ретроспективная экспертиза и верификация всех идентифицированных случаев АГ, основываясь на критериях Европейского общества гипертонии (ESH) и Европейского общества кардиологов (ESC) [13]. Важно отметить, что из анализа заболеваемости были исключены случаи АГ, подтвержденные как вторичная АГ (405 код МКБ-9 или I15 код МКБ-10), поскольку они были вызваны конкретной и потенциально обратимой/или необратимой причиной повышения АД.
Дозиметрия
Работники основных заводов ПО “Маяк” подвергались хроническому облучению в результате профессиональной деятельности: работники реакторов – только внешнему облучению, а работники радиохимического и плутониевого заводов – сочетанному облучению, т.е. внешнему облучению и внутреннему облучению (α-частицы) от инкорпорированного плутония). С первых дней деятельности ПО “Маяк” дозы внешнего облучения измерялись индивидуальными дозиметрами, а поглощенные в органах дозы были рассчитаны с использованием дозиметрических моделей [14]. Начиная с 1970-х годов проводили измерения α-активности излучающих радионуклидов в биосубстратах (в основном, в моче), а поглощенные в органах дозы внутреннего воздействия α-излучения рассчитывались на основе этих измерений с использованием биокинетических и дозиметрических моделей [15].
В настоящем исследовании использованы индивидуальные оценки доз внешнего и внутреннего облучения улучшенной дозиметрической системы работников ПО “Маяк”, разработанной в рамках российско-американского сотрудничества – “ДСРМ-2013” [15, 16]. Согласно “ДСРМ-2013” дозы внешнего облучения были доступны для всех членов изучаемой когорты, а дозы внутреннего облучения (α-частицы) лишь для 31.1% работников, у которых были измерения α-активности в биосубстратах (у 29.1% мужчин и у 37.1% женщин).
Статистический анализ
Настоящий анализ был ограничен периодом проживания в г. Озерск, так как информация о заболеваниях и нерадиационных факторах риска для мигрантов после выезда их из города на другое постоянное место жительства была недоступна.
Сравнение проводилось внутри изучаемой когорты работников ПО “Маяк”.
Основной анализ риска включал расчет относительных рисков (ОР; RR – relative risk) для отдельных категорий лиц с суммарной поглощенной дозой внешнего γ-излучения в печени (<0.10; 0.10–0.20; 0.20–0.50; 0.50–0.75; 0.75–1.00; 1.00–1.25; 1.25–1.50; 1.50–2.00; 2.00–3.00; 3.00–4.00, ≥4.00 Гр) и суммарной поглощенной дозы внутреннего α-излучения в печени (<0.01; 0.01–0.025; 0.025–0.05; 0.05–0.10; 0.10–0.15; 0.15–0.25; 0.25–0.50; 0.50–1.00; ≥1.00 Гр) относительно референс-категории (<0.10 Гр и <0.01 Гр соответственно).
Кроме того, были описаны модели доза–эффект для оценки линейного тренда показателей заболеваемости АГ от внешнего и внутреннего облучения. С помощью этих анализов были получены оценки избыточного относительного риска (ИОР; ERR – Excess relative risk) на единицу дозы (Гр).
Оценки ОР и ИОР/Гр рассчитывались с помощью Пуассоновской регрессии с использованием модуля AMFIT программы EPICURE [17]. 95%-ные доверительные интервалы (ДИ) и статистическая значимость (значения р) были рассчитаны с помощью методов максимального правдоподобия. Все критерии статистической значимости были двусторонними. Различия считались статистически значимыми при p < 0.05.
Анализ зависимости АГ от дозы внутреннего облучения был ограничен работниками, для которых проводился мониторинг α-активности.
Как в анализах ОР, так и ИОР поправка с помощью стратификации была сделана на следующие факторы: пол, достигнутый возраст (<20, 20–25, …, 80–85, >85), календарный период (1948–1950, 1951–1955, 1956–1960, …, 2011–2013), статус курения (никогда не курил, когда-либо курил, неизвестно) и статус употребления алкоголя (редко, умеренно, злоупотребление, неизвестно).
Используемые модели Пуассоновской регрессии имели вид:
Для оценки ИОР/Гр были также проведены анализы чувствительности:
− использование различных периодов лаггирования (5, 10 и 15 лет) для дозы внешнего и внутреннего облучения, при этом для анализов с заданными периодами лаггирования, в которых чел.-годы считались от начала работы, первые х лет после начала работы были отнесены к категории “нулевой дозы”;
− исключение поправок на статус курения и употребления алкоголя;
− включение поправок (с помощью стратификации) на дополнительные факторы: индекс массы тела (ИМТ) (ниже нормы, норма, выше нормы, неизвестно); продолжительность работы (<10, ≥10 лет); индекс курения вместо статуса курения (неизвестно, 0, 0–10, 10–20, >20 пачка х лет);
− включение поправок (с помощью стратификации) на дозу внутреннего облучения при анализе дозы внешнего радиационного воздействия и наоборот. В этом случае модели Пуассоновской регрессии имели вид:
Также изучена модификация радиогенного риска заболеваемости АГ в зависимости от пола, достигнутого возраста и типа производства (критерии на гетерогенность). Кроме того, исследована зависимость риска от достигнутого возраста. В данном анализе было проведено сравнение ИОР/Гр с/без поправки на достигнутый возраст, центрированный к 50 годам (критерий на лог-линейный тренд ИОР/Гр с достигнутым возрастом).
Информацию о заводе учитывали за весь период наблюдения. К “плутониевому заводу” были отнесены работники, которые когда-либо работали на плутониевом заводе, к “радиохимическому заводу” были отнесены работники, которые работали на радиохимическом заводе, но никогда не работали на плутониевом заводе, к “реакторам” были отнесены работники, которые работали на реакторах, но никогда не работали на двух других заводах.
Сведения об отношении работников к курению учитывались за весь период наблюдения и оценивались с помощью качественного и количественного показателей. Качественный показатель принимал значения “неизвестно”, “никогда не курил”, “курил, но бросил”, “курил”. “Никогда не курившим” считали работников, которые в течение всего периода наблюдения при опросах во время медицинских обследований говорили, что никогда не курили. При стратификации категории “курил, но бросил” и “курил” объединялись в категорию “когда-либо курил”. В качестве количественного показателя был использован индекс курения. Индекс курения (ИК) вычисляли по формуле: ИК = количество пачек сигарет, выкуриваемых ежедневно × продолжительность курения (лет). Индекс курения измерялся в единицах “пачка × лет” и был равен нулю у никогда не куривших работников.
Сведения об отношении работников к употреблению алкоголя учитывались также за весь период наблюдения и оценивались только с помощью качественного показателя, учитывающего количество употребляемого алкоголя. Отношение работников к употреблению алкоголя классифицировалось следующим образом: “редко” – если в течение периода наблюдения во время медицинских обследований работник говорил, что никогда не употреблял спиртные напитки или употреблял их редко и в небольших количествах; “умеренно” – если во время медицинских обследований работник так характеризовал свое отношение к употреблению алкоголя; “злоупотребление” – если в медицинской документации были зафиксированы бытовое пьянство или хронический алкоголизм; “неизвестно”.
Информация об ИМТ учтена на момент предварительного медицинского осмотра (до начала работы на одном из основных заводов ПО “Маяк”) для того, чтобы избежать ошибок смещения, так как в некоторых исследованиях было показано, что артериальное давление и уровни липидов зависят от накопленной дозы облучения. ИМТ рассчитывали по формуле: ИМТ = масса тела (кг)/рост (м)2. Для интерпретации величины ИМТ пользовались классификацией ВОЗ. ИМТ < < 18.5 кг/м2 – дефицит массы тела; ИМТ 18.5–24.9 кг/м2 – нормальная масса тела; ИМТ 25.0–29.9 кг/м2 – избыточная масса тела; ИМТ ≥ 30 кг/м2 – ожирение. В исследование ИМТ включали как качественный показатель, который принимал значения “неизвестно”, “ниже нормы”, “норма”, “выше нормы”.
РЕЗУЛЬТАТЫ
На конец периода наблюдения в изучаемой когорте работников было верифицировано 8425 случаев АГ в течение 429 707 чел.-лет наблюдения.
Распределение случаев АГ в зависимости от пола и достигнутого возраста работников изучаемой когорты представлено в табл. 1.
Следует отметить, что 64.2% случаев АГ у мужчин и 73.0% случаев АГ у женщин обнаружено среди работников, подвергшихся внешнему воздействию γ-излучения в суммарной дозе <0.5 Гр. Средняя суммарная поглощенная в печени доза внешнего облучения у мужчин составила 0.45 ± ± 0.65 Гр (среднее ± стандартное отклонение) и у женщин – 0.37 ± 0.56 Гр. Установлено, что почти половина случаев АГ (47.9%) выявлена у работников, подвергшихся внутреннему облучению в суммарной поглощенной в печени дозе <0.025 Гр, в то время как одна треть случаев АГ (31.8% у мужчин и 36.3% у женщин) наблюдалась у работников, подвергшихся внутреннему облучению в суммарной поглощенной в печени дозе 0.05–1.0 Гр. Средняя суммарная поглощенная в печени доза внутреннего облучения у мужчин составила 0.23 ± 0.65 Гр и у женщин – 0.44 ± 1.93 Гр.
Ранее было показано, что заболеваемость АГ в изучаемой когорте работников статистически значимо зависела от таких нерадиационных факторов, как достигнутый возраст, календарный период и возраст найма на предприятие, календарный период установления диагноза, продолжительность работы, индекс массы тела (ИМТ) [18, 19].
Результаты категориального анализа, представленные в табл. 2, показали повышенный статистически значимый риск заболеваемости АГ во всех дозовых категориях по сравнению с референс-категорией (работники, подвергшиеся хроническому внешнему облучению в суммарной поглощенной в печени дозе <0.1 Гр) за исключением последней дозовой категории (>4.0 Гр), что, по-видимому, связано с небольшим количеством случаев в этой группе (семь случаев). Следует отметить, что риск заболеваемости АГ возрастал с увеличением суммарной дозы внешнего облучения: от ОР = = 1.11 (95%-ный ДИ 1.03; 1.19) в дозовой категории 0.1–0.2 Гр до ОР = = 1.6 (95%-ный ДИ: 1.15; 2,17) в дозовой категории 3.0–4.0 Гр) (табл. 2).
Таблица 2.
ОР заболеваемости АГ в различных диапазонах суммарных поглощенных в печени доз внешнего γ-излучения и внутреннего α-излучения Table 2. RR of hypertension incidence for various ranges of cumulative liver absorbed γ-ray doses of external exposure and α-particle doses of internal exposure
| Диапазон дозы, Гр | Средняя доза, Гр | Чел.-лет | Число случаев | ОР (95%-ный ДИ) |
|---|---|---|---|---|
| Внешнее воздействие γ-излучения | ||||
| 0.0–0.1 | 0.04 | 171 290 | 2986 | 1 |
| 0.1–0.2 | 0.14 | 57 964 | 1234 | 1.11 (1.03; 1.19) |
| 0.2–0.5 | 0.32 | 78 072 | 1662 | 1.10 (1.03; 1.17) |
| 0.5–0.75 | 0.62 | 30 819 | 659 | 1.13 (1.03; 1.23) |
| 0.75–1.0 | 0.87 | 20 977 | 452 | 1.13 (1.02; 1.26) |
| 1.0–1.25 | 1.12 | 15 367 | 350 | 1.21 (1.08; 1.36) |
| 1.25–1.5 | 1.37 | 10 910 | 251 | 1.27 (1.11; 1.45) |
| 1.5–2.0 | 1.73 | 15 037 | 336 | 1.22 (1.08; 1.38) |
| 2.0–3.0 | 2.32 | 9939 | 252 | 1.41 (1.22; 1.61) |
| 3.0–4.0 | 3.34 | 1550 | 41 | 1.60 (1.15; 2.17) |
| >4.0 | 4.39 | 509 | 7 | 0.72 (0.31; 1.40) |
| Внутреннее воздействие α-излучения | ||||
| 0.00–0.01 | 0.003 | 101 958 | 1686 | 1 |
| 0.01–0.025 | 0.016 | 33 389 | 846 | 1.06 (0.97; 1.16) |
| 0.025–0.05 | 0.036 | 22 226 | 592 | 1.01 (0.91; 1.12) |
| 0.05–0.10 | 0.071 | 17 754 | 491 | 1.05 (0.94; 1.18) |
| 0.10–0.15 | 0.122 | 8361 | 263 | 1.16 (1.01; 1.33) |
| 0.15–0.25 | 0.193 | 8194 | 275 | 1.14 (0.99; 1.31) |
| 0.25–0.50 | 0.348 | 6650 | 244 | 1.23 (1.06; 1.42) |
| 0.5–1.00 | 0.695 | 3416 | 130 | 1.33 (1.09; 1.60) |
| >1.00 | 3.187 | 3336 | 99 | 1.08 (0.87; 1.34) |
При другом категориальной анализе (табл. 2) обнаружено, что у работников, подвергшихся внутреннему воздействию α-излучения в суммарной поглощенной в печени дозе 0.10–0.15, 0.25–0.5 и 0.5–1.0 Гр, заболеваемость АГ была выше при сравнении с работниками, подвергшимися облучению в дозе <0.01 Гр (р < 0.05). Причем риск заболеваемости АГ также возрастал с увеличением суммарной дозы внутреннего облучения, за исключением тех работников, кто подвергся воздействию α-излучения в дозе >1.0 Гр, что обусловлено небольшим количеством случаев АГ в этой группе (99 случаев).
Установлена статистически значимая линейная зависимость заболеваемости АГ от суммарной поглощенной в печени дозы внешнего γ-излучения с учетом поправок на нерадиационные факторы; ИОР/Гр = 0.14 (95%-ный ДИ 0.09; 0.20) – табл. 3 и рис. 1. Дополнительная поправка на дозу внутреннего облучения (α-частицы) не оказывала влияния на величину риска заболеваемости АГ в изучаемой когорте работников: ИОР/Гр = 0.14 (95%-ный ДИ 0.09; 0.20). Оценка риска заболеваемости АГ увеличивалась с увеличением периода лаггирования, но уменьшалась при исключении поправок на статус курения и употребления алкоголя. Выявлено, что риск заболеваемости АГ увеличивался при включении в стратификацию дополнительных поправок на ИМТ и продолжительность работы, но не изменялся при введении поправки на индекс курения вместо статуса курения (табл. 3).
Таблица 3.
Результаты анализа заболеваемости АГ в зависимости от суммарной поглощенной в печени дозы внешнего облучения и внутреннего облучения Table 3. Results of the analysis of hypertension incidence in relation to cumulative liver absorbed γ-ray dose of external exposure and α-particle dose of internal exposure
| Анализ | ИОР/Гр (95% ДИ) | |
|---|---|---|
| внешнее γ-облучениe | внутреннее α-облучениe | |
| Основной анализ (лаг-период 0 лет) | 0.14 (0.09; 0.20) | –0.01 (n/a; 0.05) |
| Анализ с другими лаг-периодами: | ||
| лаг-период 5 лет | 0.15 (0.09; 0.21) | –0.003 (n/a; 0.08) |
| лаг-период 10 лет | 0.17 (0.11; 0.24) | 0.01 (n/a; 0.11) |
| лаг-период 15 лет | 0.19 (0.12; 0.26) | 0.02 (n/a; 0.16) |
| Анализ с исключением поправки на курение и употребление алкоголя, лаг-период 0 лет | 0.13 (0.08; 0.19) | –0.01 (n/a; 0.05) |
| Анализ с добавлением в стратификацию (лаг-период 0 лет): | ||
| индекс массы тела | 0.17 (0.12; 0.24) | –0.01 (n/a; 0.06) |
| продолжительность работы | 0.17 (0.11; 0.23) | –0.004 (n/a; 0.07) |
| индекс курения | 0.14 (0.08; 0.20) | –0.01 (n/a; 0.05) |
| доза внутреннего α-излучения при анализе внешнего и наоборот | 0.14 (0.09; 0.20) | –0.02 (n/a; 0.04) |
| Анализ, ограниченный работниками (лаг-период 0 лет): | ||
| Реакторный завод | 0.19 (0.04; 0.37) | – |
| Радиохимический завод | 0.18 (0.10; 0.27) | 0.07 (n/a; 0.27) |
| Завод по производству плутония | 0.18 (0.04; 0.34) | –0.02 (n/a; 0.04) |
| Тест на гетерогенность между работниками различных заводов | p1 = 0.39 | p1 = 0.18 |
| Продолжительность работы: | ||
| <1 года | 0.17 (n/a; 0.96) | 1.11 (n/a; 22.19) |
| 1–5 | 0.21 (0.08; 0.36) | 0.06 (n/a; 0.43) |
| 5–10 | 0.12 (0.02; 0.26) | –0.03 (n/a; 0.16) |
| 10–20 | 0.12 (0.02; 0.25) | –0.05 (n/a; 0.04) |
| 20–30 | 0.25 (0.11; 0.42) | 0.02 (n/a; 0.15) |
| 30+ | 0.13 (0.01; 0.30) | 0.14 (n/a; 0.49) |
| Тест на гетерогенность между работниками с различной продолжительностью работы | p2 = 0.16 | p2 > 0.50 |
| Мужчины | 0.15 (0.09; 0.22) | 0.10 (–0.04; 0.27) |
| Женщины | 0.14 (0.05; 0.24) | –0.03 (n/a; 0.03) |
| Тест на гетерогенность между мужчинами и женщинами | p3 > 0.50 | p3 = 0.09 |
| Работники с достигнутым возрастом: | ||
| <40 | 0.06 (n/a; 0.18) | 0.07 (n/a; 0.45) |
| 40–49 | 0.11 (0.01; 0.24) | –0.03 (n/a; 0.05) |
| 50–59 | 0.14 (0.04; 0.25) | –0.03 (n/a; 0.07) |
| 60–69 | 0.26 (0.14; 0.41) | 0.07 (n/a; 0.25) |
| 70+ | 0.16 (0.02; 0.34) | –0.03 (n/a; 0,20) |
| Тест на гетерогенность между группами работников различного достигнутого возраста | p4 = 0.22 | p4 > 0.50 |
| Тест на лог-линейный тренд ИОР/Гр по достигнутому возрасту | p5 = 0.28 | p5 > 0.50 |
Рис. 1.
Зависимость заболеваемости АГ от суммарной поглощенной в печени дозы внешнего воздействия γ-излучения.
Fig. 1. Hypertension incidence association with cumulative liver absorbed γ-ray dose of external exposure.
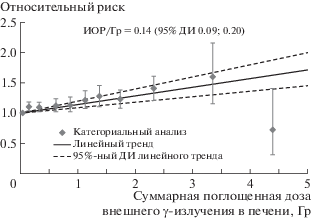
Оценки ИОР/Гр внешнего облучения для заболеваемости АГ были примерно одинаковыми у мужчин и женщин изучаемой когорты (р > 0.05). Примерно одинаковые оценки риска получены на всех типах производства, и статистически значимых различий между ними не выявлено (р = = 0.39). Не установлено модификации риска заболеваемости АГ продолжительностью работы (p = 0.16). Несмотря на то, что оценка ИОР/Гр внешнего облучения для заболеваемости АГ возрастала с увеличением достигнутого возраста, не выявлено статистически значимого тренда (р = = 0.28) – табл. 3.
Анализ заболеваемости АГ от суммарной поглощенной в печени дозы внутреннего облучения не выявил статистически значимой зависимости при использовании линейной модели с учетом поправок не нерадиационные факторы (табл. 3). При основном анализе, учитывающем весь диапазон доз, ИОР/Гр внутреннего облучения для заболеваемости АГ составил –0.01 (95%-ный ДИ n/a; 0.05). Невозможно оценить влияние различных периодов лагирования в связи с неопределенной оценкой нижней границы 95%-ного ДИ. Исключение поправок на статус курения и употребления алкоголя, введение поправок на дополнительные нерадиационные факторы (ИМТ, продолжительность работы, индекс курения вместо статуса курения) и дозу внешнего облучения не оказали влияния на полученный результат. Также не установлено модификации риска заболеваемости АГ полом индивида, типом производства, достигнутым возрастом и продолжительностью работы (р = 0.09, р = 0.18, р > 0.5, р > 0.5 соответственно) – табл. 3.
ОБСУЖДЕНИЕ
Результаты настоящего исследования свидетельствовали о повышенном риске заболеваемости АГ во всех диапазонах суммарных доз внешнего облучения >0.1 Гр по сравнению с референс-категорией (<0.1 Гр). Риск заболеваемости АГ увеличивался с возрастанием суммарной дозы внешнего облучения, и наиболее высокий риск выявлен у работников, подвергшихся облучению в суммарной дозе более 3.0 Гр (ОР = 1.60 (95%-ный ДИ: 1.15–2.17)). Повышенный статистически значимый риск заболеваемости АГ обнаружен также у работников, подвергшихся внутреннему воздействию α-излучения в суммарных поглощенных в печени дозах более 0.01 Гр, по сравнению с референс-категорией (<0.01 Гр).
В результате анализа доза–эффект обнаружена статистическая значимая линейная зависимость заболеваемости АГ от суммарной поглощенной в печени дозы внешнего облучения, ИОР/Гр составил 0.14 (95%-ный ДИ 0.09; 0.20) как с поправкой, так и без поправки на дозу внутреннего облучения.
Сравнение полученных результатов с таковыми, полученными в других работах, было затруднено в связи с тем, что исследования зависимости доза–эффект для заболеваемости АГ крайне ограничены; к тому же исследователи изучали разные подтипы АГ и их комбинаций. Так, впервые повышенный риск смертности от АГ показан в исследовании японской когорты лиц, выживших после атомной бомбардировки (когорта LSS) [20] – табл. 4. В когорте 85 600 человек, наблюдавшихся в период 1950–1990 гг., обнаружен избыточный относительный риск смертности от АГ на единицу дозы (ИОР/Зв = 0.21 (95%-ный ДИ 0.00; 0.45). В другом исследовании с расширенным периодом наблюдения до 2003 г. в этой же когорте была показана статистически значимая зависимость смертности, вызванной АГ (МКБ-9 коды: 402, 404), от дозы облучения; ИОР/Гр = 0.37 (95%-ный ДИ 0.08; 0.72) [8]; а при расширении периода наблюдения до 2008 г. ИОР/Гр составил 0.36 (95%-ный ДИ 0.10; 0.68) [7]. В исследовании, посвященном изучению здоровья лиц, выживших после атомной бомбардировки в другой японской когорте (когорта AHS), обнаружена статистически значимая квадратичная зависимость заболеваемости АГ (401 код МКБ-9 или I10 код МКБ-10) от дозы облучения; ИОР/Гр = 0.03 (95%-ный ДИ 0.01; 0.06) [21].
Таблица 4.
Сравнение полученных результатов с результатами других исследований Table 4. Comparison of the observed findings with findings of other studies
| Исследование | Ссылки | Количество субъектов | Период наблюдения | Средняя доза и диапазон, Зв | Изучаемый эффект (коды МКБ-9) | Число конечных точек | ИОР/Гр |
|---|---|---|---|---|---|---|---|
| Life Span Study, LSS (смертность) | Shimizu et al., 1999 | 86.572 | 1950–1990 | 0.1 (0–4) | АГ (401–405) | 1199 | 0.21 (0.00; 0.45) р = 0.003 |
| Shimizu et al., 2010 | 86.611 | 1950–2003 | 0.1 (0–4) | АГ с поражением сердца (402, 404) | 922 | 0.37 (0.08; 0.72) р = 0.009 | |
| АГ без поражения сердца (401, 403, 405) | 411 | 0.07 (–0.22; 0.55) р > 0.5 | |||||
| I. Takahashi et al., 2017 | 86.600 | 1950–2008 | 0.1 (0–4) | АГ с поражением сердца и почек (402–404) | 1122 | 0.36 (0.10; 0.68) р = 0.004 | |
| АГ с поражением сердца (402) | 879 | 0.37 (0.07; 0.73) | |||||
| АГ с поражением почек (403) | 174 | 0.39 (–0.15; 1.30) | |||||
| АГ с одновременным поражением сердца и почек (404) | 69 | 0.26 (–0.79; 1.31) | |||||
| Adult Health Study, AHS (заболеваемость) Результат в скобках – без поправки на курение и алкоголь | Yamada et al., 2004 | 10.339 | 1958–1998 (1958–1960; 1996–1998) | 0.1 (0–4) | АГ (401) – линейная модель | 5.035 | 0.05 (–0.01; 0.10)
р = 0.08 (0.04 (–0.01; 0.09) р = 0.14) |
| АГ (401) – квадратичная модель | 5.035 | 0.03 (0.01; 0.06)
р = 0.01 (0.03 (n/a; 0.06) р = 0.028) |
|||||
| АГ с поражением сердца (402, 404) – линейная модель | 1.886 | –0.01 (–0.09; 0.09) р = 0.87 (0.01 (–0.08; 0.10) р = 0.86) |
|||||
| Участники ликвидации аварии на ЧАЭС (заболеваемость) | V.K. Ivanov et al., 2006 | 61.017 | 1986–2000 | 0.109 (0…>0.5) | АГ (401–405) | 15.484 | 0.26 (–0.04; 0.56) р = 0.08 |
| АГ (401) | 11.910 | 0.36 (0.005; 0.71) р = 0.04 | |||||
| АГ с поражением сердца (402) | 7.680 | 0.04 (–0.36; 0.44) р = 0.85 | |||||
| В.К. Иванов и др., 2017 | 53.704 (когорта А) | 1986–2012 | 0.161 | АГ (401–405) | 29.695 | 0.26 (0.12; 0.41) р < 0.001 | |
| Когорта работников ПО “Маяк”, впервые нанятых в 1948–1982 гг., (заболеваемость) | Настоящее исследование | 22.377 | 1948–2013 | 0.45 ± 0.65 Гр (муж.) 0.37 ± 0.56 Гр (жен.) | АГ (401–404) – линейная модель | 8425 | 0.14 (0.09; 0.20) |
Результаты исследования когорты ликвидаторов последствий аварии на Чернобыльской атомной электростанции (ЧАЭС), включающей 61 017 лиц, и наблюдавшихся в период 1986–2000 гг., свидетельствуют о статистически значимом повышенном риске заболеваемости АГ (401 код МКБ-9 или I10 код МКБ-10); ИОР/Гр = 0.36 (95%-ный ДИ 0.005; 0.71) [22] – табл. 4. При расширении периода наблюдения до 2012 г. в субкогорте ликвидаторов последствий аварии на ЧАЭС (53 704 человека), которые начали работу в зоне аварии в период с 26 апреля 1986 г. по 25 апреля 1987 г., была обнаружена статистически значимая зависимость заболеваемости АГ (401–405 коды МКБ-9 или I1–I15 коды МКБ-10) от дозы внешнего облучения; ИОР/Гр = 0.26 (95%-ный ДИ 0.12; 0.41) [9].
В целом можно отметить, что оцененный риск заболеваемости АГ в когорте работников ПО “Маяк”, подвергшихся хроническому внешнему облучению, был выше такового в когорте лиц, выживших после атомной бомбардировки в Японии (AHS), но ниже, чем в когорте ликвидаторов последствий радиационной аварии на ЧАЭС (табл. 4). Это может быть связано с рядом причин и, прежде всего, с существенными различиями сценариев облучения: члены японской когорты подверглись острому однократному облучению с высокой мощностью дозы; ликвидаторы последствий радиационной аварии на ЧАЭС – кратковременному (дни и месяцы) облучению в умеренных дозах, а работники ПО “Маяка” – хроническому воздействию радиации в диапазоне умеренных и низких доз (но с низкой мощностью дозы) на протяжении многих лет.
Что касается оценок влияния внутреннего облучения от инкорпорированного плутония на заболеваемость АГ, в доступной нам литературе такие сведения отсутствуют, поэтому мы не можем сравнить полученные результаты с другими подобными данными. Результаты настоящего исследования свидетельствуют о повышенном ОР заболеваемости АГ в отдельных диапазонах доз внутреннего облучения (0.10–0.15 Гр; 0.25–0.5 Гр; 0.5–1.0 Гр). В то же время не выявлена статистически значимая зависимость заболеваемости АГ от суммарной поглощенной в печени дозы внутреннего облучения, что обусловлено, в первую очередь, отсутствием оценок доз облучения на большую часть когорты (68.9%) и существенными неопределенностями поглощенных доз при таком облучении, о чем неоднократно было указано ранее [23].
Настоящее исследование, как и предыдущие работы по БСК [3–6], имеет ряд существенных преимуществ: большая численность изучаемой когорты (22 377 человек); длительный период наблюдения (1948–2013 гг.), гетерогенность когорты по полу и возрасту; индивидуальные измеренные дозы облучения в результате профессиональной деятельности и достаточная статистическая мощность исследования. Одним из главных преимуществ является то, что все работники изучаемой когорты, независимо от места работы, профессии и дозы облучения, проходили обязательные ежегодные медицинские обследования. Кроме этого, во время медицинских осмотров проводили измерения АД, роста и веса тела, а также опрос о вредных привычках, в первую очередь о курении и употреблении алкоголя, и эта очень важная информация доступна для преобладающего большинства работников изучаемой когорты (95%).
Недостатками исследования является ограничение анализа периодом проживания в г. Озерск, так как информация о перенесенных заболеваниях и нерадиационных факторах недоступна для мигрантов; отсутствие измерений α-активности в биосубстратах у большинства работников изучаемой когорты (68.9%) и существенная неопределенность оценок поглощенных в органах доз внутреннего облучения.
В рамках настоящего исследования не проводился анализ смертности от АГ, как основной причины смерти, из-за небольшого числа смертей от АГ среди членов изучаемой когорты (101 смерть) и, как следствие, недостаточной статистической мощности.
Наблюдение за когортой работников ПО “Маяк” продолжается, и на следующем этапе исследования мы планируем оценить риск смертности от АГ и риск заболеваемости отдельными подтипами АГ, расширив период наблюдения, а также используя уточненные оценки доз (новая дозиметрическая система – “ДСРМ-2016”) работников ПО “Маяк”.
ЗАКЛЮЧЕНИЕ
Результаты настоящего исследования показали, что заболеваемость АГ в когорте работников ПО “Маяк”, подвергшихся хроническому облучению с низкой мощностью дозы, зависела от суммарной дозы внешнего облучения. Установлена статистически значимая линейная зависимость заболеваемости АГ от суммарной поглощенной в печени дозы внешнего облучения; ИОР/Гр = 0.14 (95%-ный ДИ 0.09; 0.20).
Не выявлено статистически значимой зависимости заболеваемости АГ от суммарной поглощенной в печени дозы внутреннего облучения; ИОР/Гр = –0.01 (95%-ный ДИ n/a; 0.05).
Риск заболеваемости АГ в изучаемой когорте работников был выше такового в японской когорте лиц, выживших после атомной бомбардировки (AHS), но ниже, чем в когорте ликвидаторов последствий радиационной аварии на ЧАЭС. Эти различия обусловлены, прежде всего, существенными различиями сценариев облучения.
Список литературы
МКБ-9. Руководство по кодированию заболеваний, травм и причин смерти. Пересмотр 1975. Женева: ВОЗ, 1980. 752 c. [ICD-9 Guidelines for coding diseases, injuries and causes of death/revision 1975. Geneva, WHO, 1980. 752 p.]
Effects of ionizing radiation. UNSCEAR 2006 Report to the General Assembly, with scientific annexes. Volume I. New York: United Nations, 2008. 392 p.
Moseeva M.B., Azizova T.V., Grigoryeva E.S., Haylock R.G. Risks of circulatory diseases among Mayak PA workers with radiation doses estimated using the improved Mayak Worker Dosimetry System 2008 // Radiat. Environ. Biophys. 2014. V. 53. № 2. P. 469–477. https://doi.org/10.1007/s00411-014-0517-x
Azizova T.V., Haylock R.G., Moseeva M.B., et al. Cerebrovascular diseases incidence and mortality in an extended Mayak worker cohort 1948–1982 // Radiat. Res. 2014. V. 182. № 5. P. 529–544. https://doi.org/10.1667/RR13680.1
Azizova T.V., Grigoryeva E.S., Haylock R.G., et al. Ischeamic heart disease incidence and mortality in an extended cohort of Mayak workers first employed in 1948–1982 // Br. J. Radiol. 2015. V. 88. № 1054. P. 20150169. https://doi.org/10.1259/bjr.20150169
Azizova T.V., Bannikova M.V., Grigorieva E.S., et al. Risk of lower extremity arterial disease in a cohort of workers occupationally exposed to ionizing radiation over a prolonged period // Radiat. Environ. Biophys. 2016. V. 55. № 2. P. 147–159. https://doi.org/10.1007/s00411-016-0645-6
Takahashi I., Shimizu Y., Grant E.J., et al. Heart Disease Mortality in the Life Span Study, 1950–2008 // Radiat. Res. 2017. V. 187. № 3. P. 319–332. https://doi.org/10.1667/RR14347.1
Shimizu Y., Kodama K., Nishi N., et al. Radiation exposure and circulatory disease risk: Hiroshima and Nagasaki atomic bomb survivor data, 1950–2003 // BMJ. 2010. № 340. P. 534–539. https://doi.org/10.1136/bmj.b5349
Иванов В.К., Чекин С.Ю., Максютов М.А. и др. Радиационный риск заболеваемости гипертензиями среди российских участников ликвидации аварии на Чернобыльской АЭС // Мед. радиология и радиац. безопасность. 2017. Т. 62. № 1. С. 32–37. [Ivanov V.K., Chekin S.Yu., Maksyutov M.A. et al. Radiation risk of incidence of hypertensia among Russian recove-ry operation workers of the Chernobyl accident. Medical Radiology and Radiation Safety. 2017. V. 62. № 1. P. 32–37. (in Russian)] https://doi.org/10.12737/25050
Gillies M., Richardson D.B., Cardis E., et al. Mortality from Circulatory Diseases and other Non-Cancer Outcomes among Nuclear Workers in France,the United Kingdom and the United States (INWORKS) // Radiat. Res. 2017. V. 188. № 3. P. 276–290. https://doi.org/10.1667/RR14608.1
Little M.P. Radiation and circulatory disease // Mutat. Res. 2016. V. 770. Pt. B. P. 299–318. https://doi.org/10.1016/j.mrrev.2016.07.008
Azizova T.V., Day R.D., Wald N. et al. The “clinic” medi-cal-dosimetric database of Mayak production association workers: Structure, characteristics and prospects of utilization // Health Phys. 2008. V. 94. № 5. P. 449–458. https://doi.org/10.1097/01.HP.0000300757.00912.a2
Mancia G., Fagard R., Narkiewicz K. et al. Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // J. Hypertens. 2013. V. 31. № 7. P. 1281–1357. https://doi.org/10.1097/HJH.0000000000001940
Vasilenko E.K., Scherpelz R.I., Gorelov M.V. et al. External Dosimetry Reconstruction for Mayak Workers. AAHP Special Session Health Physics Society Annual Meeting, 2010. URL: http://www.hps1.org/aahp/public/AAHP_Special_Sessions/2010_Salt_Lake_City/pm-1.pdf (дата обращения 01.11.2016).
Napier B.A. The Mayak Worker Dosimetry System (MWDS-2013): an introduction to the documentation // Radiat. Prot. Dosim. 2017. V. 176. № 1–2. P. 6–9. https://doi.org/10.1093/rpd/ncx020
Fountos B.N. The Department of Energy’s Russian Health Studies Program // Radiat. Prot. Dosim. 2017. V. 176. № 1–2. P. 3–5. https://doi.org/10.1093/rpd/ncw110
Preston D., Lubin J., Pierce D., McConney M. Epicure Users Guide. Seattle, WA: Hirosoft International Corporation, 1993. 335 p.
Кузнецова К.В., Азизова Т.В., Банникова М.В. Артериальная гипертензия в когорте работников атомной промышленности // Радиация и риск. 2018. Т. 27. № 2. С. 86–96. [Kuznetsova K.V., Azizova T.V., Bannikova M.V. Hypertension incidence among workers at the Mayak nuclear complex // Radiation & Risk. 2018. V. 27. № 2. P. 86–89. (in Russian)] https://doi.org/10.21870/0131-3878-2018-27-2-86-96
Кузнецова К.В., Азизова Т.В., Банникова М.В. и др. Показатели заболеваемости артериальной гипертензией в когорте работников атомной промышленности // Артериальная гипертензия. 2016. № 22(3). С. 299–308. [Kuznetsova K.V., Azizova T.V., Bannikova M.V. et al. Arterial hypertension incidence rates in a cohort of nuclear workers // Arterial Hypertension. 2016. V. 22. №3). P. 299–308. (in Russian)] https://doi.org/10.18705/1607-419X-2016-22-3-299-308
Shimizu Y., Pierce D.A., Preston D.L. et al. Studies of the mortality of atomic bomb survivors. Report 12, part II. Noncancer mortality: 1950–1990 // Radiat. Res. 1999. V. 152. № 4. P. 374–389.
Yamada M., Wong F.L., Fujiwara S. et al. Noncancer disease incidence in atomic bomb survivors, 1958 – 1998 // Radiat. Res. 2004. V. 161. № 6. P. 622–632. https://doi.org/10.1667/rr3183
Ivanov V.K., Maksioutov M.A., Chekin S.Y. et al. The risk of radiation-induced cerebrovascular disease in Chernobyl emergency workers // Health Phys. 2006. V. 90. № 3. P. 199–207. https://doi.org/10.1097/01.HP.0000175835.31663.ea
Азизова Т.В., Хэйлок Р., Мосеева М.Б. и др. Риск заболеваемости и смертности от цереброваскулярных заболеваний в когорте работников ПО “Маяк”: 1948–1982 // Мед. радиология и радиац. безопасность. 2015. Т. 60. № 4. С. 43–61 [Azizova T.V., Haylock R., Moseeva M.B. et al. Cerebrovascular disease incidence and mortality in an extended Mayak worker cohort: 1948–1982 // Medical radiology and radiation safety. 2015. V. 60. № 4. P. 43–61. (in Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


