Радиационная биология. Радиоэкология, 2021, T. 61, № 2, стр. 158-166
Влияние препарата супероксиддисмутазы “Рексод” на число КОЕС у облученных мышей
А. В. Аклеев 1, 2, И. А. Шапошникова 1, *, И. В. Чурилова 3, А. Н. Гребенюк 3, 4, Е. А. Пряхин 1
1 Уральский научно-практический центр радиационной медицины ФМБА России
Челябинск, Россия
2 Челябинский государственный университет
Челябинск, Россия
3 Государственный научно-исследовательский институт особо чистых биопрепаратов ФМБА России
Санкт-Петербург, Россия
4 Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова
Санкт-Петербург, Россия
* E-mail: shaposhnikova@lenta.ru
Поступила в редакцию 10.08.2020
После доработки 01.12.2020
Принята к публикации 16.12.2020
Аннотация
Исследована противолучевая эффективность препарата Рексод® (ГосНИИ ОЧБ ФМБА России), содержащего рекомбинантную супероксиддисмутазу (СОД) человека, по критерию сохранности и пролиферативной активности кроветворных стволовых клеток у мышей самцов инбредной линии С57В1/6 SPF категории после острого внешнего γ-облучения. Животных подвергали общему γ-облучению на установке ИГУР-1М с источником 137Cs в дозах от 3.0 до 7.5 Гр при мощности дозы 0.78 Гр/мин. Рекомбинантную СОД вводили внутрибрюшинно однократно в дозе 180 мг/кг (в объеме 1 мл) за 15 мин до облучения. Оценку противолучевых свойств СОД проводили по количеству колониеобразующих единиц в эндотесте (КОЕс), ядросодержащих клеток в костном мозге и тимусе, эритроцитов и лейкоцитов в периферической крови, динамике массы тимуса и селезенки. Показано, что применение СОД позволяет повысить сохранность КОЕс после острого γ-облучения мышей в дозе 4 Гр. Отмеченные изменения зависимости числа КОЕс и других гематологических показателей после введения СОД могут свидетельствовать о стимуляции гемопоэза в селезенке. Выявленное стимулирующее действие СОД на эритропоэз и количество ядерных клеток в тимусе как у облученных, так и у необлученных животных открывает новые перспективы применения препарата и требует дальнейшего изучения механизмов выявленных эффектов.
К настоящему времени получено много доказательств, что антиоксиданты способны модифицировать реакции гемопоэза на радиационное воздействие. Радиозащитный эффект антиоксидантов был установлен в экспериментальных исследованиях in vitro, in vivo и в клинических условиях [1]. Механизм противолучевого действия антиоксидантов прямо и косвенно связан с ингибированием цитотоксических и мутагенных эффектов активных радикалов посредством их элиминации, угнетения перекисного окисления липидов, активации ферментов репарации повреждений, снижения активности NO-синтазы [2]. Показано, что высокая радиочувствительность некоторых клеточных линий обусловлена нарушением антиоксидантной активности [3].
Хорошо известно, что ключевыми ферментами антиоксидантной защиты клеток являются марганецзависимая и медь-цинкзависимая супероксиддисмутазы (СОД), которые контролируют окислительные процессы с участием свободных радикалов кислорода и азота, образование продуктов пероксидации липидов, повышенный уровень которых наблюдается после радиационного воздействия и при многих патологических состояниях, сопряженных с оксидативным стрессом [1, 4, 5]. Хотя показано, что СОД может приводить к повышению выживаемости кроветворных стволовых клеток (КСК) человека и к повышению выживаемости животных при костномозговой форме острого лучевого синдрома [6], механизмы ее действия на гемопоэз остаются не ясными. В настоящей работе было исследовано противолучевое действие рекомбинантной человеческой СОД препарата Рексод®, созданной во ФГУП Государственный научно-исследовательский институт особо чистых биопрепаратов Федерального медико-биологического агентства (ГосНИИ ОЧБ ФМБА России). Основным действующим веществом препарата Рексод®, который обладает антиоксидантным, антицитолитическим и противовоспалительным действием (РУ ЛП-004754-260318), является рекомбинантная СОД человека, получаемая по генно-инженерной технологии с использованием в качестве продуцента культуры дрожжей Saccharomyces cerevisiae, штамм Y21341 [7].
Целью работы была оценка влияния препарата Рексод® на гемопоэз мышей, включая анализ сохранности и пролиферативной активности кроветворных стволовых клеток после острого внешнего γ-облучения.
МАТЕРИАЛЫ И МЕТОДИКА
Работа выполнена на кондиционных половозрелых мышах самцах инбредной линии С57В1/6 SPF категории (питомник ИЦИГ, Новосибирск) в возрасте 2.0–2.5 мес. с массой тела 20–23 г. Условия содержания и кормления животных осуществлялись в соответствии с приказом № 742 от 13.11.1984 “Об утверждении Правил проведения работ с использованием экспериментальных животных” и приказом Министерства здравоохранения и социального развития РФ от 23 августа 2010 г. № 708н “Об утверждении Правил лабораторной практики”. При проведении исследований соблюдались правила гуманного обращения с экспериментальными животными в соответствии с “Правилами проведения работ с использованием экспериментальных животных”, утвержденными приказом Минздрава СССР (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. № 775) и стандартами Этического комитета ФГБУН Уральский научно-практический центр радиационной медицины (УНПЦ РМ).
Лабораторные животные содержались в оптимальных для данного вида условиях. Температура воздуха в помещении +22°С, влажность – 50–60%. Длина светового дня регулировалась с помощью искусственного освещения и составляла 12 ч. Животных содержали на стандартном рационе с неограниченной подачей питьевой воды.
Первоначально была проведена оценка зависимости количества КОЕс (колониеобразующие единицы в селезенке, эндоколонии) [8] от дозы внешнего γ-облучения для выбора дозы, используемой в эндотесте с целью определения радиозащитного действия СОД. Процедуру метода эндотеста проводили в точном соответствии с модификацией, предложенной А.Е. Переверзевым [9].
Было сформировано 15 групп по восемь животных в каждой. Определение выживаемости КОЕс оценивали после острого тотального γ-облучения мышей в дозах 3.0; 3.25; 3.5; 3.75; 4.0; 4.5; 5.0; 5.25; 5.5; 5.75; 6.0; 6.25; 6.5; 7.0; 7.5 Гр. Облучение животных проводили на установке ИГУР-1М, которая содержит четыре источника 137Cs. Мощность дозы γ-излучения установки составляет 0.78 Гр/мин, неравномерность γ-поля в рабочем пространстве – не более 5%. Определение количества КОЕс в селезенке проводили на 9-е сутки после острого тотального γ-облучения.
Для оценки радиозащитных свойств рекомбинантой человеческой СОД использовали препарат Рексод®, раствор для внутривенного введения 3.2 млн ЕД (РУ ЛП-004754-260318), производства ГосНИИ ОЧБ ФМБА России. Оценку радиозащитных свойств препарата проводили по показателям, характеризующим состояние кроветворения (количество КОЕс, ядросодержащих клеток (ЯСК) в костном мозге, эритроцитов и лейкоцитов в периферической крови) и лимфоидных органов – тимуса (масса и количество клеток в органе) и селезенки (масса). Оценку радиозащитного действия препарата Рексод® проводили в двух независимых экспериментах.
В первой серии экспериментов было сформировано две группы по 20 животных в каждой. Мышам опытной группы внутрибрюшинно (в/б) однократно вводили препарат Рексод® в объеме 1 мл (в дозе 180 мг/кг) за 15 мин до облучения в дозе 4 Гр, мышам контрольной группы – внутрибрюшинно вводили растворитель (физиологический раствор) в те же сроки и в том же объеме за 15 мин до облучения.
На 9-е сутки после острого тотального γ-облучения проводили эвтаназию, вскрытие, макроскопическое исследование внутренних органов, измерение массы селезенки и тимуса, оценку количества КОЕс в селезенке, ЯСК в костном мозге и тимусе, количества клеток периферической крови.
Во второй серии экспериментов было сформировано четыре группы животных:
− 1-я группа – 20 самцов мышей, которым за 15 мин до облучения в дозе 4 Гр проводилось в/б введение 1 мл препарата Рексод® (в дозе 180 мг/кг);
− 2-я группа (контроль) – 20 самцов мышей, которым за 15 мин до облучения в дозе 4 Гр проводилось в/б введение 1 мл физиологического раствора;
− 3-я группа – 11 самцов мышей, которым проводилось в/б введение 1 мл препарата Рексод® (в дозе 180 мг/кг) (необлученные животные);
− 4-я группа (контроль) – 11 самцов мышей, которым проводилось в/б введение 1 мл физиологического раствора (необлученные животные).
На 9-е сутки после острого тотального γ-облучения проводили эвтаназию, вскрытие, макроскопическое исследование внутренних органов, измерение массы селезенки и тимуса, количества КОЕс в селезенке, количества ЯСК в костном мозге и тимусе, количества клеток периферической крови.
Анализ полученных результатов осуществляли с помощью общепринятых методов статистики [10]: рассчитывали среднее арифметическое значение и стандартную ошибку, для оценки взаимосвязи исследованных показателей использовали корреляционный и регрессионный анализ. При анализе распределения показателей с помощью критерия Колмогорова–Смирнова было показано, что они статистически значимо не отличались от нормального, поэтому применяли параметрические методы анализа. Сравнение средних проводили с помощью t-критерия Стьюдента. Статистически значимыми принимали отличия при р ≤ 0.05.
РЕЗУЛЬТАТЫ
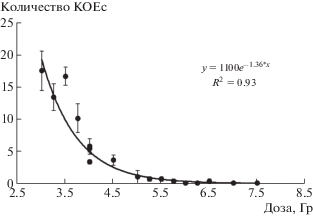
На первом этапе проводили оценку зависимости количества сохранивших жизнеспособность КОЕс у самцов мышей С57В1/6 от дозы внешнего общего γ-облучения. Результаты подсчета КОЕс в разных дозовых группах мышей представлены на рис. 1. Видно, что выживаемость КОЕс хорошо описывалась экспоненциальной функцией (R2 = = 0.93; F = 190.95; р = 6.15 × 10–10). Расчетное значение D0 для КОЕс у самцов мышей С57В1/6 составило 0.73 Гр. Для дальнейшего тестирования радиозащитного действия препарата Рексод® была выбрана доза 4 Гр.
Рис. 1.
Количество эндоколоний в селезенке мышей С57В1/6 при облучении в различных дозах, КОЕс/селезенку.
Fig. 1. The number of endocolonies in the spleen of C57B1/6 mice under irradiation at different doses, CFU/spleen.
Результаты первой серии экспериментов по оценке радиозащитного действия препарата Рексод®, полученные в исследованиях с острым однократным облучением мышей линии С57В1/6, представлены в табл. 1. Количество клеток в периферической крови у мышей опытной и контрольной групп статистически значимо не отличалось, хотя у животных опытной группы отмечалось более высокое содержание эритроцитов и лейкоцитов.
Таблица 1.
Результаты первой серии экспериментов по оценке радиозащитного действия СОД при остром γ-облучении мышей линии С57В1/6 в дозе 4 Гр Table 1. Results of the first series of experiments to assess the radioprotective effect of SOD during acute γ-irradiation of C57B1/6 mice at 4 Gy
| Группы | Масса животных, г | Масса селезенки, мг | КОЕс | ЯСК в костном мозге, млн/бедро | Масса тимуса, мг | ЯСК в тимусе, млн/мг | Эритроциты, млн/мкл | Лейкоциты, млн/мл |
|---|---|---|---|---|---|---|---|---|
| Опыт СОД + 4 Гр | 22.42 ± 0.30 | 33.45 ± 1.50 | 8.05 ± 0.90 p = 0.02 | 18.70 ± 0.60 | 22.35 ± 0.50 p = 0.05 | 1.81 ± 0.10 | 2.35 ± 0.10 | 2.53 ± 0.10 |
| Контроль Физиол. р-р + 4 Гр | 22.40 ± 0.20 | 32.90 ± 1.80 | 5.45 ± 0.60 | 19.36 ± 0.70 | 24.10 ± 0.68 | 2.02 ± 0.08 | 2.11 ± 0.14 | 2.21 ± 0.13 |
Масса тимуса у животных опытной группы была статистически значимо ниже, чем у животных контрольной группы и составляла 22.35 ± ± 0.50 мг (p = 0.05) при 24.10 ± 0.68 мг в контроле. Количество ядросодержащих клеток в тимусе животных опытной группы значимо не отличалось относительно контроля (2.02 ± 0.08 млн ЯСК/мг) и составило 1.81 ± 0.10 млн ЯСК/мг.
Статистически значимые отличия наблюдались при оценке количества КОЕс у животных опытных и контрольных групп. Количество КОЕс у животных, которым вводили препарат Рексод® за 15 мин до облучения, было в 1.5 раза выше по сравнению с контролем и составило 8.05 ± 0.90 (p = 0.02). В контрольной группе показатель составил 5.45 ± 0.60.
Результаты второй серии экспериментов по оценке радиозащитного действия препарата Рексод®, полученные в исследованиях с острым однократным облучением мышей линии С57В1/6, представлены в табл. 2. При применении Рексод® был воспроизведен эффект повышения числа стволовых клеток. Количество КОЕс у животных, которым вводили препарат за 15 мин до облучения, было на 40% выше (р = 0.02) по сравнению с контролем и составило 10.30 ± 0.98. В контрольной группе этот показатель был равен 7.35 ± 0.70.
Таблица 2.
Результаты второй серии экспериментов по оценке радиозащитного действия СОД при остром γ-облучении мышей линии С57В1/6 в дозе 4 Гр Table 2. Results of the second series of experiments to assess radioprotective effect of SOD during acute γ-irradiation of C57B1/6 mice at 4 Gy
| Группы | Масса животных, г | Масса селезенки, мг | КОЕс | ЯСК в костном мозге, млн/бедро | Масса тимуса, мг | ЯСК в тимусе, млн/мг | Эритроциты, млн/мкл | Лейкоциты, млн/мл |
|---|---|---|---|---|---|---|---|---|
| СОД + 4 Гр | 23.39 ± 0.30 | 32.50 ± 1.30 | 10.30 ± 0.98 p = 0.02 | 18.19 ± 0.70 | 27.55 ± 1.0 | 1.94 ± 0.10 p = 0.0001 | 5.01 ± 0.20 p = 0.0001 | 2.25 ± 0.10 p = 0.02 |
| Физиол. р-р + 4 Гр | 23.25 ± 0.17 | 31.15 ± 0.66 | 7.35 ± 0.70 | 18.13 ± 0.89 | 26.30 ± 1.01 | 1.47 ± 0.05 | 3.44 ± 0.16 | 1.88 ± 0.12 |
| СОД | 22.63 ± 0.60 | 51.50 ± 2.40 | – | 21.01 ± 0.80 | 27.17 ± 2.30 p = 0.05 | 1.60 ± 0.10 p = 0.01 | 6.31 ± 0.20 p = 0.0001 | 11.06 ± 0.70 |
| Физиол. р-р | 22.05 ± 0.40 | 48.27 ± 1.40 | – | 21.79 ± 1.20 | 21.64 ± 1.40 | 0.91 ± 0.20 | 3.96 ± 0.20 | 11.51 ± 1.30 |
Количество эритроцитов у облученных животных, которые получили Рексод®, было в 1.5 раза выше (p = 0.0001), чем в контрольной облученной группе и составляло 5.01 ± 0.20 млн/мкл. У необлученных мышей введение препарата также приводило к статистически значимому увеличению количества эритроцитов в периферической крови по сравнению с необлученным контролем (p = = 0.0001).
В группе, где животные получали препарат Рексод® до облучения, среднее содержание лейкоцитов было равно 2.25 ± 0.10 млн/мл, что было статистически значимо выше (p = 0.02) данного показателя у облученного контроля – 1.88 ± 0.12 млн/мл.
Во второй серии экспериментов масса тимуса у облученных животных первой и второй групп не имела достоверных отличий. Однако у необлученных мышей, которые получили Рексод®, масса тимуса составила 27.17 ± 2.30 мг и была статистически значимо выше (p = 0.05) показателя у необлученного контроля – 21.64 ± 1.40 мг.
Количество ядросодержащих клеток в тимусе в экспериментальных группах, где животные получали Рексод®, было статистически значимо выше показателей облученных и необлученных животных.
Для оценки влияния СОД на реакцию гемопоэза после общего острого облучения методами регрессионного и корреляционного анализа исследовали взаимосвязи изученных показателей с количеством КОЕс у облученных мышей, получавших Рексод®, и в группе облученного контроля.
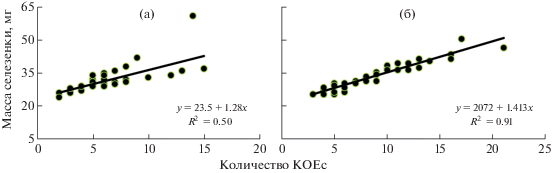
В группе облученного контроля и в группе, где мыши получали Рексод®, была отмечена положительная связь между количеством КОЕс и массой селезенки (рис. 2). Зависимость массы селезенки от количества КОЕс в группе контроля хорошо описывалась линейной функцией (R2 = 0.50; F = = 38.57; p < 0.001). В группе, где облученные животные получали Рексод®, зависимость имела аналогичный характер, но была более выражена (R2 = 0.91; F = 370.35; p < 0.001).
Рис. 2.
Результаты регрессионного анализа связи количества КОЕс и массы селезенки у животных контрольной группы (а) и мышей, получавших Рексод® (б).
Fig. 2. Results of the regression analysis of the relationship between the number of CFUs and the mass of the spleen in the animals of the control group (a) and mice treated with Rexod® (b).
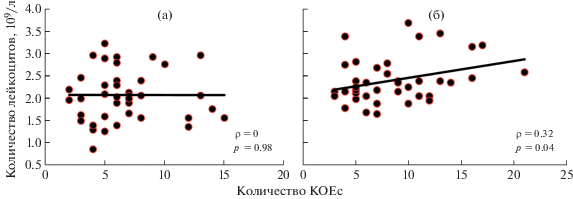
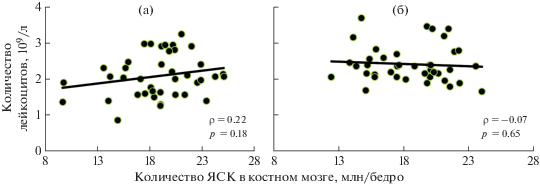
Корреляционный анализ не позволил отметить статистически значимой связи между количеством КОЕс и количеством ЯСК в костном мозге мышей в группе облученного контроля (рис. 3, а). Однако у облученных животных, которым вводили Рексод®, была зарегистрирована статистически значимая обратная связь между количеством КОЕс и количеством ЯСК в костном мозге (рис. 3, б). У мышей из группы облученного контроля не было выявлено статистически значимой связи между количеством КОЕс и лейкоцитов в периферической крови (рис. 4, а), тогда как у облученных мышей, получивших Рексод®, была зарегистрирована положительная статистически значимая связь между этими показателями (рис. 4, б).
Рис. 3.
Результаты корреляционного анализа связи количества КОЕс и количества ЯСК в костном мозге у животных контрольной группы (а) и мышей, получавших Рексод® (б).
Fig. 3. Results of the correlation analysis of the relationship between the number of CFUs and the number of NSCs in the bone marrow in the animals of the control group (a) and mice receiving Rexod® (b).
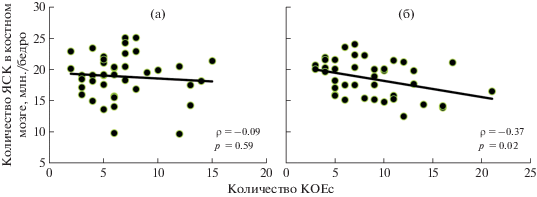
Рис. 4.
Результаты корреляционного анализа связи количества КОЕс и количества лейкоцитов в периферической крови животных контрольной группы (а) и мышей, получавших Рексод® (б).
Fig. 4. Results of the correlation analysis of the relationship between the number of CFUs and the number of leukocytes in the peripheral blood of the animals of the control group (a) and mice receiving Rexod® (b).
Важно отметить, что в сравниваемых группах не было установлено зависимости между ЯСК в костном мозге и числом лейкоцитов в периферической крови (рис. 5).
Рис. 5.
Результаты корреляционного анализа связи количества ЯСК в костном мозге и количества лейкоцитов в периферической крови у животных контрольной группы (а) и мышей, получавших Рексод® (б).
Fig. 5. Results of the correlation analysis of the relationship between the number of NSC in the bone marrow and the number of leukocytes in the peripheral blood in the animals of the control group (a) and mice receiving Rexod® (b).
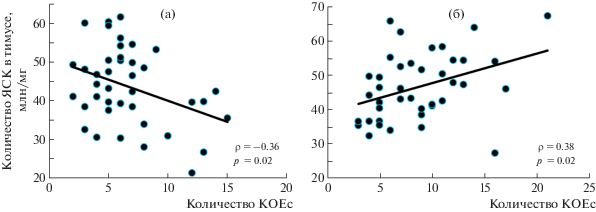
Как отмечалось выше, во второй серии экспериментов (табл. 2) было показано, что Рексод® оказывает положительное влияние на восстановление количества ЯСК в тимусе после острого облучения. Корреляционный анализ свидетельствует о принципиальном изменении зависимости числа ЯСК в тимусе от количества КОЕс у мышей, получавших препарат. Так, у мышей из группы облученного контроля была зарегистрирована статистически значимая обратная зависимость количества ЯСК в тимусе от количества КОЕс (рис. 6, а), тогда как введение препарата приводило к изменению этой зависимости с отрицательной на положительную (рис. 6, б).
Рис. 6.
Результаты корреляционного анализа связи количества КОЕс и количества ЯСК в тимусе у животных контрольной группы (а) и облученных мышей, получавших Рексод® (б).
Fig. 6. Results of the correlation analysis of the relationship between the number of CFUs and the number of NSCs in the thymus in the animals of the control group (a) and irradiated mice receiving Rexod® (b).
ОБСУЖДЕНИЕ
Известно, что радиационное воздействие даже в малых дозах способно изменять содержание антиоксидантных ферментов в клетках [11]. Установлено, что редоксчувствительный NF-κB активируется малыми дозами радиации, что приводит к повышению генной экспрессии марганецзависимой СОД, ее ферментативной активности и изменению радиочувствительности клетки [12].
Ранее во многих экспериментальных и клинических исследованиях было отмечено противолучевое действие СОД при ее введении как до, так и после облучения [4, 6]. Имеются данные, что СОД-содержащие препараты способствуют уменьшению числа морфологически измененных клеток и приводят к повышению их выживаемости при γ-облучении в высоких дозах [13, 14]. Лечение препаратами СОД оказалось достаточно эффективным при лечении постлучевого фиброза [14]. Однако механизмы столь широкого биологического действия препаратов СОД до настоящего времени остаются неясными. Можно полагать, что эффективность СОД при ряде заболеваний различной этиологии может быть обусловлена ее действием на стволовые клетки, а универсальный механизм радиозащитного действия СОД, связанный с инактивацией активных форм кислорода и азота, обусловлен предохранением стволовых клеток различных тканей от оксидативного повреждения.
Оценка эффективности действия рекомбинантного препарата Рексод® в поддержании пула стволовых клеток после острого облучения, проведенная с использованием теста КОЕс, показала его высокую эффективность. По результатам пилотного исследования было установлено, что препарат СОД при внутрибрюшинном введении в дозе 180 мг/кг за 15 мин до острого тотального γ-облучения в дозе 4 Гр в тесте оценки КОЕс (эндоколонии) повышает выживаемость стволовых клеток у мышей инбредной линии С57В1/6. Эффект был подтвержден в двух сериях независимых экспериментов.
Анализ зависимости массы селезенки от количества КОЕс позволяет интерпретировать полученные результаты с точки зрения пролиферативной активности стволовых клеток, формирующих колонии. Поскольку коэффициент, отражающий наклон линии регрессии, характеризует среднюю массу колоний, статистически значимое увеличение этого коэффициента может свидетельствовать как о повышении пролиферативной активности стволовых клеток, так и об увеличении их выживаемости. В настоящем исследовании не было выявлено статистически значимых отличий массы одной колонии в группе облученного контроля (1.28 ± 0.21 мг) от значения показателя в группе, где облученные животные получали Рексод® (1.41 ± 0.07 мг, р = 0.55). Полученные результаты свидетельствуют о том, что Рексод®, по-видимому, повышает только выживаемость стволовых клеток, но не влияет на их пролиферативную активность.
В настоящее время установлено, что критическими факторами выживания КСК при оксидативном стрессе являются гены FoxO и их транс-крипционные факторы. Предполагается, что они играют важную роль в регуляции клеточного цикла, поддерживая состояние покоя КСК и сохраняя в течение длительного времени их самообновление и репопуляцию. Показано, что транс-крипционный фактор FoxO3 подавляет образование активных радикалов в КСК посредством стабилизации гена АТМ [15].
Результаты корреляционного и регрессионного анализа позволили предположить, что у облученных животных, получавших Рексод®, превалирует кроветворение в селезенке. Предположение о влиянии СОД на перераспределение гемопоэза у облученных животных из преимущественно костномозгового в преимущественно селезеночный находит свое подтверждение при корреляционном анализе зависимости числа лейкоцитов в периферической крови и КОЕс. Отмеченная отрицательная корреляционная зависимость между количествоем КОЕс и ЯСК в костном мозге, а также положительная связь между КОЕс и количеством лейкоцитов в периферической крови у облученных мышей, получавших Рексод®, по сравнению с отсутствием таковых у мышей из группы облученного контроля, позволяет предположить, что СОД у облученных животных приводит к перераспределению активного гемопоэза из костного мозга в селезенку.
Перераспределение активного гепомопоэза из костного мозга в селезенку у облученных мышей, получавших препарат, позволяет полагать, что СОД повлиял на структуру гемопоэза. О вовлечении СОД в сигнальные пути регуляции гемопоэза свидетельствует участие внеклеточной СОД в регуляцию экспрессии гена эритропоэтина [16].
Отмеченное в исследовании противолучевое действие Рексод® на КОЕс может косвенно свидетельствовать о потенциальной эффективности препарата в отношении стволовых клеток и других органов (например, костного мозга и тимуса). Было отмечено, что на 9-е сутки после облучения препарат повышает количество ядерных клеток в тимусе, эритроцитов и лейкоцитов в периферической крови у облученных мышей по сравнению с облученным контролем. Анализ числа эритроцитов и лейкоцитов в периферической крови у облученных в сублетальных дозах животных, получавших СОД, свидетельствует о достаточной активации гемопоэза в целом. Активация кроветворения, возможно, связана с повышением выживаемости стволовых клеток не только селезенки, но и костного мозга и тимуса. Ранее в модели нокаутных животных с сочетанным дефицитом генов Fancc-/- Sod1-/- было показано, что СОД способна оказывать влияние на пролиферацию и выживаемость кроветворных клеток [17].
Кроме радиозащитного действия выявлено стимулирующее действие Рексод® на эритропоэз и лимфопоэз в тимусе у необлученных животных. Изменение зависимости между числом КОЕс и ЯСК тимуса с отрицательной у животных γ-контроля на положительную у облученных мышей, получавших Рексод®, позволяет предположить, что СОД оказывает влияние не только на гемопоэз, но и на иммунитет. Ранее было показано, что внеклеточная СОД-3, которая является изоформой СОД, контролирует иммунный ответ, регулируя созревание дендритных клеток, активацию и пролиферацию Т-клеток, а также дифференцировку Т-хелперов 2-го типа (Th2) и регуляторных Th17. Предполагается, что СОД участвует в регуляции адаптивного иммунитета опосредованно через влияние на экспрессию редокс-чувствительного транскрипционного фактора Nrf2 [18].
ЗАКЛЮЧЕНИЕ
Результаты настоящего пилотного исследования свидетельствуют о повышении выживаемости кроветворных стволовых клеток у мышей линии С57В1/6 в тесте оценки КОЕс (эндоколонии) после острого тотального γ-облучения мышей в сублетальной дозе при внутрибрюшинном введении рекомбинантной СОД человека производства ГосНИИ ОЧБ ФМБА России (торговое наименование Рексод®) в дозе 180 мг/кг за 15 мин до облучения. Показано, что СОД способна регулировать иммуногемопоэз. Результаты эксперимента продемонстрировали, что СОД изменяет баланс костномозгового и селезеночного кроветворения и вызывает перераспределение активного гемопоэза из костного мозга в селезенку. Выявлено стимулирующее действие Рексод® на эритропоэз и Т-лимфопоэз у необлученных животных. Вышеуказанные эффекты могут быть связаны как с СОД-индуцированным повышением выживаемости стволовых клеток костного мозга и тимуса, так и с изменением баланса активности гемопоэза в организме.
Отмеченные модифицирующие иммуногемопоэз эффекты СОД требуют более детального изучения для прояснения механизмов. Полученные результаты указывают на то, что лекарственный препарат Рексод® является перспективным средством для коррекции иммуногемопоэза, в том числе и после радиационного воздействия.
Список литературы
Stewart F.A., Akleyev A.V., Hauer-Jensen M. et al. Early and late effects of radiation in normal tissues and organs – threshold doses for tissue reactions in a radiation protection context. ICRP Publication 118 / Ed. C.H. Cle-ment // Elsevier. 2012. P. 322.
Shirazi A., Ghobadi G., Ghazi-Khansari M. A radiobiological review on melatonin: a novel radioprotector // J. Radiat. Res. 2007. V. 48. P. 263–272.
Tulard A., Hoffschir F., de Boisferon F.H. et al. Persistent oxidative stress after ionizing radiation is involved in inherited radiosensitivity // Free Radic. Biol. Med. 2003. V. 35. P. 68–77.
Пушкина Т.А., Токаев Э.С., Попова Т.С., Бородина Е.Н. Супероксид-дисмутаза в составе антиоксидантной терапии: состояние вопроса и перспективы (обзор литературы) // Журн. им. Н.В. Склифосовского “Неотложная медицинская помощь”. 2016. № 4. С. 42–47. [Pushkina T.A., Tokayev E.S., Popova T.S., Borodina E.N. Superoxide dismutase as a component of antioxidant therapy: current state of the issue and prospects. A literature review // Russian Sklifosovsky Journal “Emergency Medical Care”. 2016. № 4. P. 42–47. (In Russian)]
Antonic V., Rabbani Z.N., Jackson I.L., Vujaskovic Z. Subcutaneous administration of bovine superoxide dismutase protects lungs from radiation induced lung injury // Free Radic. Res. 2015. V. 49. № 10. P. 1259–1268.
Деримедведь Л.Ю. Экспериментальное обоснование использования препаратов супероксиддисмутазы при патологических состояниях, обусловленных активацией процессов свободнорадикального окисления: Автореф. дис. … д-ра мед. наук. К., 2006. [Derimedved L.Yu. Experimental justification of the use of superoxide dismutase preparations in pathological conditions caused by the activation of free radical oxidation processes: Dis. Abstr. … Dr Med. Sci. K., 2006. (In Russian)]
Козлов Д.Г., Ефремов Б.Д., Ломакин И.Г. и др. Штамм дрожжей Saccharomyces cerevisiae – продуцент СОД человека: Патент РФ № 2044771, сентябрь, 1995. [Kozlov D.G., Efremov B.D., Lomakin I.G. et al. Saccharomyces cerevisiae yeast strain – producer of human SOD: RF Patent № 2044771, September, 1995. (In Russian)]
Коноплянников А.Г., Коноплянников М.А. Стволовые клетки и регенеративная медицина // IV Всерос. науч. шк.-конф. 24–27 октября 2011 г. М.: Изд-во МГУ, 2011. С. 47. [Konoplyannikov A.G., Konoplyannikov M.A. Stem cells and regenerative medicine // IV All-Russian Scientific School-Conference October 24–27, 2011 Moscow: Publishing House of Moscow State University, 2011. P. 47. (In Russian)]
Переверзев А.К. Кроветворные колониеобразующие клетки и физические стресс-факторы. Л.: Наука, 1986. 172 с. [Pereverzev A.K. Hematopoietic colony-forming cells and physical stressors. L.: Nauka, 1986. 172 p. (In Russian)]
Гринхальт Т. Основы доказательной медицины: Пер. с англ. И.Н. Денисова, К.И. Сайткулова. М.: Гэотар Медиа, 2008. 54 с. [Greenhalgh T. Foundations of evidence based medicine: Trans. from English I.N. Denisova, K.I. Saitkulova. M.: Geotar Media, 2008. 54 p. (In Russian)]
Klucinski P., Wojcik A., Grabowska-Bochenek R. et al. Erythrocyte antioxidant parameters in workers occupationally exposed to low levels of ionizing radiation // Ann. Agric. Environ. Med. 2008. V. 15. P. 9–12.
Murley J.S., Nantajit D., Baker K.L. et al. Maintenance of manganese superoxide dismutase (SOD2)-mediated delayed radioprotection induced by repeated administration of the free thiol form of amifostine // Radiat. Res. 2008. V. 169. P. 495–505.
Prasad K.N. Rationale for using multiple antioxidants in protecting humans against low doses of ionizing radiation // Br. J. Radiol. 2005. V. 78. P. 485–492.
Campana F., Zervoudis S., Perdereau B. et al. Topical superoxide dismutase reduces post-irradiation breast cancer fibrosis // J. Cell. Molec. Med. 2004. V. 8. № 1. P. 109–116.
Tothova Z., Kollipara R., Huntly B.J. et al. FoxOs are critical mediators of hematopoietic stem cell resistance to physiologic oxidative stress // Cell. 2007. V. 128. P. 325–339.
Zelko I.N., Folz R.J. Extracellular superoxide dismutase functions as a major repressor of hypoxia-induced erythropoietin gene expression // Endocrinol. 2005 Jan. V. 146. № 1. P. 332–340. Epub. 2004 Sep 16.https://doi.org/10.1210/en.2004-1007
Hadjur S., Ung K., Wadsworth L. et al. Defectiv e hematopoiesis and hepatic steatosis in mice with combined deficiencies of the genes encoding Fancc and Cu/Zn superoxide dismutase // Blood. 2001. Aug. 15. V. 98. № 4. P. 1003–1011. https://doi.org/10.1182/blood.v98.4.1003
Myung-Ja K., Yun-Jae J., Kyo-Young L., Tae-Yoon K. Superoxide dismutase 3 controls adaptive immune responses and contributes to the inhibition of ovalbumin-induced allergic airway inflammation in mice // Antioxid Redox Signal. 2012. Nov. 15. V. 17. № 10. P. 1376–1392. https://doi.org/10.1089/ars.2012.4572
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


