Радиационная биология. Радиоэкология, 2021, T. 61, № 2, стр. 167-173
Поведенческая активность и уровень кортикостерона в сыворотке крови мышей в динамике семидневного воздействия наносекундным импульсным микроволновым излучением
А. В. Самойлова 1, 2, 3, *, М. А. Большаков 1, 3, Л. П. Жаркова 1, 3, А. А. Гостюхина 1, 4, О. П. Кутенков 1, В. В. Ростов 1
1 Институт сильноточной электроники СО РАН
Томск, Россия
2 Сибирский государственный медицинский университет Минздрава России
Томск, Россия
3 Национальный исследовательский Томский государственный университет
Томск, Россия
4 Сибирский Федеральный научно-клинический центр Федерального медико-биологического агентства
Северск, Россия
* E-mail: kereya21@mail.ru
Поступила в редакцию 29.10.2019
После доработки 15.09.2020
Принята к публикации 16.12.2020
Аннотация
Исследовано влияние наносекундного импульсно-периодического микроволнового излучения (ИПМИ, 4000 импульсов ежедневно, частоты повторения импульсов 13 и 22 Гц, пиковая плотность потока мощности (пППМ) 1500 Вт/см2, несущая частота 10 ГГц) на головной мозг лабораторных мышей. Эффект воздействия оценивали по изменению поведенческих реакций мышей в “открытом поле” и уровню гормона кортикостерона в сыворотке крови животных в динамике. Установлено, что 3-, 5- и 7-дневное облучение наносекундным ИПМИ разнонаправленно влияет на поведенческие реакции мышей и содержание кортикостерона. Выявленные эффекты воздействия зависят от частоты повторения импульсов ИПМИ. Полученные результаты указывают на непосредственное влияние излучения на головной мозг – оно может стимулировать развитие разных фаз общего адаптационного синдрома (стресса) в организме после облучения наносекундным ИПМИ.
В настоящее время источники наносекундных микроволновых импульсов малой длительности (единицы-десятки наносекунд) с высокой пиковой плотностью потока мощности (пППМ) (единицы-десятки кВт/см2) используются в научно-исследовательской деятельности при тестировании радиоэлектронной аппаратуры на электромагнитную устойчивость, в дефектоскопии материалов и конструкций [1]. Предполагается, что наносекундные ИПМИ в дальнейшем будут использоваться в медицине, ветеринарии и биотехнологии. При этом возникает вопрос относительно безопасности воздействия данных излучений на человека, прежде всего, на обслуживающий персонал. Все вышеперечисленное определяет актуальность исследования на лабораторных животных физиологических эффектов и закономерностей действия наносекундных микроволновых излучений.
Ранее выполненными экспериментами показано, что наносекундные импульсные микроволны влияют на развитие дрозофилы, синтез нуклеиновых кислот и пролиферацию опухолевых клеток, изменяют показатели периферической крови, структуру и функцию печени крыс, влияют на регенерацию кожных ран и изъязвлений слизистой желудка, изменяют уровень АФК в митохондриях гепатоцитов и активность ферментов антиоксидантной защиты митохондрий [2–4]. Все выявленные эффекты зависят от интенсивности воздействия и частоты повторения импульсов. Относительно недавно было показано: наносекундное ИПМИ влияет на головной мозг мышей, что проявляется изменением активности нейронов гипоталамуса и ретикулярной формации [5]. Как известно, в регуляции всех физиологических функций организма важнейшую роль играет головной мозг. Поэтому нейрофизиологические эффекты низкоинтенсивного микроволнового излучения активно изучались и продолжают изучаться. В частности, в одном из недавних исследований было показано, что повторяющиеся в течение 15 дней воздействия немодулированным ЭМИ (10 ГГц, по 2 ч ежедневно) изменяют поведение мышей и способствуют формированию окислительного стресса в тканях мозга [6]. В этом плане пока неясно, как будет реагировать организм на облучение мозга наносекундными микроволновыми импульсами, будет ли эффект зависеть от частоты повторения, как это наблюдалось ранее в экспериментах с воздействием модулированных ЭМИ на ЦНС [6, 7]. В частности, было показано, что воздействие на целостный организм мышей сопровождается рядом физиологических реакций, которые трактуются авторами как развитие стресса [8].
Исходя из изложенного, целью настоящего исследования было изучить реагирование организма лабораторных мышей в динамике после локального воздействия на головной мозг наносекундного ИПМИ с оценкой эффекта изменения поведенческой активности и уровня кортикостерона в сыворотке крови.
МАТЕРИАЛЫ И МЕТОДИКА
Эксперименты выполнены на 84 половозрелых белых мышах самцах массой 25–30 г. Животных содержали при комнатной температуре и постоянной влажности, в клетках при световом режиме освещения 12:12, на стандартном рационе питания со свободным доступом к воде и пище. Исследование проводили в соответствии с этическими нормами работы с лабораторными животными и санитарными правилами по устройству, оборудованию и содержанию экспериментально-биологических клиник [9]. Мыши были разделены на группы облученных и ложнооблученных (ЛО, контроль), по шесть животных для каждого из использованных режимов воздействия. В ходе исследования контрольных мышей подвергали всем аналогичным манипуляциям, что и облученных, но без включения микроволнового генератора. Процедуры облучения проводили в одно и то же время суток (с 9.00 до 11.00 час.). Для обеспечения локального воздействия на головной мозг и устранения возможности облучения всего организма тело животных (кроме головы) на время облучения покрывали радиопоглощающим материалом. Голова животного в течение 3, 5, 7 дней в соответствующих группах мышей подвергалась ежедневному однократному воздействию ИПМИ (4000 импульсов за сеанс) с частотами повторения 13 и 22 Гц. Эти частоты по результатам ранее проведенных исследований показали наибольшую биологическую эффективность. Кроме того, они соответствуют основным частотам спектра электроэнцефалограмм мозга, и, как полагают некоторые авторы [7], воздействие с такими частотами может наиболее эффективно влиять на деятельность мозга. Продолжительность облучения варьировала от 5 до 10 мин в зависимости от частоты повторения импульсов. В качестве источника ИПМИ использовали лабораторный импульсный генератор на основе магнетрона МИ-505 (изделие серийного производства ОАО “Тантал”, Россия). Несущая частота генератора составляла 10 ГГц, выходная пиковая мощность 180 кВт, длительность импульсов на половинном уровне мощности 100 нс. Пиковая интенсивность, составившая во всех экспериментах 1500 Вт/см2, оценивалась с помощью стандартных методик на основе антенных измерений и калориметрических калибровок [10]. Во время воздействий животных в пластиковых контейнерах диаметром 3 см помещали в дальней зоне рупора антенны на расстоянии 20 см. Это обеспечивало воздействие на область головы мышей при средних значениях интенсивности от 0.6 до 2.4 мВт/см2. Мышей подвергали облучению с удельной поглощенной мощностью (УПМ) 7.8 и 9.6 мВт/г при частотах повторения 13 и 22 Гц соответственно. УПМ оценивали в соответствии с общепринятой методикой по скорости нагрева тканей головного мозга [11]. Определение скорости нагрева, а также контроль температуры тканей во время экспериментов осуществляли с помощью волоконно-оптического термометра МТ-4МО-1 (Россия). Реакции на воздействие ИПМИ оценивали по поведению мышей в “открытом поле” и уровню гормона кортикостерона в сыворотке крови животных. Эффект воздействия ИПМИ оценивали по изменению показателей облученных животных относительно ложнооблученных (ЛО). В качестве индикаторных показателей в “открытом поле” были исследованы общая двигательная и вертикальная активности, норковый рефлекс, количество дефекаций и уринаций, груминг, реакции замирания. Тестирование в круглой арене “открытого поля” при уровне освещенности 180 лк, что оценивалось с помощью измерителя потока света (Pocket light meter 8581, Тайвань), проводили в течение 5 мин у экспериментальных и ложнооблученных (контрольных) животных дважды – за день до начала облучения и на следующий день после окончания воздействий (на 4-й, 6-й и 8-й дни после 3-, 5- и 7-дневного облучения соответственно). Через сутки после тестирования в открытом поле животных всех групп выводили из эксперимента одномоментным декапитированием под СО2 наркозом. У декапитированных животных для получения сыворотки кровь собирали в чистую сухую пробирку. Затем кровь центрифугировали без охлаждения 2000 об/мин в течение 15 мин, полученную сыворотку собирали в пробирки Eppendorf. Для проведения иммуноферментного анализа образцы сыворотки центрифугировали 1000 об/мин в течение 2 мин. В сыворотке крови облученных и ложнооблученных мышей с помощью твердофазного иммуноферментного “сэндвич” метода (ELISA) определяли содержание гормона кортикостерона. Процедура выполнения иммуноферментного анализа проводилась по инструкциям, предлагаемым производителями тест-систем (“DRG”, Германия). Полученные результаты подвергали статистической обработке с помощью пакета прикладных программ Statsoft STATISTICA for Windows 8.0, при которой рассчитывались средняя арифметическая величина показателя и ошибка средней. Значимость различий между показателями облученных и ложно облученных животных определяли с помощью непараметрического U-критерия Манна–Уитни. Корреляционную зависимость между показателями поведенческих реакций и уровнем кортикостерона, а также зависимость от частоты повторения импульсов определяли с использованием коэффициента корреляции Спирмена.
РЕЗУЛЬТАТЫ
Проведенное исследование и анализ полученных результатов позволили установить, что воздействие наносекундным ИПМИ на головной мозг лабораторных мышей влияет на него и изменяет функциональное состояние организма. Зарегистрированные эффекты проявляются в разнонаправленном изменении поведенческих реакций в “открытом поле”, а также в изменении содержания кортикостерона в сыворотке крови.
Поведенческие реакции мышей в “открытом поле” после воздействия на головной мозг наносекундным ИПМИ. После облучения в течение 3 дней головного мозга мышей ИПМИ с частотой повторения 13 Гц происходило статистически значимое снижение общей двигательной и норковой активностей по сравнению с контрольной группой (табл. 1). В дальнейшем, с 5-го по 7-й дни воздействий, норковая активность продолжала снижаться, а общая двигательная активность, напротив, возрастала. Можно предположить, что у животных наблюдался период адаптации к воздействующим факторам, характеризующийся развитием стадии резистентности.
Таблица 1.
Поведение мышей в “открытом поле” после облучения головного мозга наносекундными импульсными микроволнами с пППМ 1500 Вт/см2Table 1. The behavior of mice in the “open field” after irradiation of the brain with nanosecond pulsed microwaves with a RPM of 1500 W/cm2
| Показатель поведенческой активности в “открытом поле” | Экспериментальные группы (n = 6) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| контроль | 13 Гц | 22 Гц | |||||||
| Дни облучения | |||||||||
| 3 | 5 | 7 | 3 | 5 | 7 | 3 | 5 | 7 | |
| ОДА | 166.5 ± 20.4 | 145.2 ± 25.3 | 123.8 ± 15.2 | 124.2 ± 16.4* | 128.8 ± 20.9 | 179.0 ± 20.5** | 148.3 ± 16.0 | 98.5 ± 21.3* | 131.2 ± 28.6 |
| ВА | 33.7 ± 6.6 | 28.0 ± 6.6 | 19.2 ± 5.6 | 27.0 ± 5.4 | 28.3 ± 6.1 | 35.7 ± 4.8 | 26.0 ± 5.6 | 22.0 ± 5.8 | 24.3 ± 7.0 |
| НР | 40.2 ± 6.1 | 33.5 ± 5.6 | 28.3 ± 4.9 | 21.8 ± 3.3* | 19.0 ± 3.3* | 19.2 ± 1.7* | 35.2 ± 3.3 | 14.0 ± 4.8* | 15.5 ± 3.7* |
| Гр | 1.2 ± 0.7 | 0.5 ± 0.2 | 1.5 ± 0.7 | 1.8 ± 0.6 | 2.8 ± 1.1 | 0.7 ± 0.4 | 1.2 ± 0.3 | 4.7 ± 2.1** | 2.3 ± 0.5 |
| Дф | 2.3 ± 0.3 | 2.3 ± 0.8 | 2.8 ± 0.7 | 1.7 ± 0.4 | 2.5 ± 0.8 | 1.5 ± 0.3 | 2.0 ± 0.4 | 1.0 ± 0.4 | 2.5 ± 0.7 |
Примечание. n – число мышей в группе; ОДА – общая двигательная активность, ВА – вертикальная активность, НР – норковый рефлекс, Гр – груминг, Дф – дефекации. * Снижение показателя относительно контрольной группы, ** – увеличение показателя относительно контрольной группы; *, ** различия статистически значимы (р ≤ 0.05).
После воздействия ИПМИ с частотой повторения 22 Гц с 3-го по 7-й день облучения общая двигательная активность изменялась волнообразно. На 3-е сутки отмечалось ее увеличение, на 5-е сутки происходило снижение, а на 7-й день – вновь увеличение показателя до аналогичного уровня в контрольной группе. При этом с 5-х по 7-е сутки облучения регистрировалось снижение норковой активности. Параллельно с этим на 5-й день отмечалось повышение груминга, который к 7-м суткам снижался до уровня у ложнооблученных мышей (табл. 1).
Полученные результаты определенно указывают, что после воздействия на головной мозг мышей наносекундным ИПМИ через 3 дня у животных формируются тревожность и подавленное состояние. Тем не менее с 5-го по 7-й дни облучения мышей с частотой 22 Гц поведенческие показатели достигают уровней ложнооблученной группы, что, по-видимому, характеризует фазовый переход общего адаптационного синдрома от тревоги к истощению у мышей [12].
Анализ контрольной (ложнооблученной) группы выявил тенденцию к снижению общей двигательной активности в “открытом поле” от 3-го к 7-му дню эксперимента. По-видимому, нахождение мышей в условиях ограничения движений, аналогичных условиям облучения, но без включения источника ИПМИ, приводило к фазовому развитию стадии тревоги. Снижение двигательной активности к 7-му дню эксперимента может свидетельствовать о развитии стадии истощения, что подтверждается увеличением количества актов дефекаций (табл. 1).
Динамика содержания кортикостерона в сыворотке крови после воздействия наносекундным ИПМИ на головной мозг. Изменение двигательной активности, указывающее на возможность развития стресса в организме, предполагает дополнительную проверку с измерением уровня общепринятого индикатора у грызунов – гормона кортикостерона. Известно, что стрессорные нагрузки разного характера вызывают достоверное увеличение уровня кортикостерона в плазме крови у крыс [13, 14].
В настоящем исследовании выяснилось, что уровень кортикостерона в ложнооблученной группе мышей после 3 и 5 дней эксперимента был выше по сравнению с облученными группами (рис. 1).
Рис. 1.
Динамика содержания кортикостерона в сыворотке крови мышей после воздействия наносекундным ИПМИ (пППМ 1500 Вт/см2) на головной мозг в течение 3, 5 и 7 дней облучения. Примечание. Представлены среднеарифметические значения показателя ± ошибка среднего. * Различия статистически значимы по отношению к показателям ЛО животных (р ≤ 0.05).
Fig. 1. Dynamics of corticosterone level in the mice blood serum after brain exposure to nanosecond RPM (peak power density of 1500 W/cm2) at 3, 5 and 7 days. Note. The arithmetic mean values of the indicator are presented ± error of the mean. * Differences are statistically significant in relation to the Sham indicators of animals (p ≤ 0.05).
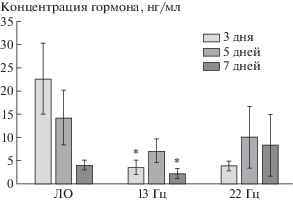
Поскольку ложнооблученные животные на протяжении 3 и 5 дней ежедневно в течение 3–5 мин подвергались размещению в специальных камерах, предназначенных для облучения опытных групп, вероятной причиной такого повышения могло быть развитие стресса в связи с нахождением мышей в узких пеналах. Однако при ежедневном ограничении подвижности в течение 7 дней уровень гормона достоверно снижался. Известно, что 3-часовая иммобилизация в тесных пеналах неодинаково влияет на индивидуальные значения уровня кортикостерона в плазме крови у лабораторных крыс [14]. В этом исследовании было показано, что средняя концентрация кортикостерона у крыс, подвергшихся иммобилизации, достоверно повышалась, однако у 30% особей после пребывания в таких условиях уровень этого гормона, наоборот, снижался [14]. Можно предположить, что в нашем эксперименте у мышей с 3-го по 7-й день ограничения движений в узких пеналах с продолжительностью от 3 до 5 мин последовательно формируются стадии общего адаптационного синдрома – от тревоги до истощения [15].
У облученных ИПМИ мышей с частотой повторения импульсов 13 Гц отмечалось значительное снижение концентрации кортикостерона в сыворотке крови через 3 и 7 дней после облучения (рис. 1). При этом не обнаружилось статистически значимых различий между группами, облученными с обеими частотами повторения импульсов. Согласно литературным данным, снижение концентрации кортикостерона в кровотоке может свидетельствовать о развитии заключительной фазы стресса – истощении [15]. Однако обнаруженная высокая положительная корреляционная связь (r = 0.88) между уровнем кортикостерона и количеством актов груминга у мышей, облученных в течение 5 дней с частотой 22 Гц, может означать, что в этот период сочетание двух стрессорных нагрузок в виде ограничения двигательной активности животных и облучения формировало у мышей стадию тревоги. Следует отметить, что уровень кортикостерона на 5-е сутки облучения в обеих опытных группах не отличается от такового в ложнооблученной группе. Не исключено, что данный эффект воздействия двух стрессорных факторов (ограничения движений и облучения) свидетельствует о развитии перекрестной адаптации [15, 16]. По-видимому, организм мышей, адаптированный к действию одного из факторов, становится в результате этого более устойчивым к действию другого.
В совокупности полученные результаты выявили сложный характер влияния ИПМИ на мозг животных и, соответственно, на контролируемые им метаболические и физиологические процессы, что нашло отображение в изменении поведенческих реакций мышей и уровня кортикостерона в сыворотке крови.
ОБСУЖДЕНИЕ
В соответствии с принципом Гроттгуса, биологический эффект воздействия формируется частью электромагнитной энергии, поглощенной объектом [17]. Расчеты распределения поля внутри объекта, выполненные применительно к использованному в работе наносекундному ИПМИ c пиковой плотностью потока мощности 1500 Вт/см2 (среднее значение ППМ 1.2 мВт/см2), показали, что при частотах повторения 13 и 22 Гц удельная поглощаемая мощность (УПМ) для мозга мышей составляет 7.8 и 9.6 мВт/г соответственно. При этом в зависимости от частоты повторения импульсов нагрев ткани головного мозга не превышает 0.4–0.7°С. Результаты этих расчетов указывают на реальную способность поля проникать в ткани и, соответственно, влиять непосредственно на головной мозг. Воздействие ИПМИ на указанные структуры способствует формированию физиологических эффектов нетепловой природы, которые выявлены в настоящей работе.
Из работ Б.И. Давыдова и соавт. следует, что стресс, индуцированный у животных микроволновым излучением, имеет характер теплового стресса, т.е. полностью определяется существенным повышением температуры на 2–5°С в облучаемом организме, что обеспечивается воздействием со средним потоком мощности не менее 80 мВт/см2 [17]. Поскольку использованное в настоящей работе ИПМИ по своей средней интенсивности 1.2 мВт/см2 не обеспечивало такого нагрева, это дает основание предполагать, что стресс, обусловленный облучением ИПМИ, имеет нетепловую природу и запускается каким-то иным способом. Возможно, что на этапе первичного взаимодействия излучения с объектом влияние реализуется либо за счет модификации клеточных мембран, либо за счет прямого действия электрического поля ИПМИ на внутриклеточные заряженные комплексы (элементы нейрона, дыхательную цепь митохондрий) [18] с последующим формированием реакций облучаемого мозга.
Наиболее характерным физиологическим эффектом, наблюдавшимся после воздействия ИПМИ на головной мозг, было изменение общей двигательной и норковой активностей, а также интенсивности груминга, причем в большинстве случаев у облученных животных регистрировалось снижение этих показателей. Известно, что стресс по своей природе является защитной биологической реакцией и развивается в ответ на действие широкого спектра агрессивных факторов внешней среды, в том числе электромагнитных излучений [19]. При всех этих воздействиях активируется гипоталамо-гипофизарно-адренокортикальная система. Центральным звеном этой системы являются нейроэндокринные нейроны паравентрикулярного ядра гипоталамуса, синтезирующие кортикотропин-рилизинг гормон, который опосредует синтез и выделение глюкокортикоидов. В условиях воздействия стрессорных факторов кортикостерон у лабораторных животных, по-видимому, является активатором или ингибитором поведенческой стратегии. Считается, что гипоталамо-гипофизарно-адренокортикальная система активирует увеличение синтеза стресс-гормонов, требующееся для любой интенсивной работы организма [20, 21]. Однако возможно, что для повышенной устойчивости организма к неблагоприятным факторам среды при их продолжительном или повторном действии происходит не увеличение выработки этих гормонов, a наоборот, – поддерживается обычный или пониженный уровень [22].
В настоящем исследовании при определении уровня кортикостерона в сыворотке крови мышей было установлено, что его содержание у ложнооблученных животных последовательно снижается от 3-го к 7-му дню эксперимента. Мыши этой группы оказывались в обстановке “новизны”, поскольку подвергались только кратковременному ограничению движений в связи с размещением в специальные контейнеры на несколько минут. По-видимому, в этой группе наблюдалась смена стадий общего адаптационного синдрома – от тревоги к истощению. У животных, облученных наносекундным ИПМИ, на фоне ограничения подвижности наблюдалась иная картина. Воздействие двух стрессорных факторов к 7-му дню облучения с частотой 22 Гц приводило к нормализации содержания кортикостерона в сыворотке крови и отсутствию различий между показателями поведенческой активности у опытной и контрольной групп. По-видимому, сочетанное влияние кратковременной иммобилизации и облучения ИПМИ формировало у животных перекрестную адаптацию, хотя такое объяснение требует отдельного специального исследования.
Таким образом, воздействие на головной мозг мышей наносекундным ИПМИ может быть причиной развития стресса, которое ранее наблюдалось в экспериментах с воздействием на целый организм. Не исключено, что при облучении всего организма и локальном облучении мозга срабатывают одни и те же стресс-активирующие системы, в частности, гипоталамус, что может быть подтверждено имеющимися к настоящему времени данными о поведенческих и метаболических реакциях мышей при воздействии наносекундного ИПМИ на головной мозг [8]. Возможность подобного потенциально неблагоприятного влияния наносекундного электромагнитного фактора в плане понимания физиологических механизмов влияния требует пристального внимания и более углубленного исследования. Это актуально как в теоретическом плане, так и с практической точки зрения для определения корректных гигиенических нормативов безопасного действия. Полученные результаты указывают на необходимость учета потенциальной опасности облучения обслуживающего персонала при эксплуатации источников наносекундных импульсно-периодических микроволновых излучений.
Список литературы
Месяц Г.А. Импульсная энергетика и электроника. М.: Наука, 2004. 704 с. [Mesyats G.A. Impul’snaya energetika i elektronika. M.: Nauka, 1993. 704 s. (In Russian)]
Литвяков Н.В., Булдаков М.А., Чердынцева Н.В. и др. Влияние импульсно-периодического СВЧ-излучения на синтез нуклеиновых кислот в опухолевых клетках // Радиац. биология. Радиоэкология. 2005. Т. 45. № 4. С. 460–463. [Litvyakov N.V., Buldakov M.A., Cherdyntseva N.V. et al. The repetitive high power microwaves effects on synthesis of nucleic acids in tumor cells // Radiatsionnaya biologiya. Radioekologiya. 2005. V. 45. № 4. P. 460–463. (In Russian)]
Большаков М.А., Жаркова Л.П., Иванов В.В., и др. Оценка активности ферментов антиоксидантной защиты митохондрий печени мышей после воздействия наносекундного импульсно-периодического микроволнового излучения // Вестн. Томского гоc. ун-та. Биология. 2012. № 3 (19). С. 122–136. [Bolshakov M.A., Zharkova L.P., Ivanov V.V. et al. The activity of antioxidant enzymes of liver mitochondria of mice after exposure to nanosecond repetitive pulsed microwave // Tomsk State University Journal of Biology. 2012. V. 3. № 19. P. 122–136 (In Russian)]
Жаркова Л.П., Мамонова Н.В., Князева И.Р. и др. Регенерация нейрогенных изъязвлений слизистой желудка после облучения импульсно-периодическим микроволновым излучением // Вестн. Томского гос. ун-та. Биология. 2010. № 2 (10). С. 112–122. [Zharkova L.P., Mamonova N.V., Knyazeva I.R. et al. Regeneration of neurogenous mucosal ulceration after repetitive pulsed microwaves exposure // Tomsk State University Journal of Biology. 2010. V. 2. № 10. P. 112–122 (In Russian)]
Керея А.В., Большаков М.А., Ходанович М.Ю. и др. Оценка реакции мозга мышей на воздействие наносекундных микроволновых импульсов по экспрессии белка c-fos // Радиац. биология. Радиоэкология. 2017. Т. 57. № 2. С. 179–184. [Kereya A.V., Bolshakov M.A., Khodanovich M.Yu. et al. Evaluation of mice brain reactions after nanosecond microwave pulses using c-fos expression // Radiatsionnaya biologiya. Radioekologiya. 2017. V. 57. № 2. P. 179–184. (In Russian)]. https://doi.org/10.7868/S0869803117020072
Sharma A., Kesari K.K., Saxena V.K. et al. Ten gigahertz microwave radiation impairs spatial memory, enzymes activity, and histopathology of developing mice brain // Molec. Cell. Biochem. 2017. Nov. V. 435. № 1–2. P. 1–13. https://doi.org/10.1007/s11010-017-3051-8
Chizhenkova R.A. Impulse fluxes of neuronal populations of the cerebral hemispheres on exposure to weak ultrahigh frequency electromagnetic radiation // Biophysics. 2003. V. 48. № 3. P. 509–515.
Knyazeva I.R., Medvedev M.A., Vasilev A.V. et al. The features of the stress-reaction to repetitive nanosecond microwave pulses // Proceedings – 2018 20th Int. symp. on high-current electronics, ISHCE. 2018. Institute of Electrical and Electronics Engineers Inc., 2018.
Euro guide on the accommodation and care of animals used for experimental and other scientific purposes. London, UK: FELASA, 2007. www.felasa.eu.
Klimov A.I., Eltchaninov A.A., Konobeeva E.Yu. Measurements of Parameters of X-Band High-Power Microwave Pulses // Izvestiya vysshikh uchebnykh zavedenii. Fizika. (Russian Physics Journal). 2006. V. 49. №11. P. 431–434.
Pakhomov A.G., Prol H.K., Mathur S.P. et al. Role of Field Intensity in The Biological Effectiveness of Millimeter Waves At A Resonance Frequency // Bioelectrochem. Bioenerg. 1997. V. 43. № 1. P. 27–33. https://doi.org/10.1016/S0302-4598(97)00022-6
Кириллов О.И. Стрессовая гипертрофия надпочечников: Автореф. дис. … д-ра мед. наук. Владивосток, 1996. 43 с. [Kirillov O.I. Stressovaya gipertrofiya nadpochechnikov: [dissertation]. Vladivostok, 1996. 43 p. (In Russian)]
Mora F., Segovia G., Del Arco A. et al. Stress, neurotransmitters, corticosterone and body-brain integration // Brain Res. 2012, Oct 2. V. 1476. P. 71–85. https://doi.org/10.1016/j.brainres.2011.12.049
Умрюхин П.Е., Григорчук О.С. Уровень кортикостерона крови и динамика кровяного давления у крыс при стрессорной нагрузке // Междунар. журн. прикл. и фунд. исследований. 2015. № 12-4. С. 668–671. [Umriukhin P.E., Grigorchuk O.S. Blood corticosterone concentration and dynamic of the blood pressure during stress in rats // International journal of applied and fundamental research. 2015. № 12-4. P. 668–671 (In Russian)]
Селье Г. Очерки об адаптационном синдроме. М.: Медгиз, 1960. 254 с. [Sel’e G. Essays on the Adaptation Syndrome. M.: Medgiz, 1960. 254 р. (in Russian)]
Меерсон Ф.З., Пшенникова М.Г. Адаптация к стрессорным ситуациям и физическим нагрузкам. М.: Медицина, 1988. 253 с. [Meerson F.Z., Pshennikova M.G. Adaptation to the stress situations and physical activity. M.: Meditsina Publ., 1988. 253 p. (in Russian)]
Давыдов Б.И., Тихончук В.С., Антипов В.В. Биологическое действие, нормирование и защита от ЭМИ. М.: Энергоатомиздат, 1984. 177 c. [Davydov B.I., Ti-khonchuk V.S., Antipov V.V. Biologicheskoe deistvie, normirovanie i zashchita ot EMI. M.: Energoatomizdat, 1984. 177 s. (In Russian)]
Bolshakov M.A., Knyazeva I.R., Rostov V.V. et al. Initiation of free-radical oxidation in albino mice by exposure to pulse periodic microwaves and X-rays // Biophysics. 2005. V. 50. № 1. P. 104–109.
Мулик А.Б. Уровень общей неспецифической реактивности организма человека: Монография / Ред. А.Б. Мулик, М.В. Постнова, Ю.А. Мулик. Волгоград: Волгоградское науч. Изд-во, 2009. 224 с. [Mulik A.B. Uroven’ obshchei nespetsificheskoi reaktivnosti organizma cheloveka: monografiya / Eds A.B. Mulik, M.V. Postnova, Yu.A. Mulik. Volgograd: Volgogradskoe nauchnoe izdatel’stvo, 2009. 224 s. (In Russian)]
Schommer N.C., Hellhammer D.H., Kirchbaum C. Dissociation between reactivity of the hypothalamus-pituitary-adrenal axis and the sympathetic-adrenal-medullary system to repeated psychosocial stress // Psychosomatic Med. 2003. V. 65. № 3. P. 450–460. https://doi.org/10.1097/01.psy.0000035721.12441.17
Boldyreff B., Wehling M. Aldosteron: refreshing a slow hormone by swift action // News Physiol. Sci. 2004. V. 19. P. 97.
Казин Э.М., Свиридова И.А., Березина М.Г. и др. Влияние социально-биологических факторов на особенности формирования приспособительных реакций учащихся в пубертатном периоде онтогенеза // Физиол. человека. 2008. Т. 34. № 4. С. 431–439. [Kazin E.M., Sviridova I.A., Berezina M.G. et al. Effect of sociobiological factors on the formation of adaptive responses in school students during puberty // Human Physiology. 2008. V. 34. № 4. P. 431–439 (In Russian)]
Дополнительные материалы отсутствуют.
Инструменты
Радиационная биология. Радиоэкология


