Прикладная биохимия и микробиология, 2023, T. 59, № 1, стр. 56-64
Иммобилизация глюкозооксидазы на микросферах альгината натрия
П. Ю. Стадольникова 1, *, Б. Б. Тихонов 1, Е. А. Прутенская 1, А. И. Сидоров 1, М. Г. Сульман 1
1 Тверской государственный технический университет
170026 Тверь, Россия
* E-mail: p.stadolnikova@mail.ru
Поступила в редакцию 23.03.2022
После доработки 10.07.2022
Принята к публикации 02.09.2022
- EDN: CVHSNC
- DOI: 10.31857/S0555109923010129
Аннотация
Глюкозооксидаза из Aspergillus niger была иммобилизована посредством ковалентной сшивки на поверхности альгинатных микросфер, полученных методом эмульгирования/внутреннего гелеобразования. Проведено сравнение каталитических свойств свободного и иммобилизованного фермента. Размер полученных микросфер составил менее 200 мкм. В инфракрасных Фурье-спектрах диффузионного отражения полупродуктов синтеза биокатализатора были выявлены пики, соответствующие образованным ковалентным связям между ферментом и носителем. Эксперименты показали, что иммобилизованный фермент имел активность на 40% ниже, чем свободная глюкозооксидаза, но при этом обладал активностью в более широком диапазоне температур. Кинетические параметры для нативной глюкозооксидазы: Vmax – 0.341 ммоль/л·мин, Km – 5.41 ммоль/л; для иммобилизованной – 0.203 ммоль/л·мин и 11.43 ммоль/л соответственно; биокатализатор теряет менее 25% активности за 5 циклов повторного использования. Синтезированный биокатализатор может быть использован в пищевой промышленности качестве хлебопекарного улучшителя, в химической и фармацевтической промышленности для получения глюконовой кислоты, а также в аналитической химии для определения концентрации глюкозы.
Глюкозооксидаза (К.Ф. 1.1.3.4, D-глюкозо-1-оксидаза, GOX) – димерный флавопротеин, относящийся к семейству глюкоза-метанол-холин оксидоредуктаз [1]. Основная роль – участие в метаболизме глюкозы в клетках. Глюкозооксидазу можно получить из большого числа природных источников – водорослей, растений, животных, насекомых, бактерий и грибов, однако наиболее широко используемыми промышленными продуцентами глюкозооксидазы являются мицелиальные грибы родов Aspergillus и Penicillium [2].
Глюкозооксидаза, выделенная из аскомицетов, представляет собой гликопротеин, состоящий из 2 идентичных полипетидных цепей, ковалентно связанных между собой дисульфидными связями [3]. Фермент содержит 2 молекулы флавинадениндинуклеотида (ФАД) в качестве кофермента, по одной на каждую субъединицу белковой молекулы, нековалентно связанных с активным центром [4]. Гликозилированные глюкозооксидазы из Aspergillus niger и Penicillium amagasakiense представляют собой несколько вытянутые глобулярные белки с молекулярной массой 150–160 кДа со степенью гликозилирования 10–16%. Температурный оптимум грибных глюкозооксидаз находится в пределах 40–60°C, оптимум pH – 4.0–7.0, изоэлектрическая точка в пределах pH 4.0–5.0 [5]. Глюкозооксидаза катализирует окисление β-D-глюкозы по С-1 связи до D-глюконо-δ-лактона (δ-глюконо-1,5-лактона) с образованием пероксида водорода H2O2 с использованием молекулярного кислорода в качестве акцептора электронов [3].
В последние десятилетия глюкозооксидаза широко применяется в различных отраслях промышленности и науки: в медицинской диагностике и фармацевтической, химической, текстильной и пищевой сферах, а также в охране окружающей среды и в биоэнергетике [2, 4]. В том числе, глюкозооксидаза широко используется в составе аналитических систем и биосенсоров для определения содержания глюкозы в крови, сыворотке и плазме, в органическом синтезе для коммерческого получения глюконовой кислоты, применяемой в качестве пищевой добавки и компонента лекарственных средств [6]. Также глюкозооксидаза может использоваться в качестве хлебопекарных улучшителей [7]. При этом во многих процессах целесообразнее использовать иммобилизованные формы глюкозооксидазы, что позволяет существенно повысить ее устойчивость к ингибирующим воздействиям, а также обеспечить возможность многократного использования фермента [8]. Опубликован целый ряд работ, описывающих успешный опыт иммобилизации глюкозооксидазы на различных твердых носителях [6].
Среди наиболее перспективных матриц для иммобилизации глюкозооксидазы выделяют биополимеры, синтезированные живыми организмами, или синтезированные химическим путем из биологических материалов. Их преимущества – разнообразие структурного состава, специфические физико-химические свойства, широкая доступность в природе, невысокая стоимость и возобновляемый характер, что делает их особенно привлекательными для пищевой, биомедицинской и фармацевтической промышленности [9]. В частности, Донг с соавт. иммобилизовали глюкозооксидазу на модифицированном L-лизином хитозане, что существенно повысило операционную стабильность и термоустойчивость фермента [10]. Танг с соав. иммобилизовали глюкозооксидазу на частицах хитозан-триполифосфат натрия и использовали ее для улучшения хлебопекарных свойств пшеничной муки [11].
Биополимеры используются в различных формах – пленки, мембраны, волокна, гидрогели, оболочки, нано- и микрочастицы, губки и аэрогели [12]. Особый интерес представляют микрочастицы (микросферы) альгината натрия, благодаря своему размерному диапазону (1–1000 мкм), а также неоспоримым преимуществам самого альгината, таким как дешевизна, нетоксичность, биосовместимость, биоразлагаемость [13, 14] и способность водного раствора полимера к ионному гелеобразованию в присутствии двухвалентных катионов (прежде всего – кальция) [15]. Альгинат – анионный полисахарид, имеющий реакционноспособные карбоксильные группы [16], что предоставляет возможность модификации носителя с помощью функциональных реагентов для проведения эффективной иммобилизации.
Микрочастицы альгината имеют перспективы применения в различных отраслях. В фармацевтической промышленности альгинатные микрошарики представляют собой пример многокомпонентных систем доставки, предназначенных для достижения пролонгированной или контролируемой доставки лекарственных средств [17]. Микрочастицы альгината используются также в качестве матрицы для иммобилизации различных ферментов [18, 19], перспективны в сельскохозяйственных приложениях [20] и в вопросах охраны окружающей среды и ремедиации [21].
Среди существующих методов получения альгинатных микросфер широкое распространение получила техника эмульгирования/гелеобразования, которая позволяет изготавливать микросферы в микромасштабе (диаметр частиц менее 100 мкм), имеет низкую стоимость и несложное экспериментальное оборудование [14]. Стандартное исполнение метода включает в себя два этапа: образование стабильных полимерных капель в эмульсионной системе “вода-в-масле” и последующая ионотропная сшивка этих капель посредством взаимодействия с ионами сшивающего агента [22]. В рамках метода эмульгирования для формирования гидрофобной фазы при получении эмульсий возможно использование различных масел: парафинового [23], рапсового [24], соевого [25], подсолнечного [26]. Использование растительных масел является более предпочтительным, так как минеральные масла могут представлять потенциально большую опасность для окружающей среды, а также их использование может приводить к увеличению диаметра альгинатных микросфер и затруднять дальнейший их переход из масляной фазы в водную [27, 28]. Следует отметить, что на размер и однородность микросфер решающее влияние оказывает баланс между дисперсионными силами и поверхностным натяжением, который определяет размер эмульсионных капель [29]. Ключевую роль в этом играют сурфактанты, снижающие межфазное натяжение между гидрофильной и гидрофобной фазами, приводя к образованию стабильных эмульсий, уменьшая размер эмульсионных капель и предотвращая их коалесценцию для получения дискретных микрочастиц [14]. В эмульсификационном методе получения альгинатных микросфер используются неионогенные поверхностно-активные вещества (например, из группы Span и Tween) [30], имеющие определенные преимущества перед ионными ПАВ, а именно менее выраженное взаимодействие с двувалентными ионами и высокую растворимость в масляных средах, что используется для очистки и извлечения альгинатных частиц [31].
Как уже было указано выше, альгинат образует стойкие гидрогели в мягких условиях и в присутствии двухвалентных катионов [32]. Гелеобразование может быть двух типов: внутреннее и внешнее. При внешнем гелеобразовании ионы сшивающего агента диффундируют из внешней непрерывной фазы внутрь полимерных капель, тогда как при внутреннем гелеобразовании полимерные капли уже содержат сшивающий агент в недиссоциированной форме, а инициаторы гелеобразования (например, ионы H+) диффундируют в капли из внешней фазы и вызывают высвобождение сшивающего агента и последующее гелеобразование [33]. В частности, Ванг с соавт. [34] провели успешную иммобилизацию глюкозооксидазы на поверхности твердых альгинатных микросфер, полученных методом эмульгирования, и с последующим их покрытием 1%-ным (масс./об.) хитозаном с сохранением 83% активности фермента.
Цель работы – создать многокомпонентную биокаталитическую систему на основе глюкозооксидазы, ковалентно иммобилизованной на микросферах из альгината натрия, полученных методом эмульгирования/внутреннего гелеобразования, и исследовать ее физико-химические и каталитические свойства.
МЕТОДИКА
Реактивы и оборудование. В работе использовали альгинат натрия, D-глюкозу, ледяную уксусную кислоту, растворимый крахмал Линтнера производства “Химмедсервис” (Россия), карбонат кальция, йодид калия, молибдат аммония – “Реахим” (Россия), масло подсолнечное рафинированное дезодорированное “Каждый день” (“Аквилон”, Россия), Span 80, кумасси бриллиантовый синий G-250 (“Sigma-Aldrich”, США), Tween 80 (“PanReac”, Германия), N-гидроксисукцинимид (“Acros Organics”, Бельгия), N-(3-диметиламинопропил)-N'-этил-карбодиимид гидрохлорид (далее – “карбодиимид”, “Fluka”, Япония), пероксид водорода (“Росбио”, Россия).
Для микроскопирования микросфер использовали микроскоп Inskam-315 (“Inskam”, Китай) с цифровой камерой (12 мегапикселей, внешний экран 7 дюймов) и оптический микроскоп XSZ-107 (“Армед”, Россия). Размер микрочастиц и кластеров оценивался с помощью размерной сетки камеры Горяева. Для измерения оптической плотности реакционной смеси использовали спектрофотометр СФ-2000 (“Спектр”, Россия).
Получение микросфер альгината методом эмульгирования/внутреннего гелеобразования. К 0.08 г микрокристаллического порошка карбоната кальция СаСО3 добавляли 20 мл 1.5%-ного раствора альгината натрия при постоянном перемешивании. Полученную суспензию диспергировали в 40 мл подсолнечного масла, содержащего Span 80 (2 об. %) и интенсивно перемешивалась в течение 2 мин. После эмульгирования в смесь добавляли 30 мл подсолнечного масла, содержащего 2% (об.) Span 80 и 0.2 мл ледяной уксусной кислоты. Интенсивное перемешивание продолжали в течение 10 мин. Далее в смесь добавляли 150 мл дистиллированной воды, перемешивание продолжали при умеренной интенсивности в течение 30 мин. Для отделения образовавшихся гелевых кальций-альгинатных шариков от масляной фазы добавляли 250 мл осаждающего раствора 0.05 М хлорида кальция, содержащего 1% (об.) твин 80. Полученные микросферы осаждали из масляной фазы, которая удалялась из системы декантацией. Далее осадок альгинатных микросфер промывали 0.05 М раствором хлорида кальция, содержащего 1% (об.) твин 80. Микрочастицы отмывали несколько раз водой до полного удаления следов масла, наблюдаемых в поле оптического микроскопа.
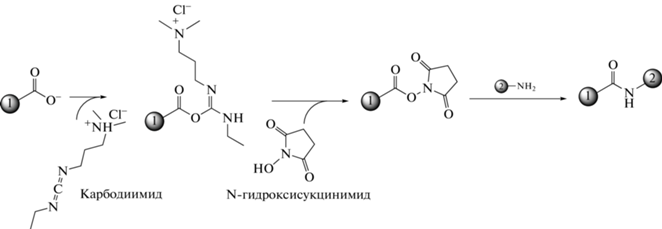
Иммобилизация глюкозооксидазы. Полученные альгинатные микросферы выдерживали в течение 12 ч в 50 мл раствора, содержащего 0.394 г карбодиимида и 0.144 г N-гидроксисукцинимида. Схема активации карбоксильных групп альгината натрия карбодиимидом и N-гидроксисукцинимидом представлена на рис. 1.
Рис. 1.
Схема активации карбоксильных групп альгината натрия карбодиимидом и N-гидроксисукцинимидом: 1 – альгинатные микросферы; 2 – глюкозооксидаза.
Полученные микрочастицы промывали дистиллированной водой, выдерживали в течение 6 ч в растворе глюкозооксидазы (25 мг в 50 мл фосфатного буферного раствора с рН 6.0) и снова промывали дистиллированной водой. Иммобилизованный фермент хранили до проведения экспериментов в холодильнике при температуре 4 ± 1°С.
Окрашивание красителем кумасси бриллиантовый синий G-250. Визуализация распределения иммобилизованного фермента на поверхности микрочастиц проводили окрашиванием полученной системы реактивом Брэдфорда – кумасси бриллиантовый синий G-250. 0.5 мл раствора, содержащего микросферы, смешивали с 0.5 мл реактива, оставляли на 5 мин до развития синей окраски, после чего проводили микроскопирование для обнаружения окрашенных комплексов фермента с красителем.
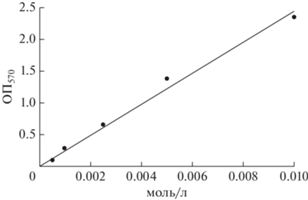
Определение ферментативной активности. Для определения активности микросферы с нанесенной глюкозооксидазой смешивали с 40 мл раствора глюкозы (2.2 мМ) и проводили реакцию окисления при постоянном перемешивании и температуре 25°С в течение 60 мин с периодическим отбором пробы из реакционной смеси. Активность глюкозооксидазы оценивали по концентрации пероксида водорода в реакционной смеси, которую определяли по реакции пероксида водорода с йодидом калия в кислой среде и фотометрировании образующегося синего комплекса йод-крахмал [35]. В кювету спектрофотометра СФ-2000 вносили микропипеткой 10 мкл реакционной смеси, после чего строго последовательно добавляли 2.0 мл раствора HCl (0.05 н.), 0.2 мл раствора KI (16.6 мас. %), 0.2 мл раствора молибдата аммония (0.12 мас. %), 0.2 мл раствора крахмала Линтнера (5%) и через 3 мин измеряли оптическую плотность (ОП) смеси относительно дистиллированной воды при длине волны 570 нм. Калибровочный график строили по стандартным растворам H2O2 (рис. 2).
Кинетические параметры синтезированных биокатализаторов рассчитывали по результатам реакций, проведенных при различных начальных концентрациях глюкозы с помощью линеаризации уравнения Михаэлиса-Ментен в координатах Лайнуивера-Берка.
За 1 ед. активности биокатализатора принимали такое его количество, которое катализирует окисление 1 мкмоль субстрата в 1 мин при оптимальных условиях.
Для определения зависимости активности свободной и иммобилизованной глюкозооксидазы от значения рН реакционной среды раствор глюкозы готовился в буферных растворах с различными значениями рН. Определение зависимости активности свободной и иммобилизованной глюкозооксидазы от температуры реакционной среды проводилось в термостатируемом стеклянном реакторе.
Каждый из экспериментов проводили в трех повторностях. На графиках и в таблице представлены средние величины.
Инфракрасная Фурье-спектроскопия. Анализ инфракрасных спектров образцов проводился с помощью инфракрасного спектрофотометра с преобразованием Фурье и приставкой диффузионного отражения IRPrestige-21 (“Shimadzu”, Япония).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
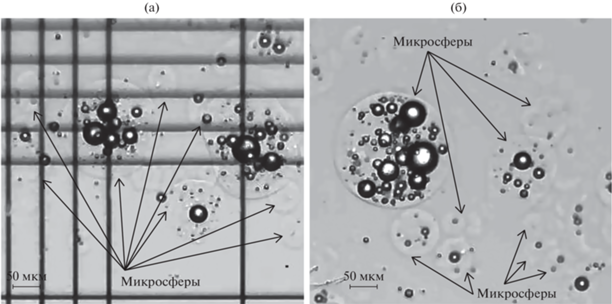
Характеристика кальций-альгинатных микросфер с иммобилизованной глюкозооксидазой. Влажные кальций-альгинатные шарики – микрочастицы преимущественно сферической формы, с просматривающимися воздушными полостями внутри полимерного тела матрицы (рис. 3). Такая структура может быть объяснена типом гелеобразования, используемого в работе: ионы кальция в виде нерастворимой соли, заключенные внутри альгинатных капель, высвобождаются посредством снижения значений pH, что вызывает разложение карбоната кальция с образованием углекислого газа, воды и катионов Ca2+, сшивающихся с альгинатным полимером изнутри, поэтому данный механизм гелеобразования получил название внутреннего [33, 36]. Получаемые этим методом микросферы часто мягкие и имеют тенденцию к высокой агломерации вследствие слабого гелеобразования [37], а выделение углекислого газа способствует образованию внутренних полостей в структуре гелевой матрицы [33], что подтверждают результаты исследования микрочастиц, полученные в работе.
Рис. 3.
Микрочастицы альгината, полученные методом эмульсификации/внутреннего гелеобразования, с иммобилизованной глюкозооксидазой: а – кальций-альгинатные микросферы внутри размерной сетки камеры Горяева (сторона малого квадрата 0.05 ± 0.001 мм); б – кальций-альгинатные микросферы, образующие скопления.
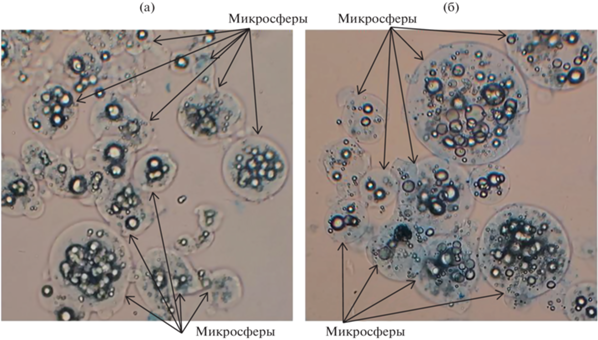
Известно, что кумасси бриллиантовый синий G-250, связываясь с аминокислотными остатками белков, в частности с аргинином и лизином, образует с ними окрашенный синий комплекс, что позволяет обнаруживать белки с высокой точностью вплоть до 1 мкг [38]. Для идентификации иммобилизованного фермента на поверхности полученных микросфер было проведено окрашивание кумасси G-250 с последующим микроскопированием образцов. Полученные результаты представлены на рис. 4. На фотографиях отчетливо видна синяя окраска микросфер с иммобилизованной глюкозооксидазой, образующей комплекс с азокрасителем.
Рис. 4.
Частицы многокомпонентной системы, окрашенные реактивом Брэдфорда (увеличение 160×): а – кальций-альгинатные микросферы без фермента; б – кальций-альгинатные микросферы с иммобилизованным ферментом, образующим синий комплекс с азокрасителем кумасси бриллиантовый синий G-250.
Полученные в данной работе микросферы альгината имели в диаметре до 200 мкм. Наблюдаемая размерная неоднородность микрочастиц объяснялась особенностью метода эмульгирования/гелеобразования: случайная коалесценция полимерных капель в эмульсии “вода-в-масле” может приводить к получению частиц, различающихся по размерам и формам [39], однако улучшенный физико-химический контроль позволяет уменьшить полидисперсность получаемых микросфер [40]. В зависимости от конкретных требований к частицам, эмульсификационный метод позволяет получать конкретный размер альгинатных частиц [14].
Определение активности свободного и иммобилизованного фермента. Протекание реакции в виде изменения концентрации образующегося пероксида водорода во времени для свободной формы глюкозооксидазы при варьировании начальной концентрации глюкозы представлен на рис. 5а, для иммобилизованной на альгинатных микросферах – на рис. 5б.
Рис. 5.
Кривые реакции окисления различных концентраций (1–5) глюкозы свободной (а) и иммобилизованной (б) формой глюкозооксидазы: 1 – 22; 2 – 16; 3 – 11; 4 – 5.5; 5 – 2.2 мМ.
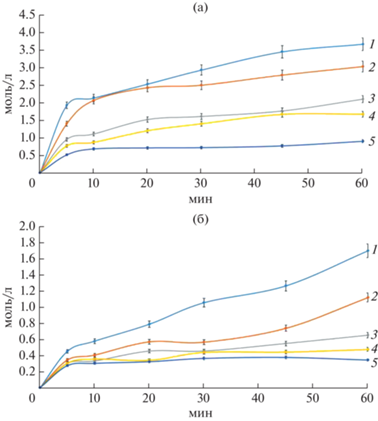
Из рис. 5б видно, что иммобилизованный препарат глюкозооксидазы обладал гораздо меньшей активностью по сравнению с ее свободной формой, что связано прежде всего с гетерогенизацией процесса вследствие иммобилизации фермента на нерастворимом носителе, появлением диффузионных ограничений, а также с потерями фермента во время иммобилизации. Однако иммобилизация позволяет легко отделить фермент от реакционной смеси и получать более чистый продукт, а также многократно использовать фермент, что компенсирует потерю активности при однократном использовании.
Кинетические параметры синтезированных биокатализаторов, рассчитанные линеаризацией уравнения Михаэлиса–Ментен в координатах Лайнуивера–Берка, приведены в табл. 1.
Таблица 1.
Кинетические параметры синтезированных биокатализаторов*
| Глюкозооксидаза | Активность, ед. ×103* |
Кm, ммоль/л* |
Vmax, ммоль/л мин* |
|---|---|---|---|
| Свободная | 5.46 ± 0.10 | 5.41 ± 0.10 | 0.341 ± 0.005 |
| Иммобилизованная на альгинатных микросферах | 3.25 ± 0.10 | 11.43 ± 0.10 | 0.203 ± 0.005 |
Как видно из табл. 1, Km для иммобилизованной глюкозооксидазы выше, а Vmax – ниже, что связано с потерями фермента при синтезе биокатализатора, уменьшением сродства фермента к субстрату, а также затруднением доступа субстрата к активным центрам фермента.
Кроме того, как показали эксперименты, иммобилизация на альгинатных микросферах несколько расширила диапазон температур и значений рН действия, по сравнению с растворимой формой фермента, что свидетельствовало о более высокой устойчивости синтезированных биокатализаторов к ингибирующим воздействиям (рис. 6).
Рис. 6.
Зависимость активности свободной (1) и иммобилизованной (2) глюкозооксидазы от значения рН реакционной среды (а) и температуры (б).
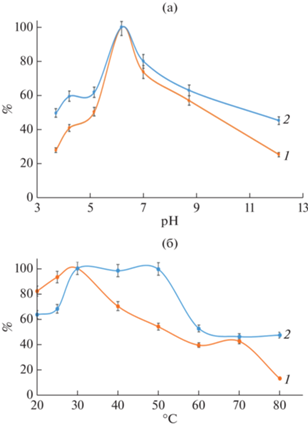
Как видно из рис. 6, рН-оптимум иммобилизованной на микросферах глюкозооксидазы не отличался от свободного фермента, при этом фермент проявлял несколько большую активность при других значениях рН.
Иммобилизованная глюкозооксидаза проявляла максимальную активность в значительно более широком пределе температур от 30 до 50°С, тогда как свободный фермент – ~30°С.
Проведенные эксперименты по многократному использованию биокатализатора показали, что он теряет менее 25% активности за 5 циклов при температурах от 30 до 50°С.
Инфракрасная Фурье-спектроскопия. Изучение полупродуктов синтеза биокатализатора методом инфракрасной Фурье-спектроскопии (рис. 7) показало, что в спектре альгинатных микросфер обнаружены полосы поглощения 2925 см–1(СH); 1638 см–1(=CO); 1409 см–1(–C–O–C–), валентных колебаний пиранозного кольца 809 см–1; интенсивные полосы 1605–1608 и 1412–1413 см–1, обусловленные асимметричными и симметричными валентными колебаниями карбонильной группы.
Рис. 7.
Инфракрасные Фурье-спектры полупродуктов синтеза биокатализатора: 1 – альгинатные микросферы; 2 – альгинатные микросферы, активированные карбодиимидом и N-гидроксисукцинимидом; 3 – альгинатные микросферы, активированные карбодиимидом и N-гидроксисукцинимидом, с нанесенной глюкозооксидазой.
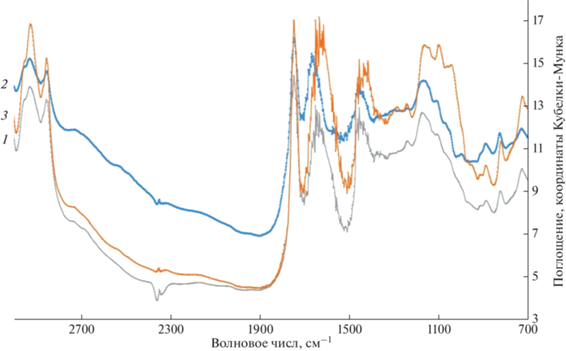
В спектре альгинатных микросфер, активированных карбодиимидом и N-гидроксисукцинимидом, выявлена полоса поглощения эфира N-ацилмочевины (полоса Амид II, 1660 см–1), которая отсутствовала в предыдущем спектре, что свидетельствовало об эффективной активации свободных карбоксильных групп альгината для последующей иммобилизации. В спектре синтезированного биокатализатора выявлены полосы поглощения амидной связи – 1650, 1550 см–1, что подтверждало образование ковалентной связи между активированными карбоксильными группами альгината натрия с аминогруппами глюкозооксидазы.
На основании полученных результатов можно сделать вывод о том, что альгинатные микросферы, полученные методом эмульгирования/внутреннего гелеобразования, являются перспективным носителем для химической иммобилизации глюкозооксидазы. Наличие у биополимера свободных карбоксильных групп позволило провести активацию носителя карбодиимидом и N-гидроксисукцинимидом для последующей ковалентной иммобилизации глюкозооксидазы в мягких условиях, обеспечивая прочное связывание фермента посредством амидных связей с поверхностью микросфер. Использование данного носителя позволило повысить устойчивость фермента к ингибирующим воздействиям среды (рН, температура) и многократно использовать фермент. Таким образом, альгинатные частицы, получаемые в микродиапазоне размеров, на основе доступного, безопасного и биодеградируемого биополимера, могут служить носителем для ковалентной иммобилизации глюкозооксидазы для создания многокомпонентных биокаталитических систем с перспективой применения в пищевой промышленности в качестве хлебопекарных улучшителей, в химической и фармацевтической промышленности для получения глюконовой кислоты и в аналитической химии для определения концентрации глюкозы.
Список литературы
Ferri S., Kojima K., Sode K. // J. Diabetes Sci. Technol. 2011. V. 5. № 5. P. 1068–1076.
Dubey M.K., Zehra A., Aamir M., Meena M., Ahirwal L., Singh S. et al. // Front. Microbiol. 2017. V. 8. P. 1–22.
Wilson R., Turner A.P.F. // Biosens. Bioelectron. 1992. V. 7. P. 165–185.
Bankar S.B., Bule M.V., Singhal R.S., Ananthanarayan L. // Biotechnol. Advances. 2009. V. 27. № 4. P. 489–501.
Kornecki J.F., Carballares D., Tardioli P.W., Rodrigues R.C., Berenguer-Murcia Á. et al. // Catal. Sci. Technol. 2020. V. 10. P. 5740–5771.
Tikhonov B., Sulman E., Stadol’nikova P., Sulman A., Golikova E., Sidorov A., Matveeva V. // Catal. Ind. 2019. V. 11. P. 251–263.
Dagdelen A.F., Gocmen D. // J. Food Qual. 2007. V. 30. P. 1009–1022.
Schmidt A., Dordick J.S., Hauer B., Kiener A., Wubbolts M., Witholt B. // Nature. 2001. V. 409. P. 258–268.
Smith A.M., Moxon S., Morris G.A. Wound Healing Biomaterials: Vol. Two, Functional Biomaterials. Biopolymers as wound healing materials / Ed. Magnus S. Ågren. Woodhead Publishing, 2016. P. 261–287.
Dong L. C., Wang G., Xiao Y., Xu Y., Zhou X., Jiang H., Luo Q. // Chem. Biochem. Eng. Q. 2011. V. 25. № 3. P. 395–402.
Tang L., Yang R., Hua X., Yu C., Zhang W., Zhao W. // Food Chem. 2014. V. 161. P. 1–7.
Gheorghita R., Anchidin-Norocel L., Filip R., Dimian M., Covasa M. // Polymers. 2021. V. 13. P. 1–33.
Ching S.H., Bansal N., Bhandari B. // Crit. Rev. Food Sci. Nutr. 2017. V. 57. № 6. P. 1133–1152.
Uyen N.T.T., Hamid Z.A.A., Tram N.X.T., Ahmad N.B. // Int. J. Biol. Macromol. 2019. V. 153. P. 1–34.
Dhamecha D., Movsas R., Sano U., Menon J.U. // Int. J. Pharm. 2019. V. 569. P. 1–13.
Alnoch R.C., Santos L.A., Almeida J.M., Krieger N., Mateo C. // Catalysts. 2020. V. 10. № 6. P. 1–29.
Viscusi G., Gorrasi G. // Int. J. Biol. Macromol. 2021. V. 184. P. 271–281.
Liu Q., Rauth A.M., Wu X.Y. // Int. J. Pharm. 2007. V. 339. P. 148–156.
Arisanti C.I.S., Rachmawati H., Pamudji J.S., Sumirtapura Y.C. // J. Pharm. Sci. App. 2012. V. 1. № 1. P. 47–61.
Juric S., Dermic E., Topolovec–Pintaric S., Bedek M., Vincekovic M. // J. Integr. Agric. 2019. V. 18. № 11. P. 2534–2548.
Üçüncü T.E., Terzioğlu K., Türe H. // Chem. Ecol. 2017. V. 33. № 7. P. 652–668.
Liu L., Wua F., Ju X.-J., Xie R., Wang W., Niu C.H., Chu L.-Y. // J. Colloid Interf. Sci. 2013. V. 404. P. 85–90.
Uyen N.T.T., Hamid Z.A.A., Nurazreena A. // Mater. Today: Proc. 2019. V. 17. P. 792–797.
Bӧrner R.A., Aliaga M.T.A., Mattiasson B. // Biotechnol. Lett. 2013. V. 35(3). P. 397–405.
Cai S., Zhao M., Fang Y., Nishinari K., Phillips G.O., Jiang F. // Food Hydrocoll. 2014. V. 39. P. 295–300.
Kim E.S., Lee J.-S., Lee H.G. // Food Sci. Biotechnol. 2016. V. 25(5). P. 1337–1343.
Poncelet D., Lencki R., Beaulieu C., Halle J.P., Neufeid R.J., Fournier A. // Appl. Microbiol. Biotechnol. 1992. V. 38. P. 39–45.
Reis C.P., Neufeld R.J., Vilela S., Ribeiro A.J., Veiga F. // J. Microencapsul. 2006. V. 23(3). P. 245–257.
Silva C.M., Ribeiro A.J., Figueiredo M., Ferreira D., Veiga F. // AAPS J. 2006. V. 7(4). P. 903–913.
Ching S.H., Bansal N., Bhandari B. // Crit. Rev. Food Sci. Nutr. 2017. V. 57. № 6. P. 1133–1152.
Machado A.H.E., Lundberg D., Ribeiro A.J., Veiga F.J., Lindman B., Miguel M.G., Olsson U. // Langmuir. 2012. V. 28 № 9. P. 4131–4141.
Zhang Z., Ortiz O., Goyal R., Kohn J. Handbook of Polymer Applications in Medicine and Medical Devices. Part 4: Polymeric Biomaterials. / Ed. K. Modjarrad, S. Ebnesajjad. William Andrew, 2014. P. 303–335.
Leong J.-Y., Lam W.-H., Ho K.-W., Voo W.-P., Lee M.F.-X., Lim H.-P. et al. // Particuology. 2016. V. 24. P. 44–60.
Wang X., Zhu K.-X., Zhou H.-M. // Int. J. Mol. Sci. 2011. V. 12. № 5. P. 3042–3054.
Тихонов Б.Б., Стадольникова П.Ю., Сидоров А.И., Сульман М.Г. // Вестник ТвГУ. Серия: Химия. 2021. № 2(44). С. 18–25.
Song H., Yu W., Gao M., Liu X., Ma X. // Carbohydr. Polym. 2013. V. 96. № 1. P. 181–189.
Mark D., Haeberle S., Zengerle R., Ducree J., Vladisavljevic G.T. // J. Colloid Interf. Sci. 2009. V. 336. № 2. P. 634–641.
The Protein Protocols Handbook: Second Edition / Ed. John M. Walker. Humana Press Inc., 2002. 1147 p.
Zhao Y., Teresa Carvajal M., Won Y.-Y., Harris. M.T. // Langmuir. 2007. V. 23. № 25. P. 12489–12496.
Poncelet D., Poncelet De Smet B., Beaulieu C., Huguet M.L., Fournier A., Neufeld R.J. // Appl. Microbiol. Biotechnol. 1995. V. 43. P. 644–650.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология