Прикладная биохимия и микробиология, 2023, T. 59, № 1, стр. 65-73
Влияние экзогенных ИУК и БАП на метаболизм клеток зоны адгезии у корней проростков гороха (Pisum sativum L.) в начальные периоды взаимодействия с Rhizobium leguminosarum bv. viceae
Л. Е. Макарова 1, *, Г. П. Акимова 1, А. А. Ищенко 1, П. А. Бизиков 1, Т. В. Копытина 1
1 Сибирский институт физиологии и биохимии растений Сибирского отделения
Российской академии наук
664033 Иркутск, Россия
* E-mail: makarova@sifibr.irk.ru
Поступила в редакцию 14.06.2022
После доработки 16.08.2022
Принята к публикации 02.09.2022
- EDN: CUSFLJ
- DOI: 10.31857/S055510992301004X
Аннотация
Исследовали действие экзогенных 10–11 М индолил-уксусной кислоты (ИУК) и 10–9 М 6-бензиламинопурина (БАП) на метаболизм клеток в зоне адгезии корня этиолированных проростков гороха, расположенной на расстоянии 5–15 мм от его апекса, через 1 и 24 ч после инокуляции бактериями Rhizobium leguminosarum bv. viceae. Сравнивали инокулированные ризобиями проростки, не подверженные действию ИУК и БАП (контроль) и выросшие на растворах этих фитогормонов. Данные по активности растворимых и связанных с клеточными стенками пероксидаз и полифенолоксидаз, концентрации в тканях пероксида водорода (H2O2), оксида азота (NO), общего содержания растворимых фенольных соединений и флавоноидов (экстрагируемых этилацетатом и н-бутанолом) и нерастворимых фенольных соединений показали усиление защитных ответов в клетках зоны адгезии при действии экзогенной ИУК и их ослабление при действии БАП. Выявленные изменения в метаболизме клеток зоны адгезии объясняют причину положительного влияния на нодуляцию экзогенного БАП и ингибирования этого процесса при действии экзогенной ИУК
На начальных этапах нодуляции индолил-уксусная кислота (ИУК) и цитокинины (ЦК) участвуют в инициации образования примордиев клубеньков. В зоне инфицирования ризобиями в начале митотических процессов, предшествующих образованию клубеньковых примордиев в области коры корня, отмечали аккумуляцию ИУК в локусах образования данных структур и изменения соотношения ИУК: ЦК в сторону повышения доли ЦК [1–4]. Такие изменения в аккумуляции и локализации ИУК и ее соотношения с ЦК происходят при участии флавоноидов и пероксидаз (ПО) [2–5]. Изменения в фитогормональном балансе могут быть вызваны окислительными процессами при участии полифункциональных “стрессовых” ферментов с активностью пероксидаз (ПО), ИУК-оксидаз (ИУКО), полифенолоксидазы (ПФО), при этом в качестве регуляторов их активности могут выступать фенольные соединения (ФС) [6]. ПО не только окисляет ИУК, а также предположительно имеет центр специфического связывания с последней [7]. Полагают, что ПФО и ИУКО имеют общий активный центр на апоферменте [8], а также что они оказывают сходное действие, регулируя содержание ИУК [6]. ПФО в различных клеточных компартментах подвергают окислению разнообразные ФС и с ее активностью может быть связано накопление активных форм кислорода (АФК) и изменение окислительно-восстановительного статуса [9, 10].
Ранее была исследована роль флавоноидов в ингибировании полярного транспорта ауксинов, приводящего к локальному их накоплению в кортексе корней, где инициируются процессы деления клеток и последующее образование примордиев клубеньков [4, 5]. По данным авторов работы [4], при инокуляции ризобиями экспрессия генов, ответственных за синтез флавоноидов, происходит за короткое время, а локальное накопление этих соединений начинает фиксироваться позднее, в течение 24 ч после воздействия ризобиальных Nod-факторов. И в этот же период начинаются нарушения в полярном транспорте ИУК и последующие возникновения очагов делений клеток с образованием клубеньковых примордиев.
Усиление синтеза ФС рассматривается как проявление защитной реакции на инокуляцию ризобиями, связанной с ауторегуляцией растением инфицирования клеток их корня этими бактериями [11–13]. Возможно, отчасти их участие в этом процессе в тканях корней связано с локальными проявлениями защитных реакций, направленных на противодействие прямому инфицированию их клеток [12].
Значительную роль в регуляции уровней защитных реакций и запуске сигнальных систем для органогенеза клубенька при бобово-ризобиальных взаимодействиях отводят ризобиальным Nod-факторам [14]. При этом каскад защитных реакций у бобового растения, возникающий уже с первых минут инфицирования ризобиями, подобно тому, как и при патогенезе, включает повышение уровня и активное взаимодействие таких вторичных продуктов аэробного метаболизма, как АФК и активных форм азота (АФА). Повышение уровня этих метаболитов в начальный период (в течение 1 ч) после инокуляции эффективными по азотфиксации бактериями Rhizobium [15, 16], вероятно, могут запускать синтез ФС [17, 18]. Следует заметить, что увеличение содержания ФС, и в том числе флавоноидов, в корнях бобовых культур фиксировали не ранее, чем через 10 ч от момента инокуляции ризобиями, или под влиянием их Nod-факторов, т.е., до и во время органогенеза клубеньков [4, 19].
К участку корня, где происходит проникновение ризобий и инициируется образование примордия, примыкает не менее важный для формирования бобово-ризобиального симбиоза участок – зона адгезии, которая по мере роста корня возникает в виде прироста со стороны меристемы. При инфицировании ризобиями ее поверхность покрывается слоем бактерий, часть которых образуют с эпидермальными клетками корня прочные связи [20].
Ранее было показано, что метаболизм ФС в клетках зоны адгезии отличался от метаболизма в области корня, где через 24 ч после инокуляции регистрировали начало проникновения ризобий в корневые волоски [13, 20]. В частности, данные по содержанию “растворимых” ФС и их антиоксидантной активности в липофильных системах, содержанию ФС, связанных с клеточными стенками, свидетельствовали об ослаблении участия этих веществ в защитных реакциях в зоне адгезии и об усилении участия - в зоне проникновения.
Повышенные концентрации экзогенной ИУК может негативно действовать на процесс нодуляции [21]. Обработка корней цитокининами, напротив, способствует усилению формирования клубеньков [22]. В работе [23] также показано неоднозначное влияние экзогенных ИУК и ЦК на метаболизм клеток восприимчивых к ризобиям зоны корня еще в начальный период взаимодействия симбионтов и на нодуляцию. Полученные данные об изменении уровня салициловой кислоты и в активности ПО показали, что ингибированию нодуляции корней, произраставших на растворе ИУК, способствуют более выраженные, в сравнении с действием экзогенного ЦК, проявления защитных реакций в участке корня, где начинается проникновение ризобий в корневые волоски и возникают зачатки примордиев клубеньков [23].
Цель работы – проследить изменения метаболизма клеток проростков гороха (Pisum sativum L.) в зоне адгезии в ответ на одновременное действие Rhizobium leguminosarum bv. viceae и экзогенных фитогормонов – ИУК и ЦК (6-бензиламинопурина) в течение 1 и 24 ч.
МЕТОДИКА
Объекты исследования. В работе использовали этиолированные проростки гороха (Pisum sativum L.) сорта Аксайский усатый 3, выращенные в темноте при температуре 21°С в кюветах на фильтровальной бумаге, смоченной кипяченной водопроводной водой. Исходным материалом служили 2-суточные проростки, выращенные в тех же условиях. Средние размеры корней у исходных и исследуемых в период 0–60 мин от начала эксперимента составляли 30–35 мм, по окончании эксперимента (24 ч) – 45–50 мм. При проведении экспериментов 2-суточные проростки помещали на фильтровальную бумагу, которую смачивали растворами 10–11 М ИУК или 10–9 М БАП, а на корни проростков наносили по 1 мл инокулята (титр 106 кл./мл) бактерий Rhizobium leguminosarum bv. viceae штамм 1026. Штамм был получен из Всероссийского научно-исследовательского института сельскохозяйственной микробиологии (Санкт-Петербург, Россия). В предварительных экспериментах были подобраны концентрации фитогормонов ИУК и БАП [23, 24]. Критерием выбора концентрации было положительное влияние на рост корня, а в случае с БАП, также и стимуляция образования клубеньков. Подбор титра бактерий, не вызывающего существенных изменений роста корней, и способ нанесения инокулята был отработан ранее [24]. Инокулированные ризобиями контрольные растения росли на воде. Инокулят готовили смывом бактерий с твердой агаризованной питательной среды. Титр в полученной суспензии определяли, измеряя плотность суспензии при 675 нм на планшетном спектрофотометре “Immunochem-2100” (“High Technology Inc.”, США).
Из участка корня, расположенного на расстоянии 5–15 мм от кончика корня с помощи бритвы вырезали отрезки корней для исследований в начале экспозиции (0–60 мин) и через 24 ч.
Определение активности полифенолоксидазы. Две фракции ПФО “растворимую” (цитоплазматическая) и связанную с клеточными стенками, выделяли как описано в работе [25]. Фиксированные жидким азотом отрезки корня гомогенизировали в 0.01 М фосфатном буфере (pH 6.0), гомогенат центрифугировали при 1800 g 20 мин, отделяли супернатант, содержащий ПФО “растворимой” фракции. Из осадка 1 М NaCl экстрагировали ионно-связанную ПФО, а затем обработкой 0.25%-ным раствором целлюлазы и пектиназы (“Onozuka”, Япония) ковалентно связанную ПФО. Экстракты, содержащие ионно- и ковалентно связанные с клеточными стенками ПФО, из-за низких показателей во фракции 2 (на 2 порядка), объединяли в общую фракцию “связанных с клеточными стенками”.
Активность ПФО определяли спектрофотометрически по изменению оптической плотности (ОП) при 420 нм за 1 мин в реакционной смеси с субстратом для окисления – пирокатехином [26]. В состав реакционной смеси входили: 2 мл 0.05 М фосфатного буфера, рН 7.0, 0.5 мл белковой вытяжки и 0.5 мл 0.05 М раствора пирокатехина. Активность ферментов выражали в условных единицах в расчете на 1 г сырой ткани.
Определение активности пероксидазы. Выделение разных форм ПО – растворимой, ионно˗ и ковалентно связанной с клеточными стенками и определение их активности осуществляли по методикам, описанной в работе [23]. В соответствии с описанным методом после гомогенизации растительного материала в фосфатном буфере (рН 6.2), центрифугированием отделяли супернатант, содержащий растворимые формы пероксидаз. Затем из промытого раствором 2%-ного Тритона Х-100 нерастворимого осадка экстрагировали 1 М NaCl ионно связанные, а после обработки смесью 0.25%-ных растворов пектиназы и целлюлазы (соотношение 1 : 1) – ковалентно связанные формы пероксидаз. На каждом этапе экстракции центрифугировали по 15 мин при 5000 g и 4°С.
Для определения оксидазной (прооксидантной) активности фермента в качестве субстрата использовали ИУК, пероксидазной (антиоксидантной) – о˗дианизидин. Активность ПО (усл. ед./г сырой массы) определяли по начальной скорости окисления о˗дианизидина пероксидом водорода в 0.1 М натрий˗фосфатном буфере, рН 7.0. ИУКО (мкг/мин г сырой массы) – по убыли ИУК в реакционной смеси.
Определение содержания перекиси водорода. Содержание Н2О2 в гомогенате отрезков корней определяли спектрофотометрически (СФ-Hitachi U-1100, “Hitachi”, Япония) при 560 нм с использованием индикатора ксиленового оранжевого [15]. Количество Н2О2 рассчитывали по калибровочному графику, построенному для разных концентраций Н2О2, и выражали в мкМ/г сырой массы отрезка корня.
Определение содержания NO. Для изучения динамики генерации оксида азота в корнях проростков гороха определяли интенсивность флуоресценции NO в течение 1 ч с интервалом в 10 мин на соответствующих варианту опыта средах. Для этого отрезки корней (3 шт.), взятые у проростков на расстоянии 5–15 мм от кончика корня, окрашивали в среде, содержащей 10 мкМ DAF-2DA (5,6-диаминофлуоресцеиндиацетат, “Sigma-Aldrich”, США) в 10 мМ Tрис-HCl буфере, pH 7.4. Окрашивание проводили в течение 20 мин на качалке и при температуре 26°С. Из окрашенных отрезков получали поперечные срезы (не менее 10) толщиной 100–150 мкм и анализировали на флуоресцентном микроскопе AxioObserver Z1 (“Zeiss”, Германия) с цифровой монохромной камерой Axio CamMRm3 и пакетом программного обеспечения для захвата и анализа изображений “AxioVision Rel.4.6”, с использованием блока фильтров № 10 с длиной волны возбуждения 450-490 нм, эмиссией 515–565 нм. Интенсивность флуоресцентного свечения выражали в относительных единицах (отн. ед.). Кривая изменения уровня NO строилась относительно показателей флуоресценции в начале эксперимента (% от 0 мин).
Получение экстрактов фенольных соединений (ФС). Экстракты ФС получали из растительного материала, зафиксированного 96%-ным этанолом и затем гомогенизированного. Выделение ФС проводили по ранее разработанной схеме [27, 28]. ФС экстрагировали 80%-ным этанолом (50 мл на 1 г растительного материала, 3–4-кратно), а после его удаления на роторном испарителе, водный остаток подкисляли 2 н HCl до рН 3–4 и экстрагировали этилацетатом растворимые липофильные ФС (фракция I), а затем н-бутанолом в соотношении 1 : 1 (об.) 3–4-кратно водорастворимые ФС (фракция II). Из нерастворимого остатка (клеточные стенки) после 1-часового гидролиза 2 н HCl на кипящей водяной бане экстрагировали “нерастворимые” ФС (фракция III) этилацетатом в соотношении 1 : 1 (об.) 3–4-кратно. Полученные экстракты упаривали в условиях затемнения в вакууме досуха, сухие остатки растворяли в небольшом объеме 95%-ного этанола для определения в них общего содержания ФС и флавоноидов.
Определение содержания фенольных соединений. Содержание ФС определяли с реактивом Фолина-Дениса по стандартной методике [29]. Количества ФС рассчитывали по калибровочному графику, построенному для кемпферола, и выражали в мкг/г сырой массы отрезка корня.
Определение содержания флавоноидных соединений. Содержание флавоноидов в экстрактах, содержащих растворимые ФС, определяли по методу, описанному в работе [30]. Оптическую плотность определяли на спектрофотометре Specord S-100 (“Karl Zeiss”, Германия) при 510 нм против контроля: 4.5 мл воды + 0.5 этанола. Содержание флавоноидов рассчитывали по калибровоному графику для катехина и выражали как эквиваленты катехина, в мкг/г сырой массы отрезка корня.
Статистическая обработка результатов. Для статистической обработки полученных результатов использовали Microsoft Excell. На рисунках и в таблицах приведены средние значения и стандартные отклонения для них, которые получены из трех независимых экспериментов. Значимость различий между средними значениями определяли, используя t˗критерий Стьюдента при уровне Р < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В течение 1 ч от момента помещения проростков в растворы фитогормонов и одновременной инокуляции ризобиями в зоне адгезии наблюдали ранние ответы на действие ИУК и ЦК по изменению уровня NO. Через 24 ч экспозиции в указанных условиях роста проростков в отрезках их корней определяли содержание ФС в трех фракциях экстрагируемых этилацетатом, н-бутанолом, и связанных с клеточными стенками, содержание флавоноидов, активность растворимых и связанных с клеточными стенками ПФО.
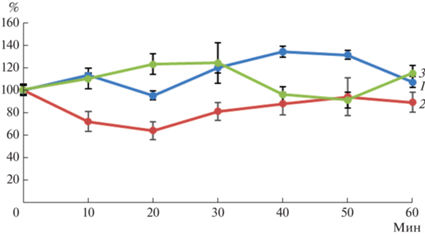
На рис. 1 представлено сравнение динамики содержания NO в клетках зоны адгезии у корней проростков гороха в течение 1 ч от начала действия на них ризобий (контроль) и при совместном действии бактерий и экзогенных ИУК и БАП. Отмечена разница в характере ответной реакции клеток исследуемого участка корней при одновременном действии на них ризобий и экзогенных ИУК и БАП (рис. 1). ИУК дважды вызывала повышение уровня NO, при этом, 1 повышение происходило ранее, чем при действии ризобий без участия этого фитогормона – в период 10–30 мин, второе – на 60-й мин (рис. 1). В присутствии БАП уровень NO на протяжении того же времени экспозиции был заметно ниже, не только по сравнению с ИУК, но и с контролем. При этом слабое повышение уровня NO при действии БАП имело место, причем в тот же период, как и у контрольных растений – начиная с 30 мин (рис. 1). Обнаруженные существенные различия в динамике NO при действии на корни БАП и ИУК (рис. 1) свидетельствовали о различном влиянии этих фитогормонов на активность NO-синтазной системы в начальный период взаимодействия симбионтов.
Рис. 1.
Влияние экзогенных 10–9 М БАП и 10–11 М ИУК на динамику интенсивности флуоресценции (% от значения в 0 точке) оксида азота в течение 1 ч после инокуляции ризобиями: 1 – рост инокулированных проростков без фитогормонов (контроль); 2, 3 – рост инокулированных проростков на растворах БАП и ИУК соответственно.
Показателями ранней реакции растения на воздействия бактерий также служат данные по изменению содержания АФК, и, в частности, содержания пероксида водорода [14, 15]. Важную роль в регуляции уровня пероксида в растительных клетках отводят пероксидазам, поскольку вследствие полифункциональности эти ферменты могут участвовать в реакциях оксигеназного, пероксидазного и оксидазного окисления в клетках [7]. На рис. 2 приведены отношения показателей содержаний H2O2 и активности цитоплазматичекой ПО в исследуемой зоне в течение 1 ч экспозиции при действии экзогенных фитогормонов по отношению к тем же показателям у растений в контроле. Указанные соотношения показателей позволяют зафиксировать реакцию проростков на одновременное действие на них ризобий и экзогенных БАП и ИУК по сравнению с проростками, на которые воздействовали только эти бактерии. При действии ИУК и БАП выявлено 2 периода повышения содержания Н2О2, совпадающих по времени (рис. 2а). Эти повышения уровня пероксида можно оценивать как свидетельство проявления защитных реакций клеток зоны адгезии. При действии обоих фитогормонов активность ПО оказалась максимальной в те периоды, когда в ответ на действие фитогормонов максимально возрастало содержание пероксида (рис. 2б). При этом более высокий уровень Н2О2, который оказался при действии БАП, а не при действии ИУК (рис. 2а), скорее всего, обусловлен менее активной в клетках этого варианта “растворимой” ПО (рис. 2б).
Рис. 2.
Влияние экзогенных 10–11 М ИУК (1) и 10–9 М БАП (2) на динамику изменения содержания H2O2 (а, % к контролю) и активность “растворимой” ПО (б, % к контролю) в течение 1 ч после инокуляции ризобиями.
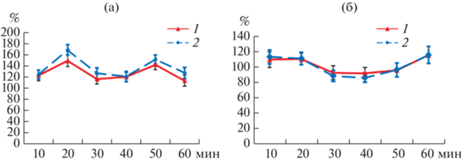
Сравнение влияния БАП и ИУК на динамику содержания NO и Н2О2 (рис. 1, 2а) позволяет констатировать различия в характере, интенсивности и времени проявления защитных ответов с участием этих метаболитов в зоне адгезии в течение 1 ч после инокуляции корней ризобиями. При этом обращает на себя внимание, что БАП, по сравнению с ИУК, очевидно, имел выраженный ингибирующий эффект на NO-синтазную систему и в большей степени вызывал повышение уровня пероксида водорода в клетках исследуемой зоны корня.
Через 24 ч от начала инокуляции и помещения корней в растворы с фитогормонами в участке корня на расстоянии 5–15 мм от его апекса было прослежено влияние БАП и ИУК на содержание ФС, активность ПО и ПФО. Данный участок в описанных выше условиях роста корня (см. Методику) сформировался за 24 ч экспозиции с фитогормонами за счет клеток, перешедших из зоны меристемы в зону растяжения. Первоначально исследуемый участок корня (в течение первого экспозиции) за 24 ч удалился от апекса в зону, где наступил следующий этап взаимодействия с ризобиями – начало проникновения последних в корневые волоски [23].
Показано, что активность “растворимых” и связанных с клеточными стенками антиоксидантной ПО через 24 ч выше, чем через 1 ч после начала эксперимента в 1.5–2.0 раза (в зависимости от варианта выращивания). Активность прооксидантной ПО возрастала в меньшей степени, либо не изменялись (ковалентно-связанные с клеточными стенками в контроле и в присутствии БАП). Отношения активности ферментов при действии фитогормонов к тем же показателям в контроле (табл. 1) показли разницу в действии ИУК и БАП, которую оценивали по степени проявлении активности про- и антиоксидантной ПО. Рост на растворе ИУК приводил к заметному возрастанию активности фермента ИУКО, который способен окислять данный фитогормон [6], и, вероятно, в наибольшей степени во фракции связанных с клеточными стенками (табл. 1). Под влиянием же БАП существенно снижалась активность ИУКО в цитоплазме и ПО в клеточной стенке (табл. 1).
Таблица 1.
Влияние БАП и ИУК на активность ПО и ПФО в зоне адгезии инокулированных Rhizobium корней проростков гороха через 24 ч экспозиции*
| Вариант | Цитоплазматический фермент | Фермент, связанный с клеточными стенками | ||||
|---|---|---|---|---|---|---|
| ПО, % | ИУКО, % | ПФО, % | ПО, % | ИУКО, % | ПФО, % | |
| +ИУК | 107.22 ± 7.4a | 112.9 ± 5.1a | 124.74 ± 6.8a | 106.09 ± 6.1a | 131.6 ± 4.5a | 134.37 ± 6.5a |
| +БАП | 101.89 ± 7.3a | 58.06 ± 4.6b | 108.95 ± 4.5b | 77.64 ± 7.0b | 104.48 ± 6.8b | 101.4 ± 4.6b |
Действие фитогормонов в клетках исследуемой зоны вызывало изменение активности другого окислительного фермента – ПФО (табл. 1). Активность ПФО в цитоплазматической фракции у контрольных растений составляла 0.155 ± ± 0.02 отн. ед./г сырой массы отрезка, а в клеточных стенках она оказалась выше в 1.9 раза. Как следует из данных табл. 1, влияние ИУК в большей мере, чем влияние БАП, приводило к повышению активности этого фермента, и особенно во фракции, связанной с клеточными стенками. В клеточных стенках изменения активностей ИУКО и ПФО были близки как при действии ИУК, так и при действии БАП (табл. 1). В цитоплазме этого не наблюдалось.
Как ответную реакцию на действие неблагоприятных факторов на растение рассматривают повышение содержания ФС в растительных клетках [31]. В настоящей работе представлены данные по содержанию ФС (рис. 3), и в том числе флавоноидов (рис. 4) в исследуемой зоне, полученные через 24 ч после инокуляции. Повышение уровня NO и Н2О2 в начальный период бобово-ризобиального взаимодействия может положительно влиять на экспрессию гена pal, кодирующего фенилаланинаммиак-лиазу – ключевого фермента фенилпропаноидного пути биосинтеза ФС [17, 18], и генов chs и chi, кодируюших, соответственно, халкон-синтазу и халкон-изомеразу [17], участвующих в синтезе флавоноидов [32]. По данным литературы, экспрессия обсуждаемых генов при инокуляции обнаружена через 3 ч от ее начала, а накопление ФС фиксировали не ранее 10–13 ч [15, 16].
Рис. 3.
Влияние экзогенных БАП и ИУК на содержание ФС (мкг/г сырой массы), экстрагируемых этилацетатом (I), н-бутанолом (II) и высвобождаемых из клеточных стенок (III), в зоне адгезии через 24 ч после инокуляции Rhizobium: рост инокулированных Rhizobium проростков на воде (1, контроль), на 10–9 М БАП (2), 10–11 М ИУК (3).
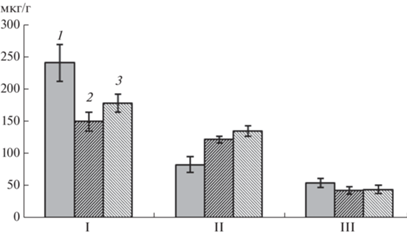
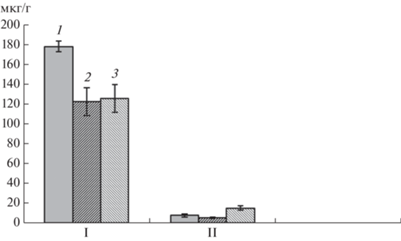
Рис. 4.
Влияние экзогенных БАП и ИУК на содержание флавоноидов (мкг/г сырой массы) во фракции экстрагируемых этилацетатом (I) и н-бутанолом (II), в зоне адгезии через 24 ч после инокуляции Rhizobium, 1, 2, 3 –как на рис. 3.
Флавоноиды являются компонентами растительных клеток, которые наиболее значимы в регуляции уровня фитогормонов в точках формирования примордиев клубеньков [3]. Синтез флавоноидов индуцируется в области проникновения ризобий в корнях бобовых растений под влиянием ризобиальных Nod-факторов, а в зоне адгезии флавоноиды секретируются во внешнюю среду в составе корневых эксссудатов. В работе [2] показано, что в зоне образования примордиев клубеньков после инокуляции ризобиями все изменения в аккумуляции и локализации ИУК происходят при участии флавоноидов и ПО.
Суммарная концентрация ФС (по данным рис. 3) в трех полученных фракциях через 24 ч экспозиции составляла в расчете на г сырой массы зоны в корнях в контроле – 345.5 мкг, а при росте на растворах ИУК и БАП, соответственно, 392.4 и 321.8 мкг. Максимальное содержание ФС в исследуемой зоне наблюдали при действии ИУК, минимальное – при действии БАП. При этом роль ФС исследуемых фракций в метаболизме клеток, несомненно, различалась. Как было показано ранее [26] ФС, входящие в состав фракции, экстрагируемой этилацетатом, представляют собой липофильные ФС с достаточно высокой биологической активностью.
ФС, экстрагируемые н-бутанолом, это хорошо растворимые в воде компоненты, вероятно, локализующиеся в вакуолях [33], их биологическая активность низка [28]. Концентрацию ФС данной фракции в клетках зоны адгезии повышали БАП и, еще более – ИУК. Вероятно, это связано с усилением растяжения клеток [23], сопряженным с усилением вакуолизации в исследуемой зоне корня. На это указывает аналогичная тенденция прироста за 24 ч экспозиции корней в тех же вариантах выращивания.
ФС третьей фракции играли важную роль в укреплении клеточных стенок [31]. В образовании связей между ФС и компонентами клеточных стенок участвуют ПО [34]. Очевидно, именно более низкая активность этих ферментов в варианте с БАП (табл. 1) может служить объяснением наиболее низкого, по сравнению с контролем и вариантом с ИУК количества ФС, высвобождаемых из клеточных стенок (рис. 3). Обнаруживаемое при этом повышение активности ПФО в цитоплазме и клеточных стенках в варианте с ИУК (табл. 1), вероятно, связано с окислением данного фитогормона [6].
Состав биологически активной группы ФС, входящих во фракцию экстрагируемых этилацетатом, может зависеть от внешних обстоятельств [35]. Так, в тканях зоны проникновения под влияние БАП и ИУК может повышаться содержание салициловой кислоты [23], отнесенной к негативным регуляторам нодуляции [36].
Важными компонентами для процессов нодуляции при бобово-ризобиальном симбиозе являются некоторые флавоноиды. Их роль в зоне проникновения ризобий – инициация образования примордиев клубеньков, а в зоне адгезии – как индуктора экспрессии ризобиальных nod-генов, в основном в связи с их активностью в составе корневых экссудатов [3]. Оба фитогормона в участке корня, относящегося к зоне адгезии, вызывали снижение общего содержания флавоноидов в составе фракции, экстрагируемой этилацетатом (рис. 4). При этом экзогенная ИУК способствовала повышению концентрации флавоноидов в составе бутанольной фракции, а БАП – вызывала небольшое снижение их количества. Однако возникшие при действии фитогормонов изменения в содержании данной фракции флавоноидов на общей тенденции падения концентрации флавоноидов в тканях исследуемого участка корня не отразились. Причины практически одинакового снижения содержания флавоноидов в исследуемой зоне при действии БАП и ИУК не ясны и требуют дальнейших исследований.
Анализ приведенных выше показателей по активности ПО и уровня Н2О2 в клетках зоны адгезии, позволяет оценить защитную реакцию клеток исследуемой зоны на действие фитогормонов в течение 1 и 24 ч. Приведенные результаты работы свидетельствуют о влиянии экзогенных ЦК на метаболизм клеток зоны адгезии в разные периоды роста корня после его инокуляции бактериями Rhizobium. Проанализированные показатели содержания NO, H2O2 и активности ПО в ранний период (до 1 ч) взаимодействия симбионтов выявили защитные реакции в клетках исследуемой зоны при действии на них ИУК. Между растениями в контроле и под воздействием БАП и ИУК наиболее существенными были различия по характеру изменения уровня NO (рис. 1). Они показали роль ИУК в более раннем активировании NO-синтазной системы, по сравнению с растениями контроля, на которые действовали только ризобии, так и то, что при действии экзогенных ЦК этот процесс может ингибироваться.
Ответные реакции на действие ЦК и ИУК в клетках исследуемой зоны имели различия и через 24 ч от начала эксперимента, когда в соседнем с зоной адгезии участке корня начиналось проникновение ризобий в корневые волоски [20, 37]. В этот период в зоне адгезии фиксируется существенное усиление активности ПО. При этом активности ИУКО и ПФО оказались заметно выше у растений, на которые действовала экзогенная ИУК. От вида фитогормона зависело содержание ФС в трех исследуемых фракциях. ИУК вызывала повышение их общего содержания за счет входящих в состав ФС веществ, экстрагируемых бутанолом. Под влиянием БАП обнаружено снижение общего содержания ФС. Оно происходило в наибольшей степени за счет биологически активной фракции “растворимых” ФС, и в меньшей степени за счет ФС, связанных с клеточными стенками. Содержание “растворимых” ФС, по сравнению с контролем, возрастало, но в меньшей мере, чем при действии ИУК. Важной особенностью обоих экзогенно действующих фитогормонов оказалось существенное снижение общего содержания флавоноидов в исследуемой нами зоне. Данное явление требует дальнейших более детальных исследований изменений в их составе. Известно, что определенные виды флавоноидов могут регулировать уровень ИУК в области формирования клубеньков у бобовых растений разных видов [38].
Приведенные результаты показали, что более выраженные защитные реакции при действии ИУК в зоне адгезии имели негативные последствия для нодуляционных процессов. Данное высказывание подтверждают данные, описанные в работе [23], где приводилось исследование экзогенного действия 10–9 М БАП и 10–11 М ИУК на нодуляцию корней растений гороха. Было установлено небольшое стимулирование нодуляции при действии ЦК и полное ингибирование при действии ИУК. Это дает основание предположить, что подобное ингибирование нодуляции у бобовых культур могут происходить при внесении в их ризосферу микробных препаратов, включающих бактерии с повышенной продуктивностью ИУК, что необходимо учитывать на практике.
Работа выполнена в рамках проекта № госрегистрации 122041100050-6 при использовании оборудования Центра коллективного пользования (ЦКП) “Биоаналитика” Сибирского института физиологии и биохимии растений СО РАН (Иркутск, Россия).
Список литературы
Долгих Е.А., Кириенко А.Н., Леппянен И.В., Долгих А.В. // Сельскохозяйственная биология. 2016. Т. 51. С. 585–592. https://doi.org/10.15389/agrobiology.2016.5.585rus
Mathesius U. // J. Exp. Bot. 2001. V. 52. № 1. P. 419–426.
Reddy P.M., Rendón-Anaya M., de los Dolores Soto del Río M., Khandual S. // Dynamic Soil, Dynamic Plant. 2007. V. 1. № 2. P. 83–94
Mathesius U., Bayliss C., Weinman J.J., Schlaman H.R.M., Spaink H.P., Rolfe B.G., VcCully M.E., Djordjevic M.A. // MPMI. 1998. V. 11. № 12. P. 1223–1232.https://doi.org/10.1094/MPMI.1998.11.12.1223
Mathesius U., Schlaman H.R.M., Spaink H.R., Sautter C., Rolfe B.G., Djordjevic M.A. // The Plant J. 1998. V. 14. P. 23–34.
Ибрагим-заде Х., Абришамхи П. // Физиология растений. 2001. Т. 48. № 2. С. 223–228.
Рогожин В.В., Верхотуров В.В., Рогожина Т.В. Пероксидаза: строение и механизм действия. Иркутск: Изд-во ИрГТУ, 2004. 200 с.
Srivastava O.P., Van Huystee R.B. // Can. J. Bot. 1977. V. 55. № 20. P. 2630–2635.
Mayer A.M. // Phytochemistry. 2006. V. 67. № 21. P. 2318–2331. https://doi.org/10.1016/j.phytochem.2006.08.006
Webb K.J., Cookson A., Allison G., Sullivan M.L., Winters A.L. // Front Plant Sci. 2014. V. 5. № 94. Article 700. https://doi.org/10.3389/fpls.2014.00700
Vasse J., Billi F., Truchet G. // Plant J. 1993. V. 4. №3. P. 555–566.
Santos R., Hěrouart D., Sigaud S., Touati D., Puppo A. // MPMI. 2001. V. 14. № 1. P. 86–89.
Глянько А.К., Акимова Г.П., Соколова М.Г., Макарова Л.Е., Васильева Г.Г. // Прикл. биохимия и микробиология. 2007. Т. 43. № 3. С. 289–297.
Glyan’ko A.K. // J. Stress Physiology & Biochemistry. 2018. V. 14. № 2. P. 36–57. www.jspb.ru/issues/2018/N2/JSPB_2018_2_36-57.html.
Акимова Г.П., Верхотуров В.В., Соколова М.Г. // Известия вузов. Прикладная химия и биотехнология. 2017. Т. 7. № 4. С. 126–131. https://doi.org/10.21285/2227-2925-2017-7-4-126-131
Ищенко А.А., Филинова Н.В., Сидоров А.В. // Известия вузов. Прикладная химия и биотехнология. 2020. Т. 10. № 2. С. 294–302. https://doi.org/10.21285/2227-2925-2020-10-2-294-302
Ahn S.Y., Kim S.A., Cho K.S., Yun H.K. // Biologia Plantarum. 2014. V. 58. № 4. P. 758–767. https://doi.org/10.1007/s10535-014-0437-2
Durner J., Wendehemme D., Klessig D.F. // Proc. Natl. Acad. Sci. USA. 1998. V. 95. № 17. P. 10328–10333. https://doi.org/10.1073/pnas.95.17.10328
Рудиковская Е.Г., Акимова Г.П., Федорова Г.А., Соколова М.Г., Дударева Л.В., Рудиковский А.В. // Физиология растений. 2010. Т. 57. № 2. С. 266–272.
Makarova L.E., Akimova G.P., Sokolova M.G., Luzova G.B., Rudikovskaya E.G., Nurminsky V.N. // Academic Open Internet J. 2004. V. 12. № 2.
Spaepen S., Vanderleyden J., Remans R. // FEMS Microbiol. Rev. 2007. V. 31. № 4. P. 425–448. https://doi.org/10.1111/j.1574-6976.2007.00072.x
Cooper J.B., Long S.R. // Plant Cell. 1994. V. 6. № 2. P. 215–225. https://doi.org/10.1105/tpc.6.2.215
Макарова Л.Е., Акимова Г.П., Соколова М.Г., Петрова И.Г. // Физиология растений. 2022. Т. 89. № 2. С. 179–188. https://doi.org/10/31857/S0015330322010110
Акимова Г.П., Соколова М.Г., Нечаева Л.В. // Физиология растений. 1999. Т. 46. № 5. С. 806–810.
Юсупова З.Р., Хайруллин Р.М., Максимов И.В. // Физиология растений. 2006. Т.53. № 6. С. 910–917.
Ярош Н.П., Арасимович В.В., Ермаков А.И., Перуанский Ю.В. Определение активности ферментов и их ингибиторов. / В сб.: Методы биохимического исследования растений. / Ред. А.И. Ермакова. 3 изд. Л.: Агропромиздат, 1987. С. 36–84.
Макарова Л.Е. // Сибирский экологический журн. 2002. № 2. С. 243–247.
Макарова Л.Е., Лузова Г.Б., Ломоватская Л.А. // Физиология растений. 1998. Т. 45. № 6. С. 824–832.
Запрометов М.Н. Основы биохимии фенольных соединений. М.: Высшая школа, 1974. 214 с.
Zhishen J., Mengcheng T., Jianming W. // Food Chemistry. 1999. V. 64. № 4. P. 555–559.
Макарова Л.Е. // Вестник Харьковского национального аграрного университета. Серия биология. 2012. № 2(26). С. 25–40.
Запрометов М.Н. Фенольные соединения: распространение, метаболизм и функции в растениях. М.: Наука, 1993. 272 с.
Озолина Н.В., Макарова Л.Е., Возненко А.Н., Колесникова Е.В., Дударева Л.В. // Химия растительного сырья. 2014. № 3. С. 175–183. https://doi.org/10.14258/jcprm.1403175
Максимов И.В., Черепанова Е.А., Бурханова Г.Ф., Сорокань А.В., Кузьмина О.И. // Биохимия. 2011. Т. 76. № 6. С. 749–763.
Макарова Л.Е., Латышева С.Е., Екимова Е.Г. // Физиология растений. 2003. Т. 50. № 2. С. 291–298.
Цыганова А.В., Цыганов В.Е. // Сельскохозяйственная биология. 2018. Т. 53. № 1. С. 3–14. https://doi.org/10.15389/agrobiology.2018.1.3rus
Макарова Л.Е., Нурминский В.Н. // Цитология. 2005. Т. 47. № 6. С. 519–525.
Subramanian S., Stacey G., Yu O. // TRENDS in Plant Science. 2007. V. 12. № 7. P. 282–285.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


