Прикладная биохимия и микробиология, 2023, T. 59, № 1, стр. 81-95
Метод количественного определения активного рецептора бета-лактамных антибиотиков BlaR-CTD для биоаналитического применения
Т. С. Серченя 1, *, П. А. Семижон 2, Е. П. Счесленок 2, И. В. Горбачева 1, И. И. Вашкевич 1, О. В. Свиридов 1
1 Институт биоорганической химии НАН Беларуси
220141 Минск, Беларусь
2 Республиканский научно-практический центр эпидемиологии и микробиологии
220114 Минск, Беларусь
* E-mail: serchenya@tut.by
Поступила в редакцию 03.08.2022
После доработки 29.08.2022
Принята к публикации 02.09.2022
- EDN: CVMIEW
- DOI: 10.31857/S0555109923010105
Аннотация
Разработана биоаналитическая сэндвич-система для количественного определения рекомбинантного рецептора бета-лактамов BlaR-CTD, обладающего лигандсвязывающей активностью и иммунореактивностью. В этой тест-системе BlaR-CTD из биологической жидкости или калибровочной пробы связывается за счет рецепторного сайта с иммобилизованным в лунке микропланшета ампициллином, а через эпитопы периферической структуры взаимодействует со специфическими поликлональными антителами. Аналитическая чувствительность метода оказалась равной 2 нг/мл, рабочий диапазон составил 5–215 нг/мл. Проведен мониторинг биологической активности и дана оценка стабильности BlaR-CTD в процессах его гетерологической экспрессии, выделения и приготовления реагентных форм. Получен высокоочищенный рекомбинатный рецептор бета-лактамов BlaR-CTD. Показано, что этот белок обладал достаточно высокой устойчивостью к денатурации хаотропными агентами (мочевина и гуанидингидрохлорид) и стабилен в широком диапазоне рН среды. Кроме того, предложены конструкции и методики применения конкурентных систем для биоанализа бета-лактамных антибиотиков, основанные на рецепторных и антигенных свойствах BlaR-CTD, в микропланшетах (аналитическая чувствительность 0.02 нг/мл, IC50 = 0.28 нг/мл) и на хроматографических тест-полосках (предел обнаружения 1–2 нг/мл).
Антибиотики широко применяются в ветеринарной медицине в качестве профилактических средств для предотвращения заболеваний у здоровых животных и терапевтических препаратов для лечения заболевших особей. Из-за избыточного и неправильного использования эти лекарства загрязняют продукты питания человека и порождают проблему накопления, распространения и эволюции устойчивых к антибиотикам бактерий. Остаточные количества антибиотиков в продукции животного происхождения законодательно регламентируются в мировом масштабе [1]. Для контроля применяют биоаналитические способы скрининга, преимущественно иммуноанализ, и инструментальные методы подтверждения – главным образом высокоэффективную жидкостную хроматографию с масс-спектрометрической детекцией [2–4].
Все это относится и к бета-лактамам – пенициллинам, цефалоспоринам, карбапенемам и монобактамам, которые являются одними из наиболее используемых антибиотиков в мире. Родоначальником пенициллинового ряда выступает природное соединение бензилпенициллин (пенициллин G), известный с сороковых годов прошлого столетия. Кроме него максимально допустимые уровни (в мкг/кг) в разных видах продовольствия установлены для полусинтетических субстанций, включающих амоксициллин, ампициллин (по 4–50 мкг/кг), оксациллин, клоксациллин, диклоксациллин, нафциллин (по 30–300) и клавулановую кислоту (по 100–400), а также для еще одного природного антибиотика феноксиметилпенициллина или пенициллина V (25–250). Из цефалоспоринов контролируются цефапирин (10–50), цефкином, цефалоний (по 20–100), цефоперазон, цефазолин (по 50), цефтиофур, цефалексин (по 100) и цефацетрил (125) [5, 6].
Уже на протяжении многих лет целям обнаружения и количественного определения бета-лактамных антибиотиков в различных пищевых матриксах служит иммуноанализ, основанный на реакции антиген-антитело в системах различных конструкций. Известны способы синтеза иммуногенных конъюгатов пенициллинов и цефалоспоринов с инертными белками и получения поликлональных или моноклональных антител, способных узнавать в конкурентной реакции связывания несколько близких структурных аналогов каждого ряда и среди них антиген с детектируемой меткой в растворе или иммобилизованный на твердой фазе. Отметим, что лишь в единичных случаях удается получить высокоаффинные антитела и достичь требуемой чувствительности анализа [7–11]. Не описаны антитела, взаимодействующие со всеми или многими пеницилиллинами или цефалоспоринами, не говоря уже об их групповой специфичности в отношении полного перечня контролируемых бета-лактамов. К тому же каждый из препаратов антител имеет свой уникальный набор свойств, что создает трудности в стандартизации иммуноаналитических методик и тест-систем.
Следует подчеркнуть, что молекулярным элементом, определяющим химическое поведение и антибактериальную активность всех обсуждаемых соединений, является четырехчленное бета-лактамное кольцо. Этот фрагмент на примере пенициллинов представлен на рис. 1. Из-за структурного напряжения в кольце бета-лактамы активны в химических реакциях, в частности, они легко подвергаются гидролизу в водных растворах. Распад важнейшего структурного фрагмента бета-лактамных антибиотиков протекает также под действием β-лактамаз в бактериальных клетках, что приводит к полной инактивации лекарственной субстанции. Способность этих ферментов связывать бета-лактамы была использована для разработки биоанализа антибиотиков, в котором бета-лактам из исследуемой или градуировочной пробы блокирует в активном центре β-лактамазы эпитопы связывания специфического моноклонального антитела [12]. В ветеринарной химиотерапии для ингибирования бактериальных β-лактамаз в состав препаратов вводят уже упоминавшуюся выше клавулановую кислоту, имеющую бета-лактамное кольцо в своей структуре.
Однако открытие, исследование и применение in vitro совсем других бактериальных белков, проявляющих сродство к бета-лактамам, обеспечило значительное развитие биоанализа данного класса антибиотиков. Речь идет о мембранных рецепторах бета-лактамов в бактериальных клетках, например в Streptococcus pneumoniae, получивших название пенициллинсвязывающие белки (PBP) [13–17]. Природная функция PBP ферментная, так как они участвуют в биосинтезе пептидогликанов клеточной стенки бактерии в качестве DD-транспептидаз. Бета-лактамный цикл антибиотика имитирует дипептидную структуру D-Ala–D-Ala в пептидогликанах и за счет этого рецептор-фермент связывает данные лиганды, создавая условия для ключевой стадии их антимикробного действия. В бактериальной клетке при лечении инфицированного животного белок-рецептор выступает в качестве мишени введенного бета-лактамного антибиотика. После связывания лекарственной субстанции его напряженное бета-лактамное кольцо раскрывается и происходит ацилирование остатка серина в активном центре белка, что ингибирует ферментативный процесс формирования клеточной стенки микроорганизма. Образование нековалентного комплекса между PBP и бета-лактамом происходит и в биоаналитической системе, но оно не приводит к химической модификации активного центра рецептора из-за крайне малых концентраций реагентов. Результаты такого лиганд-белкового связывания разные: в системе in vitro происходит высокочувствительная детекция бета-лактама, а in vivo прекращается функционирование рецептора, что вызывает гибель болезнетворной бактерии. Научные исследования механизмов возникновения лекарственной устойчивости к бета-лактамам, обусловленной мутациями в активном центре рецептора и снижением сродства к этим антибиотикам, стимулировали развитие генетической инженерии PBP и появление целого ряда рекомбинантных вариантов, различающихся по аффинитету и специфичности в отношении пенициллинов и цефалоспоринов [18]. Общность механизмов лекарственного действия бета-лактамов и их распознавания в рецепторной системе in vitro позволяет утверждать, что все фармацевтически активные субстанции этого класса антибиотиков должны с той или иной степенью чувствительности детектироваться рецептором. И, наоборот, биоаналитически негативные в этой системе детекции новые бета-лактамные препараты не должны обладать антибактериальной активностью. То есть в принципе рецепторная система может положительно проявлять себя и в скрининге новых бета-лактамов на биологическую (антибактериальную) активность.
К суперсемейству PBP, представители которого специфически связывают и гидролизуют бета-лактамные антибиотики с участием остатка серина в активных центрах, относится и трасмембранный белок BlaR – рецептор бета-лактамных антибиотиков и трансдуктор сигнала в индуцируемом бета-лактамами синтезе бета-лактамазы Bacillus licheniformis [19]. Этот белок состоит из N-концевой внутриклеточной части (BlaR-NTD, остатки 1–345) и С-концевого домена (BlaR-СTD, остатки 346–601), экспонированного вне клетки. Цельный белок включает четыре трансмембранных сегмента и три петли, две из которых расположены в цитоплазме. Сенсорный домен BlaR-СTD выполняет рецепторную функцию и специфически связывает бета-лактам, который затем ацилирует остаток серина в активном центре. Структурные изменения формируют сигнал, передающийся через трансмембранную область в большую петлю BlaR-NTD и вызывающий ее гидролитическое действие, в результате которого инактивируется белок-репрессор, включается транскрипция гена и осуществляется синтез бета-лактамазы.
BlaR-СTD был гетерологически экспрессирован в E. сoli в форме водорастворимого пенициллинсвязывающего белка с молекулярной массой 26 кДа [20]. Более продуктивный штамм E. сoli и трехстадийная методика высокой очистки (99%) рекомбинантного BlaR-СTD в препаративных количествах описаны в работах [21, 22]. Анализ кристаллической структуры BlaR-СTD [22] показал, что его полипептидная цепь свернута в 2 домена с полостью лигандсвязывающего центра между ними. Интересно, что BlaR-СTD и β-лактамаза класса D имеют близкие характеристики фолдинга и схожие топологии лигандсвязывающих сайтов. Однако на основании кинетических параметров реакции активного центра BlaR-СTD с бета-лактамными антибиотиками [21, 22] сделано заключение о том, что эта сенсорная часть BlaR является высокочувствительным PBP, но не β-лактамазой. Интересно, что в экспрессированном и очищенном сенсорном домене BlaR из Staphylococcus aureus химическая модификация бета-лактамом остатка серина в лигандсвязывающем центре активировалась необычным карбоксилированным лизилом, обнаруженном в этом белке [23]. Существенные конформационные изменения, которые развивались в полипептиде от образования комплекса с антибиотиком до завершения реакции ацилирования, считают главным структурным процессом феномена передачи сигнала внутрь клетки [23].
В последнее десятилетие появились публикации об эффективном применении рекомбинантного BlaR-СTD из B. licheniformis дикого и мутантного типов в рецепторноаналитических системах различных форматов, предназначенных для количественного определения широкого спектра бета-лактамных антибиотиков в пищевых продуктах [24–27]. По мере совершенствования методик гетерологической экспрессии этого рецептора и конструкций тест-систем с его применением [24, 26, 27], а также повышения стабильности и аффинитета путем направленного мутагенеза [25, 26] увеличивалась чувствительность детекции бета-лактамов, а групповая специфичность определения расширилась от 15 [24] до 21 [26], а затем до 33 [27] антибиотиков этого класса. В новой по конструкции тест-системе мембранной хроматографии конъюгат бета-лактама иммобилизован на тест-полоске, а в подвижной фазе мутантный BlaR-СTD-M (I188K/S19C/G24C) иммунохимически связан с золотыми наночастицами через адсорбированное на них моноклональное антитело [27].
Таким образом, важными для конструирования биоаналитических систем оказываются не только взаимодействия рецептора с лигандами, но и его реакции как антигена, например, в ходе биоспецифической иммобилизации на твердофазных антителах [11]. BlaR-СTD и другие рекомбинантные рецепторные белки могут частично или полностью терять лигандсвязывающую активность и/или иммунореактивность в процессах экспрессии, очистки, транспортирования, хранения и обработок перед применением.
Цель настоящего исследования − разработка метода количественного определения в культуральных жидкостях, биологических средах и растворах BlaR-СTD, эффективного в качестве базового реагента биоаналитических систем, основанных на рецепции бета-лактамных антибиотиков и взаимодействиях рецептора со специфическими антителами.
Примененный в работе методический подход может быть полезным для мониторинга процессов получения, выделения, хранения и применения также и других важных для практики рекомбинантных рецепторов, например, микробного белка, связывающего тетрациклины [28].
МЕТОДИКА
Реагенты и материалы. В экспериментальной работе использовали: трис, хлорид кальция, бычий сывороточный альбумин, пероксидазу из корней хрена, 30%-ный водный раствор H2O2, 3,3',5,5'-тетраметилбензидин (ТМБ), гуанидингидрохлорид, изопропил-β-D-1-тиогалактопиранозид (ИПТГ), каприловую кислоту, додецилсульфат натрия (ДДС), акриламид, бисакриламид, β-меркаптоэтанол, кумасси синий R 250, консерванты тимеросаль, проклин 300 и 5-бромо-5-нитроo-1,3-диоксан (BND, “Sigma-Aldrich”, США), глицерин, стандарты для электрофореза, колонки Zeba для обессоливания, ферменты XhoI, SmaI, T4 ДНК-лигаза (“Thermo Fisher Scientific”, США), SmАrtTaq-полимеразы (“АртБиоТех”, Беларусь), диметилсульфоксид, мочевину, лактозу (“Applichem”, Германия), хлорид натрия, имидазол, хлорид магния, твин-20, кислоту лимонную моногидрат (“Merck”, Германия), сахарозу (“Riedel-de Haën”, Германия), колонки с Sephadex G-25 (“GE Healthcare”, США). Применявшиеся реактивы отечественных и российских производителей – натрий фосфорнокислый двузамещенный 12-водный, натрий фосфорнокислый однозамещенный 2-водный, NaHCO3, (NH4)2SO4, гидроокись натрия, соляная кислота, серная кислота, глицерин – имели классификацию не ниже “ч. д. а.”. Антитела козы против иммуноглобулинов мыши были получены на Опытном производстве Института биоорганической химии НАН Беларуси. Сухие порошки высокоочищенных антибиотиков пенициллина G и ампициллина приобретены у “Sigma-Aldrich” (США).
Для приготовления растворов использовали деионизированную воду с удельным электрическим сопротивлением 17–18 МОм · см, полученную в модульной системе очистки воды Arium® pro VF фирмы “Sartorius” (Германия).
При проведении рецепторно-ферментного анализа в качестве твердофазных носителей использовали разборные полистирольные микропланшеты с 96 лунками от фирмы “Хема-медика” (Россия). Системы хроматографического анализа на тест-полосках конструировали с применением комплекта мембран из набора MDI Easypack (“Advanced Microdevices”, Индия), использовали нитроцеллюлозную мембрану CNPF с размером пор 10 мм, мембрану для образца GFB-R7L и верхнюю впитывающую мембрану AP045.
Рекомбинантный мутантный белок BlaR-CTD-M был любезно предоставлен проф. Chuanlai Xu (Цзяннаньский университет, КНР).
Спектральные измерения. Спектры поглощения препаратов рецепторного белка и очищенных антител снимали в кювете с длиной оптического пути 1 см на приборе Tecan Infinite 200 (Австрия).
Масс-спектры. Масс-спектры MALDI-TOF регистрировали на приборе Microflex LRF “Bruker” (Германия).
Электрофоретический анализ. Электрофорез продуктов амплификации бактериальной ДНК и продуктов рестрикции плазмидной ДНК проводили в 2 и 0.8%-ных гелях агарозы и визуализировали окрашиванием геля бромистым этидием. При оценке уровня экспрессии рекомбинантного белка, анализе хроматографических фракций и конечного препарата рекомбинантного полипептида, а также препарата очищенных антител электрофоретический анализ проводили в 12 и 15% ПААГ в присутствии ДДС по Лэммли. Для окрашивания белков использовали Кумасси R 250.
Бактериальные штаммы и клеточные линии. Бактериальный штамм Bacillus licheniformis В-80541 был получен из Национального биоресурсного центра Всероссийской коллекции промышленных микроорганизмов НИЦ “Курчатовский институт” (аналог штамма АТСС 14580) и использован как источник ДНК. Для проведения генно-инженерных работ и накопления гибридной плазмидной ДНК использовали штамм E. coli DH5α (“Promega”, США). Для получения рекомбинантного полипептида после индукции ИПТГ применяли штамм E. coli BL21 (DE3).
Выделение ДНК, получение праймеров и проведение ПЦР. Выделение ДНК проводили с помощью набора реагентов “НК-экстра” (Республиканский научно-практический центр эпидемиологии и микробиологии эпидемиологии и микробиологии, Беларусь).
Анализ нуклеотидных последовательностей для выбора и последующего синтеза олигонуклеотидных затравок (праймеров), а также для определения оптимальных условий проведения полимеразной цепной реакции (ПЦР) выполняли с использованием программ “Gene Runner 3.00” и “Vector NTI Advance 9.1”.
Праймеры для амплификации фрагмента ДНК, кодирующего карбокситерминальный пенициллинсвязывающий рецептор, имели следующую нуклеотидную последовательность 5' → 3' – GCCTCGAGTATGCAAAGAGATACGCACTTTTT (BlaR-F) и CGCCCGGGTTATCGGGAAGCGGATGG (BlaR-R) и содержали сайты узнавания рестриктазами, которые необходимы для последующего клонирования фрагментов в экспрессирующий вектор. Олигонуклеотидные последовательности выбранного состава были синтезированы и очищены по заказу в “АртБиоТех” (Беларусь). Постановку ПЦР осуществляли с использованием фермента SmАrtTaq-полимеразы в присутствии хлорида магния. Продукты амплификации анализировали электрофоретически.
Конструирование экспрессирующего вектора. В качестве экспрессирующего вектора использовали плазмиду pJC40, обеспечивающую транскрипцию клонированных генов в бактериальных клетках под контролем Т7-промотора [29]. Особенностью этой плазмиды является наличие дополнительного фрагмента, кодирующего десять остатков гистидина, которые при трансляции локализуются в N-концевой части рекомбинантного полипептида, что позволяет выполнить его очистку металлоаффинной хроматографией.
Рестрикцию вектора и амплифицированных фрагментов проводили с использованием ферментов эндонуклеаз XhoI и SmaI. Для лигирования фрагмента ДНК в исходный вектор pJC40 применяли фермент T4 ДНК-лигаза. Амплифицированные фрагменты ДНК и продукты рестрикции гибридных плазмид анализировали электрофоретически.
Полученной лигазной смесью трансформировали компетентные клетки E. coli штамм DH5α. Трансформацию клеток выполняли в присутствии хлорида кальция. Далее клетки-трансформанты высевали на селективную среду. Селекцию гибридных клонов осуществляли, после высева рассеянных штрихом одиночных колоний клеток-трансформантов (от 5 до 12 клонов) на твердой питательной среде с последующим выделением плазмидной ДНК и ее рестрикционным анализом. Выделение плазмидной ДНК осуществляли с использованием коммерческих наборов QIAprep Miniprep Kit (“Qiagen”, Нидерланды), GeneJET Plasmid Miniprep Kit (“Thermo Fisher Scientific”, США), Fast-n-Easy Plasmid Mini-Prep Kit (“Jena Bioscience”, Германия) в соответствии с рекомендациями производителя.
Индукция синтеза рекомбинантного белка. Индукцию бактериальной культуры E. coli штамм BL21(DE3) проводили с использованием ИПТГ. Единичные колонии клеток E. coli, штамм BL21 (DE3), трансформированные соответствующей гибридной плазмидой, выращивали при 37°С в питательной среде LB при постоянном перемешивании на шейкере до достижения культурой логарифмической фазы роста (D600 = 0.3). Затем вносили в среду ИПТГ в конечной концентрации 0.4 мM и инкубировали в течение 3 ч. Клетки осаждали центрифугированием и ресуспендировали в 0.02 M трис-HCl, pH 7.5, с 0.5 М NaCl. Анализировали бактериальный лизат электрофоретически в 15%-ном ПААГ.
Очистка целевого белка. Очистку рекомбинантного белка проводили методом металлохелатной аффинной хроматографии с использованием сорбента с иммобилизованными катионами Ni2+ (“Sigma-Aldrich”, США) в условиях без применения денатурирующих агентов. Связывание с данным сорбентом происходит за счет 10 остатков гистидина, имеющихся на N-конце полученного рекомбинантного белка.
Для приготовления лизата клетки E. coli осаждали центрифугированием при 2500 g в течение 10 мин. Супернатант удаляли, осадок ресуспендировали в 0.02 М трис-HCl, рН 7.5, содержащем 5 мМ имидазол и 0.5 М NaCl. Далее клеточную суспензию обрабатывали с помощью 5 циклов соникации при 20 кГц в течение 30 с на льду. После обработки ультразвуком клеточные лизаты E. coli центрифугировали при 4000 g в течение 30 мин при +4°С. Супернатант, содержащий растворимые белки, собирали и наносили на колонку со скоростью 15–20 мл/ч. Затем колонку промывали 10 объемами связывающего буфера, содержащего 0.02 М трис-HCl, рН 7.5, содержащий 5 мМ имидазол и 0.5 М NaCl, и далее 10 объемами промывочного буфера, содержащего 0.02 М трис-HCl, рН 7.5, 20 мМ имидазол, 0.5 М NaCl. Элюцию связавшегося рекомбинантного белка проводили буферным раствором, содержащим 0.02 М трис-HCl, рН 7.5, 500 мМ имидазол, 0.5 М NaCl. Дополнительную очистку белка проводили с использованием колонки с гидроксиапатитом (“Bio-Rad”, США).
Полученные в процессе его очистки фракции белка, включая лизат клеток до и после обработки ультразвуком, осадок после УЗ-обработки клеточной суспензии, растворенный в мочевине (конечная концентрация 6 М), хроматографические фракции до и после нанесения на колонку, а также препарат очищенного белка анализировали электрофоретически в 15%-ном ПААГ. Концентрацию целевого активного белка во всех перечисленных фракциях определяли разработанным биоаналитическим методом. Содержание очищенного белка контролировали также спектрофотометрически и по методу Бредфорда.
Получение поликлональных антител к BlaR-CTD и мечение их пероксидазой. Рекомбинантным белком BlaR-CTD из одной и той же охарактеризованной партии иммунизировали мышей линии BALB/c путем многократного подкожного введения с полным адъювантом Фрейнда по 50 мкг BlaR-CTD на одну инъекцию с интервалом в 14 сут. Через 7 дней после каждой повторной инъекции у животных отбирали сыворотку крови и анализировали динамику продукции антител путем детекции поликлональных антител к BlaR-CTD с помощью ИФА. Далее внутрибрюшинно прививали мышам последовательно 0.2 мл пристана, 50 мкг BlaR-CTD и 105–106 клеток карциномы Эрлиха с интервалом в 3–5 сут. Выделение поликлональных антител из полученной асцитической жидкости осуществляли последовательным осаждением альбумина каприловой кислотой и иммуноглобулинов сульфатом аммония. Концентрацию антител определяли спектрофотометрически при 280 нм, используя коэффициент экстинкции 1.35 г–1 · л · см–1.
Конъюгат полученных антител с высокоочищенной (Rz ≥ 3.0) пероксидазой из корней хрена (“Диаэм”, Россия) синтезировали путем окисления углеводных цепей фермента перйодатом натрия, присоединения иммуноглобулина с образованием основания Шиффа и стабилизацией аддукта восстановлением двойной связи борогидридом натрия.
Рецепторно-иммунная система сэндвич-ИФА–BlaR-CTD. В лунках микропланшета иммобилизовали конъюгат ампициллина с альбумином, полученным и охарактеризованным, как описано ранее [17], внесением во все лунки по 100 мкл раствора с концентрацией 0.5 мкг/мл и инкубации при 4–8°С в течение 18 ч. При выборе условий анализа использовали также растворы с концентрацией конъюгата 0.15 и 1.0 мкг/мл. Стабилизацию проводили внесением во все лунки по 150 мкл 0.05 М натрий-фосфатного буфера (НФБ), рН 7.0, содержащего 0.15 М NaCl, 0.05% Твин 20, 1 мг/мл БСА, 2% сахарозы, 0.01% эуксил К-100, и выдерживанием планшета при 4–8°С в течение 18 ч. Стандарты (калибровочные растворы) активного и охарактеризованного BlaR-CTD, готовили в 0.05 М НФБ, рН 7.0, содержащем 0.15 М NaCl, 0.05% Твин 20, 1 мг/мл БСА, 0.01% эуксил К-100 в диапазоне концентраций 0. 5–215 нг/мл. При проведении анализа в лунки вносили по 100 мкл калибровочных растворов с возрастающими концентрациями рецепторного белка или по 100 мкл исследуемых проб, предварительно разведенных тем же буферным раствором, и проводили инкубацию в течение 30 мин при температуре 25°С в термостате. Далее удаляли непрореагировавшие компоненты и промывали планшет с использованием промывочного раствора (0.01 M НФБ, рН 7.0, 0.15 M NaCl, 0.05% Твин 20). На второй стадии вносили в лунки по 100 мкл раствора конъюгата поликлональных антител к BlaR-CTD с пероксидазой с титром 1 : 5000. После инкубации при 25°С в течение 30 мин содержимое лунок удаляли и промывали планшет, как описано выше. В лунки вносили по 100 мкл хромоген-субстратного раствора, содержащего ТМБ и пероксид водорода (0.1 М натрий-цитратный буфер, pH 4.2, 3 мМ H2O2 и 1 мМ TMБ) и инкубировали 15 мин при 20–25°С. Ферментативную реакцию останавливали добавлением в лунки по 100 мкл 5%-ной H2SO4. Измеряли оптическую плотность при 450 нм (D450) с помощью планшетного спектрофотометра Infinity M 200 Tecan (Австрия). Концентрацию активного BlaR-CTD в пробах определяли по калибровочной кривой, построенной в координатах D450 (ось ординат, линейная) и концентрация BlaR-CTD в стандартах (ось абсцисс, логарифмическая), используя аппроксимацию y = a lg(x) + b.
Аналитическую чувствительность (предел обнаружения, минимальную достоверно измеряемую концентрацию) получали из калибровочного графика как абциссу точки (В0 + 2 SD).
Все эксперименты по исследованию лиганд-рецепторного связывания проводили не менее чем в трех повторах. Обработку данных проводили с помощью программы Microsoft Excel. На калибровочных графиках и в таблицах планки погрешностей обозначают среднеквадратичное отклонение (SD).
Исследование стабильности связывающих свойств BlaR-CTD при хранении. Для установления условий сохранения активности BlaR-CTD при его применении в биоаналитических системах готовили пробы рецепторного белка в стабилизирующих буферных растворах, которые содержали либо только консервирующие добавки против бактериального роста, либо дополнительно включали стабилизирующие белковые и небелковые наполнители. Пробы белка разводили в 0.05 М НФБ, рН 7.0, содержащем консерванты – 0.03% проклин 300 и 0.015% BND (буфер № 2), или в 0.05 М НФБ, рН 7.0, содержащем 0.15 М NaCl, 0.05 М твин-20, 1%-ный БСА, 1%-ный декстран 70, 10%-ный глицерин, 0.03%-ный проклин 300, 0.015%-ный BND (буфер № 1), или 0.05 М НФБ, рН 7.0, содержащем 0.1%-ный БСА, 1%-ную лактозу, 0.03%-ный проклин 300, 0.015%-ный BND (буфер № 3) и выполняли анализ.
Белок в указанных буферных растворах № 1 и № 2 выдерживали при температурах 4°С, –20°С или –70°С в течение 1–12 мес. и проводили контроль в периоды 0, 1, 3, 6, 12 мес. Также в качестве контроля применяли препарат лиофилизованного рецепторного белка в буфере № 3. Исследуемые пробы, хранившиеся при –20 и –70°С, готовили в аликвотах и анализировали после однократного размораживания. Количественное определение BlaR-CTD проводили методом сэндвич-ИФА–BlaR-CTD и рассчитывали концентрацию в пробах по калибровочной кривой. Остаточную активность рецепторного белка после хранения определяли как отношение концентраций этого белка в хранившихся и исходных пробах.
Частичная денатурация BlaR-CTD и связывание с лигандом и антителами. Для определения структурно-функциональной стабильности рецептора бета-лактамов проводили анализ его связывания с лигандом и антителами в системе сэндвич-ИФА–BlaR-CTD после воздействия на рецепторный белок факторов, способных нарушать вторичную и третичную структуры. Пробы BlaR-CTD выдерживали в течение 1 ч при температуре 25°С в средах, содержащих мочевину в диапазоне концентраций 1–10 М, гуанидингидрохлорид (1–6 М), ДДС (1–4%), а также в 0.1 М НФБ с рН 6.0 (контроль), 7.0, 8.0 и рН 12.0 или в 0.1 М фосфатно-цитратном буфере с рН 3.0 и 5.0, или в 0.1 М карбонатном буфере с рН 10.0. Кроме того, проводили инкубации в течение 1 ч при температурах 25, 37, 55 и 100°С. Затем разводили пробы в 100 раз инкубационным раствором для нивелирования действия денатурантов и агрессивных сред на связывание рецептора с иммобилизованным ампициллином и растворенными антителами в тест-системе сэндвич-ИФА–BlaR-CTD и выполняли анализ. Для оценки остаточной активности BlaR-CTD (%) средние значения концентрации рецептора в подвергнутых денатурирующим воздействиям пробах относили к среднему значению его концентрации в контрольной пробе.
Рецепторная система для определения бета-лактамов в микропланшетах. В лунках микропланшета иммобилизовали конъюгат ампициллина с альбумином, как описано выше. Калибровочные пробы, содержащие ампициллин, готовили в 0.05 М НФБ, рН 7.0, содержащем 0.15 М NaCl, 0.05% Твин 20, 1 мг/мл БСА, 0.01%-ный эуксил К-100 в диапазоне концентраций 0, 0.025–4 нг/мл. При проведении анализа в лунки вносили по 50 мкл калибровочных растворов или исследуемых проб и по 50 мкл раствора BlaR-CTD и проводили инкубацию в течение 30 мин при 25°С. Далее удаляли непрореагировавшие компоненты и промывали планшет. На второй стадии вносили в лунки по 100 мкл раствора конъюгата поликлональных антител к BlaR-CTD с пероксидазой. Планшет инкубировали 30 мин при 25°С, затем содержимое лунок удаляли и промывали планшет. Далее проводили ферментативное окрашивание и измерение D450, как описано выше. Рассчитывали соотношение Bi/B0 в %, где B0 – оптическая плотность в отсутствие антибиотика в растворе, Bi – оптическая плотность в присутствии возрастающих концентраций антибиотика в растворе. Калибровочные графики зависимости конкурентного связывания от концентраций пенициллина в калибровочных пробах строили в координатах: Bi/B0 в % (ось ординат, линейная) и концентрация в нг/мл (ось абсцисс, логарифмическая). Значение минимальной достоверно измеряемой концентрации получали из калибровочного графика как абциссу точки (В0 – 2SD).
Рецепторная система для определения бета-лактамов на тест-полосках. На нитроцеллюлозную мембрану наносили реагенты с помощью автоматического диспенсера IsoFlow (“ImageneTechnology”, США). Аналитическую зону тест-полоски формировали путем нанесения конъюгата ампициллина из раствора с концентрацией 0.5 мг/мл, а в контрольной зоне иммобилизовали антивидовые антитела (иммуноглобулины козы против иммуноглобулинов мыши) из раствора с концентрацией 0.2 мг/мл. Далее мембраны сушили на воздухе при температуре 20–25°C не менее 20 ч. Затем собирали их в мультимембранный композит вместе с подложкой для исследуемой пробы и впитывающей мембраной. Тест-полоски нарезали шириной 3.5 мм с помощью автоматического гильотинного нарезчика IndexCutter 1 (“A PointTechnologies”, США).
Наночастицы золота получали восстановлением золотохлористоводородной кислоты цитратом натрия по методу Френса, как описано [30]. Функционализацию наночастиц осуществляли путем адсорбции на них поликлональных антител к BlaR-CTD в концентрации 12 мкг/мл, выбранной по фотометрическим данным. Для проведения анализа в лунки инертного пластмассового микропланшета вносили иммобилизованный через антитела на золотых наночастицах BlaR-CTD и добавляли ампициллин в возрастающих концентрациях в диапазоне 0, 0.5–4.0 нг/мл. Далее реагенты выдерживали в течение 3 мин и в лунку помещали подготовленные тест-полоски. Хроматографию проводили в течение 10 мин и визуально регистрировали окрашивание.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работе представлен новый методический подход для мониторинга одновременно лигандсвязывающей активности и иммунореактивности рецептора бета-лактамных антибиотиков в процессах его гетерологической экспрессии, выделения и технологической обработки для применения в аналитических системах. Разработана система рецепторно-иммунного связывания для количественного определения BlaR-CTD с неповрежденными структурами связывающего центра и периферии макромолекулы. Метод исследован в ходе контроля выходов биологически активного белка на стадиях биопродуцирования и очистки, а также при оценке стабильности этого рецептора в различных условиях технологической обработки и хранения как базового реагента тест-систем на бета-лактамные антибиотики.
Принцип метода и характеристика рецепторно-иммунной системы сэндвич-ИФА–BlaR-CTD. Данная система позволяет в одном тесте количественно оценить две независимые биоспецифические реакции BlaR-CTD, включающие его взаимодействия за счет рецепторного сайта и иммунореактивных эпитопов. В ходе анализа рецепторный белок сначала связывается посредством своего активного центра с бета-лактамным антибиотиком, иммобилизованным в составе конъюгата с инертным белком на внутренней поверхности лунки полистирольного микропланшета. Затем экспонированный в раствор иммунореактивный фрагмент структуры связанного рецептора в роли антигена взаимодействует с очищенными поликлональными антителами к BlaR-CTD, конъюгированными с пероксидазой из корней хрена (рис. 1). Альтернативно для детекции BlaR-CTD в его комплексе с твердофазным бета-лактамом могут применяться немеченые первичные антитела с последующим прибавлением пероксидазного конъюгата антивидового иммуноглобулина. По калибровочной кривой, основанной на использовании интактного BlaR-CTD, рассчитывается концентрация активного рецептора в исследуемых пробах. Анализ занимает 1 ч 15 мин.
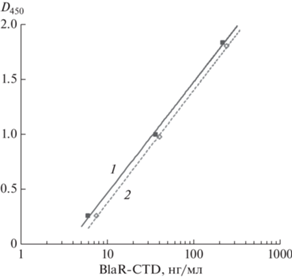
В работе получены все специфические компоненты и разработана конструкция сэндвич-ИФА–BlaR-CTD. Выбраны оптимальные концентрации реагентов для иммобилизации в лунках микропланшета и для взаимодействия в растворе с целью обеспечения наилучших показателей связывания и чувствительности анализа. Показано, что 0.5 мкг/мл является оптимальной концентрацией конъюгата в растворе для иммобилизации на твердой фазе (рис. 2а). Видно, что при увеличении содержания конъюгата на твердой фазе (раствор 1.0 мкг/мл) калибровочный график быстрее выходит на плато и таким образом сужается диапазон определяемых концентраций, соответствующий прямолинейному участку. При уменьшении плотности покрытия лунок конъюгатом ампициллина (раствор 0.15 мкг/мл) наблюдаются низкие значения связывания в единицах оптической плотности. Выбрана также оптимальная концентрация антител к BlaR-CTD на второй стадии анализа (рис. 2б). При увеличении содержания антител наблюдается постепенное увеличение связывания и соотношения значений сигнал/фон для калибровочного графика.
Рис. 2.
Калибровочные графики гетерофазной рецепторно-иммунной системы сэндвич-ИФА–BlaR-CTD при различных концентрациях специфических реагентов. а Твердофазный конъюгат иммобилизован из раствора в концентрациях 1.0 (1), 0.5 (2) и 0.15 мкг/мл (3). б Концентрация антител к BlaR-CTD в анализе – 0.5 (1) и 0.25 (2) мкг/мл.
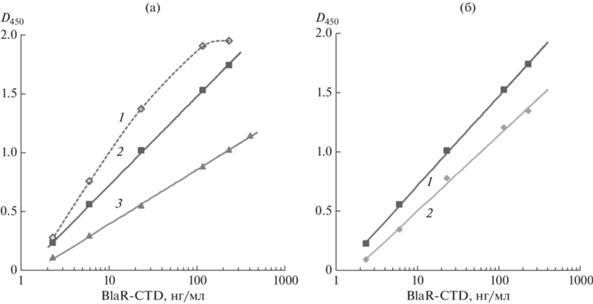
Диапазон достоверно определяемых концентраций активного BlaR-CTD составляет 5–215 нг/мл. Аналитическая чувствительность полностью соответствует назначению системы и составляет 2 нг/мл. Коэффициент вариации результатов определений не превышает 7%. Для обеспечения практического применения разработанной системы экспериментально установлены способы долговременной стабилизации всех ее компонентов. Далее проведена апробация системы сэндвич-ИФА–BlaR-CTD в процессах экспрессии и очистки BlaR-CTD. С ее помощью исследовано влияние температуры и продолжительности хранения, а также различных физико-химических факторов на лигандсвязывающую и антигенную активности рецепторного белка.
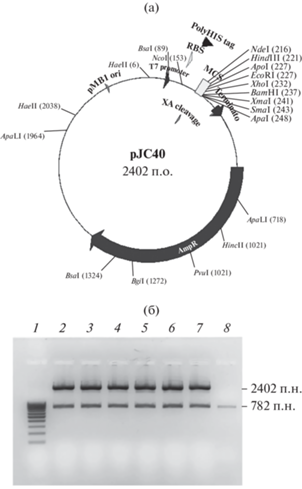
Получение рекомбинантного белка BlaR-CTD. Для биосинтеза рекомбинантного карбокситерминального фрагмента пенициллинсвязывающего рецептора использовали экспрессирующий вектор pJC 40 и бактериальный штамм E. coli BL21 (DE3). Плазмидный вектор pJC 40 широко используется для эффективной и специфической суперэкспрессии клонированных генов под контролем Т7-промотора (рис. 3а). Количество экспрессируемого продукта может составлять до 10% от общего клеточного белка. Вектор содержит гистидиновый участок, который становится частью N-конца экспрессируемого полипептида. Наличие последовательности, кодирующей 10 остатков гистидина, позволяет осуществлять очистку рекомбинантного белка BlaR-CTD аффинной металлохеллатной хроматографией.
Рис. 3.
Схематическая карта плазмидного вектора pJC40 (а) и электорофореграмма продуктов рестрикции рекомбинантной плазмиды pJC40/BlaR-CTD (б): 1 – маркер молекулярных масс; 2–7 – продукты рестрикции плазмидной ДНК по сайтам XhoI и SmaI, выделенной из гибридных клонов клеток DH5α/pJC40/BlaR-CTD; 8 – амплификат, полученный с парой праймеров, ограничивающих область BlaR-CTD.
Для синтеза фрагмента ДНК, кодирующего карбокситерминальный пенициллинсвязывающий рецептор, была подобрана и искусственно синтезирована пара олигонуклеотидов BlaR-F и BlaR-R, ограничивающая фрагмент генома Bacillus licheniformis (GenBank, CP034569) с 1036 по 1800 н.о. В структуру праймеров были дополнительно включены сайты для узнавания специфическими рестриктирующими эндонуклеазами XhoI и SmaI и для дальнейшего встраивания синтезированного фрагмента в клонирующий вектор рJC40.
Предварительно осуществляли накопление бактериальной культуры Bacillus licheniformis В-80541, выделение бактериальной ДНК и постановку ПЦР на полученной ДНК-матрице. В результате был получен специфический фрагмент размером 782 п.о. (рис. 3б, дорожка 8) – полный ампликон, включающий сайты для клонирования. Далее данный фрагмент использовали для клонирования в экспрессирующий вектор pJC40. На рис. 3а представлены схематическая карта экспрессирующего вектора и электрофореграмма рестрикционного анализа плазмидной ДНК pJC40/ BlaR-CTD. Показано, что обработка рестриктазами XhoI и SmaI делит полученную плазмидную ДНК на 2 фрагмента, один из которых аналогичен исходному вектору (2402 п.н.), а второй фрагмент (782 п.н.) содержит специфическую вставку, кодирующую рецептор BlaR-CTD (рис. 3б, дорожки 1–7). Таким образом, в результате генно-инженерных манипуляций получена рекомбинантная плазмидная ДНК pJC40/ BlaR-CTD.
Для экспрессии BlaR-CTD полученной плазмидой трансформировали бактериальную культуру пермиссивных клеток E. coli, штамм BL21 (DE3). Оптимизация процесса получения рекомбинантного рецептора по таким параметрам, как условия подготовки “компетентных” клеток E. coli, количество индуктора в среде и время индукции, температура культивирования, позволила достигнуть высокой продукции белка.
Эффективность экспрессии оценивали по интенсивности соответствующих зон при электрофоретическом анализе (рис. 4). Так, в лизате продуцента (клетки, содержащие соответствующую рекомбинантную плазмиду) наблюдалась экспрессия полипептида и присутствие мажорного белкового продукта с молекулярной массой в области 25 кДа (рис. 4, дорожки 1, 2) в отличие от контрольного лизата клеток E. coli, штамм BL21 (DE3) без плазмиды, где эта полоса отсутствовала (рис. 4, дорожка 5).
Рис. 4.
Электрофоретический анализ фракций биосинтеза и выделения рекомбинантного рецептора BlaR-CTD. 1, 2 – исходный лизат клеток, экспрессирующих рецептор BlaR-CTD; 3, 4, 10 – маркеры молекулярных масс в кДа; 5 – лизат клеток E. coli, штамм BL21, не содержащих экспрессирующий вектор; 6, 7 – бактериальный лизат до и после проведения металлохелатной хроматографии, соответственно; 8 – фракция, полученные при промывке металлоаффинной колонки после связывания целевого белка; 9 – фракция элюции.
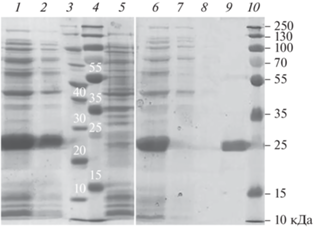
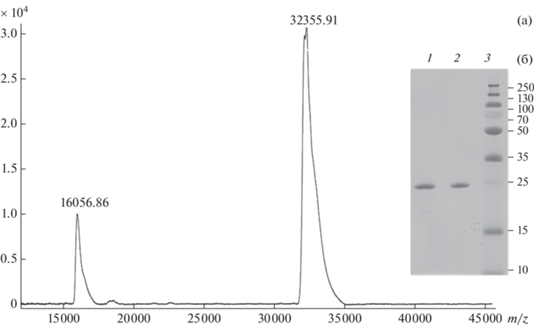
Для получения рекомбинантного рецепторного белка, максимально очищенного от клеточных белков, были использованы металл-хелатная хроматография и последующая хроматография на гидроксиапатите. Обе хроматографии проводили в нативных условиях для сохранения структурно-функциональных свойств BlaR-CTD. Для дезинтеграции целевого белка клеточную суспензию обрабатывали 5 циклами соникации. Электрофоретический анализ фракций (рис. 4) рекомбинантного полипептида показал, что фракция элюции (дорожка 9) содержит белок, соответствующий молекулярной массе 25 кДа, и при этом отсутствуют фоновые клеточные белки. Полученный белок характеризовался повышенной электрофоретической подвижностью, так как теоретически рассчитанная молекулярная масса продуцируемого BlaR-CTD составляет 32.22 кДа. Это подтвердили результаты MALDI-TOF, согласно которым полученный BlaR-CTD имел молекулярную массу 32.32 ± 0.06 кДа (рис. 5а). Дополнительная очистка хроматографией на гидроксиапатите позволила сконцентрировать белок, перевести его в буферный раствор без имидазола и достичь чистоты продукта не менее 95% (риc. 5б).
Рис. 5.
Спектр MALDI-TOF (а) и электрофореграмма (б) очищенного рецепторного белка BlaR-CTD. 1–2 – препарат очищенного BlaR-CTD, 3 – маркер молекулярных масс в кДа.
Этот препарат был охарактеризован далее как основной реагент биоаналитических систем для определения бета-лактамных антибиотиков. Перед этим его использовали для иммунизации лабораторных мышей с целью быстрого получения специфических поликлональных антител против BlaR-CTD.
Определение содержания BlaR-CTD во фракциях при его гетерологической экспрессии и хроматографической очистки. Применение разработанной тест-системы сэндвич-ИФА–BlaR-CTD позволило провести специальное исследование содержания BlaR-CTD во фракциях при его получении в чистом виде.
Во всех исследованных пробах специфическим методом измерялся именно целевой белок (табл. 1). В анализе использовали следующие фракции: супернатант LB среды, исходный лизат клеточной суспензии, лизат клеток после УЗ (супернатант и осадок), элюат металлохелатной хроматографии, фракции с колонки после нанесения образца и после промывки колонки.
Таблица 1.
Характеристика стадий получения рекомбинантного BLaR-CTD
| № п/п |
Фракции, получаемые при выделении и очистке | Содержание BLaR-CTD*, мкг | Степень чистоты, % | Выход BLaR-CTD, % |
|---|---|---|---|---|
| 1 | Супернатант LB среды | 5 ± 1 | – | – |
| 2 | Лизат клеточной суспензии | 2400 ± 50 | 29 ± 1 | – |
| 3 | Лизат клеток после УЗ-обработки, супернатант | 2750 ± 50 | 33 ± 2 | 100.0 |
| 4 | Лизат клеток после УЗ-обработки; осадок, растворенный в 6М мочевине | 300 ± 20 | – | – |
| 5 | Неадсорбированная фракция металл-хелатной хроматографии | 25 ± 5 | – | – |
| 6 | Промывка металлохелатной колонки | 30 ± 5 | – | – |
| 7 | Элюат имидазолом в металл-хелатной хроматографии | 1950 ± 50 | 95 ± 1 | 70.9 |
Известно, что некоторые рекомбинантные белки при экспрессии в гетерологичных системах способны к неспецифической агрегации и формированию “телец включения”. Поэтому мы определяли содержание рецептора в растворимой и нерастворимой фракциях после сонации клеток. При этом для получения растворимого белкового препарата использовали раствор мочевины.
Установлено, что основная фракция наработанного белка находится в клетках (88%), и часть белка присутствует в тельцах включения (12%). При работе с клетками нарабатывается около 2 мг рецепторного белка на 200 мл среды. Измерения BlaR-CTD в различных фракциях с использованием сэндвич-ИФА–BlaR-CTD представлены из расчета на 200 мл среды. В самой LB среде целевой белок практически отсутствовал (табл. 1). В исходном лизате присутствовало 2.4 ± 0.05 мг белка, а после обработки УЗ его содержание составило 2.75 ± 0.05 мг. Выход BlaR-CTD после аффинной хроматографии составлял около 70%. Показано, что во фракциях, собранных после нанесения образца на металл-хелатную колонку, и фракциях, полученных после промывки этой колонки, целевой белок также практически отсутствовал. Таким образом, согласно данным рецепторно-иммунного анализа разработана эффективная схема получения рекомбинантного BlaR-CTD.
Характеристика поликлональных антител к BlaR-CTD. В работе получены антитела к BlaR-CTD и исследованы их иммунохимические свойства в отношении интактного BlaR-CTD и его мутантной формы BlaR-CTD-М (I188K/S19C/G24C), переданной нам из лаборатории, в которой мутантный белок был ранее получен и всесторонне охарактеризован [26, 27]. Установлена способность поликлональных антител идентично выявлять обе формы рецептора бета-лактамов в составе их твердофазных комплексов с ампициллином. Калибровочные графики сэндвич-ИФА–BlaR-CTD с применением в качестве стандартов рецепторных белков дикого и мутантного типов представлены на рис. 6.
Рис. 6.
Взаимодействие BlaR-CTD (1) и его мутантной формы BlaR-CTD-М (2) с твердофазным бета-лактамом и меченными пероксидазой поликлональными антителами к BlaR-CTD в системе сэндвич-ИФА–BlaR-CTD.
Мониторинг активности BlaR-CTD при различных температурно-временных условиях хранения. Для биоаналитического применения полученного рецептора как базового реагента тест-систем контроля содержания остаточных количеств бета-лактамных антибиотиков в пищевой продукции изучена его стабильность при хранении в течение 1–12 мес. при температурах –70, –20°С или 4°С, в различных буферных средах, в том числе со стабилизирующими наполнителями (табл. 2). Показано, что наиболее полно связывающие свойства BlaR-CTD сохраняются при его сублимационной сушке и выдерживании в виде лиофилизованного препарата. Активность BlaR-CTD оставалась прежней или лишь незначительно падала при его хранении в буферных растворах, содержащих белковые наполнители и глицерин, в температурном диапазоне от –70 до 4°С. В случае выдерживания этого белка в буферном растворе без наполнителей оптимальным является замораживание при –70°С, при этом допускается двукратное оттаивание/замораживание. В таких условиях активность BlaR-CTD составляла 95–100%.
Таблица 2.
Активность BLaR-CTD при различных условиях и продолжительности хранения
| № | Условия хранения | Активность, % | ||||
|---|---|---|---|---|---|---|
| Среда | t, °С | 1 мес | 3 мес | 6 мес | 12 мес | |
| 1 | Буфер 1 | 4 | 97 ± 1 | 93 ± 2 | 89 ± 2 | 88 ± 2 |
| 2 | –18 | 100 ± 1 | 99 ± 2 | 99 ± 2 | 96 ± 2 | |
| 3 | –70 | 100 ± 1 | 100 ± 1 | 100 ± 1 | 100 ± 1 | |
| 4 | Буфер 2 | +4 | 84 ± 2 | 81 ± 2 | 80 ± 2 | 81 ± 2 |
| 5 | –18 | 86 ± 3 | 70 ± 3 | 55 ± 3 | 50 ± 3 | |
| 6 | –70 | 91 ± 2 | 89 ± 2 | 88 ± 2 | 88 ± 2 | |
| 7 | Буфер 3 | Лиофилизация | 100 ± 1 | 100 ± 2 | 100 ± 1 | 100 ± 1 |
Стабильность BlaR-CTD при денатурирующих воздействиях. Лигандсвязывающие свойства и иммунореактивность BlaR-CTD могут меняться в агрессивных средах, моделирующих условия технологических обработок в процессах приготовления его реагентных форм. Поэтому перед применением в рецепторно-иммунных тест-системах на антибиотики необходимо оценивать запас структурно-функциональной прочности данного белка. Для этого BlaR-CTD инкубировали в растворах с различными концентрациями денатурирующих агентов или при повышенных температурах. Затем пробы разводили буферным раствором для нивелирования действия денатурантов и при комнатной температуре измеряли в них концентрации биологически активного белка тест-системой сэндвич-ИФА–BlaR-CTD.
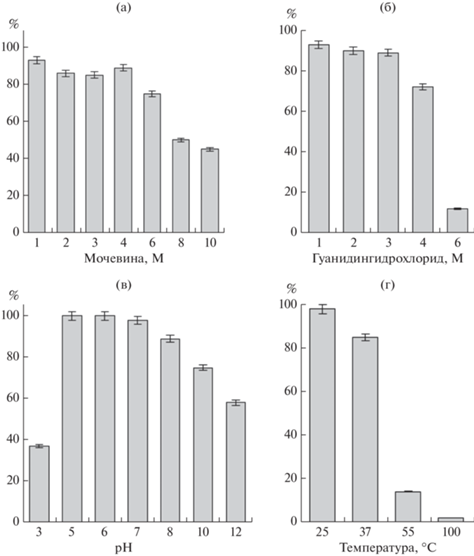
Установлена достаточно высокая устойчивость BlaR-CTD к денатурации. При воздействии хаотропных агентов происходило постепенное, но незначительное снижение связывающих свойств рецепторного белка (рис. 7а, 7б). Так, даже в условиях 6 М мочевины или 4 М гуанидингидрохлорида белок сохранял 72–75% своей лигандсвязывающей активности и иммунореактивности. Даже в присутствии 10 М мочевины не происходило полной денатурации, и остаточная активность белка составила 45%. В то же время после воздействия 6 М гуанидингидрохлорида определялось лишь 12% активного BlaR-CTD. В растворах ДДС с концентрациями 1–4% происходила инактивация 90% присутствующего в пробах рецепторного белка.
Найдено, что в растворах с рН 5–7 максимально сохранялись способности BlaR-CTD взаимодействовать с твердофазным бета-лактамом и растворимыми антителами (рис. 7в). Однако при выдерживании в среде с рН 3 наблюдалось подавление связывающих свойств белка, и подвергнутый такой обработке BlaR-CTD характеризовался остаточной активностью 37%. Увеличение рН среды с 7 до 12 приводило к постепенному уменьшению биоактивности BlaR-CTD до значения 58%.
Анализ стабильности при тепловой обработке в диапазоне 25–100°С показал, что выдерживание при температуре 37°С уже приводило к изменению активности рецепторного белка, а в результате инкубации при 55°С в течение 1 ч его остаточная активность составила только 14% (рис. 7г). Исходя из полученных данных, можно было сделать выводы об оптимальных условиях функционирования BlaR-CTD in vitro. Для сохранения биоактивности рецептора предпочтительным является его применение и хранение в буферных растворах с рН в диапазоне 5–7. При выполнении биоанализа следует проводить инкубации при температуре около 25°С. В процессах выделения, очистки и приготовления реагентных форм BlaR-CTD можно использовать растворы мочевины или гуанидингидрохлорида в соответствующих концентрациях до 6 и 4 М включительно.
Рецепторная тест-система для определения бета-лактамов. Используя BlaR-CTD в качестве основного биореагента, мы разработали систему непрямого рецепторно-иммуноферментного анализа бета-лактамных антибиотиков. Принцип анализа заключается в конкурентном взаимодействии рецептора с бета-лактамом, адсорбированным в лунках микропланшета в составе конъюгата с инертным белком, и свободными бета-лактамами в жидкой фазе. Выявление иммобилизованного комплекса лиганд−рецептор осуществляли посредством специфических антител к BlaR-CTD, меченных пероксидазой. В результате экспериментов по оптимизации условий лиганд−рецепторного взаимодействия (содержание бета-лактамов на твердой и в жидкой фазах, концентрация BlaR-CTD в растворе, рН и ионная сила среды, температура) получены аналитические характеристики системы, которые отражены в калибровочной кривой, представленной на рис. 8а. В калибровочных пробах находился ампициллин в возрастающих концентрациях. Рабочий диапазон анализа составлял 0.05–4.0 нг/мл при IC50 = 0.28 ± ± 0.01 нг/мл (n = 3). Аналитическая чувствительность 0.02 нг/мл в отношении ампициллина превышала показатели, представленные в литературе [8, 15]. Разработанная конструкция может стать прототипом набора реагентов для рецепторно-иммуноферментного анализа бета-лактамов в пищевой продукции животного происхождения.
Рис. 8.
Взаимодействия BLaR-СTD с конъюгатом ампициллина, иммобилизованным в лунках микропланшета (а) или в аналитической зоне тест-полоски (б), при возрастающих концентрациях свободного ампициллина в жидкой фазе в модельных системах рецепторного анализа. (б) Ампициллин в концентрациях 0 (1), 0.5 (2), 1 (3), 2 (4), 4 (5) нг/мл. I и II – аналитическая и контрольная зоны тест-полоски.
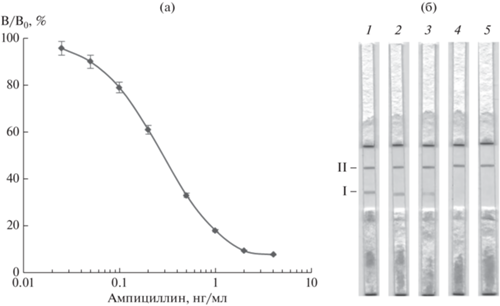
BlaR-CTD в рецепторнохроматографическом анализе бета-лактамов. Тест-системы экспрессного анализа на тест-полосках широко востребованы, благодаря быстроте и простоте выполнения, высокой производительности и возможности проведения анализа вне лаборатории без сложного оборудования. В работе были исследованы лигандсвязывающие свойства и иммунореактивность полученного рецепторного белка BlaR-CTD в конструкции рецепторно-хроматографической тест-системы. В ходе анализа тест-полоска помещалась в коллоидный раствор, содержащий иммобилизованный рецептор и стандартные пробы антибиотика. При движении раствора вдоль полоски к впитывающей верхней мембране происходило взаимодействие твердофазного конъюгата ампициллина с меченным золотом BlaR-CTD в аналитической зоне и связывание в контрольной зоне адсорбированных на мембране антивидовых антител с антителами к BlaR-CTD в составе детектирующего комплекса на золотых наночастицах. Аналитический процесс состоял из одной стадии. Оценка результатов заключалась в визуальном контроле наличия или отсутствия окрашивания в аналитической и контрольной зонах тест-полоски (рис. 8б). Установлено, что порог визуальной детекции ампициллина составлял 1–2 нг/мл, что указывало на пригодность тест-системы для анализа этой ветеринарной субстанции в продуктах питания и позволяло выявлять ампициллин в концентрациях даже ниже значений его максимально допустимого уровня в продуктах питания [5, 6]. Отметим, что найденное значение предела обнаружения лежало также ниже аналогичных значений, представленных в литературе для тест-систем на основе антител и других пенициллинсвязывающих белков [7, 8, 15, 26, 31].
Описанная модельная система рецепторно-хроматографического анализа на бета-лактамы при проведении дальнейших исследований с использованием широкого круга антибиотиков этого класса и различных пищевых матриксов может стать практическим аналитическим средством экспрессного контроля биобезопасности продуктов питания.
Таким образом, в результате работы получен в чистом виде рекомбинатный микробный белок BlaR-CTD, связывающий бета-лактамные антибиотики и взаимодействующий со специфическими антителами в двух форматах тест-систем на бета-лактамы. С помощью разработанной системы рецепторно-иммунного анализа исследована устойчивость его активности к лигандам и антителам в процессах экспрессии, очистки и биоаналитического применения.
Список литературы
Сазыкин И.С., Хмелевцова Л.Е., Селиверстова Е.Ю., Сазыкина М.А. // Прикл. биохимия и микробиология. 2021. Т. 57. № 1. С. 24–35. https://doi.org/10.31857/S0555109921010335
Kantiani L., Farre M., Barcelo D. // Trends Anal. Chem. 2009. V. 28. № 6. P. 729–744. https://doi.org/10.1016/j.trac.2009.04.005P
Dzantiev B.B., Byzova N.A., Urusov A.E., Zherdev A.V. // Trends Anal. Chem. 2014. V. 55. P. 81–93. https://doi.org/10.1016/j.trac.2013.11.007
Ahmed S., Ning J., Peng D., Chen T., Ahmad I., Ali A., Lei Z, Shabbir M.A., Cheng G., Yuan Z. // Food Agric. Immunol. 2020. V. 31. №. 1. P. 268–290. https://doi.org/10.1080/09540105.2019.1707171
Decision of the EEC Board of February 13, 2018 N 28. https://docs.eaeunion.org/docs/ru-ru/01217013/clcd_15022018_28.
European Commission. Commission Regulation (EU) No 37/2010 of 22 December 2009 on Pharmacologically Active Substances and their Classification Regarding Maximum Residue Limits in Foodstuffs of Animal Origin. // Official Journal of the European Union. 2010. L 15/10. https://ec.europa.eu/health/sites/health/files/-files/eudralex/vol-5/reg_2010_37/reg_2010_37_en.pdf.
Strasser A., Usleber E., Schneider E., Dietrich R., Bürk C., Märtlbauer E. // Food Agric. Immunol. 2003. V. 15. № 2. P. 135–143. https://doi.org/10.1080/09540100400003493
Cliquet P., Goddeeris B.M., Okerman L., Cox E. // Food Agric. Immunol. 2007. V. 18. № 3–4. P. 237–252. https://doi.org/10.1080/09540100701802908
Bremus A., Dietrich R., Dettmar L., Usleber E., Märtlbauer E. // Anal. Bioanal. Chem. 2012. V. 403. № 2. P. 503–515. https://doi.org/10.1007/s00216-012-5750-z
Jiao S.N., Wang P., Zhao G.X., Zhang H.C., Liu J., Wang J.P. // J. Environ. Sci. Health. B. 2013. V. 48. № 6. P. 486–494. https://doi.org/10.1080/03601234.2013.761908
Kuprienko O.S., Serchenya T.S., Vashkevich I.I., Harbachova I.V., Zilberman A.I., Sviridov O.V. // Russ. J. Bioorg. Chem. 2022. V. 48. № 1. P. 105–114. https://doi.org/10.1134/S106816202201006X
Chambers S.J., Wyatt G.M., Morgan M.R. // Anal Biochem. 2001. V. 288. № 2. P. 149–155. https://doi.org/10.1006/abio.2000.4883
Macheboeuf P., Contreras-Martel C., Job V., Dideberg O., Dessen A. // FEMS Microbiol. Rev. 2006. V. 30. № 5. P. 673–691. https://doi.org/10.1111/j.1574-6976.2006.00024.x
Sauvage E., Kerff F., Terrak M., Ayala J.A., Charlier P. // FEMS Microbiol. Rev. 2008. V. 32. № 3. P. 234–258. https://doi.org/10.1111/j.1574-6976.2008.00105.x
Zeng K., Zhang J., Wang Y., Wang Z.H., Zhang S.X., Wu C.M., Shen J.Z. // Biomed. Environ. Sci. 2013. V. 26. № 2. P. 100–109. https://doi.org/10.3967/0895-3988.2013.02.004
Chen Y., Wang Y., Liu L., Wu X., Xu L., Kuang H., Li A., Xu C. // Nanoscale. 2015. V. 7. № 39. P. 16381–16388. https://doi.org/10.1039/c5nr04987c
Serchenya T.S., Harbachova I.V., Sviridov O.V. // Russ. J. Bioorg. Chem. 2022. V. 48. № 1. P. 85–95. https://doi.org/10.1134/S1068162022010125
Moon T.M., D’Andréa E.D., Lee C.W., Soares A., Jakoncic J., Desbonnet C. et al. // J. Biol. Chem. 2018. V. 293. № 48. P. 18574–18584. https://doi.org/10.1074/jbc.RA118.006052
Zhu Y.F., Curran I.H., Joris B., Ghuysen J.M., Lampen J.O. // J. Bacteriol. 1990. V. 172. № 2. P. 1137–1141. https://doi.org/10.1128/jb.172.2.1137-1141.1990
Joris B., Ledent P., Kobayashi T., Lampen J.O., Ghuysen J.M. // FEMS Microbiology Letters. 1990. V. 70. № 1. P. 107–113. https://doi.org/10.1016/0378-1097(90)90111-3
Duval V., Swinnen M., Lepage S., Brans A., Granier B., Franssen C., Frère J.-M., Joris B. // Mol. Microbiol. 2003. V. 48. № 6. P. 1553–1564. https://doi.org/10.1046/j.1365-2958.2003.03520.x
Kerff F., Charlier P., Colombo M.-L., Sauvage E., Brans A., Frère J.-M., Joris B., Fonzè E. // Biochemistry. 2003. V. 42. № 44. P. 12835–12843. https://doi.org/10.1021/bi034976a
Golemi-Kotra D., Cha J.Y., Meroueh S.O., Vakulenko S.B., Mobashery S. // J. Biol. Chem. 2003. V. 278. № 20. P. 18419–18425. https://doi.org/10.1074/jbc.M300611200
Peng J., Cheng G., Huang L., Wang Y., Hao H., Peng D., Liu Z., Yuan Z. // Anal. Bioanal. Chem. 2013. V. 405. № 27. P. 8925–8933. https://doi.org/10.1007/s00216-013-7311-5
Ning J., Ahmed S., Cheng G., Chen T., Wang Y., Peng D., Yuan Z. // J. Biological Engineering. 2019. V. 13. № 1. P. 27–43. https://doi.org/10.1186/s13036-019-0157-4
Lia Y., Xua X., Liua L., Kuanga H., Xua L., Xu C. // Analyst. 2020. V. 145. № 9. P. 3257–3265. https://doi.org/10.1039/d0an00421a
Li Y., Liu L., Xu C., Kuang H., Sun L. // Sci. China Mater. 2021. V. 64. № 8. P. 2056–2066. https://doi.org/10.1007/s40843-020-1578-0
Wang G., Zhang H.C., Liu J., Wang J.P. // Anal. Biochem. 2019. V. 564–565. P. 40–46. https://doi.org/10.1016/j.ab.2018.10.017
Clos J., Brandau S. // Protein Expr. Purif. 1994. V. 5. № 2. P. 133–137. https://doi.org/10.1006/prep.1994.1020
Frens G. // Nature Physical Science. 1973. V. 241. № 105. P. 20–22. https://doi.org/10.1038/physci241020a0
Byzova N.A., Zvereva E.A., Zherdev A.V., Dzantiev B.B. // Appl. Biochem. Microbiol. 2011. V. 47. № 6. P. 627–634. https://doi.org/10.1134/S0003683811060032
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология