Прикладная биохимия и микробиология, 2023, T. 59, № 1, стр. 74-80
Новый метод экспресс-детекции антибиотикорезистентности
С. Н. Плескова 1, 2, *, Е. В. Лазаренко 1, 2, И. С. Судакова 2, Р. Н Крюков 1, Н. А. Безруков 1, 2
1 Нижегородский государственный университет им. Н.И. Лобачевского,
Министерство науки и высшего образования
603950 Нижний Новгород, Россия
2 Нижегородский государственный технический университет им. Р.Е. Алексеева,
Министерство науки и высшего образования
603115 Нижний Новгород, Россия
* E-mail: pleskova@mail.ru
Поступила в редакцию 20.05.2022
После доработки 19.07.2022
Принята к публикации 02.09.2022
- EDN: CVOIPK
- DOI: 10.31857/S0555109923010075
Аннотация
В работе использовался режим осцилляции атомно-силового микроскопа (АСМ) для создания системы высокочувствительной детекции антибиотикорезистентности в режиме реального времени. Такой режим позволяет оценить чувствительность или резистентность грамотрицательных (Escherichia coli) и грамположительных (Staphylococcus aureus) бактерий к антибиотику за 15–30 мин. В основе аналитического сигнала (изменения амплитудно-частотных характеристик кантилевера) лежит метаболическая активность бактерий. Бактерии, высаженные на кантилевер, вызывали его колебания с высокой амплитудой. В случае если бактерии чувствительны к антибиотику, амплитуда статистически значимо падала в течение 15–30 мин, если бактерии резистентны, то амплитуда либо не изменялась, либо увеличивалась. Полученные результаты сопоставимы с диско-диффузионным методом.
Устойчивость к антибиотикам является естественным свойством микроорганизмов в различных экосистемах [1]. Однако “экологический прессинг” вызвал ускоренное распространение генов резистентности среди нозокомиальных штаммов. За более чем 70 лет с момента начала производства были синтезированы мегатонны антибиотиков и серьезной проблемой стало широкое их использование для самых разных целей [2]. В настоящее время некоторые эксперты предупреждают о возвращении к доантибиотической эпохе. Эти опасения связаны с тем, что открыто уже более 20 000 потенциальных генов резистентности к антибиотикам [3]. Наряду с разработкой и внедрением новых классов антибиотиков и контролем за их рациональным использованием должны разрабатываться методы экспресс-тестирования антибиотикорезистентности, которые обеспечат клиницистов информацией, необходимой для своевременного назначения оптимальной и эффективной терапии и ее коррекции у тяжелых больных с такими заболеваниями как сепсис, тяжелая пневмония, бактериальный эндокардит, перитонит, менингит и др., при которых ошибка в выборе антибактериальной тактики приводит к гибели или инвалидизации пациента. Диско-диффузионный метод считается золотым стандартом подбора антибиотиков и антимикотиков для этиотропной терапии [5, 6], поскольку имеет целый ряд преимуществ: простота, низкая стоимость, возможность тестировать большое количество микроорганизмов и антимикробных агентов, простота интерпретации полученных результатов. Однако можно отметить и существенные недостатки, поскольку ингибирование роста бактерий не означает их гибель. Кроме того, этот метод не дает информации о бактерицидном или бактериостатическом действии, не подходит для определения минимальной ингибирующей концентрации (МИК), так как невозможно количественно определить количество противомикробного агента, диффундировавшего в среду [7]. Но самым существенным недостатком диско-диффузионного метода является время его выполнения: для получения антибиотикограммы требуется не менее суток, за это время пациенту назначается эмпирическая антибиотикотерапия, что способствует формированию антибиотикорезистентности у микроорганизмов.
В 2015 г. группа С. Казаса [8] сформулировала идею о том, что можно высаживать бактерии на поверхность кантилевера атомно-силового микроскопа (АСМ), который до этого использовался исключительно для исследования морфологии и ригидности живых клеток с высоким разрешением. Бактерии, прикрепленные к кантилеверу АСМ, вызывают колебания, которые напрямую коррелируют с жизнеспособностью микроорганизма. Позднее на основе этого была разработана система быстрой и эффективной детекции антибиотикорезистентности [9]. Эта система позволяла в отличие от диско-диффузионного метода выдавать результат о чувствительности или резистентности бактерий уже через 1–2 ч. В работе [10] были разработаны и апробированы: оптимальные кантилеверы для исследования жизнеспособности бактерий, методы фиксации бактерий на кантилевере, методы детекции различий в колебаниях кантилевера между живыми бактериями и бактериями подвергнутыми воздействию антибиотика с бактерицидной активностью, различия в колебаниях кантилеверов для одного и того же штамма бактерий при его пребывании в системе с антибиотиком, к которому он был чувствителен и в системе с антибиотиком, к которому он был резистентен.
Цель работы – исследование чувствительности/резистентности к антибиотикам грамотрицательных Escherichia coli 321 и грамположительных – Staphylococcus aureus 2879M бактерий с помощью нового метода экспресс-диагностики антибиотикорезистентности, исследование динамики метаболической активности бактерий и сопоставление данных по антибиотикорезистентности, полученные в режиме осцилляции атомно-силового микроскопа с классическим диско-диффузионным тестом.
МЕТОДИКА
Получение бактериальной суспензии. Штаммы E. coli 321 и S. aureus 2879M были взяты из коллекции культур микроорганизмов Научно-образовательного центра “Физика твердотельных наноструктур” ННГУ им. Н.И. Лобачевского. Культуры выращивали на LB бульоне (“Invitrogen”, США) при 37°С 18 ч, после чего их трижды отмывали LB бульоном, центрифугировали при 450 g 5 мин и стандартизовали до концентрации 109 кл/мл на спектрофотометре СПЕКС-ССП (“Спектроскопические системы”, Россия) при λ = 670 нм, что соответствовало 10 МЕ по стандарту МакФарланда.
Диско-диффузионный метод. На чашки Петри со стерильно разлитым ГМФ-агаром (ферментированный гидролизат говяжьего мяса, Научно-исследовательский центр фармакотерапии, Россия) наносили 100 мкл бактериальной суспензии (109 кл/мл) и равномерно распределяли ее шпателем по поверхности агара. Не позднее чем через 15 мин после инокуляции на поверхность питательной среды по центру чашки Петри наносили квадраты фильтровальной бумаги, пропитанной антибиотиком. Аппликацию проводили стерильным пинцетом, после чего чашки Петри немедленно помещали в термостат на 24 ч при 37°С. Результат учитывали на следующий день на матовой поверхности в отраженном свете. Диаметр зон задержки роста измеряли с точностью до 1 мм. При проведении диско-диффузионного метода и учете его результатов использовали рекомендации МУК 4.2.1890–04.
Предобработка кантилевера для фиксации бактерий. Нитрид-кремниевый кантилевер А-MLCT (f0 – 22 кГц, k – 0.07 Н/м, “Bruker”, США) функционализировали 0.01%-ным поли-L-лизином (“Merck”, США) при 24°С в течение 10 мин, а затем трехкратно аккуратно отмывали дистиллированной водой. Кантилеверы подсушивали при 24°С 5 мин, после чего на них наносили суспензию бактерий и инкубировали при 37°С 30 мин.
Исследование жизнеспособности бактерий в режиме осциляции атомно-силового микроскопа. Подробно метод и подбор режимов исследования описаны в работе [10]. Коротко: кантилевер с нанесенной на него суспензией бактерий устанавливали в держатель АСМ-микроскопа NTegra (“NT-MDT”, Россия) и погружали в аналитическую камеру с 5 мл LB-бульона. Для контроля использовали кантилевер, покрытый поли-L-лизином, без бактерий.
Устанавливали лазер в центр четырехсекционного фотодиода, переводили микроскоп в режим регистрации осцилляций (Nova, версия Px.3.4.0 rev 17188, режим Oscilloscope) и снимали аналитический сигнал DFL (разностный сигнал между верхним и нижним участками фотодиода – difference signal between top and bottom halves of the photodiode). Нановибрации в контроле и в опыте с бактериями снимали в течение 60 мин.
Исследование чувствительности/резистентности к антибиотику. После снятия аналитического сигнала DFL для характеристики колебаний живых бактерий из аналитической камеры отбирали 2 мл LB-бульона и вносили 2 мл антибиотика (конечная концентрация 16 мг/мл) 4%-ного раствора гентамицина сульфата (“Микроген”, Россия) для исследования чувствительности/резистентности штамма E. coli 321, либо 2 мл 1%-ного раствора (конечная концентрация 40 мг/мл) цефтриаксона (“Биосинтез ПАО”, Россия) для исследования чувствительности/резистентности штамма S.aureus 2879M.
Кантилевер с бактериями опускали в раствор гентамицина либо цефтриаксона, инкубировали при 24°С 60 мин, после чего переводили микроскоп в режим регистрации сигнала DFL. Были отобраны два антибиотика, к одному из которых штаммы E. coli 321 и S. aureus 2879M были чувствительны, а к другому – резистентны. Цефтриаксон оказался единственным из протестированных антибиотиков, к которому были резистентны оба штамма, поэтому он был выбран в качестве антибиотика, к которому S. aureus 2879M резистентен. Выбор гентамицина среди антибиотиков, к которым оба штамма чувствительны, обусловлен несколькими факторами: гентамицин – антибиотик широкого спектра действия, который активно применяется в клинической практике, для него характерна средняя зона отсутствия роста, что позволяет одновременно оценить насколько чувствителен новый метод, физико-химические свойства гентамицина, поскольку плотность гентамицина ближе всего к плотности забуференного физиологического раствора, который в серии предварительных экспериментов использовался в качестве отрицательного контроля.
Обработка полученных результатов. Полученный массив данных обрабатывали в программе Origin Pro 8 SR4 v8.0951. С помощью Фурье-фильтра из аналитического сигнала удаляли колебания с частотами ниже 1 Гц (колебания электросети и другие внешние колебания). Согласно работе [11] частоты колебаний, характеризующие метаболическую активность бактерий, лежат в диапазоне 1.6–5 Гц. Производили определение квадрата стандартного отклонения (вариансы) в каждом из опытов для характеристики амплитуды сигнала кантилевера. При анализе данных для учета вариаций характеристик кантилевера и различий в количестве фиксированных бактерий производили нормировку данных, путем принятия за единицу сигнала DFL от кантилевера с бактериями с последующим принятием за нуль сигнала DFL от кантилевера, функционализированного только поли-L-лизином.
Контроль жизнеспособности бактерий после эксперимента. После проведения основного эксперимента по исследованию чувствительности/ резистентности бактерий аккуратно производили смыв с поверхности кантилевера, затем суспензию бактерий в количестве 100 мкл наносили на чашки Петри со стерильно разлитым ГМФ-агаром, немедленно равномерно распределяя ее шпателем по поверхности агара. После экспозиции чашек Петри при 37°С в течение 24 ч учитывали результат на матовой поверхности в отраженном свете, подсчитывая количество колониеобразующих единиц (КОЕ).
Статистическая обработка. Статистическую обработку проводили в программе Origin Pro 8 SR4 v8.0951 (“Origin Lab Corparation”, США). Определяли границы нормального распределения количественных показателей выборок с использованием критерия Шапиро-Уилка. Поскольку распределения не соответствовали критериям нормальности, определяли медиану и 25-й процентиль. Для сравнения двух выборок использовали непараметрический критерий Вилкоксона.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследовали штамм грамположительных S. aureus 2879M бактерий, которые не имели жгутиков и, соответственно, собственной двигательной активности и грамотрицательных E. coli 321 бактерий, которые характеризовались перетрихальным жгутикованием и высокой двигательной активностью, для того, чтобы доказать, что колебания кантилевера обусловлены метаболической активностью микроорганизмов, а не связаны исключительно с двигательной активностью бактерий [12]. Эти виды микроорганизмов наиболее часто выделяются у пациентов в клинической практике. В частности, S. aureus является одним из ведущих возбудителей нозокомиальных инфекций хирургических стационаров и родильных домов [13], а E. coli вызывает до 90% инфекций мочеполовой системы [14].
Предварительно с использованием диско-диффузионного метода была исследована чувствительность/резистентность штаммов E. coli 321 и S. aureus 2879M к целому ряду антибиотиков. Результаты диско-диффузионного метода суммированы в табл. 1.
Таблица 1.
Результаты диско-диффузионного теста по определению чувствительности/резистентности бактерий к антибиотикам
| Антибиотик | Концентрация, мг/мл | Чувствительность (ч)/ резистентность (р) | Зона отсутствия роста, мм |
|---|---|---|---|
| E. coli 321 | |||
| Бициллин-3 | 36 | р | – |
| Гентамицин | 40 | ч | 10 |
| Ванкомицин | 100 | ч | 10 |
| Метрогил | 5 | ч | 8 |
| Рифампицин | 20 | р | – |
| Амоксициллин | 50 | р | – |
| Ампициллин | 5 | ч | 13 |
| Цефазолин | 250 | ч | 10 |
| Клиндамицин | 150 | ч | 10 |
| Линкомицин | 300 | ч | 11 |
| Цефтриаксон | 285 | р | – |
| S. aureus 2879M | |||
| Бициллин-3 | 36 | ч | 13 |
| Гентамицин | 40 | ч | 11 |
| Метрогил | 5 | ч | 14 |
| Цефтриаксон | 285 | р | – |
| Амоксициллин | 50 | ч | 10 |
| Цефазолин | 250 | ч | 19 |
| Клиндамицин | 150 | ч | 13 |
| Линкомицин | 300 | ч | 18 |
Из спектра исследованных антибиотиков отобрали два для апробации метода экспресс-диагностики: гентамицин, к которому чувствителен штамм E. coli 321 и цефтриаксон, к которому резистентен штамм S. aureus 2879M.
На рис. 1 и 2 контроль – собственные колебания кантилевера атомно-силового микроскопа, функционализированного поли-L-лизином. В режиме осцилляции на верхнюю часть зонда, который выступает в качестве зеркала, падает лазер, который отражается от зонда в центр четырехсекционного фотодиода. Перемещения сигнала отраженного лазера на фотодиоде (аналитический сигнал DFL) характеризуют колебания зонда. Они зависят от амлитудно-частотных характеристик (АЧХ) зонда, поэтому важно снимать контрольный сигнал.
Рис. 1.
Амплитудно-частотные характеристики кантилевера при измерении колебаний в режиме осцилляции (представлены результаты одного в серии из 4 воспроизводимых экспериментов): 1 – колебания пустого кантилевера, функционализированного поли-L-лизином; 2 – колебания кантилевера, с фиксированным на нем E. coli 321; 3, 4, 5 – колебания кантилевера через 15, 30 и 45 мин соответственно после добавления в систему с E. coli 321 гентамицина сульфата в конечной концентрации 16 мг/м. N – нормированная амплитуда колебаний кантилевера. Нормировка произведена путем деления регистрируемого сигнала на суммарный сигнал.
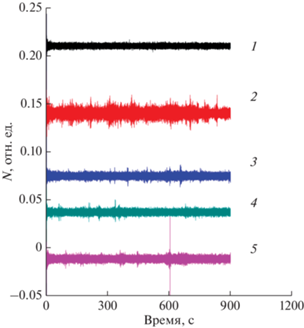
Рис. 2.
Амплитудно-частотные характеристики кантилевера при измерении колебаний кантилевера в режиме осцилляции (представлены результаты одного в серии из 4 воспроизводимых экспериментов): 1 – колебания пустого кантилевера, функционализированного поли-L-лизином; 2 – колебания кантилевера, с фиксированным на нем S.aureus 2879M; 3, 4, 5 – колебания кантилевера через 15, 30 и 45 мин соответственно после внесения в систему с S.aureus 2879M цефтриаксона в конечной концентрации 40 мг/мл. N – нормированная амплитуда колебаний кантилевера. Нормировка произведена путем деления регистрируемого сигнала на суммарный сигнал.
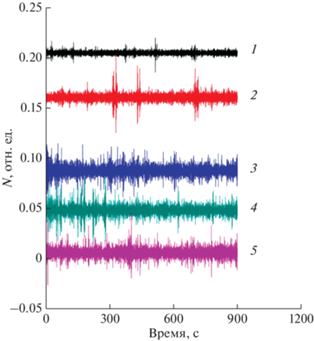
На рис. 1 и 2 (кривые 2) представлены колебания кантилевера с фиксированными на нем бактериями, видно, что бактерии существенно увеличивают осцилляцию кантилевера. Следует отметить, что для E. coli 321 осцилляция увеличивалась значительнее, чем для S. aureus 2879M, но оба штамма вызывали статистически значимое увеличение аналитического сигнала DFL по сравнению с контролем. Таким образом, усиление осцилляции нельзя объяснить исключительно двигательной активностью бактерий, имеющих жгутики. Вероятнее всего нанодвижения бактерий обусловлены их собственной метаболической активностью. Исследованиями Вилларта с соавт. [15] было показано, что нанодвижения дрожжевых клеток существенно замедляются, если вместо полноценной питательной среды, необходимой для метаболизма клеток, использовать фосфатный буфер.
На рис. 1 (кривые 3–5) показывают, что аналитический сигнал DFL статистически значимо падал после 15, 30 и 45 мин пребывания E. coli 321 в системе с гентамицином. В этом случае характер аналитического сигнала практически соответствовал нановибрациям кантилевера без бактерий, функционализированного 0.01% поли-L-лизином. Таким образом, новый метод экспресс-диагностики антибиотикорезистентности оказался настолько быстрым и высокочувствительным, что давал ответ о чувствительности бактерий к антибиотику уже через 15 мин, а не через 18–24 ч, как диско-диффузионный метод.
На рис. 2 (кривые 3–5) кривые показывают, что аналитический сигнал DFL возрастает в случае пребывания S. aureus 2879M в системе с антибиотиком цефтриаксоном, к которому по результатам диско-диффузионного теста штамм резистентен. Хотя статистически значимых различий между вариансами (квадратами стандартных отклонений), характеризующими изменения АЧХ кантилевера во всем спектре записи нановибраций не обнаружено, идет существенное усиление аналитического сигнала. Поскольку идет увеличение метаболической активности бактерий, можно предположить, что происходила активация синтеза и работы ферментных систем золотистого стафилококка, вызывающих модификацию или деструкцию молекул антибиотика, либо активация насосов, обеспечивающих эффлюкс антибиотика из бактериальной клетки. Учитывая временной отрезок в 15 мин и интенсивность реакции бактерий, эти два механизма наиболее вероятны, менее вероятно подключение и других механизмов: модификация мишени и глобальной адаптации клетки [16]. Для доказательства жизнеспособности S. aureus после исследования в среде с антибиотиком производился высев смыва с кантилевера с последующим подсчетом КОЕ. Результаты 5 экспериментов показали, что среднее число КОЕ 649.0 ± 250.1. Таким образом, было подтверждено, что бактерии резистентны к цефтриаксону, и выживали после проведения эксперимента.
Исследование динамики метаболической активности E. coli 321 после пребывания в системе с гентамицином, антибиотиком, к которому данный штамм был чувствителен и S. aureus 2879M в системе с цефтриаксоном, антибиотиком, к которому данный штамм был резистентен, представлены на рис. 3.
Рис. 3.
Динамика исследования резистентности/чувствительности штамма E. coli 321 к гентамицина сульфату 16 мг/мл (а) и S. aureus 2879M к цефтриаксону 40 мг/мл (б). D2 – нормированная дисперсия (варианса) амплитуды колебаний кантилевера. *Различия статистически значимы (р < 0.05)
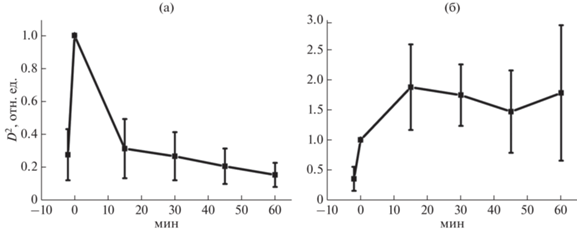
Первая точка обоих графиков соответствует “нулевому” значению, то есть собственным колебаниям функционализированного кантилевера в контроле, вторая точка получена при осцилляции кантилевера с фиксированными на нем бактериями без внесения антибиотиков. На эту точку произведено нормирование всех серий экспериментов. Необходимость нормировки обусловлена наличием вариабельности отражающей способности покрытия разных партий кантилеверов и незначительной вариабельностью в количестве бактерий, фиксируемых на поверхности кантилевера. Последующие точки – средние значения варианс аплитуд нановибраций кантилевера через 15, 30, 45 и 60 мин после добавления в аналитическую камеру антибиотика соответственно. Очевидно, что уже через 15 мин после внесения антибиотика для этих двух исследуемых штаммов можно дать ответ о чувствительности/резистентности к антибиотику и этот ответ будет коррелировать с данными диско-диффузионного теста. Для надежности результатов можно увеличить время наблюдения до 30 мин.
Таким образом, разработан принципиально новый метод экспресс-диагностики антибиотикорезистентности грамотрицательных и грамположительных микроорганизмов, который позволяет с высокой скоростью и чувствительностью дать ответ о резистентности штаммов к антибиотикам и корректировать антибиотикотерапию.
Работа выполнена в рамках программы стратегического академического лидерства “Приоритет-2030” Нижегородского государственного университета им. Н.И. Лобачевского при поддержке Российского научного фонда, № проекта 22-14-20001.
Список литературы
Crofts T.S., Gasparrini A.J., Dantas G. // Nat. Rev. Microbiol. 2017. V. 15. P. 422–434.
Davies J., Davies D. // Microbiol. Mol. 2010. V. 74. № 3. P. 417–433.
Liu B., Pop M. // Nucleic Acids Res. 2009. V. 37. № 1. P. 443–447.
Nathwani D., Varghese D., Stephens J., Ansari W., Martin S., Charbonneau C. // Antimicrob. Resist. Infect. Control. 2019. V. 8. № 35. https://doi.org/10.1186/s13756-019-0471-0
CLSI, Performance Standards for Antimicrobial Disk Susceptibility Tests, Approved Standard / Ed. 7, CLSI document M02-A11. Clinical and Laboratory Standards Institute, 2012.
CLSI, Method for Antifungal Disk Diffusion Susceptibility Testing of Yeasts, Approved Guideline. / Ed. 2, CLSI document M44-A. Clinical and Laboratory Standards Institute, 2004.
Balouiri M., Sadiki M., Ibnsouda S.K. // J. Pharm. Anal. 2016. V. 6. № 2. P. 71–79.
Kasas S., Ruggeri F.S., Benadiba C., Maillard C., Stupar P., Tournu H. et al. // Proc. Natl. Acad. Sci. 2015. V. 112. № 2. P. 378–381.
Venturelli L., Kohler A.C., Stupar P., Villalba M.I., Kalauzi A., Radotic K. et al. // J. Mol. Recognit. 2020. V. 33. № 12. P. 1–14.
Pleskova S.N., Fomichev O.I., Kriukov R.N, Sudakova I.S. // Biophysics. 2021. V. 66. № 6. P. 950–955.
Villalba M.I., Stupar P., Chomicki W., Bertacchi M., Dietler G., Arnal L. et al. // Small. 2018. V. 14. № 4. 1702671. https://doi.org/10.1002/smll.201702671
Kasas S., Malovichko A., Villalba M.I., Vela M.E., Yantorno O., Willaert R.G. // Antibiotics. 2021. V. 10. № 3. 287. https://doi.org/10.3390/antibiotics10030287
Pal S., Sayana A., Joshi A., Juyal D. // J. Family Med. Prim. Care. 2019. V. 8. № 11. P. 3600–3606.
Lee D.S., Lee S.J., Choe H.S. // Biomed. Res. Int. 2018. V. 26. 7656752. https://doi.org/10.1155/2018/7656752
Willaert R.G., Vanden Boer P., Malovichko A., Alioscha-Perez M., Radotic K., Bartolic D. et al. // Sci. Adv. 2020. V. 6. № 26. eaba3139. https://doi.org/10.1126/sciadv.aba3139
Munita J.M., Cesar A. // Microbiol. Spectr. 2016. V. 4. № 2. 1128. https://doi.org/10.1128/microbiolspec.VMBF-0016-2015
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


