Прикладная биохимия и микробиология, 2023, T. 59, № 1, стр. 96-102
Разработка поляризационного флуоресцентного иммуноанализа сульфатиазола и его применение для тестирования меда
И. С. Нестеренко 1, О. Д. Гендриксон 2, Н. И. Смирнова 2, С. А. Еремин 3, Д. В. Сотников 2, *
1 Всероссийский государственный центр качества и стандартизации лекарственных средств
для животных и кормов
123022 Москва, Россия
2 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова, химический факультет
119991 Москва, Россия
* E-mail: sotnikov-d-i@mail.ru
Поступила в редакцию 15.05.2022
После доработки 15.08.2022
Принята к публикации 02.09.2022
- EDN: CUSONF
- DOI: 10.31857/S0555109923010051
Аннотация
Разработан поляризационный флуоресцентный иммуноанализ (ПФИА) для выявления остаточных количеств антибактериального препарата сульфатиазола из класса сульфаниламидов, применяемого для профилактики и лечения инфекционных заболеваний пчел. Определены условия проведения ПФИА, обеспечивающие достижение высоких аналитических характеристик. Продолжительность ПФИА составляла 5 мин, предел обнаружения – 3 нг/мл. Показана высокая селективность ПФИА по отношению к сульфатиазолу; коэффициенты перекрестного реагирования для других сульфаниламидов не превышали 3%. Подтверждена эффективность обнаружения сульфатиазола разработанным ПФИА в пробах меда, для тестирования которых выбрана оптимальная методика пробоподготовки. Полученные результаты демонстрируют возможности использования разработанного иммуноанализа для быстрого и чувствительного контроля качества и безопасности меда.
Пчеловодство – важная отрасль сельского хозяйства, обеспечивающая потребителей продуктами с уникальными свойствами. Из видов пчеловодческой продукции наибольший интерес представляет мед, источник разнообразных биологически активных соединений [1]. Обладая высокой пищевой ценностью и отличными вкусовыми качествами, мед востребован и как индивидуальный продукт, и как компонент различных композитов [2].
В пчеловодстве для профилактики инфекций пчел широко применяется обработка пасек антибиотиками, которые останавливают распространение патогенов и предотвращают вспышки инфекций [3, 4]. Однако такие обработки приводят к контаминации меда и другой продукции пчеловодства антибиотиками. Употребление в пищу меда, содержащего остатки антибактериальных препаратов, может вызвать аллергические реакции, кишечные расстройства, нарушения обмена веществ и другие нежелательные последствия для здоровья, а также способствовать распространению антибиотикорезистентных патогенов [5, 6].
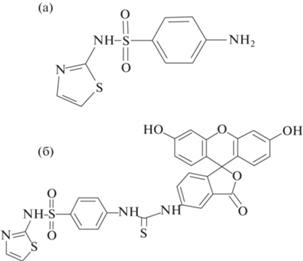
К широко применяемым в пчеловодстве антибактериальным препаратам относятся сульфаниламиды, в частности, сульфатиазол (СТ) (рис. 1а), который используется при профилактических обработках против гнильца – болезни расплода пчел [6]. В странах Евразийского экономического союза и других странах максимально допустимый уровень (МДУ) этого соединения и других сульфаниламидов в различных продуктах питания составляет 100 мкг/кг [7–9]. В меде наличие сульфаниламидов не допускается.
Обеспечение качества меда неотъемлемо связано с измерениями содержания в нем различных токсикантов, включая антибактериальные препараты. Для контроля за содержанием сульфаниламидов в продуктах питания применяются такие инструментальные методы, как высокоэффективная жидкостная хроматография с масс-спектрометрической детекцией [10, 11], электрохимические [12] и микробиологические [13] методы, капиллярный электрофорез [14] и др. Однако реализация этих методов сопряжена с рядом трудностей, обусловленных необходимостью дорогостоящего оборудования и высокой квалификации персонала, многостадийной пробоподготовкой, низкой производительностью и др.
Большое значение приобретает разработка высокочувствительных и специфичных методов, позволяющих быстро и с минимальными трудозатратами проводить скрининговый контроль наличия контаминантов в большом числе проб. К таким методам относятся иммунохимические методы анализа [15–17], в том числе гомогенный метод поляризационного флуоресцентного иммуноанализа (ПФИА) [18, 19]. При проведении ПФИА молекулы выявляемого соединения–антигена, содержащиеся в тестируемой пробе, конкурируют за связывание со специфическими антителами с трейсером – производным антигена, модифицированным флуорофором. При облучении реакционной смеси плоскополяризованным светом, возбуждающим флуорофор, сохранение поляризации излучаемым светом зависит от того, находится ли трейсер в комплексе с антителами. Соответственно, степень деполяризации излучения отражает содержание антигена в пробе. Детектируемый сигнал изменяется непосредственно в момент иммунного взаимодействия и может быть зарегистрирован в режиме реального времени. К достоинствам ПФИА относятся отсутствие длительных диффузионно-зависимых взаимодействий между иммобилизованными и находящимися в растворе реагентами и многостадийных инкубаций с разделением прореагировавших и непрореагировавших компонентов. ПФИА характеризуется не только высокой чувствительностью и быстротой тестирования, но и отсутствием необходимости в сложной пробоподготовке [18].
В настоящее время в литературе представлены разработки ПФИА для определения некоторых соединений из группы сульфаниламидов – сульфаметазина, сульфадиазина и сульфаниламида – в молоке, мясе курицы, сточных водах [20–22]. Однако до сих пор не рассматривалось применение ПФИА для контроля меда на наличие сульфаниламидов, в том числе сульфатиазола.
Цель работы – создание методики экспрессного выявления СТ с помощью ПФИА и ее апробация при тестировании проб меда.
МЕТОДИКА
Реактивы и оборудование. В работе использовали сульфаниламиды (СТ, сульфаметазин, сульфадиазин, сульфамеразин, сульфахлорпиридазин, сульфаметоксазол, сульфахиноксалин, сульфапиридин, сульфаниламид, сульфадиметоксин, сульфаметоксипиридазин), флуоресцеинизотиоцианат (ФИТЦ), азид натрия, Тритон X-100 (“Sigma-Aldrich”, США), ацетонитрил, метанол, триэтиламин, дихлорметан, хлороформ (“Merck”, Германия). Все вспомогательные реагенты (соли, кислоты, щелочи и органические растворители) были аналитической или химической чистоты. Овечья антисыворотка к сульфатиазолу была предоставлена профессором Р. Джакманом (Центральная ветеринарная лаборатория Эдлестона, Сюррей, Великобритания).
Для выделения и очистки СТ, меченного ФИТЦ, методом тонкослойной хроматографии (ТСХ) использовали пластины “Silufol” (Чехия). Стандартные растворы сульфаниламидов готовили разбавлением исходного раствора концентрацией 1 мг/мл в метаноле до концентраций 1, 3, 10, 30, 100, 300, 1000, 3000, 10000 нг/мл в воде или ацетонитриле. Для пробоподготовки использовали шейкер S-4 с качающейся платформой, (“Elmi”, Латвия). При проведении ПФИА в качестве рабочего буфера использовали 25 мМ боратный буфер (ББ) с 0.1%-ным азидом натрия, рН 8.5, Измерения поляризации флуоресценции проводили с помощью анализатора TDx (“Abbott”, США) и поляризационного флуориметра “Beacon 2000” (“Panvera”, США).
Синтез конъюгата СТ с ФИТЦ (трейсера). К раствору 2.5 мг СТ в 1 мл метанола (10 мкмоль/мл), содержащему 50 мкл триэтиламина, добавляли 4 мг (10 мкмоль) ФИТЦ. Реакционную смесь перемешивали в течение 12 ч при комнатной температуре. СТ–ФИТЦ выделяли методом ТСХ в смеси хлороформ–метанол, 4 : 1. С пластин собирали основную полосу (Rf = 0.1). Экстракцию продукта реакции проводили 1 мл метанола [24]. Раствор трейсера хранили при 4°С.
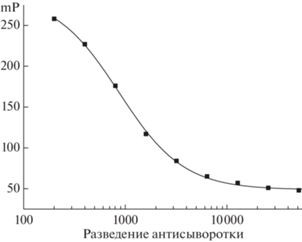
Тестирование антисыворотки методом ПФИА. Антисыворотку, специфичную к СТ, разводили в ББ в пределах 1 : 200–1 : 106 и добавляли раствор трейсера. Рабочую концентрацию трейсера определяли как разведение, при котором интенсивность флуоресценции составляла ~1000 относительных единиц (ОЕ). Титр антисыворотки определяли как разведение, соответствующее 50% связыванию с трейсером. Для проведения ПФИА использовали разведение антисыворотки, соответствующее 70–80% связыванию с трейсером.
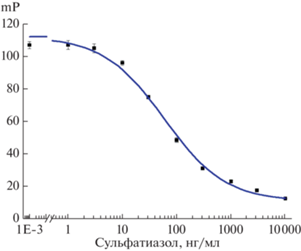
ПФИА СТ. Для проведения анализа в кюветы вносили по 25 мкл растворов СТ (0, 1, 3, 10, 30, 100, 300, 1000, 3000, 10 000 нг/мл) и по 250 мкл трейсера (0.6 нМ) и антисыворотки в разведении 1 : 870, затем измеряли поляризацию флуоресценции, регистрируя величину mP. Длина волны возбуждающего света – 485 нм, регистрируемого излучения – 525 нм.
Математическая обработка результатов ПФИА. Зависимость поляризации флуоресценции (y) от концентрации аналита в пробе (x) аппроксимировали при помощи программного продукта Origin 7.5 (“Origin Lab”, США), используя четырехпараметрическую сигмоидную функцию:
где A и B – асимптотические максимум и минимум сигнала, C – точка перегиба кривой в полулогарифмических координатах (50%-ное снижение сигнала, IC50), D – наклон кривой в точке перегиба.
Концентрации СТ, вызывающие снижение сигнала на 20% и 80%, рассматривали в качестве нижнего и верхнего пределов диапазона определяемых концентраций. Концентрацию СТ, вызывающую 10%-ное снижение сигнала, рассматривали как предел обнаружения (ПрО) [25].
Оценка специфичности ПФИА. Для оценки специфичности анализа определяли коэффициенты перекрестной реактивности (ПР) структурных аналогов СТ. Для этого реализовали ПФИА как описано выше, добавляя вместо СТ растворы других сульфаниламидов. Величины ПР рассчитывали по формуле:
где IC50СТ – концентрация СТ, IC50СА – концентрация перекрестно-реагирующего сульфаниламида.
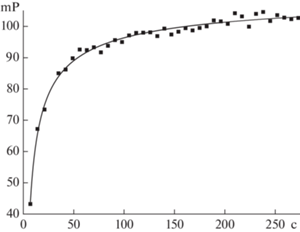
Изучение кинетики образования иммунных комплексов. Для изучения кинетики ассоциации трейсера с антителами, специфичными к СТ, в кювету вносили в рабочих концентрациях трейсер (250 мкл), сыворотку (250 мкл) и измеряли поляризацию флуоресценции с интервалом 7 с. После достижения равновесия добавляли стандартный раствор СТ (25 мкл) и регистрировали кинетику диссоциации комплекса антитело–трейсер.
Пробоподготовка меда. Методика 1. Мед разбавляли до концентрации 50 мг/мл фосфатно-солевым буфером с тритоном (ФСБТ; 50 мМ фосфатный буфер, pH 7.4, с 0.1 М NaCl, 0.05% детергента Тритон X-100), полученный раствор перемешивали на шейкере в течение 10 мин.
Методика 2. К 1 г меда добавляли 4 мл смеси этилацетат–вода, 1 : 1, и перемешивали на шейкере в течение 10 мин. Затем смесь центрифугировали при 3000 g и температуре 4°С в течение 10 мин. Органический слой отбирали и упаривали при 60°С.
Методика 3. К 2.5 г меда добавляли 2.5 мл 2 М соляной кислоты и перемешивали на шейкере в течение 15 мин, затем 10 М гидроксидом натрия доводили рН раствора до 4.5 и добавляли 5 мл ацетонитрила, 1.25 мл дихлорметана и 0.25 г хлорида натрия. Полученную смесь перемешивали на шейкере в течение 10 мин, центрифугировали при 15 000 g и температуре 4°С в течение 10 мин и отбирали органический слой.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Получение и характеристика специфических иммунореагентов. Эффективность ПФИА напрямую связана со свойствами меченого аналита (трейсера). В данной работе в качестве трейсера был синтезирован конъюгат сульфатиазола с флуоресцентной меткой флуоресцеинизотиоцианатом (рис. 1б). ФИТЦ является традиционным маркером в ПФИА, частый выбор которого обусловлен доступностью и легкостью присоединения к антигенам [18]. Перед реализацией ПФИА было изучено взаимодействие трейсера с антителами, специфичными к СТ; на основании полученных результатов выбирали его рабочую концентрацию. Оптимальной являлась концентрация трейсера, при которой интенсивность его флуоресценции в 10 раз больше фоновой флуоресценции в ББ, то есть составляла ~1000 ОЕ. Это требование достигалось при концентрации трейсера 0.6 нМ.
Использованная в работе овечья антисыворотка была получена против конъюгата СТ с овальбумином. Для определения титра антисыворотки к серии ее разведений добавляли раствор трейсера и регистрировали поляризацию флуоресценции. На рис. 2 представлена кривая титрования антисыворотки, подтверждающая взаимодействие трейсера с антителами. За величину титра антисыворотки принимали разведение 1 : 1500, которое обеспечивало 50% связывания с меченым антигеном. Максимальная чувствительность ПФИА достигалась при 50%-ном связывании трейсера, но при этом уменьшался диапазон определяемых концентраций; поэтому использовали разведение антисыворотки 1 : 870, обеспечивающее 70–80%-ное связывание с трейсером.
ПФИА сульфатиазола. Используя выбранные на предыдущем этапе концентрации иммунореагентов, получили градуировочную кривую, представленную на рис. 3. Согласно результатам аппроксимации этой кривой, ПрО СТ составлял 3 нг/мл, рабочий диапазон определяемых концентраций – 9–350 нг/мл, IC50 = 59 нг/мл.
Оценка специфичности ПФИА. Специфичность анализа оценивали, детектируя структурные аналоги СТ. Для этого в качестве тестируемой пробы вместо СТ брали другой сульфаниламидный препарат и регистрировали поляризацию флуоресценции. Установленные коэффициенты перекрестной реактивности представлены в табл. 1. Хотя все изученные сульфаниламиды являются структурными аналогами СТ, отличаясь только радикалом при N4-атоме, коэффициенты перекрестного реагирования для них не превосходили 3%. Таким образом, разработанный ПФИА характеризовался высокой специфичностью, что позволило применять его для обнаружения СТ в присутствии близких по структуре соединений.
Таблица 1.
Коэффициенты перекрестной реактивности (ПР) ПФИА сульфатиазола и его структурных аналогов
| Название соединения | Коэффициент ПР, % |
|---|---|
| Сульфатиазол | 100 |
| Сульфаметазин | 0.5 |
| Сульфадиазин | 0.2 |
| Сульфамеразин | <0.1 |
| Сульфаметоксазол | 1.6 |
| Сульфахиноксалин | <0.1 |
| Сульфадиметоксин | <0.1 |
| Сульфапиридин | 2.9 |
| Сульфаниламид | <0.1 |
| Сульфахлорпиридазин | 0.7 |
| Сульфаметоксипиридазин | <0.1 |
Изучение кинетики комплексообразования антиген–антитело. При исследовании формирования и диссоциации иммунных комплексов измерения поляризации флуоресценции проводили через промежутки времени, равные 7 с. Этот интервал был минимально достаточным для измерения вертикальной и горизонтальной составляющей излучаемого света для используемых анализаторов. Зависимость поляризации флуоресценции от времени при взаимодействии антител с флуоресцентно меченым антигеном приведена на рис. 4. Как видно из графика, равновесие в системе наступает через 1.5–2 мин, то есть анализ может быть реализован за очень короткое время. Экспрессность – одно из главных преимуществ ПФИА по сравнению с таким широко распространенным методом, как твердофазный иммуноферментный анализ.
Определение сульфатиазола в меде. Мед – один из наиболее сложных для тестирования пищевых матриксов, представляющий собой смесь углеводов, белков, органических кислот и других биологически активных соединений [26]; поэтому при тестировании проб меда обязательна пробоподготовка, обеспечивающая эффективную экстракцию СТ и снижение влияния матрикса на получаемые результаты. Известно, что сульфаниламиды образуют ковалентные связи с глюкозой, фруктозой и другими углеводами, что усложняет пробоподготовку [27]. Следует также учитывать, что на величину поляризации флуоресценции значительное влияние оказывает вязкость среды, которая возрастает с ростом концентраций углеводов и белков, содержащихся в меде. При этом для экспрессного тестирования нужна простая в реализации методика пробоподготовки с минимальным количеством стадий.
Учитывая все вышесказанное, были сопоставлены три методики. Первая заключалась в простом разведении меда в ФСБТ. Во второй методике СТ экстрагировали смесью воды и этилацетата с последующим центрифугированием, упариванием экстрактов и их перерастворением в ФСБТ. В третьей методике проводили гидролиз ковалентных связей между углеводами и сульфаниламидами, а также осаждение органическими растворителями содержащихся в меде белков. Сравнение полученных концентрационных зависимостей ПФИА показало, что наиболее эффективна третья методика пробоподготовки, позволяющая минимизировать матричные эффекты меда. Эта методика является простой и быстрой, ее продолжительность – 35 мин. Она и была выбрана для дальнейших экспериментов.
Проанализировали 17 проб разных видов меда из различных регионов России. Для определения коэффициентов извлечения СТ в пробы цветочного меда из Брянской области, не содержащего сульфаниламиды, вносили известные количества СТ, а после пробоподготовки проводили ПФИА. Из представленных в табл. 2 данных видно, что разработанная методика выявляет 76–84% СТ в меде. Некоторое снижение выявленной концентрации СТ относительно добавленной может быть связано с неполной экстракцией аналита, а также с частичной экстракцией сахаров, которые мешают определению [27]. Полученные данные позволили реализовать ПФИА СТ в пробах с неустановленным содержанием сульфаниламидов. Результаты приведены в табл. 3. Из таблицы видно, что все пробы содержали СТ, однако его содержание ниже МДУ.
Таблица 2.
Коэффициенты извлечения СТ из меда, определенные в ПФИА
| Добавленный СТ, нг/г | Определенный СТ, нг/г | Коэффициент извлечения, % |
|---|---|---|
| 25 | 19 ± 3 | 76 ± 8 |
| 50 | 41 ± 2 | 83 ± 5 |
| 70 | 59 ± 6 | 84 ± 8 |
| 210 | 164 ± 10 | 78 ± 5 |
Таблица 3.
Определение СТ в пробах меда методом ПФИА
| № пробы | Регион России | Содержание СТ, нг/г (n = 3) |
|---|---|---|
| 1 | Волгоградская область | 33 ± 3 |
| 2 | Башкирия | 48 ± 5 |
| 3 | Волгоград | <16 |
| 4 | Новосибирск | 24 ± 1 |
| 5 | Адыгея | 30 ± 3 |
| 6 | Тамбовская область | <16 |
| 7 | Саратовская область | <16 |
| 8 | Брянск | 18 ± 1 |
| 9 | Брянская область | <16 |
| 10 | Воронеж | <16 |
| 11 | Вятка | <16 |
| 12 | Ставрополье | <16 |
| 13 | Не указан | <16 |
| 14 | Не указан | 32 ± 1 |
| 15 | Не указан | 24 ± 1 |
| 16 | Не указан | <16 |
| 17 | Не указан | <16 |
Таким образом, впервые разработан поляризационный флуоресцентный иммуноанализ антибактериального препарата сульфатиазола как одного из контаминантов меда и другой пчеловодческой продукции. Анализ характеризовался пределом обнаружения 3 нг/мл, что существенно ниже нормативных требований для сульфаниламидов. Высокая специфичность аналитической системы позволит использовать ее для селективного выявления сульфатиазола. Показана применимость разработанного подхода для выявления сульфатиазола в пробах меда.
Авторы выражают благодарность профессору Р. Джакману (Центральная ветеринарная лаборатория Эдлестона, Сюррей, Великобритания) за предоставление антисыворотки к сульфатиазолу.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 20-76-10033).
Список литературы
Pasupuleti V.R., Sammugam L., Ramesh N., Gan S.H. // Oxid. Med. Cell Longev. 2017. V. 1. P. 259–510.
Samarghandian S., Farkhondeh T., Samini F. // Pharmacognosy Res. 2017. V. 9. № 2. P. 121–127.
Reybroeck W., Daeseleire E., De Brabander H.F., Herman L. // Vet. Microbiol. 2012. V. 158. № 1–2. P. 1–11.
Bacanlı M., Başaran N. // Food Chem. Toxicol. 2019. V. 125. P. 462–466.
Arsène M.M.J., Kitio A., Podoprigora I.V., Smolyakova L.A., Sarra S., Khelifi I., Das M.S. // Vet. World. 2022. V. 15. № 3. P. 662–671.
Martinello M., Baggio A., Gallina A., Mutinelli F. // J. Agric. Food Chem. 2013. V. 61. № 38. P. 9275–9279.
ТР ТС 021/2011. Технический регламент Таможенного Союза о безопасности пищевой продукции. М.: Изд-во стандартов, 2011. 27 с.
Commission Regulation (EU) No 37/2010 of 22 December 2009 on pharmacologically active substances and their classification regarding maximum residue limits in foodstuffs of animal origin. // Official J. European Communities. 2010. N L15. P. 1–72.
Moretti S., Saluti G., Galarini R. // In: Honey Analysis. / Eds. Vagner De Alencar, Arnaut De Toledo. Chapter 15. London: Intechopen, 2017. P. 325–365.
de Campos V.M., Andrade M.A., Maciel E.V.S., de Toffoli A.L., Lanças F.M. // Food Addit. Contam. Part A. 2022. V. 39. № 5. P. 925–937.
Dubreil-Chéneau E., Pirotais Y., Verdon E., Hurtaud-Pessel D. // J. Chromatogr. A. 2014. V. 1339. P. 128–136.
Hassani N.E.A.E., Baraket A., Neto E.T.T., Lee M., Salvador J.P., Marco M.P. et al. // Biosens. Bioelectron. 2017. V. 93. P. 282–288.
Li X., Yang Y., Miao J., Yin Z., Zhai Y., Shi H., Li Z. // Rev. Argent. Microbiol. 2019. V. 51. № 4. P. 345–353.
Tumini M., Nagel O G., Althaus R.L. // Electrophoresis. 2020. V. 41. № 18–19. P. 1584–1591.
Ouyang S., Yu S., Le Y. // Foods. 2022. V. 11. № 6. Article 803. https://doi.org/10.3390/foods11060803
Adunphatcharaphon S., Elliott C.T., Sooksimuang T., Charlermroj R., Petchkongkaew A., Karoonuthaisiri N.J. // J. Hazard. Mater. 2022. V. 432. Article 128706. https://doi.org/10.1016/j.jhazmat.2022.128706
Rodriguez R.S., O’Keefe T.L., Froehlich C., Lewis R.E., Sheldon T.R., Haynes C.L. // Anal. Chem. 2021. V. 93. № 1. P. 23–40.
Hendrickson O.D., Taranova N.A., Zherdev A.V., Dzantiev B.B., Eremin S.A. Sensors. 2020. V. 20. № 24. Article 7132. https://doi.org/10.3390/s20247132
Xiao X., Zhen S. // RSC Adv. 2022. V. 12. № 11. P. 6364–6376.
Wang Z., Zhang S., Nesterenko I.S., Eremin S.A., Shen J. // J. Agric. Food Chem. 2007. V. 55. № 17. P. 6871–6878.
Zhang S., Wang Z., Nesterenko I.S., Eremin S.A., Shen J. // Int. J. Food Sci. Tech. 2007. V. 42. № 1. P. 36–44.
Murtazina N.R., Eremin S.A., Mozoleva O.V., Everest S.J., Brown J.A., Jackman R. // Int. J. Food Sci. Tech. 2004. V. 39. № 8. P. 879–889.
Wang Z., Zhang S., Ding S., Eremin S.A., Shen J. // Food Addit. Contam. Part A. 2008. V. 25. № 5. P. 574–582.
Eremin S.A., Smith D.S., Landon J., Jackman R. // Analyst. 1994. V. 119. № 12. P. 2723–2726.
Uhrovcik J. // Talanta. 2014. V. 119. P. 178–180.
Mateo R., Bosch-Reig F. // Food Chem. 1997. V. 60. № 1. P. 33–41.
Schwaiger I., Schuch R. // Deutsche Lebensmittel-Rundschau. 2000. V. 96. № 3. P. 93–98.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология