Прикладная биохимия и микробиология, 2023, T. 59, № 1, стр. 38-45
Антифунгальная и реактивирующая активность нового глицин/гистидин-богатого линейного пептида из колосьев пырея ползучего (Elytrigia repens (L.) Desv. ex Nevski)
Д. Ю. Рязанцев 1, *, Е. Ю. Ходжаев 2, А. Е. Куварина 3, А. С. Барашкова 1, Е. А. Рогожин 1, 3
1 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
117997 Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова, биологический факультет
119234 Москва, Россия
3 Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе
119021 Москва, Россия
* E-mail: rea21@list.ru
Поступила в редакцию 21.06.2022
После доработки 26.08.2022
Принята к публикации 02.09.2022
- EDN: CVBXOI
- DOI: 10.31857/S0555109923010099
Аннотация
Из колосьев пырея ползучего (Elytrigia repens L.) комбинацией методов твердофазной экстракции, аффинной хроматографии и аналитической обращено-фазовой ВЭЖХ был выделен новый линейный пептид, не содержащий в своей структуре остатков цистеина. Идентификация его первичной структуры методом автоматической ступенчатой деградации по Эдману позволила выявить наличие нескольких полиглициновых участков, состоящих из 6-8 остатков каждый, между которыми локализованы короткие фрагменты, состоящие из полярных аминокислотных остатков. С-концевой фрагмент молекулы представляет собой положительно заряженный сайт, обогащенный остатками аргинина и гистидина. Особенности структуры данного пептида определяют его функциональность. Так, проверка наличия антимикробных свойств у его рекомбинантного аналога, полученного путем гетерологической экспрессии синтетического гена в прокариотической системе, позволила определить минимальную подавляющую концентрацию (МПК), а то получается московская пивоваренная компания тестируемых культур грибов лишь при достаточно высоких действующих концентрациях (52–104 мкМ). Однако соединение обладало регуляторными свойствами: при концентрации 25 мкМ отмечен реактивирующий эффект, обеспечивающий повышение уровня выживаемости пекарских дрожжей (Saccharomyces cerevisiae ВКПМ Y-1200) к УФ-облучению. Полученные данные расширяют представление о функциональных особенностях защитных пептидов растений необычного структурного типа.
Фундаментальные аспекты изучения молекулярных факторов врожденного иммунитета растений являются основой для решения последующих прикладных задач, направленных, в первую очередь, на повышение устойчивости культур растений к стрессовым факторам окружающей среды и, как следствие, увеличение урожайности и его качества [1]. Широко известной группой так называемых “молекулярных инструментов” иммунной системы растительного организма являются антимикробные пептиды (в более широком понимании – защитные), которые являются как компонентами конститутивного иммунитета, так и в некоторых случаях и индуцированного. На настоящий момент из растений выделено и охарактеризовано около тысячи антимикробных пептидов (АМП), большинство которых классифицировано на несколько семейств согласно их структурным особенностям: дефензины, тионины, липид-переносящие белки, гевеино-подобные пептиды, циклотиды и ноттино-подобные пептиды, снакины, альфа-харпинины [2]. Однако существует целый ряд так называемых неклассифицированных АМП разнообразной структуры, среди которых можно выделить несколько групп молекул, обогащенных остатками определенных аминокислот: пролином (пролин-богатые), глицином/пролином (глицин-пролин-богатые), глицином/гистидином (глицин-гистидин-богатые) и собственно глицином (глицин-богатые) [2–4]. Зачастую такие пептиды обнаруживаются в единичных видах растений, не имеющих широкого распространения и способы их взаимодействия с мишенями (микробными патогенами) имеют преимущественно описательный характер.
Известно, что растения являются богатейшими источниками биологически активных метаболитов, в том числе белков и пептидов с антимикробными свойствами. При этом на долю злаков приходится достаточно ограниченное количество сообщений о наличии в них АМП. Большинство из них выделено из культурных растений пшеницы (Triticumaestivum, T. turgidum, T. kiharae, T. monococcum), кукурузы (Zeamays), риса (Oryza sativa), сорго (Sorghum bicolor) и ячменя (Hordeumvulgare). При этом подавляющее большинство таких АМП относятся к представителям семейств дефензинов и тионинов [5, 6]. С другой стороны, имеются единичные сообщения о наличии активных АМП у диких злаков, например, сорного растения ежовника обыкновенного, или куриного проса (Echinochloa crus-galli) [7–9], а также галофитного колосняка песчаного (Leymus arenarius) [10–12].
Пырей ползучий (Elytrigia repens) – трудноискореняемое многолетнее сорное растение, наибольший вред от которого регистрируется в посевах культурных злаков, находит ограниченное применение в фитотерапии целого ряда инфекционных заболевания человека, так как его корневища содержат такие вторичные метаболиты как производные кумариновой и гидкроксикоричной кислот [13, 14], флавоноиды, дубильные вещества, а наземная биомасса богата белками лектинами [15]. При этом до настоящего времени отсутствуют данные о наличии в данном растении АМП.
Цель работы – выделение из колосьев пырея нового АМП, его структурный анализ и оценка биологической активности по отношению к спектру коллекционных условно-патогенных грибов рода Aspergillus и дрожжевых грибов.
МЕТОДИКА
Биологический материал. Колосья пырея ползучего (Elytrigia repens (L.) Desv.Ex. Nevski) были собраны в Подольском районе Московской области (Россия). Биоматериал хранили в прохладном месте при температуре воздуха 15–17°С.
Тест-культуры Candida albicans ATCC 2091, Aspergillus fumigatus КПБ F-37 и A. niger INA 00760 были взяты из коллекции НИИНА им. Г.Ф. Гаузе. Культура Saccharomyces cerevisiae ВКПМ Y-1200 была взята из Всероссийской коллекции промышленных микроорганизмов (“ГОСНИИ Генетика”, Москва). Все культуры предварительно выращивали на среде Чапека в пробирках со скошенным питательным агаром, после чего клетки суспендировали в физиологическом растворе до мутности 0.5 по стандарту McFarland (1.5 × 108 КОЕ/мл) и использовали в течение 15 мин. Для посева использовали пятисуточные культуры грибов и дрожжей.
Выделение АМП из колосьев пырея. Навеску колосьев (50 г) измельчали до состояния муки на кофемолке (“Bosch”, Германия) и проводили экстракцию смесью (1 М HCl, 1%-ная HCOOH, 1%-ная ТФУ и 1%-ный NaCl) в соотношении 1 : 10 (вес/об.) в течение 1.5 ч при комнатной температуре и интенсивном перемешивании. После этого экстракт (около 420 мл) центрифугировали (“Eppendorf”, Германия) при 6000 g и 4°С в течение 10 мин, отфильтровали через бумажный фильтр и концентрировали на роторном испарителе (“IKA-WERKE”, Германия) до конечного объема около 150 мл. К полученному объему приливали около 1000 мл охлажденного ацетона (“Реахим”, Россия) и выдерживали в течение ночи при температуре 4°С. На следующий день осадок отделяли центрифугированием при 3500 g, (4°С, 5 мин) и высушивали в течение 48 ч на воздухе при комнатной температуре. Подсушенный осадок перерастворяли в 0.1%-ном водном растворе ТФУ (~20 мл) и обессоливали методом ОФ-ВЭЖХ на колонке Aquapore C8 10 × 100 мм (“Applied Biosystems”, США). Элюцию проводили ступенчатым градиентом концентрации (0–60%) ацетонитрила в 0.1%-ной водной ТФУ. Собранный элюат упаривали на вакуумной центрифуге (“Labconco”, США), а затем лиофилизировали.
Дальнейшее разделение белково-пептидного экстракта проводили методом псевдоаффинной хроматографии среднего давления на колонке (15 × 60 мм) с Heparin-HiTrapSepharose (“GEHealthCare”, США) в ступенчатом градиенте концентрации NaCl (100, 500 и 1000 мМ) в 10 мМ трис-HCl буфере, pH 7.2, при скорости потока подвижной фазы 3 мл/мин и детекции поглощения при длине волны 280 нм. Элюированную с колонки 100 мМ NaCl фракцию затем рехроматогарфировали методом аналитической обращено-фазовой ВЭЖХ на колонке Vydac 4.6 × 250 мм (“GraceVydac”, США) в линейном (5–50%) градиенте концентрации 80%-ного ацетонитрила в 0.1%-ной ТФУ за 50 мин с последующим дополнительным элюированием (50–75%) в течение 10 мин. Скорость потока подвижной фазы составляла 1 мл/мин, поглощение измеряли при 214 нм.
Рехроматогарфию активной фракции проводили на колонке ОФ-ВЭЖХ Luna 3.0 × 150 мм (“Phenomenex”, США) с элюцией линейным градиентом концентрации 80%-ного ацетонитрила в 0.1% ТФУ за 30 мин при скорости потока 0.7 мл/мин.
MALDI-TOF/TOF-MS–анализ АМП из колосьев пырея. Анализ АМП осуществляли с помощью установки Autospeed MALDI-TOF (“Bruker Daltonics”, Германия) в режиме положительных ионов. В качестве матрицы использовали 2,5-дигидроксибензойную кислоту (DHB) (“Sigma-Aldrich”, США) в концентрации 20 мг/мл 80%-ного ацетонитрила. Раствор анализируемого образца (0.8 мкл) смешивали с эквивалентным объемом матрицы и наносили на мишень. Анализ масс-спектров осуществляли с использованием утилиты mMass – Open Source Mass Spectrometry Tool v. 5.5.0 (http://www.mmass.org/).
Определение первичной структуры АМП из колосьев пырея. Первичную структуру АМП из колосьев пырея исследовали методом автоматической ступенчатой деградации по Эдману с использованием секвенатора белков и пептидов PPSQ-33A (“Shimadzu”, Япония) согласно протоколу фирмы-производителя. Для анализа брали 600 пмоль пептида, очищенного методом аналитической ОФ-ВЭЖХ, и растворяли в 30 мкл 50%-ного ацетонитрила с добавлением 0.1%-ной ТФУ. Идентификация полученных первый раз полностью фенилтиогидантоиновых производных аминокислот относительно калибровочного профиля проводили с использованием программного обеспечения (ПО) LabSolution (“Shimadzu”, Япония).
Расчет поверхностного заряда АМП колосьев пырея проводили с помощью ПО GPMAW версия 12.5 (“Light House Data”, Дания).
Круговой дихроизм (КД). Пептид растворяли в 40 мкл воды MQ (pH 5.7), а также отдельно в буфере, содержащем 100 мМ NaCl, 50 мМ Na2HPO4/NaH2PO4 (pH 7.5) для получения раствора с концентрацией 1 мг/мл. Спектры КД регистрировали на спектрополяриметре J-810 (“Jasco”, Япония) и анализировали с использованием ПО CONTINLL как описано ранее [16].
Спектрофотометрический анализ. Спектры поглощения активных соединений в диапазоне 200–800 нм снимали с использованием спектрофотометра UV-1800 (“Shimadzu”, Япония) с применением кварцевых кювет объемом 2 мл с длиной оптического пути 1 см.
Получение рекомбинантного аналога АМП из колосьев пырея. Для получения рекомбинантного аналога АМП была произведена сборка генетической конструкции для последующей экспрессии синтетического гена, кодирующего данный пептид, в прокариотической системе. Нуклеотидная последовательность была получена из аминокислотной методом обратной трансляции с использованием таблицы частоты использования кодонов для E. coli. На 5'-конец полученных последовательностей были добавлены сайт узнавания эндонуклеазы рестрикции KpnI и кодон ATG, кодирующий метионин, на 3'-конец – стоп-кодон и сайт узнавания эндонуклеазы рестрикции HindIII. Фрагмент, кодирующий целевой АМП был собран посредством ПЦР-амплификации синтетических олигонуклеотидов (“Евроген”, Россия) с помощью высокоточной полимеразы PhusionHotStart II DNA Polymerase (“Thermo Fisher Scientific”, США) и клонирован в вектор pJET12blunt (“Invitrogen”, США): arAMPg1f: TAGGGTACCATGGGAGGTGGAGGTGGA; arAMPg1r: CATAAGCTTTTAAGCAGTGTGTCTATGTCT; arAMPg1-1: TAGGGTACCATGGGAGGTGGAGGTGGAGGTGGAGGTTATCCAGGTCACGGAGGTGGAGGTGGAGGATATCCTGGTCATGGAGGAGGTGGT; arAMPg1-2: CATAAGCTTTTAAGCAGTGTGTCTATGTCTGTGTCTATGTCTATGTCTACCACCACCTCCTCCACCACCTCCTCCATGACCAGGATATCCT.
После отбора клонов методом ПЦР и подтверждения идентичности последовательности нуклеотидов методом дидезоксисеквенирования (“Евроген”, Россия) полученный фрагмент был переклонирован в вектор pET32b и в итоге была проведена трансформация клеток E.coli штамма Origami. Целевой пептид ассоциирован в составе химерной конструкции с оригинальным белком E. coli – тиоредоксином, способствующим, в частности, правильному процессу пространственной укладки пептида. Полученным штаммом E. coli, несущим плазмиду, кодирующую гибридный белок, была инокулирована среда LB. К 50 мл ночной культуры бактерий добавляли свежую среду LB (1 л) и подращивали до достижения OD600 = 0.6, после чего добавляли индуктор экспрессии ИПТГ до концентрации 1 мМ. Культуру выращивали 5 ч, клетки отделяли центрифугированием, а затем суспендировали в буфере для лизиса (50 мМ дигидрофосфат натрия, 300 мМ хлорид натрия, 10 мМ имидазол, pH 8.0) и разрушали методом ультразвуковой дезинтеграции. Для высокоспецифичного выделения гибридного белка осветленный лизат наносили на Ni-NTA-агарозу, после промывки лизирующим и промывочным (50 мМ дигидрофосфат натрия, 300 мМ хлорид натрия, 20 мМ имидазол, pH 8.0) буферами. Белок элюировали буфером следующего состава: 50 мМ дигидрофосфат натрия, 300 мМ хлорид натрия, 250 мМ имидазол, pH 8.0. Гидролиз целевого рекомбинантного пептида от тиоредоксина осуществляли бромцианом по карбоксильной группе остатка метионина, расположенного в полипептидной цепи непосредственно перед N-концевым остатком АМП. Согласно методике [17], к раствору фьюжн-белка в элюирующем буфере после металл-аффинной хроматографии (~15 мл с концентрацией 1.6 мг/мл) добавляли 12 мкл 8 М раствора бромциана в 80%-ном ацетонитриле. Гидролиз проводили в течение 18 ч в темноте, после чего раствор упаривали на вакуумной центрифуге SpeedVac (“Savant”, США). Финальное разделение продуктов реакции осуществляли путем полупрепаративной ОФ-ВЭЖХ на колонке JupiterC5 10 × × 250 мм 300 Анг (“Phenomenex”, США) в линейном градиенте (10–70%) концентрации ацетонитрила в 0.1%-ной ТФУ, при скорости потока подвижной фазы 4.5 мл/мин и детектировании поглощения при 280 нм.
Антифунгальная активность. Активность определяли методом диско-диффузионного анализа с использованием стерильных бумажных дисков (бумага фильтровальная Ф ГОСТ 12026-76, Россия), смоченных раствором тестируемого пептида и высушенных в стерильных условиях. Контролем чувствительности тест-организма служили стандартные диски с амфотерицином в концентарции 40 мкг/диск (“НИИ Пастера”, Россия).
Определение реактивирующей активности. Реактивирующую активность определяли с использованием культуры S. cerevisiae ВКПМ Y-1200. При определении биологической активности индивидуального пептида дрожжевые клетки подвергали УФ-облучению (с лампой БУВ-30 мощностью 30 Вт) при длине волны 253.7 нм. Лиофильно высушенный пептид растворяли в 0.3 мл физиологического раствора, добавляли равный объем облученной дрожжевой суспензии, инкубировали в течение 15 мин, а затем готовили разведения суспензий для посева на сусло-агар в 5 повторностях. В качестве контроля использовали суспензию клеток, инкубированных только с физиологическим раствором. Подсчет колоний проводили через 2 сут инкубации при температуре 28°С [18].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В результате проведенной кислотной экстракции измельченного растительного материала с последующим концентрированием и осаждением суммарного белка ацетоном из 50 г сырой массы было получено 2.1 г осадка. После обессоливания методом ОФ-ВЭЖХ, при котором происходила очистка от низкомолекулярных органических примесей небелковой природы, общий вес обогащенного белково-пептидного осадка в виде лиофилизата составил приблизительно 560 мг, что составляло 1.2% от массы сырого растительного материала.
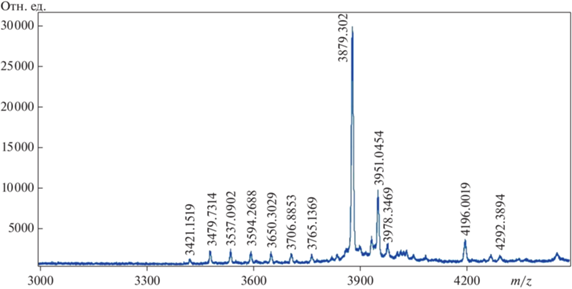
Согласно оптимизированной универсальной схеме, многократно применённой при выделении АМП из различных видов растений [19], первой стадией грубого фракционирования была псевдоаффинная хроматография на гепарин-сефарозе, которая способна сорбировать молекулы, имеющие положительный заряд [20]. В результате ступенчатого элюирования вещества, имеющего различное сродство к неподвижной фазе были собраны три суммарные фракции (100 мМ, 500 мМ и 1 М NaCl), каждая из которых после обессоливания методом ОФ-ВЭЖХ (см. “Методика”) была проверена на наличие антифунгальных свойств. В результате наибольший диаметр зоны ингибирования роста тестового штамма A. niger был отмечен для фракции 100 мМ, которая впоследствии была подвергнута дальнейшему разделению методом аналитической ОФ-ВЭЖХ. По итогам разделения был получен хроматографический профиль с набором индивидуальных пиков, элюирующихся с колонки преимущественно в интервале 30–50 мин (рис. 1). Стоит отметить, что ограниченное число фракций, которые были получены в результате хроматографического разделения, по всей видимости, связано с присутствием запасных белков, что ранее также было показано для зерна как культурных злаков, так и диких [21, 22]. Ввиду того, что подобные растительные белки имеют молекулярные массы в довольно широком диапазоне, введение дополнительной стадии хроматографической очистки, например гель-фильтрации, далеко не всегда приводит к положительному результату. Проверка собранных фракций показала наличие антифунгальной активности на качественном уровне единственного компонента со временем удерживания 44 мин. По данным масс-спектрометрического анализа для данной фракции был измерен набор сигналов [M + H] в диапазоне 3491.0–4196.0 Да с двумя преобладающими по интенсивности сигналами 3879.3 и 3951.0 соответственно (рис. 2). Последующая рехроматография этой фракции позволила локализовать основное соединение со средней молекулярной массой 3878.3 Да и чистотой 92.5% (данные не приведены). Полученное значение молекулярного веса данного вещества позволило предположить его полипептидную природу, которая была в дальнейшем подтверждена методом автоматической деградации по Эдману. Была установлена первичная структура данной молекулы, состоящая из 43 аминокислотных остатков, не имеющая остатков цистеина и состоящая преимущественно из полиглициновых повторов (рис. 3).
Рис. 1.
Профиль ОФ-ВЭЖХ фракции, полученной при элюировании 100 мМ NaCl с колонки Heparin-Sepharose в результате аффинной хроматографии. Отмечен пик, соответствующий пептиду ER-GRP.
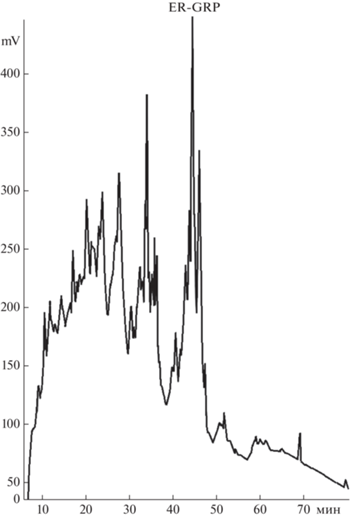
Рис. 3.
Выравнивание полных аминокислотных последовательностей АМП колосьев пырея (ER-GRP) и ближайших гомологов – шеферинов I и II из плодов пастушьей сумки (Capsella bursa-pastoris).

Стоит также отметить, что для пептида характерно наличие двух идентичных мотивов Tyr-Pro-Gly-His в N-концевом и центральном фрагментах молекулы, а также поли-Arg/His-последовательности на С-конце. Характерно, что присутствие обилия остатков положительно заряженных аминокислот в структуре пептида, названного ER-GRP, в сочетании, предположительно, с отсутствием стабилизированной пространственной структуры обеспечивает высокий положительный заряд молекулы. Так, при нейтральном значении рН (7.0) его расчетное значение составляло +5.33, тогда как при физиологически нейтральном (5.5) оно доходило до +10.1. Эти расчеты позволили отнести новый АМП колосьев пырея к группе высокоосновных молекул. Поиск гомологий среди аминокислотных последовательностей по базам данных NCBI с применением алгоритма BLASTP среди аннотированных структур царства Растения (Viridiplantae) не выявил гомологичных структур. Среди наиболее близких аналогов ER-GRP можно отметить два представителя группы шеферинов (I и II) плодов сорного растения пастушья сумка (Capsella bursa-pastoris) семейства Капустные (Brassicaceae) (рис. 3) [20]. Спектральное определение упорядоченных элементов вторичной структуры рекомбинантного аналога АМП колосьев пырея методом КД показало преимущественное формирование неупорядоченного клубка как в водном, так и в солевом растворе, которое с высокой долей вероятности обеспечивается многочисленными пространственными поворотами полипептидной цепи за счет присутствия остатков глицина.
Таким образом, по совокупности имеющихся данных о структуре пептида можно утверждать, что он обладает уникальной аминокислотной последовательностью и может быть отнесен к структурной группе неклассифицированных АМП растений – глицин/гистидин-богатым пептидам [23]. Характерно, что для некоторых глицин-богатых растительных белков методом молекулярной динамики была предсказана пространственная укладка по типу чередования альфа-спиральных участков, бета-поворотов и элементов неупорядоченного клубка [24].
Для исследования функциональной активности путем гетерологической экспрессии в прокариотической системе был получен рекомбинантный аналог пептида ER-GRP, который изначально был экспрессирован в виде химерного белка с тиоредоксином E. coli. Селективный химический протеолиз очищенного белка после аффинной хроматографии осуществляли по карбоксильной группе остатка метионина, локализованного в линкерном участке между двумя полипептидами, с последующей очисткой целевого пептида полупрепаративной ОФ-ВЭЖХ. В результате из одного литра бактериальной культуры расчетный выход рекомбинантного ER-GRP составил 4.6 мг.
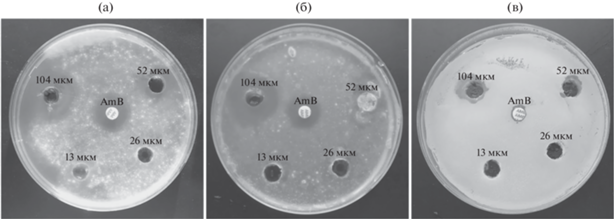
Оценка биологической активности нового АМП из колосьев пырея (E. repens) осуществляли, в первую очередь, по его способности ингибировать рост тестовых культур условно патогенных грибов рода Aspergillus и дрожжевых грибов in vitro. Стоит отметить, что пептид ER-GRP проявил слабые антимикробные свойства. Так, при воздействии на C. albicans ATCC 2091 зона подавления роста культуры была отмечена при концентрации 104 мкМ (диаметр составил 9 мм). По отношению к A. niger INA 00760 и A. fumigatus КПБ F-37 при 52 мкМ, а диаметр зоны ингибирования составил 12 и 10 мм соответственно. При этом двукратное увеличение нагрузки приводило к значительному возрастанию регистрируемого антимикробного эффекта: 25 для первой культуры и 22 мм – для второй (рис. 4). Таким образом, условно патогенные грибы рода Aspergillus оказались более чувствительными к действию исследуемого пептида, по сравнению с дрожжевой культурой. В сравнительном аспекте наиболее близкие к ER-GRP гомологи, шаферины I и II из пастушьей сумки (Capsella bursa-pastoris) обладали более выраженным антифунгальным эффектом, в первую очередь, по отношению к дрожжевым культурам рода Candida в широком диапазоне действующих концентраций (1.56–50 мкМ) [25] и одновременно слабым эффектом против условно патогенных грибов, в частности, из рода Aspergillus [20].
Рис. 4.
Диско-диффузионный методом определения антифунгальной активности ER-GRP в отношении следующих культур: Aspergillus niger INA 00760 (а), A. fumigatus КПБ F-37 (б), Candida albicans ATCC 2091 (в).
При проверке пептида ER-GRP на способность к реактивирующему действию, обеспечивающему повышение уровня выживаемости пекарских дрожжей (Saccharomyces cerevisiae ВКПМ Y-1200) после УФ-облучения в пределах концентраций 7.5–52 мкМ, при 26 мкМ наблюдали ее достоверное увеличение в среднем в 1.46 раза по сравнению с контрольным вариантом (табл. 1). Характерно, что в случае аппликации биологически активного пептида растительного происхождения реактивирующее действие на культуру S. cerevisiae ВКПМ Y‑1200, подвергшуюся жесткому воздействию УФ-облучения, было выражено значительно меньше, чем при использовании реактивирующего фактора из Luteococcus japonicus sbsp. casei, который по химической природе также представлял короткий линейный пептид [26].
Таблица 1.
Реактивирующее действие АМП из колосьев пырея на подвергнутые стрессу клетки дрожжей S. cerevisiae*
| ER-GRP (конечная концентрация, мкМ) | КОЕ/мл, (выживаемость, %) | ||
|---|---|---|---|
| до стресса (К1) (%) | после стресса и инкубации с физ. р-ром (К2) (%) | после стресса и инкубации с пептидом (%) | |
| 52.0 | 60 × 106 (100) | 0.014 × 106 (0.023) | 0.025 × 106 (0.042) |
| 26.0 | 60 × 106 (100) | 0.014 × 106 (0.023) | 0.022 × 106 (0.0367) |
| 13.0 | 60 × 106 (100) | 0.014 × 106 (0.023) | 0.016 × 106 (0.0267) |
| 7.5 | 60 × 106 (100) | 0.014 × 106 (0.023) | 0.015 × 106 (0.025) |
Таким образом, выделен и охарактеризован новый пептид из колосьев пырея ползучего (E. repens) не содержащий в своей структуре остатков цистеина, а имеющий ряд чередующихся полиглициновых участков между которыми локализованы фрагменты, состоящие из полярных аминокислотных остатков. С-концевой фрагмент молекулы представляет собой положительно заряженный сайт, обогащенный остатками аргинина и гистидина. Функциональная характеристика данного пептида позволила установить наличие двух типов биологической активности – слабой антифунгальной и более выраженной реактивирующей, что является в достаточной степени уникальным примером участия одной и той же молекулы в иммунитете растений к стрессовым факторам как биотической, так и абиотической природы. Полученные данные расширяют представление о функциональных особенностях защитных пептидов растений необычного структурного типа, и позволит в дальнейшем обозначить подходы к их классификации.
Работа выполнена при финансовой поддержке Российского научного фонда (грант № 18-74-10073-П).
Список литературы
van der Weerden N.L., Bleackley M.R., Anderson M.A. // Cell. Mol. Life Sci. 2013. V. 70. № 19.P. 3545–3570. https://doi.org/10.1007/s00018-013-1260-1
Tam J.P., Wang S., Wong K.H., Tan. W.L. // Pharmaceuticals (Basel). 2015. V. 8. № 4. P. 711–757. https://doi.org/10.3390/ph8040711
SarikaIquebal M.A., Rai A. // Peptides. 2012. V. 36. № 2. P. 322–330. https://doi.org/10.1016/j.peptides.2012.05.012
Das K., Datta K., Karmakar S., Datta S.K. // Protein Pept. Lett.2019. V. 26. № 10. P. 720–742. https://doi.org/10.2174/0929866526666190619112438
Stec B. // Cell. Mol. Life Sci. 2006. V. 63. № 12. P. 1370–1385. https://doi.org/10.1007/s00018-005-5574-5
Parisi K., Shafee T.M.A., Quimbar P., van der Weerden N.L., Bleackley M.R., Anderson M.A. // Semin.Cell. Dev. Biol. 2019. V. 88. P. 107–118. https://doi.org/10.1016/j.semcdb.2018.02.004
Рогожин Е.А., Одинцова Т.И., Мусолямов А.Х., Смирнов А.Н., Бабаков А.В., Егоров Ц.А., Гришин Е.В. // Прикл. биохимия и микробиология. 2009. Т. 45. № 4. С. 403–409.
Рязанцев Д.Ю., Рогожин Е.А., Цветков В.О., Яруллина Л.Г., Смирнов А.Н., Завриев С.К. // Доклады Академии Наук. 2019. Т. 484. № 1. С. 104–106.
Odintsova T.I., Rogozhin E.A., Baranov Yu.V., Musolyamov A.Kh., Yalpani N., Egorov Ts.A., Grishin E.V. // Biochimie. 2008. V. 90. P. 1667–1673. https://doi.org/10.1016/j.biochi.2008.06.007
Уткина Л.Л., Жабон Е.О., Славохотова А.А., Рогожин Е.А., Шиян А.А., Гришин Е.В., Егоров Ц.А., Одинцова Т.И., Пухальский В.А. // Генетика. 2010. Т. 46. № 12. С. 1–7.
Slavokhotova A.A., Shelenkov A.A., Odintsova T.I. // Plant Mol. Biol. 2015. V. 89. № 3. P. 203–214. https://doi.org/10.1007/s11103-015-0346-6
Odintsova T.I., Slezina M.P., Istomina E.A. // Biomolecules. 2020. V. 10. № 7. E. 1029. https://doi.org/10.3390/biom10071029
Koetter U., Kaloga M., Schilcher H. // Part I. Planta Med. 1993. V. 59. № 3. P. 279–280. https://doi.org/10.1055/s-2006-959672
Beydokthi S.S., Sendker J., Brandt S., Hensel A. // Fitoterapia. 2017. V. 117. P. 22–27. https://doi.org/10.1016/j.fitote.2016.12.010
Кароматов И.Д. // Биология и интегративная медицина. 2017. № 6. С. 122–128.
Provencher S.W., Glöckner J. // Biochemistry. 1981. V. 20. № 1. P. 33–37. https://doi.org/10.1021/bi00504a006
Andreev Y.A., Kozlov S.A., Vassilevski A.A., Grishin E.V. // Anal. Biochem. 2010. V. 407. № 1. P. 144–146. https://doi.org/10.1016/j.ab.2010.07.023
Воробьева Л.И., Рогожин Е.А., Ходжаев Е.Ю., Володяшкин Р.А., Самойленко В.А. // Микробиология. 2017. Т. 86. № 6. С. 684–695.
Barashkova A.S., Rogozhin E.A. // BMC Plant Methods. 2020. V. 16. E. 143. https://doi.org/10.1186/s13007-020-00687-1
Park C.J., Park C.B., Hong S.S., Lee H.S., Lee S.Y., Kim S.C. // Plant Mol. Biol. 2000. V. 44. № 2. P. 187–197. https://doi.org/10.1023/a:1006431320677
Hilton H., Gaut B.S. // Genetics. 1998. V. 150. № 2. P. 863–872. https://doi.org/10.1093/genetics/150.2.863
Gorinstein S., Jaramillo N.O., Medina O.J., Rogriques W.A., Tosello G.A., Paredes-Lopez O. // J. Protein Chem. 1999. V. 18. № 6. P. 687–693. https://doi.org/10.1023/a:1020610424625
Czolpinska M., Rurek M. // Front Plant. Sci. 2018. V. 8. № 9. E. 302. https://doi.org/10.3389/fpls.2018.00302
Pelegrini P.B., Murad A.M., Silva L.P., Dos Santos R.C., Costa F.T., Tagliari P.D. et al. // Peptides. 2008. V. 29. № 8. P. 1271–1279. https://doi.org/10.1016/j.peptides.2008.03.013
Remuzgo C., Oewel T.S., Daffre S., Lopes T.R., Dyszy F.H., Schreier S. et al. // Amino Acids. 2014. V. 46. № 11. P. 2573–2586. https://doi.org/10.1007/s00726-014-1811-2
Рогожин Е.А., Воробьева Л.И., Ходжаев Е.Ю., Герасимов Е.С. // Микробиология. 2019. Т. 88. № 2. С. 137–143.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология