Прикладная биохимия и микробиология, 2023, T. 59, № 1, стр. 17-37
Механизмы ростстимулирующего и защитного действия эндофитных PGP-бактерий в растениях пшеницы при воздействии засухи (обзор)
О. В. Ласточкина 1, *, Ч. Р. Аллагулова 1
1 Институт биохимии и генетики – обособленное структурное подразделение Уфимского федерального исследовательского центра Российской академии наук
450054 Уфа, Россия
* E-mail: oksana.lastochkina@ufaras.ru
Поступила в редакцию 26.04.2022
После доработки 26.08.2022
Принята к публикации 02.09.2022
- EDN: CUREEM
- DOI: 10.31857/S0555109923010038
Аннотация
Обзор посвящен анализу и систематизации современных данных об участии эндофитных ростстимулирующих (PGP)-бактерий в регуляции роста, развития, формировании урожая и стрессоустойчивости культурных растений, главным образом яровой пшеницы, являющейся ведущей в мире хлебной культурой. Описаны сведения о взаимодействии растений с PGP-бактериями в норме и при воздействии засухи. Особое внимание уделено молекулярным механизмам регуляции PGP-бактериями растительного метаболизма в норме, а также их роли в снижении негативных последствий засухи, достигаемом путем модуляции в растениях различных процессов, в частности водного обмена, минерального питания, активации антиоксидантной и осмопротекторной систем. При этом важную роль играет способность PGP-бактерий продуцировать различные метаболиты, обладающие свойствами биологически активных веществ, например, веществ с антимикробной и гормональной активностью, ферментов и других соединений. Приведены сведения об эндофитном микробиоме пшеницы, выяснение функциональной активности которого необходимо для разработки эффективных и безопасных стратегий практического применения эндофитов с целью максимальной реализации адаптационного и продуктивного потенциала пшеницы в меняющихся условиях среды.
В связи с глобальными климатическими изменениями возрастает частота возникновения неблагоприятных природных явлений, среди которых засуха принадлежит к числу наиболее широко распространенных и непредсказуемых внешних факторов [1, 2]. Ее воздействие негативно отражается на всех звеньях растительного метаболизма, включая фотосинтез, дыхание, биосинтез белка, что приводит к торможению роста, развития и снижению продуктивности культурных растений [1–4]. По оценкам ФАО (FAO, Food and Agriculture Organization United Nations) потери урожая, вызываемые засухой, могут составлять свыше 50 и достигать 80%, что представляет серьезную проблему для мировой продовольственной безопасности [1, 2]. Для удовлетворения потребностей растущего населения планеты, численность которого к 2050 г. должна превысить 9 млрд человек, производство продуктов питания необходимо увеличить на 70%, а в развивающихся странах вдвое, преимущественно за счет повышения эффективности возделывания зерновых культур [5, 6]. Главной продовольственной культурой, на долю которой приходится более трети всех пахотных площадей и составляющей более 50% рациона человека является пшеница, потребление которой в 2019 г. составляло 98.7 кг в год на человека [7].
Пшеница представляет собой растение с однолетним циклом и являющееся озимым или яровым злаком [1, 5, 8–10]. На практике при возделывании культур, предусматривается применение различных удобрений и ряда химических препаратов, в частности фунгицидов и гербицидов, использование которых представляет серьезную угрозу для окружающей среды и здоровья человека. В этой связи возрастает актуальность поиска эффективных и экологически безопасных путей повышения урожайности культурных растений и снижения уровня негативного воздействия на них стрессовых факторов окружающей среды путем индукции естественных защитных механизмов растений [1, 5, 8–10].
В современном растениеводстве все более широкое распространение приобретает стратегия праймирования, которая заключается в повышении природной сопротивляемости растений под влиянием различных индуцирующих агентов [11–14]. При праймировании активация защитных программ происходит при воздействии на растения мягких внешних стимулов и сигналов, способствующих предварительной настройке растительного метаболизма к возможным в последующем неблагоприятным ситуациям [12, 15]. В качестве праймирующих агентов могут быть использованы слабые кратковременные стрессовые обработки, различные биологически активные соединения, сигнальные молекулы или микроорганизмы [12]. Опосредованная праймингом защита может быть длительной, поддерживаться на протяжении всего жизненного цикла растений и даже передаваться следующему поколению. Одной из наиболее перспективных на сегодняшний день представляется технология биопраймирования, основанная на применении полезных микроорганизмов, в частности стимулирующих рост растений бактерий, обозначаемых в литературе как PGP-бактерии (PGPB – plant growth-promoting bacteria) [14, 16]. Праймирование (предпосевная обработка) PGP-бактериями улучшает урожай и рост растений, не оказывая негативного влияния на их развитие и морфологию [15]. В растениях, предобработанных PGP-бактериями, как правило, значимых изменений в экспрессионной активности защитных генов не выявляется, однако в случае какой-либо патогенной атаки или абиотического стресса предобработанные растения отличаются от необработанных более быстрым и сильным ответом [15, 17–19]. PGP-бактерии оказывают положительное влияние на растительный организм за счет собственного синтеза различных биологически активных веществ, содействуя максимальной реализации потенциала культурных растений, являясь при этом дружественными окружающей среде [6, 16, 20, 21]. В последние годы наблюдается лавинообразный рост числа работ, свидетельствующих о повышении под влиянием PGP-бактерий устойчивости культурных растений, в том числе и пшеницы, к различным стрессовым факторам биотического [22–25] и абиотического происхождения [26–31], включая засуху [16, 21, 32–36].
Ассоциированная с растениями микробиота включает 3 группы: (1) эпифитная – микробиота, обитающая на поверхности наземных частей растений; (2) ризосферная – почвенная микробиота, обитающая у корней; (3) эндофитная – микробиота, колонизирующая внутренние ткани растения [37]. В зависимости от типа воздействия на рост растений различают полезные, вредные и нейтральные бактерии. Среди ассоциированных со злаковыми культурами PGP-бактерий, идентифицированы виды, принадлежащие к таким родам как Bacillus, Azospirillum, Arthrobacter, Acinetobacter, Azotobacter, Citricoccus, Lysinibacillus, Burkholderia, Paenibacillus, Serratia, Pseudomonas и т.д. [31, 35, 38, 39]. Особым преимуществом отличаются полезные эндофитные PGP-бактерии или эндобактерии, жизнедеятельность которых бессимптомно протекает внутри растительного организма, оказывающих положительное влияние на растительный метаболизм изнутри, обеспечивая защиту растения-хозяина от неблагоприятных внешних условий [20, 37, 40]. Кроме того, внедрившись однажды в растительный организм, эндобактерии способствуют формированию долговременной защиты растений, как в ходе всего онтогенеза, так и в послеуборочный период при хранении продукции [16, 33, 36, 41–44]. Эндофитные микроорганизмы распространены среди растительных организмов повсеместно и обнаруживаются в разных частях растений [20, 40, 45, 46]. Рост эндофитов в растительных тканях находится под контролем своего хозяина. Поддержание стабильного симбиоза с растениями достигается благодаря микробной продукции различных соединений, способствующих росту растений и их адаптации к внешним условиям [15]. Вместе с тем многие аспекты взаимодействия эндофитных PGP-бактерий с растениями пшеницы при воздействии засухи недостаточно ясны и требуют дальнейшего детального изучения. Следует также обратить внимание на то, что эффективность определенного штамма PGP-бактерий в отношении одного и того же растительного вида может варьировать в зависимости от способа обработки, генотипа растения, географии произрастания, вида стресса и других факторов [46, 48–50].
В данном обзоре проведены анализ и систематизация современных данных о вовлечении эндофитных PGP-бактерий в регуляцию ростовых процессов, формирование урожая и развитие защитных реакций культурных растений. Особое внимание уделено взаимодействию эндофитов с растениями пшеницы, описаны множественные физиолого-биохимические и молекулярные механизмы, лежащие в основе проявления PGP-бактериями ростстимулирующего и защитного эффектов на растения пшеницы в норме и при воздействии засухи. Представлены имеющиеся сведения об эндофитном микробиоме пшеницы, выяснение роли и функций которых может иметь принципиально важное значение для разработки эффективных технологий их практического применения для повышения продуктивности пшеницы в долгосрочной перспективе с сохранением окружающей среды.
МЕХАНИЗМЫ РЕАЛИЗАЦИИ ФИЗИОЛОГИЧЕСКОГО ДЕЙСТВИЯ PGP-БАКТЕРИЙ НА РАСТЕНИЯ
Имеющиеся в литературе данные позволяют утверждать, что в основе физиологического действия полезных микроорганизмов на растения лежат множественные механизмы, которые можно отнести к двум группам: прямые и косвенные [43]. При этом обе группы механизмов обуславливаются способностью PGP-бактерий продуцировать широкий спектр биологически активных веществ, например соединений с антимикробной активностью, гормонов (ауксины, цитокинины (ЦК), гиббереллины (ГБ), абсцизовая кислота (АБК), салициловая кислота (СК), жасмонаты, этилен), различных ферментов, в частности 1-аминоциклопропан-1-карбоксилат (AЦК)дезаминазу, летучих органических соединений (ЛОС), экзополисахаридов (ЭПС), биосурфактантов, сидерофоров и др. Прямые механизмы модуляции метаболизма растений могут осуществляться за счет регуляции в них эндогенного уровня фитогормонов и повышения доступности элементов минерального питания при участии PGP-бактерий в процессах азотфиксации, солюбилизации фосфатов, секвестрации железа [30, 51–53]. Непрямые механизмы связаны с индуцированием в растениях системных защитных реакций при воздействии неблагоприятных факторов окружающей среды [43]. Тесное функциональное взаимодействие разнообразных прямых и непрямых механизмов влияния PGP-бактерий на растения в совокупности способствует стимуляции роста в нормальных условиях произрастания и развитию их устойчивости при неблагоприятных внешних воздействиях, вызывающих дефицит влаги (рис. 1).
Рис. 1.
Основные механизмы ростстимулирующего и антистрессового действия эндофитных PGP-бактерий на растения пшеницы в условиях засухи. АБК – абсцизовая кислота; АО – антиоксиданты; АПО – аскорбатпероксидаза; АФК – активные формы кислорода; АЦК дезаминаза – 1-аминоциклопропан-1-карбоксилат-дезаминаза; ГБ – гиббереллины; ГР – глутатион редуктаза; ЖК – жасмоновая кислота; ИУК – индолил-3-уксусная кислота; КАТ – каталаза; ЛОС – летучие органические соединения; ПО – пероксидаза; СК – салициловая кислота; СОД – супероксиддисмутаза; ЦК – цитокинины; ЭПС – экзополисахариды; P – фосфор; K – калий; N – азот.
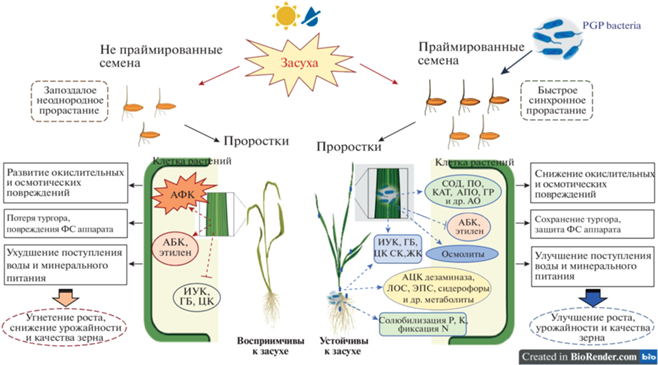
Улучшение минерального питания растений. Одним из свойств эндофитных PGP-бактерий, обусловливающим их способность оказывать положительное влияние на рост и развитие растений в норме и при стрессе, является их способность повышать доступность элементов минерального питания, т.е. функционировать в качестве биоудобрений [24, 53, 54] (рис. 1). К числу основных элементов питания растений принадлежит азот (N), который по количественному содержанию в клетке занимает четвертое место (после углерода, водорода и кислорода) и является обязательным компонентом азотистых оснований, нуклеиновых кислот и белков. Дефицит N легко распознается на злаковых культурах характерным осветлением всего растения и побурением сначала нижних листьев, а затем листьев в средней части растения, которые впоследствии засыхают. В таком состоянии замедляется протекание процессов, формирующих будущий урожай. Так, если недостаток N проявился в фазе кущения, прекращается образование продуктивных побегов, если в фазе трубки – в растениях наблюдается торможение процесса закладки дополнительных “этажей” в колосе, то есть дефицит N в фазе флагового листа приводит к тому, что не образуются дополнительные цветки, а во время колошения – зерновки. А если азотное голодание наступает во время налива зерна, то зерновки будут щуплыми, невыполненными и плохого качества [55].
Ассимиляция N в растениях пшеницы осуществляется главным образом за счет активности корней. При этом в цитозоле нитрат редуцируются до нитрита под действием НАДФН-зависимой нитратредуктазы (НАДФН-НР). На сегодняшний день в гексаплоидной пшенице идентифицированы два гена, кодирующих фермент НАДФН-НР. Поскольку нитриты характеризуются высокой реакционной способностью и могут оказывать токсическое действие на клетку, происходит их быстрая транспортировка из цитозоля в хлоропласты и пластиды, где под действием нитритредуктазы происходит превращение нитрита в ионы аммония (NH4+). Затем аммоний ассимилируется с образованием глутаминовой аминокислоты и глутамата, которые служат источником азота при синтезе других азотсодержащих соединений: аминокислот, азотистых оснований, РНК, ДНК [56]. Aктивно обсуждается роль PGP-бактерий в процессах ассоциативной азотфиксации, способствующей интенсификации роста растений, включая пшеницу. Помимо ризобиальных микроорганизмов (Rhizobium, Sinorhizobium, Bradyrhizobium, Mesorhizobium, Azorhizobium), для которых широко известно образование симбиозов с бобовыми растениями и участие в азотфиксации последних, выявлены представители эндофитных PGP-бактерий, как например, Pseudomonas, Bacillus и Azospirillum, способных к фиксации атмосферного азота (N2), а также усвоению его органических и минеральных соединений из почв, повышающих его доступность для растений пшеницы [10, 56, 57]. Было показано, что инокуляция растений пшеницы B. subtilis 2 способствовала усвоению азота, вносимого с минеральными удобрениями и уменьшению соответственно доз вносимых удобрений. При этом эти бактерии не только принимали участие в процессах трансформации азота (денитрификации и аммонификации), но и стимулировали деятельность других ризосферных азотфиксаторов [58].
Сообщается, что за счет обработки Azotobacter brasilense можно уменьшить дозу внесения азотных удобрений на 30–40 кг/га [53, 59, 60]. Например, A. brasilense обеспечило большее накопление азота (+35.5 кг/га) и микроэлементов (B, Fe, Mn, Cu) в надземной части пшеницы по сравнению с неинокулированными растениями [53], вероятно, за счет улучшения развития корневой системы, которая позволяет охватить больший объем почвы и способствует более активному усвоению питательных веществ [10, 61, 62]. В более ранних работах также сообщалось о синергическом эффекте между A. brasilense и увеличением эффективности абсорбции питательных веществ (N, P и K) в растениях пшеницы [63]. Галиндо с соавт. [61] также наблюдали, что A. brasilense AbV5 и AbV6 увеличивали концентрации N, Ca, Mg, Mn и Zn в зернах пшеницы.
Фосфор (Р) является основным, после азота, питательным элементом, лимитирующим рост, и в отличие от него, не имеет атмосферного биологически доступного источника. В сельскохозяйственной практике традиционно для улучшения фосфорного питания культурных растений регулярно используются минеральные удобрения, большая часть которых после внесения в почву быстро превращается в нерастворимую форму и доступность его для растений резко снижается [55]. Это требует внесений новых фосфорных удобрений и, таким образом, происходит накопление в почве больших количеств нерастворимых и не усвояемых растениями соединений фосфора, что приводит к “зафосфачиванию” почв. В повышении доступности этого элемента для растений большую роль играют микроорганизмы, способные растворять нерастворимые в воде и недоступные растениям формы почвенных соединений фосфора за счет продуцирования фосфатаз, органических кислот, сидерофоров, солюбилизирующих фосфаты и способствующих их усвоению растениями. Р-солюбилизирующая активность продемонстрирована для представителей родов Pseudomonas, Bacillus, Rhizobium, Enterobacter, Azospirillum [63–65].
Следующим по значимости после фосфора питательным элементом является калий (K), играющий незаменимую роль в метаболизме растений. Он необходим для нормального функционирования около сотни, ответственных за нормальное протекание различных процессов, например, таких как энергетический метаболизм, синтез крахмала, восстановление нитратов, фотосинтез и деградация сахара. Почвенный K в форме калий-алюмосиликатов, составляющий 98–99% от его общего содержания, труднодоступен для питания растений, однако его доступность может быть существенно повышена за счет микробной мобилизации. Так как использование калийных удобрений оказывает вредное воздействие на окружающую среду, необходимо найти альтернативный источник для поддержания его уровня в почвах для устойчивого производства сельскохозяйственных культур [55, 66]. К настоящему времени накопились данные, свидетельствующие о способности PGP-бактерий наряду с азотом и фосфором также повышать и содержание калия в растениях пшеницы [63]. Чандра с соавт. [67] показали, что такие виды бактерий, как Variovorax paradoxus RAA3, Pseudomonas sp. UW4, P. palleroniana DPB16 способны увеличивать содержание N, P, K, Ca2+ и Na+ как в зерне пшеницы, так и в соломе.
Положительное влияние на минеральное питание и рост растений могут оказывать продуцируемые PGP-бактериями биосурфактанты – липопептидные вещества, обладающие поверхностно-активными свойствами, способными снижать коэффициент межфазного натяжения и эмульгировать труднорастворимые гидрофобные соединения, повышая их биодоступность для растений. Образование биосурфактантов выявлено для представителей родов Pseudomonas и Bacillus [24]. Биосурфактанты PGP-бактерий могут воздействовать на патогены, изменяя проницаемость их клеточных мембран, вызывая лизис клеток и продукцию сидерофоров, которые могут ограничивать рост патогенов [68]. Сидерофоры, переводя железо (Fе) в доступную для клеток форму, могут повышать его биодоступность для растений и способствовать его усвоению. Таким образом, сидерофоры могут вносить свой вклад в проявление ростстимулирующего и защитного действия PGP-бактерий. На сегодняшний день получены сведения о стимуляции роста многих видов растений под действием сидерофоров разного типа и их практическом применении с целью повышения урожайности сельскохозяйственных культур [69–71]. В частности, ростстимулирующее действие на растения было показано для псевдобактина – сидерофора, очищенного из штамма P. putida [70, 71].
Применение эндофитных PGP-бактерий в качестве биоудобрений рассматривается как метод, альтернативный химическим удобрениям, наносящим серьезный ущерб не только растительным организмам, но всей биосфере в целом. Эндофитные PGP-бактерии можно использовать для праймирования семян и внесения в почву для получения более высокого урожая и улучшения здоровья почвы с помощью достаточного количества питательных веществ и ценной микрофлоры, поддерживая тем самым устойчивость агроэкосистем.
Продукция фитогормонов и регуляция их уровня в растениях. Ключевая роль в регуляции растительного онтогенеза и формировании устойчивости растений к стрессовым факторам среды принадлежит гормональной системе [3, 72]. Поэтому неудивительно, что ростстимулирующее и защитное действие эндофитных PGP-бактерий связывают с их способностью оказывать влияние на содержание фитогормонов в растениях и самим синтезировать вещества с гормональной активностью. Таким образом, в этом случае имеет место сложное взаимодействие гормональных систем двух партнеров, определяющее характер изменений в жизненной активности растений под влиянием эндофитов. Помимо пяти основных классов фитогормонов, к числу которых относят ауксины, ЦК, ГБ, этилен и АБК, гормональная активность была четко продемонстрирована для брассиностероидов (БС), СК, жасмонатов и стриголактонов. Если ауксины, ЦК, ГБ, БС и стриголактоны рассматриваются в качестве признанных активаторов метаболических процессов, то АБК, этилен, жасмонат и СК чаще относят к индукторам стрессовых ответов в растениях. Следует отметить, что различные процессы растительного онтогенеза контролируются не каким-то отдельным гормоном, а определенным соотношением фитогормонов, функционирующих в тесном взаимодействии в единой гормональной системе. Различные представители PGP-бактерий, в том числе эндофиты, принадлежащие к таким родам как Azospirillium, Pseudomonas, Bacillus и др., способны синтезировать гормональные соединения, такие как ауксины, ЦК, ГБ, АБК, ЖК, СК и этилен [29, 57, 73–75].
Ауксины. Среди эндофитных PGP-бактерий широко распространена способность к синтезу ауксинов, контролирующих развитие сосудистых тканей, растяжение клеток и апикальное доминирование в растениях. К природным ауксинам принадлежит индолил-3-уксусная кислота (ИУК) и к сегодняшнему дню хорошо изучен ее бактериальный синтез. Выявлены биохимические пути и гены, контролирующие синтез ИУК бактериями. PGP-бактерии влияют на экспрессию генов, белковые продукты которых принимают участие в реакциях биосинтеза ауксина, передачи сигналов или его транспортировки. Phyllobacterium brassicacearum STM196 и Bacillus sp. LZR216 повышали эндогенный уровень ИУК за счет индукции экспрессии генов синтеза ИУК [76]. Установлено, что для образования ИУК некоторыми PGP-бактериями необходимо присутствие в корневых выделениях ее метаболического предшественника L-триптофана. Обработка Burkholderia phytofirmans PsJN Arabodopsis thaliana увеличивала экспрессию генов, вовлеченных в биосинтез триптофана, и способствовала тем самым повышению уровня накопления ауксина. PGP-бактерии влияют на транспорт ауксина, изменяя активность и содержание переносчиков, участвующих в процессах оттока и притока ауксина. Так, штамм Bacillus sp. LZR216 снижал синтез транспортеров ауксина AUX1 и PIN1,2,3 [77], тогда как штамм B. phytofirmans PsJN, напротив, усиливал экспрессию PIN2 и PIN3 [78]. Получены данные о благоприятном действии ИУК, синтезируемой эндофитными PGP-бактериями, на корневую систему своих растений-хозяев стимулирующем инициацию, удлинение и ветвление корней, что в целом может способствовать улучшению потребления микро- и макроэлементов, ускорению роста растений и формированию устойчивости к неблагоприятным факторам среды [38, 79]. Инокуляция растений пшеницы синтезирующими ИУК PGP-бактериями стимулировала процессы образования и роста корней, с чем может быть связано усиление их поглотительной способности и повышение уровня поступления воды и питательных веществ в эти растения в условиях водного стресса [26, 80]. Streptomyces, продуцирующие ИУК также улучшали параметры роста и развития пшеницы в условиях нарушения водного режима [69]. Штамм A. brasilense Sp245 способствовал повышению качества зерна пшеницы, усвоению элементов минерального питания (K, Ca, Mg), поддержанию водного потенциала, абсолютного и относительного содержания воды (ОСВ) в тканях, а также сохранению эластичности клеточной стенки, что в совокупности оказывало положительное влияние на развитие засухоустойчивости растений пшеницы [81]. Продуцирующий ИУК штамм Azospirillum снижал степень негативного действия засоления на растения пшеницы, о чем можно было судить по улучшению различных продукционных параметров, включая биомассу, содержание хлорофилла и концентрацию питательных микроэлементов [82]. Имеются данные о снижении азоспириллами водного потенциала листьев и одновременном повышении в них содержания воды, что является следствием способности этих бактерий продуцировать ИУК, индуцировать формирование и рост латеральных корней растений пшеницы и повышать, таким образом, уровень поглощения воды и элементов питания в условиях засухи [32]. Важно отметить, что PGP-бактерии продуцируют ауксины в оптимальной для стимуляции роста корней концентрации, поскольку высокие концентрации ауксинов характерны для бактерий, вызывающих торможение роста корней [74]. Кроме того, PGP-бактерии могут влиять на гомеостаз ауксина посредством различных штамм-зависимых механизмов. Понимание характеристик каждого штамма PGP-бактерий является ключом к его продуктивному использованию в сельском хозяйстве [83].
Цитокинины (ЦК). Присутствие ЦК ранее было выявлено в фильтрате культур ряда бактерий, включая Azotobacter sp., Arthtrobacter, Rhizobium spp., Pantoea agglomerans, Rhodosprillum rubrum, Pseudomonas fluorescens, Bacillus subtilis и Paenibacillus polymyxa [84]. Вместе с тем, несмотря на то, что для перечисленных бактерий была зарегистрирована эндофитная активность, в литературе недостаточно сведений об ускорении ростовых процессов в растениях под влиянием продуцируемыми бактериями ЦК. Тем не менее, имеются данные об активации ростовых процессов растений пшеницы и стимуляции накопления биомассы при их инокуляции продуцирующими ЦК бактериями [74]. В частности, введение в прикорневую среду проростков пшеницы B. subtilis IB-22 приводило к значительному увеличению содержания эндогенных ЦК в побегах проростков и сопровождалось повышением скорости роста листьев и накоплением сырой и сухой массы побегов [85]. Был сконструирован штамм Sinorhizobium meliloti с избыточной продукцией ЦК путем экспрессии гена ipt Agrobacterium, находящегося под контролем промотора trp E. coli [86]. После воздействия сильной засухи, растения люцерны инокулированные сконструированным штаммом S. meliloti отличались более крупными размерами по сравнению с образцами, инокулированными исходным штаммом. Несмотря на относительно невысокую распространенность продуцирующих ЦК эндофитных бактерий, приведенные выше данные могут указывать на их участие в формировании устойчивости растений к дефициту влаги.
Гиббереллины (ГБ). Стимулирующая рост растений активность эндофитных PGP-бактерий может обуславливаться их способностью синтезировать гормоны, принадлежащие к классу ГБ [74]. Например, для эндофитных бактерий B. subtilis 11ВМ оказывающих стимулирующий рост эффект на растения пшеницы, выявлена ГБ-подобная активность [87]. Штамм PGP-бактерии Burkholderia phytofirmans PsJN не влиял напрямую на синтез ГБ, но стимулировал экспрессию гена AtGA3ox1, кодирующего фермент, катализирующий финальные реакции образования ГБ у A. thaliana [88]. Полный путь бактериального биосинтеза ГБ был описан лишь относительно недавно [89].
Сообщалось о продукции физиологически активных форм ГБ GA1 и GA3 (GA, Gibberellic Acid), a также ИУК эндофитными бактериями Acetobacter diazotrophicus и Herbaspirillum seropedicae, которые формировали эффективное взаимодействие со злаковыми культурами и способствовали улучшению роста и общей урожайности [90]. В ходе культивирования бактерий Rhizobium phaseoli дикого типа или мутантных nod- и fix- штаммов проводился анализ продукции ими ГБ и ИУК сочетанием методов высокоэффективной жидкостной хроматографии и иммуноанализа [91]. Наличие молекул, подобных GA1, GA4, GA9 и GA20 было подтверждено с помощью хроматографического подхода и масс-спектрометрии, однако молекула подобная GA20 присутствовала только в некоторых культурах, но не во всех, тогда как GA9 обнаруживалась лишь в незначительных количествах по сравнению с GA1 и GA4 [91]. Изучение nod- и fix-мутантов показало, что продукция ГБ не зависит от генов, участвующих в образовании клубеньков и в процессе азотфиксации у Rhizobium phaseoli. Для бактериального эндофита Sphingomonas sp. LK11, выделенного из листьев бобовых растений Tephrosia apollinea (Азия, Африка), была продемонстрирована способность к синтезу физиологически активной GA4 формы ГБ и неактивных GA9 и GA20 форм [92], что сопровождалось способностью увеличивать длину побегов растений томата, содержание хлорофилла и сухой массы [92].
Абсцизовая кислота (АБК). При воздействии засухи обезвоживание клеток является сигналом для быстрого синтеза и накопления АБК, играющей ключевую роль в развитии стрессоустойчивости растений. АБК вовлекается в поддержание водного баланса, регулируя закрытие устьиц и связанное с ним предотвращение избыточной потери влаги. Кроме того, она участвует в передаче стрессовых сигналов и переключении генетических программ с нормы на стресс, связанных с индукцией экспрессии защитных генов [72]. Было показано, что около 2/3 из 2000 индуцируемых засухой генов регулируется АБК [93], что лежит в основе адаптации растений к различным стрессам, приводящим к нарушению водного режима. Хотя прямое участие АБК в контролировании роста растений недостаточно изучено, сведения о карликовости АБК-мутантных растений, указывают на ее необходимость в поддержании роста в нормальных условиях [74].
Обнаружено, что некоторые штаммы PGP-бактерий повышают уровни секретируемой растениями АБК при воздействии водного стресса. При этом пока не ясно синтезируется ли АБК бактериями или растениями. Более того, было показано, что ингибирование биосинтеза АБК подавляет экспрессию TaAQP7 – гена белка водного транспорта аквапорина, активность которого возрастает при воздействии водного стресса. Эти сведения указывают на вовлечение АБК в up-регуляцию TaAQP7 гена в качестве модулятора засухоустойчивости растений. Сообщалось, что продуцирующие АБК бактерии рода Azospirillum оптимизировали водный обмен разных видов культурных растений в условиях засухи, что способствовало повышению их урожайности [94, 95]. Штамм A. brasilense Sp245 стимулировал накопление АБК в растениях A. thaliana, что приводило к снижению уровня транспирации в листьях [96]. В растениях, инокулированных продуцирующими АБК штаммами A. brasilense Sp245, B. licheniformis RtM10, P. fluorescens RtM10 увеличивалось эндогенное содержание АБК, и растения становились устойчивыми к засухе. Растения, обработанные B. aryabhattai, характеризовались более высокой устойчивостью к тепловому стрессу и повышенным уровнем продукции АБК, индуцирующей закрытие устьиц в этих растениях [97]. Штаммы B. subtilis LDR2, Arthrobacter protophormiae SA3 и Dietzia natronolimnaea STR1 способствовали поддержанию фотосинтетической активности растений пшеницы в условиях засухи. При этом, B. subtilis LDR2 и Artrobacter protophormiae SA3 снижали стресс-индуцируемое накопление АБК и предшественника этилена АЦК, тогда как Dietzia natronolimnaea STR1 существенного влияния на содержание этих соединений не оказывал [29]. Проростки пшеницы, предобработанные A. protophormiae SA3, D. natronolimnaea STR1 и B. subtilis LDR2 характеризовались усилением экспрессии TaCTR1 гена, кодирующего ключевой негативный регулятор этиленовой сигнальной трансдукции, а также гена, кодирующего TaDREB2-фактор транскрипции, вовлекаемого в регуляцию формирования устойчивости растений к широкому спектру абиотических стресс-факторов. Повышение устойчивости растений пшеницы к засухе и засолению под влиянием B. subtilis LDR2, A. protophormiae SA3 и D. natronolimnaea STR1 может быть обусловлено одновременным повышением содержания ИУК и снижением АБК и АЦК, а также модулированием активности CTR1-регуляторного компонента этиленового сигналинга и DREB2-транскрипционного фактора [29]. Кроме того, сообщается, что АБК индуцирует толерантность за счет антагонизма передачи сигналов ЦК [41], а после инокуляции PGP-бактериями в условиях стресса увеличивается накопление AБК [98, 99]. Есть свидетельства того, что B. subtilis оказывает влияние на рост и толерантность растений через устьичную регуляцию [100] с участием АБК, которая, в свою очередь, контролируется СК.
Этилен. Этилен вовлекается в регуляцию прорастания семян и выведение их из состояния покоя, однако, если после прорастания его уровень оказывается слишком высоким, замедляется рост и удлинение корней. Одним из механизмов стимуляции PGP-бактериями роста растений является снижение в них уровня этилена путем дезаминирования непосредственного его предшественника АЦК, являющегося источником питания для некоторых видов PGP-бактерий. Реакция протекает при участии ключевого фермента системы этилензависимой регуляции роста растений АЦК-дезаминазы [74]. Использование бактериями АЦК в качестве источника питания приводит к уменьшению его содержания в растениях и, соответственно, сокращению синтеза этилена в корнях и ускорению роста растений. На примере различных видов растений, включая пшеницу, показана эффективность использования PGP-бактерий, продуцирующих AЦК-дезаминазу, для снижения уровня этилена и улучшения роста растений в условиях абиотических стрессов [34, 67, 101]. К примеру, PGP-бактерии Ochrobactrum pseudogrignonense RJ12, Pseudomonas sp. RJ15 и B. subtilis RJ46, продуцирующие АЦК-дезаминазу, подавляли в растениях экспрессию гена АЦК-оксидазы, катализирующей образование этилена АЦК, а также снижение концентрации самого АЦК. Продуцирующие АЦК-дезаминазу бактерии способствовали поддержанию скорости роста корней и побегов и накоплению биомассы растений, подвергнутых водному стрессу [52].
Салициловая и жасмоновая кислоты (СК и ЖК). Во многих исследованиях было показано, что ростстимулирующая и антистрессовая активность PGP-бактерий, в том числе эндофитных, связана с их способностью синтезировать сигнальные молекулы СК и ЖК, играющих ключевую роль в запуске системной индуцированной устойчивости растений к стрессам, обусловленной активацией СК- и ЖК-зависимых защитных сигнальных путей [27, 57, 102–104]. СК или ЖК-зависимые реакции являются доминирующими первичными сигналами местных и системных индуцированных защитных ответов растений в ответ на стрессы [16, 52], и антистрессовый эффект PGP-бактерий на растения может быть связан с их способностью синтезировать эти соединения [22, 27, 103, 105, 106]. СК участвует в регуляции различных физиологических процессов, включая цветение, термогенез, закрытие устьиц и ионный транспорт, а также в инициации защитных реакций растений при биотических и абиотических стрессовых воздействиях [107]. СК играет жизненно важную роль в процессах роста и развития в норме и активно участвует в реакциях растений на засуху через активацию антиоксидантных ферментов, регуляцию экспрессии генов, синтез осмолитов и усиление накопления фотосинтетических пигментов [3, 107]. Имеются данные о том, что сигнальные пути растений, регулирующие развитие защитных реакций в ответ на стрессы, являются ключевыми мишенями PGP-бактерий [22, 49, 57]. Например, обработка B. subtilis UMAF6639 способствовала формированию стойкой резистентности дыни к мучнистой росе благодаря активации ЖК- и СК-зависимых защитных реакций [105]. Эндобактерии B. cereus AR156 индуцировали системную устойчивость A. thaliana, опосредованную NPR-1 и СК-зависимыми сигнальными путями, не оказывая влияния на ЖК/этилен-зависимые пути [22]. Формирование устойчивости нута под влиянием Pseudomonas также происходило благодаря продукции фенольных соединений и индукции системной устойчивости через СК-зависимый сигнальный путь [108]. Эндофитные Achromobacter xylosoxidans и B. pumilus усиливали рост подсолнечника в условиях водного стресса за счет эндогенной продукции СК [105, 109]. У растений табака дикого типа B. amyloliquefaciens FZB42 приводил к сверхэкспрессии генов PR-1a, LOX и ERF1, участвующих в СК, ЖК и этилен-зависимых сигнальных путях [110]. При этом остается неясным, как именно эндофитные PGP-бактерии регулируют систему защиты растений от засухи и как индуцированная бактериями система защиты растений взаимодействует с классическими сигнальными путями. Вероятно, влияние PGP-бактерий аналогично действию “слабых” патогенов на растения, однако PGP-бактерии также могут продуцировать метаболиты с гормональными и сигнальными функциями (ауксины, ЦК, этилен, ГБ, АБК, СК, ЖК) [16, 52]. Недавно было показано, что в нормальных условиях произрастания и при засухе содержание эндогенной СК в растениях пшеницы существенно варьировало в зависимости от их сорта и восприимчивости к засухе, в том числе под влиянием эндофитных бактерий B. subtilis 10-4 [49].
Таким образом, продуцируемые эндофитными PGP-бактериями фитогормоны могут участвовать не только в стимуляции роста растений и улучшении минерального питания, но и в их защите от широкого спектра стрессовых воздействий биотического и абиотического происхождения, включая обезвоживание. Однако точная роль продуцируемых эндофитами фитогормонов и механизмы их биосинтеза в растениях еще полностью не выяснены и требуются дальнейшие более углубленные исследования для лучшего понимания взаимодействия бактерий с растениями в условиях засухи.
Продукция других метаболитов и физиологически активных соединений. При воздействии засухи эндофитные PGP-бактерии в тканях растений могут продуцировать множество вторичных метаболитов в виде смеси ЛОС, способствующих ускорению роста растений и снижению повреждающего действие стрессовых факторов [41, 111, 112]. Выявлен широкий спектр ЛОС, продуцируемых PGP-бактериями, включая короткоцепочечные алифатические альдегиды и кетоны, простые и сложные эфиры, спирты, серосодержащие соединения и углеводороды [113, 114]. Синтезируемые PGP-бактериями ЛОС могут функционировать как сигнальные молекулы, играя важную роль в стимуляции роста растений и индукции системной устойчивости при патогенезе. ЛОС и их способ действия обладают дополнительным преимуществом по сравнению с другими системами биоконтроля и регулирования роста, поскольку ЛОС не требуют физического взаимодействия с частями растений или патогенами [115, 116]. К настоящему времени в единой базе данных о микробных ЛОС mVOC 3.0 Database, https://bioinformatics.charite.de/mvoc/ (mVOC, microbial Volatile Organic Compounds) зарегистрировано более 1000 различных ЛОС, продуцируемых бактериями и грибами [117]. Микробные ЛОС играют важную роль в дистанционной коммуникации микробных сообществ и участвуют, как в коммуникации между микробами, так и между растениями и микробами в ризосфере [118]. Также ЛОС влияют на экспрессию генов, участвующих в гормональной передаче сигналов, защитных путях и вызываемой микробами стресс-устойчивости, вирулентности и образовании биопленок [118, 119]. ЛОС служат сигналами для развития у растений прайминга и системной реакции на стрессы [103, 120]. В условиях засухи замачивание проростков пшеницы B. thuringiensis AZP2 увеличивало биомассу растений и увеличивало выживаемость из-за изменения продукции ЛОС и более высокого уровня фотосинтетической активности [121]. При колонизации P. chlororaphis 06 в корнях растений образовывался летучий метаболит 2R,3R-бутандиол, способствующий закрыванию устьиц, снижению потери воды и повышению засухоустойчивости [122]. Alcaligenes faecalis улучшал рост A. thaliana продуцируя смесь ЛОС, которые контролируют пути синтеза ауксина и ГБ, участвующих в росте и развитии корней и побегов в стрессовых условиях [123], а также регулируют транспортеры ионов [124]. Было предположено, что продуцируемые PGP-бактериями ЛОС могут индуцировать устойчивость растений к засухе через СК-зависимый механизм [122, 125], а также через регуляцию образования микробной биопленки вокруг корней [126]. Продуцируемые PGP-бактериями ЛОС также могут действовать как средство биоконтроля и активировать индуцированную системную устойчивость растений [127, 128]. Например, у A. thaliana обработка штаммами Bacillus sp. GB03 и IN937a способствовала высвобождению бутандиола и ацетоина и тем самым значительно снижала тяжесть инфекции, вызванной Erwinia carotovorasub sp. carotovora, и улучшала рост растений [127].
Эндофитные PGP-бактерии также продуцируют множество других стимуляторов роста растений, например экзополисахариды (ЭПС), ризобитоксин [129], некоторые сигнальные молекулы, такие как люмихром [130] и липохитоолигосахариды [131]. ЭПС являются одним из основных компонентов внеклеточного матрикса бактерий, на которые часто приходится 40–95% веса бактерий [132]. ЭПС представляют собой сложную смесь биомолекул, таких как белки, гуминовые вещества, полисахариды, нейтральные сахара, уроновые кислоты, аминосахара, органические сложноэфирные заместители и нуклеиновые кислоты, липиды и гликопротеины. Продукция и состав ЭПС зависят от фазы роста бактерий, состава среды и условий окружающей среды [132]. Как было показано, продукция PGP-бактериями таких ЭПС как альгинат и целлюлоза способствует улучшению устойчивости пшеницы к засухе. ЭПС отвечают за создание зоны прикрепления между бактериями и корневой системой, частицами почвы, а также между различными бактериями. Кроме того, продуцируемые бактериями ЭПС увеличивают проницаемость корневой системы и могут образовывать защитную биопленку (действовать как барьер вокруг корней) и улучшать рост растений в условиях дефицита влаги [133]. Если ЭПС-продуцирующие PGP-бактерии находятся в ризосфере растений, они приводят к лучшей агрегации почвы вокруг корней и более эффективному потоку воды и питательных веществ к корням растений [134, 135]. Показано, что B. thuringiensis AZP2 образует большое количество биопленки на корнях пшеницы. В условиях водного стресса вокруг корней пшеницы скапливалось в два-три раза больше почвы по сравнению с неинокулированными растениями, что позволило повысить эффективность использования воды на 63% у инокулированных растений и усилить их выживаемость при засухе [121]. Штамм-продуцент ЭПС Klebsiella sp. IG3 улучшал проницаемость прикорневой почвы за счет увеличения агрегации почвы и водного потенциала вокруг корней проростков пшеницы [136]. Секреция ЭПС штаммом Pantoea agglomerans NAS206 увеличивала соотношение прилипшей к корню почвы и ткани корня, что позволяло улучшить агрегацию почвы, окружающей корни пшеницы [137]. Это способствовало повышению проницаемости корней в почву и поддержанию лучшего водного потенциала вокруг них, оптимизируя тем самым усвоение воды и питательных веществ растениями [136, 137].
Ризобитоксин может способствовать росту и развитию растений в стрессовых условиях, ограничивая выработку в них этилена. Точно так же сигнальные молекулы люмихром и липохитоолигосахариды могут содействовать в восприятии стрессовых сигналов растениями. Более того, эти молекулы действуют как регуляторы роста в микробах и растениях, влияющие на накопление биомассы, клеточный цикл, эмбриогенез, рост побегов и корней, а также боковое ветвление корней. В частности, эти соединения инициируют симбиотические взаимодействия растений с микроорганизмами ризосферы, защищая растения от негативного воздействия биотических и абиотический стрессов [131]. PGP-бактерии способны к секреции липохитоолигосахаридов, индуцируемых флавоноидами, присутствующими в корневых экссудатах. Известен такой тип бактериоцина как турицин 17 (Th17), продуцируемый различными видами Bacillus, который также функционирует как мощное бактериальное сигнальное соединение, способствующее росту растений. Th17 является наиболее широко изученной молекулой бактериоцина из-за его значительного участия в стимулировании роста растений, в частности, прорастания в стрессовых условиях [138].
РАЗВИТИЕ ЗАСУХОУСТОЙЧИВОСТИ РАСТЕНИЙ ПШЕНИЦЫ PGP-БАКТЕРИЯМИ
В связи с глобальным потеплением климата в последние два десятилетия во многих регионах мира и России наблюдается стойкая тенденция к увеличению частоты возникновения засухи [2, 139, 140]. Ярким примером тому служит лето 2010, 2016 и 2021 гг. [139, 140]. Засуха оказывает негативное влияние на протекание всех звеньев метаболизма растений, что в целом проявляется в снижении продуктивности и качества урожая культурных растений, включая пшеницу [1, 141–143]. Для яровой пшеницы оптимальной для роста и развития считается температура воздуха от 20 до 25°С [140]. Однако в засушливые годы, к примеру, летом 2010 г температура обычно составляла 32–35°C и иногда приближалась к 40°C во время пика аномальной жары, что привело к существенным потерям урожая. В многочисленных работах было показано, что PGP-бактерии, включая эндобактерии, вносят важный вклад в снижение негативного действия дефицита влаги на растения пшеницы [29, 50, 121, 144]. К примеру, обработка B. safensis W10 и Ochrobactrum pseudogregnonense IP8 оказывала ростстимулирующее и защитное действие на шесть разных сортов пшеницы, подвергнутых засухе, что отражалось в увеличении массы корней, побегов и урожая зерна [145]. Аналогичные данные были получены и при применении других штаммов PGP-бактерий (Pantoea alhagi, R. leguminosarum, R. phaseoli, Mesorhizobium ciceri, A. brasilense, A. lipoferum) на пшенице, которая подвергалась засухе в разные фазы развития, включая период цветения [32, 144, 146–148]. Также показано, что под влиянием PGP-бактерий изменяется архитектура корневой системы и структура тканей корня [149, 150], увеличивается образование боковых корней [32, 151], что приводит к повышению засухоустойчивости пшеницы. Pseudomonas sp. E2 и Azotobacter chrocoocum E1 смягчали неблагоприятное действие засухи на растения пшеницы благодаря поддержанию целостности анатомических структур (толщины эпидермиса, тканей мезофилла и флоэмы, диаметра сосудов ксилемы и размера сосудистых пучков корневой системы), тогда как небактеризованные образцы характеризовались существенными анатомическими нарушениями [152]. Растения пшеницы, праймированные A. brasilense Sp24 при воздействии засухи характеризовались более высоким уровнем ОСВ и движения воды по апопласту, а также увеличенными размерами сосудов ксилемы и повышенным уровнем гидравлической проводимости в колеоптиле, что в целом улучшало водный статус инокулированных растений и существенно снижало амплитуду стресс-индуцированных изменений в содержании фосфолипидов [32, 144, 153]. A. brasilense и Herbaspirillum seropedicae способствовали поддержанию уровня ОСВ, сохранению целостности мембранных структур и повышению устойчивости двух разных сортов пшеницы (CD-120 и Frontana) к засухе [154]. Эффективность PGP-бактерий в повышении засухоустойчивости пшеницы показана не только при отдельном, но и при комбинированном применении разных сочетаний бактериальных культур. К примеру, обработка консорциумом из четырех PGP-бактерий заметно улучшало функциональные характеристики фотосистемы II, скорость транспирации и устьичную проводимость у растений пшеницы в норме и предотвращало резкое изменение указанных параметров в условиях обезвоживания, что отражалось на повышении урожайности зерна [155]. Колонизация растений PGP-бактериями может запускать механизмы, помогающие растениям сохранять фотосинтетическую активность в стрессовых условиях. Например, B. thuringiensis AZP2 существенно повышала уровень выживаемости растений пшеницы в условиях засухи за счет снижения уровня выделяемого CO2 и повышения интенсивности фотосинтеза [121]. Обработка Burkholderia phytofirmans PsJN положительно влияла на ОСВ, ассимиляцию CO2, интенсивность фотосинтеза, содержание хлорофилла, эффективность использования воды и урожайность пшеницы при засухе [156].
Засухоустойчивость – комплексный признак, обусловленный функционированием множества взаимосвязанных механизмов и очевидно, что праймирование PGP-бактериями может вносить свой вклад в настройку реализации этих механизмов, способствуя развитию засухоустойчивости растений. Вместе с тем, эффективность бактериальной инокуляции может сильно варьировать в зависимости от используемого штамма, генотипов растений, условий произрастания, вида стресса [47–50, 157]. К примеру, один и тот же бактериальный штамм может по-разному влиять на продуктивность и энергию роста растений [47], на развитие засухоустойчивости [49, 158] и формирование элементов структуры урожая в зависимости от генотипа пшеницы [50]. Раскрытие механизмов действия PGP-бактерий играет ключевую роль в определении наиболее эффективных путей их применения для максимального снижения повреждающего действия засухи на растения. Несмотря на то, что механизмы, посредством которых PGP-бактерии индуцируют устойчивость растений-хозяев ясны не полностью, очевидно, что в основе реализации индуцированной PGP-бактериями засухоустойчивости лежат множественные механизмы, вовлекающие, наряду с описанной выше гормональной и АЦК-дезаминазной активностями, антиоксидантную защиту, аккумуляцию осмолитов и индукцию системной толерантности к засухе.
Антиоксидантная активность и снижение окислительного стресса. Хорошо известно, что засуха наряду с другими стрессами вызывает в растениях окислительный стресс, возникающий вследствие избыточной генерации активных форм кислорода (АФК), таких как супероксидный анион-радикал $\left( {{\text{О}}_{2}^{{ \bullet - }}} \right),$ гидроксильный радикал (OH•), перекисные радикалы (RO2•), H2O2, синглетный кислород (1O2) и др., обладающих чрезвычайно высокой реакционной способностью. При нарушении баланса между образованием свободных радикалов и их нейтрализацией, они начинают самопроизвольно и неспецифически взаимодействовать с клеточными компонентами, что приводит к серьезным нарушениям структуры и функции мембран, активности ферментов, мутагенезу, остановке клеточного цикла и, в итоге к гибели клеток и всего организма [159, 160]. Обезвреживание АФК в растениях обеспечивается антиоксидантной системой (АОС), все компоненты которой находятся в сложном функциональном взаимодействии, обеспечивая устойчивость растений к стресс-индуцируемым окислительным повреждениям [160]. АОС защиты растений включает антиоксидантные ферменты: пероксидаза (ПО), каталаза (КАТ), аскорбатпероксидаза (АПО), супероксиддисмутаза (СОД), глутатионредуктаза (ГР), и компоненты неферментативной природы: аскорбиновая кислота, глутатион, цистеин, пролин [161].
К настоящему времени накоплены обширные сведения о способности PGP-бактерий индуцировать активность АОС защиты у своих растений-хозяев. К примеру, после инокуляции корней пшеницы Lactobacillus plantarum были выявлены активация КАТ и повышение интегральной антиоксидантной емкости в проростках и обнаружено нивелирование вызываемого обезвоживанием окислительного стресса, зарегистрированные по накоплению Н2О2 и малонового диальдегида (МДА) [162]. Azospirillum brasilense NO40 и Stenotrophomonas maltophilia B11 заметно снижали вызванные засухой повреждения растений пшеницы, уменьшая утечку электролитов, накопление МДА и Н2О2, а также повышая активность КАТ и ПО [35]. Под влиянием PGP-бактерий в растениях пшеницы происходило снижение уровня стресс-индуцируемого перекисного окисления липидов, проницаемости мембран и активности фермента липоксигеназы, повышение активности антиоксидантных ферментов (СОД, КАТ, АПО) в условиях нарушения водного режима [31]. Инокуляция пшеницы Klebsiella sp. IG 3 также приводила к гораздо более низкому уровню экзоосмоса электролитов и накоплению МДА в условиях засухи по сравнению с неинокулированными растениями [136]. A. brasilense NO40 и S. maltophilia B11 значительно уменьшали ингибирующее действие засухи на ОСВ в корнях, побегах и листьях, а также на площадь листьев, содержание фотосинтетических пигментов, аскорбиновой кислоты, белковые структуры корней пшеницы и заметно уменьшали экзоосмос электролитов, накопление МДА и H2O2 [35]. При инокуляции и ко-инокуляции с Bacillus sp. и Arthrobacter pascens в растениях кукурузы увеличивалось содержание сахаров, пролина и возрастала активность антиоксидантных ферментов: СОД, ПО, КАТ и АПО [163]. Аналогичные сведения были получены при инокуляции растений пшеницы арбускулярной микоризой, при которой было выявлено увеличение содержания компонентов АОС защиты неферментативной природы, в частности пролина и свободных аминокислот, а также повышение активности ряда антиоксидантных ферментов, таких как ПО и КАТ [164]. Авторы полагают, что колонизация микоризой способствует улучшению осмотической регуляции растений пшеницы при засухе, усиливает их АОС защиты и снижает окислительное повреждение клеток, что в совокупности приводит к повышению засухоустойчивости пшеницы [164]. Имеются данные о вовлечении A. brasilense NO40 и B. amyloliquefaciens 5113, оказывающих защитный эффект на растения пшеницы при засухе, в регуляцию активности гена АПО APX1 и ферментов аскорбат-глутатионового комплекса [151]. Показано, что эндофитные бактерии B. subtilis оказывают защитное действие на рост и антиоксидантный статус растений пшеницы при засухе посредством стабилизации уровня АПО и ГР [158]. У проростков пшеницы, испытывающих недостаток воды, инокуляция штаммом B. thuringiensis AZP2 усиливала активность ферментов, поглощающих АФК, таких как ГР, СОД и КАТ, что приводило к лучшей выживаемости проростков в стрессовых условиях [121]. B. safensis W10 и Ochrobactrum pseudogregnonense IP8 улучшали активность антиоксидантных ферментов и запускали накопление неферментативных антиоксидантов в растениях пшеницы в условиях засухи [145]. В частности, была увеличена активность ПО, КАТ, АПО, COД и ГР, тогда как концентрации каротиноидов, аскорбата и пролина также были повышены во время стресса. Изменение этих параметров позволило снизить степень окислительных повреждений что, в конечном счете, привело к увеличению биомассы корней и побегов пшеницы. Однако эти исследования не дают четкого понимания того вызывают ли бактерии повышенное образование антиоксидантов в растениях или снижение окислительных повреждений связано с продукцией антиоксидантов самими бактериями. В некоторых случаях сообщалось о снижении активности антиоксидантных ферментов пшеницы после инокуляции PGP-бактериями. Например, в проростках пшеницы, испытывающих водный стресс, инокуляция штаммами B. amyloliquefaciens 5113 и A. brasilense NO40 приводила к более слабой активности АПО и дегидроаскорбатредуктазы по сравнению с неинокулированными растениями. Тем не менее, бактериальное инокулирование приводило к снижению уровня окислительного стресса в растениях, их лучшей выживаемости и более высоким параметрам роста, таким как сырая/сухая масса и содержание воды [158, 165].
Продукция осмолитов и снижение осмотического стресса. Мощным защитным механизмом, позволяющим поддерживать водный статус растений в условиях засухи, является аккумуляция осмолитов, вовлекаемых в осмотическую регуляцию клеток, способствующих понижению осмотического потенциала клеточного сока. Различают внутриклеточные осмолиты неорганического происхождения, преимущественно поглощаемые из внешней среды ионы, такие как K+, Na+, Ca2+, Mg2+, Cl–, и органические вещества, синтезируемые и транспортируемые в растениях. И хотя неорганические осмолиты не требуют для накопления больших затрат энергии и углерода, они могут вызвать интоксикацию растений при высоких концентрациях [166]. Для поддержания низкого водного потенциала растения накапливают низкомолекулярные хорошо растворимые во внутриклеточной среде органические соединения, которые не являются токсичными для клетки и в отличие от неорганических ионов не вызывают изменений в метаболизме, поэтому им присваивается наименование совместимых с биополимерами веществ. К ним относятся различные аминокислоты, например пролин, аланин, четвертичные ионы: бетаин, глицин-бетаин; сахароспирты, различные моно- и олигосахариды. Накопление осмолитов обусловлено замедлением оттока ассимилятов из листьев, усилением их биосинтеза и повышением активности гидролитических ферментов. Осмолиты снижают водный потенциал клеточного сока, способствуя тем самым предотвращению потери клетками воды и восстановлению их водоснабжения. Кроме того, осмолиты вовлекаются в защиту конфигурации макромолекул, предотвращая деградацию белков и инактивацию ферментов. Поддержание осмолитами целостности структурных белков способствует сохранению функциональной активности клеточных мембран [167, 168]. Было показано, что в условиях водного стресса PGP-бактерии способны к секреции осмолитов, функционирующих в синергизме с продуцируемыми растениями осмолитами и стимулирующими их рост благодаря регуляции осмотического потенциала клеток корней [26, 169]. Имеются данные, указывающие на повышение стресс-устойчивости растений пшеницы под влиянием PGP-бактерий, опосредованное накоплением различных осмолитов [144, 150, 170].
Важнейшим осмопротектантом растений, обладающим шаперонными свойствами и снижающим степень вызываемых обезвоживанием повреждений клеточных структур, является пролин [3]. Вовлечение пролина в спектр защитного действия PGP-бактерий на различные виды дикорастущих и культурных растений, включая пшеницу, было продемонстрировано в многочисленных исследованиях [16, 26, 50, 57, 169–172]. Например, эндофитные PGP-бактерии смягчали стресс от дефицита воды у растений пшеницы за счет увеличения содержания пролина и изменения архитектуры корней [150]. Использование PGP-бактерий стимулировало прирост биомассы и повышало ОСВ в листьях благодаря аккумуляции пролина в растениях кукурузы при воздействии водного стресса [167]. Растения пшеницы, инокулированные PGP-бактериями и Piriformospora indica, накапливали большие количества пролина, β-токоферола и каротиноидов по сравнению с неинокулированными растениями, и способствовали снижению повреждающего действия дефицита влаги на растения на уровне клеток и всего растения [31]. Инокуляция штаммом A. brasilense Sp245 улучшала осмотическую регуляцию, что приводило к увеличению урожайности пшеницы на 17% [81]. Растения пшеницы, инокулированные B. safensis W10 или Ochrobactrum pseudogregnonense IP8, демонстрировали увеличение концентрации пролина и ОСВ в листьях в условиях засухи [145]. Совместная инокуляция B. subtilis и A. brasilense увеличивала (на 30%) продукцию пролина в листьях пшеницы в условиях дефицита воды и способствовали формированию засухоустойчивости [170].
В некоторых случаях сообщалось о снижении содержания осмолитов в растениях, подверженных засухе. Например, инокуляция проростков пшеницы штаммом Klebsiella sp. IG 3 приводила к значительному снижению общего содержания растворимых сахаров и пролина в условиях засухи по сравнению с неинокулированными растениями. Однако обработанные эндофитами растения характеризовались увеличением длины и ветвления корней, а также повышением сырой и сухой массы корней и побегов. В таком случае вполне вероятно, что выбранные PGP-бактерии имеют иной способ действия, как например образование биопленок, снижающих уровень воздействия водного стресса [173]. Кроме того, PGP-бактерии могут способствовать защите растений от дефицита влаги, синтезируя другие осмопротектанты, например, трегалозу. Трегалоза представляет собой высокостабильный дисахарид, образованный β-1,1-гликозидной связью между двумя остатками β-глюкозы, способной удерживать значительное количество воды внутри клетки путем связывания ее молекул, образуя гелевую фазу и снижая тем самым степень вызываемого засухой нарушений метаболизма. Кроме того, трегалоза может участвовать в предотвращении деградации и агрегации частично денатурированных белков при обезвоживании клетки. Имеются данные о существенном повышении засухоустойчивости разных видов культурных растений под влиянием бактерий, характеризующихся способностью к повышенной продукции трегалозы или соединений, индуцирующих ее синтез в растениях [174, 175].
ЭНДОФИТНЫЙ МИКРОБИОМ ПШЕНИЦЫ И ПЕРСПЕКТИВЫ ЕГО ПРИМЕНЕНИЯ
Растения эволюционировали в тесном взаимодействии со множеством микроорганизмов, играющих важную роль в росте, питании и здоровье растений. В настоящее время имеется значительный объем информации о структуре и динамике растительной микробиоты, а также о функциональных возможностях отдельных членов сообщества [37]. Микроорганизмы, тесно связанные с определенным растением (видом или генотипом), независимо от почвы и условий окружающей среды, определяются как ко́ровый микробиом (“core microbiome”) растений [176], включающий ключевые микробные таксоны, которые важны для адаптации растений. Напротив, некоторые микробные таксоны, встречающиеся в небольшом количестве на ограниченном участке, называются сателлитными таксонами. В зависимости от географического положения и специфики среды обитания могут определяться разные сателлитные таксоны. За последние годы с развитием новых методов исследований понимание структуры микробиома растений значительно расширилось [176–183]. Хотя термин ко́ровый микробиом широко используется, существуют разногласия по поводу методов, которые следует использовать для определения основных микроорганизмов, ассоциированных с определённым растением-хозяином [184]. К примеру, Симонин с соавт. [181] с использованием трех генотипов пшеницы, выращенных на восьми контрастных почвах Европы и Африки, идентифицировали в ко́ровом микробиоме пшеницы 30 бактериальных, 24 грибных и 10 таксонов, отнесенных к простейшим. В другом исследовании Россман с соавт. [182] выявили в ко́ровом микробиоме современных сортов пшеницы 22 бактериальных и 13 грибных таксона, а также 3 таксона, отнесенных к простейшим. Однако суммирование данных этих двух исследований [181, 182] показало, что только 4 рода бактерий (Arthrobacter, Massilia, Bradyrhizobium и Nitrospira), 4 таксона грибов (Bionectria, Exophiala, Chaetomium, и Fusarium) и 2 протиста (Rhogostoma и Eocercomonas) оказались общими. Эти данные указывают на высокую степень сложности точной идентификации компонентов ко́рового микробиома растений и необходимость разработки оптимальных методов в решении этой задачи. В настоящее время наиболее точными являются исследования ко́рового микробиома, основанные на метагеномном анализе, которые, однако, проводятся довольно редко [46, 185, 186]. Вместе с тем, согласно накопленным к настоящему времени данным о микробиоме пшеницы, бактерии рода Sphingomonas были обнаружены в ~80% исследований; Bradyrhizobium в ~70%; Pseudomonas и Massilia в ~60%; Arthrobacter, Flavobacterium, Chitinophaga, Pantoea, Pedobacter, Mucilaginibacter и Variovorax в ~50% исследований. Список представленных родов не является исчерпывающим [39], а лишь свидетельствует о том, что с использованием имеющихся методов и инструментов эти роды оказались многочисленными или ключевыми таксонами [39, 186].
Анализ эндофитного микробиома пшеницы был проведен разными авторами в отношении эндофитов разных частей растений (корни, листья, семена) [187–190], разных сортов [181, 188], в разные стадии развития [181, 183, 188]. Результаты показывают, что эндофитные микробные сообщества сильно зависят от органа растения, возраста растения, сорта (генотипа), а также территории выращивания и технологии возделывания [191, 192]. Анализ генетического разнообразия резидентов ризосферы пшеницы [187] показал наличие 30 таксономических единиц, включая классы Alfaproteobacteria, Betaproteobacteria, Deltaproteobacteria, Gammaproteobateria, Actinobacteria, Bacilli, Clostridia, а также наличие некультивируемых бактерий, функции которых остаются неясными. Другое исследование эндофитов ризосферы проведенное на двух сортах пшеницы (Freed-06 и Chakwal-50) на стадии цветения [188] позволило вывить, что микробное сообщество представлено 8 типами, 14 классами, 14 порядками, 23 семействами и 33 родами эндофитов. Курзнияр с соавт. [189] впервые продемонстрировали, что 7 родов бактерий (Pantoea, Streptomyces, Paenibacillus, Massilla, Methanobacterium, Lactobacillus, Serratia) являются обязательными микроорганизмами, колонизирующими семена исследованных ими сортов пшеницы Triticum aestivum L. (сорт Hondia) и T. spelta L. (сорта Rokosz и Schwabencorn). Причем, Pantoea и Paenibacillus были идентифицированы как доминанты в изученном семенном материале пшениц. Кроме того, в семенах пшеницы эндофитными бактериями были колонизированы как эндосперм, так и зародыш. Авторы пришли к выводу, что семена пшеницы нельзя рассматривать как стерильные ниши, поскольку они содержат эндофитную микробиоту, которая, в свою очередь, по составу и структуре является индивидуальной для каждого сорта [189]. Выявлено, что эндофитные бактерии, заселяющие зародыши семян даже в небольшом количестве, в дальнейшем во время роста пшеницы способны заселять их корни и/или листья [189]. В условиях in vitro обнаружено, что эндофиты присутствовали и в корнях, и в листьях пшеницы сортов Hondia и Rokosz. Однако корни пшеницы являлись более предпочтительными органами для колонизации эндофитами, чем листья, где их биоразнообразие было ограничено. In vitro эксперименты также показали, что два рода бактерий – Paenibacillus и Propionibacterium – имеют статус обязательных микроорганизмов, населяющих растения пшеницы сортов Rokosz и Hondia [189].
Одним из наиболее интересных аспектов изучения эндофитных бактерий является оценка роли факторов внешней среды и генотипа растений в формировании их популяции, а также активности в отношении стресс-факторов среды, включая засуху. Недавно, Зиаровска с соавт. [46] методом метагеномного высокопроизводительного секвенирования и анализа вариабельности 16S рРНК охарактеризовали разнообразие эндофитных бактерий в листьях засухоустойчивой и восприимчивой к засухе пшеницы. Результаты показали, что изменения в вариабельности бактериальных эндофитов связаны преимущественно с сортовыми (в отношении засухи) характеристиками анализируемых пшениц, а не с характером стрессового воздействия [46]. Растения пшеницы, обработанные ризосферными культурами Paenibacillus и Bacillus, выделенными из образцов грунта засушливых сред, характеризовались увеличением на 78% показателей роста и биомассы и 5-кратным повышением уровня выживаемости растений в условиях сильной засухи [121]. Тогда как представители этих же видов Paenibacillus и Bacillus, выделенные из почв умеренно-засушливой зоны, не способствовали повышению засухоустойчивости пшеницы [191].
В то время как микробиомы корневых систем растений были в центре внимания исследователей, микробиом семян в значительной степени игнорировался [191]. В настоящее время многие исследователи сходятся во мнении, что условия засухи оказывают значительное влияние на состав и разнообразие микробиома семян. Постулируется, что микробиом семян развивается в результате отбора хозяевами по признакам, дополняющим геном растения [191]. Предполагается, что микробиомы семян растений, подвергшихся абиотическому стрессу, обогащаются бактериями, более устойчивыми к этому стрессу, и что состав микробиомов семян различается у устойчивых и чувствительных к засухе линий пшеницы [190]. С помощью комбинации метагеномных и культуральных методов Хоне с соавт. [190] анализировали состав микробиома семян четырех засухоустойчивых и двух чувствительных к засухе линий пшеницы, произрастающих в неорошаемых и засушливых условиях с целью выявления микроорганизмов, способных повышать засухоустойчивость растения-хозяина. Коллекция микроорганизмов, выращенных из семян шести линий пшеницы, показала значительные различия в родовом разнообразии и численности в условиях засухи. Роды, принадлежащие к Gammaproteobacteria, а именно Pantoea и Pseudomonas, доминировали в микробиоме семян чувствительных к засухе линий пшеницы, тогда как в засухоустойчивых линиях их было мало. Аналогичная тенденция наблюдалась в микробиоме семян в условиях неорошаемого земледелия и в условиях засухи, где Pantoea и Pseudomonas истощались в условиях засухи. Напротив, роды, принадлежащие к Actinobacteria, подверглись линейно-зависимой селекции засухоустойчивыми линиями пшеницы. Это исследование показало, что микробиомы семян генетически различных линий пшеницы обогащаются полезными бактериями способами, которые являются зависящими, как от генотипа растения-хозяина, так и его реакции на стрессовые воздействия окружающей среды. Таким образом, семена стресс-фенотипированных линий представляют собой бесценный ресурс (резервуар) для выявления и получения культур полезных эндофитов, которые могут быть перспективными при повышении засухоустойчивости сельскохозяйственных культур, в частности, пшеницы [190].
В исследованиях, проведенных Сафином с соавт. [192] было установлено существенное различие в количественных показателях микробиома и бактериальных эндофитов семян разных сортов (генотипов) яровой пшеницы, произрастающих в разных географических зонах Евразии. Семена, выращенные в Средней Азии (республиках Казахстан и Таджикистан), характеризовались большим количеством общего микробиома и эндофитных бактерий, активных в отношении фитопатогенов, в отличие от семян, выращенных в Поволжье (Татарстан, Россия). Выявленные различия могут быть связаны не только с разными климатическими условиями, но и с разными почвенными микробиомами, а также с разными системами агротехники [192]. В связи с этим особый интерес представляет изучение вклада факторов внешней среды, системы агротехники и генома растения. Решение этой проблемы позволит использовать методы трансплантации ценных биологических агентов или целых микробиомов из одних регионов в другие для повышения стресс-устойчивости и урожайности растений. Учитывая, что в Поволжье России уровень использования химических фунгицидов значительно выше, чем в Казахстане и Таджикистане, а активность семенных эндофитов по отношению к фитопатогенам крайне низкая, возможность такого переноса и использование биологических агентов из стран Центральной Азии может быть перспективным для комплексной защиты растений [192]. Такой же подход может быть использован и с целью повышения засухоустойчивости пшеницы. Однако такие сведения в литературе пока отсутствуют. В то же время при разработке технологии переноса биологических агентов из одного региона в другой необходимо учитывать их способность адаптироваться к другим условиям среды, а также их возможные взаимоотношения с аборигенными популяциями эндофитных бактерий. Для сохранения ценных аборигенных эндофитных бактерий семян необходимо провести соответствующую работу по сбору биологического материала в местах с древней историей возделывания пшеницы и с минимальным применением химических средств защиты и регуляторов роста растений. Возникает необходимость развития сотрудничества между различными регионами, как Евразии, так и остальных регионов мира в изучении локального набора микробиома семян для разработки эффективных систем защиты для устойчивого развития производства зерна пшеницы [192] в условиях меняющегося климата.
Таким образом, выделение представителей ко́рового микробиома пшеницы, в особенности семян, и последующее определение их функциональных возможностей как in vitro, так и in planta может стать основой стратегии для разработки новых инокулянтов [39, 189] и безопасного повышения адаптационного и продукционного потенциала растений, в частности, пшеницы, в условиях стрессовых факторов, приводящих к дефициту влаги. В то же время, исследования особенностей микробиома растений пшеницы, произрастающих в разных географических регионах и с разными технологиями возделывания, а также их активности по отношению к абиотическим стрессам находятся в начальной стадии, и это требует дальнейшего изучения.
***
Совокупность накопленных к настоящему моменту сведений убедительно демонстрирует, что эндофитные PGP-бактерии играют фундаментальную роль в процессах роста и развития, а также адаптации растений пшеницы к условиям засухи. Праймирование семян PGP-бактериями способствует стимуляции роста и развитию засухоустойчивости растений посредством множества прямых и опосредованных механизмов, включая улучшение абсорбции воды, мобилизацию питательных веществ почвы, модуляцию гормонального баланса, усиление антиоксидантной и осмотической защиты растений, продукцию биоактивных соединений и сигнальных молекул.
Таким образом, в растениях под влиянием эндофитов происходит перенастройка фундаментальных метаболических процессов и модулирование биохимических и молекулярных путей, что в целом обуславливает развитие системной толерантности культуры к засухе. Однако сведения о собственном эндофитном микробиоме пшеницы, его функциональных свойствах, а также механизмах взаимодействия собственных и привнесенных бактериальных эндофитов с растениями-хозяевами, особенно в условиях абиотических стрессовых факторов, остаются мало изученными. Дальнейшие исследования эндофитного микробиома и выявление его роли в формировании засухоустойчивости растений пшеницы, несомненно, являются важными и могут быть полезны, как для характеристики семян в селекции яровой пшеницы, так и при разработке биопрепаратов на их основе, новых подходов к безопасному управлению продуктивностью и качеством урожая пшеницы в условиях глобальных изменений климата.
Работа выполнена в рамках проекта РНФ (№ 22-26-00076).
Список литературы
Asseng S., Martre P., Maiorano A., Rötter R.P., O’Leary G.J., Fitzgerald G.J. et al. // Global. Change. Biol. 2019. V. 25. № 1. P. 155–173. https://doi.org/10.1111/gcb.14481
Pequeno D.N., Hernandez-Ochoa I.M., Reynolds M., Sonder K., MoleroMilan A., Robertson R.D. et al. // Environ. Res. Lett. 2021. V. 16. № 5. P. 054070. https://doi.org/10.1088/1748-9326/abd970
Shakirova F.M., Avalbaev A.M., Bezrukova M.V., Fatkhutdinova R.A., Maslennikova D.R., Yuldashev R.A., Lastochkina O.V. In: Phytohormones and Abiotic Stress Tolerance in Plants / Ed. N. Khan, R. Nazar, N. Iqbal, N. Anjum. Berlin, Heidelberg: Springer, 2012. 308 p. https://doi.org/10.1007/978-3-642-25829-9_9
Kosova A., Varma A., Choudhary D.K. // Agric. Res. 2015. V. 4. № 1. P. 31–41. https://doi.org/10.3390/ijms160920913
Food and Agriculture Organization of the United Nations (FAO). 2016. http://www.fao.org/3/a-i6030e.pdf (2016).
Goswami M., Deka S. // Pedosphere. 2020. V. 30. № 1. P. 40‒61. https://doi.org/10.1016/S1002-0160(19)60839-8
United State Department of Agriculture. Foreign Agricultural Service // Global Market Analysis: International Production Assessment Division (IPAD). 2020. https://ipad.fas.usda.gov/
Ehrlich P.R., Wilson E.O. // Science. 1991. V. 253. № 5021. P. 758–762. https://doi.org/10.1126/science.253.5021.758
Thrupp L.A. // Int. Aff. 2000. V. 76. № 2. P. 265–281. https://doi.org/10.1111/1468-2346.00133
Galindo F.S., Teixeira Filho M.C.M., Buzetti S., Rodrigues W. L., Santini J. M. K., Alves C.J. // Acta Agric. Scand. Soil Plant Sci. 2019. V. 69. P. 606–617. https://doi.org/10.1080/09064710.2019.1628293
Dmytryk A., Michalak I., Wilk R., Chojnacka K., G’orecka H., G’orecki H. // Waste Biomass Valori. 2015. V. 6. P. 441–448. https://doi.org/10.1007/s12649-015-9363-6
Lutts S., Benincasa P., Wojtyla Ł., Kubala S., Pace R., Lechowska K., Quinet M., Garnczarska M. Seed Priming: New Comprehensive Approaches for an Old Empirical Technique / Ed. S. Araujo, A. Balestrazzi. London, UK: IntechOpen, 2016. 212 p. https://doi.org/10.5772/64420
Seifikalhor M., Hassani S.B., Aliniaeifard S. // J. Plant Growth Regul. 2020. V. 39. P. 1009–1021. https://doi.org/10.1007/s00344-019-10038-7
Gebeyaw M. // Int. J. Appl. Agric. Sci. 2020. V. 6. № 6. P. 185–190. https://doi.org/10.11648/j.ijaas.20200606.14
Singh S., Singh U.B., Malaviya D., Paul S., Sahu P.K., Trivedi M., Paul D., Saxena A.K. // Int. J. Environ. Res. Public Health. 2020. V. 17. P. 1396. https://doi.org/10.3390/ijerph17041396
Lastochkina O.V., Aliniaeifard S., Seifikalhor M., Yuldashev R., Pusenkova L., Garipova S. In: Wheat Production in Changing Environments /Ed. M. Hasanuzzaman, K. Nahar, M. Hossain. Singapore: Springer, 2019. p. 579–614.https://doi.org/10.1007/978-981-13-6883-7_23
Conrath U., Beckers G.J.M., Langenbach C.J.G., Jaskiewicz M.R. // Annu. Rev. Phytopathol. 2015. V. 53. P. 97–119. https://doi.org/10.1146/annurev-phyto-080614-120132
Pastor V., Luna E., Mauch-Mani B., Ton J., Flors V. // Environ. Exp. Bot. 2013. V. 94. P. 45–56. https://doi.org/10.1016/j.envexpbot.2012.02.013
Balmer A., Pastor V., Gamir J., Flors V., Mauch-Mani B. // Tr. Plant Sci. 2015. V. 20. P. 443–452. https://doi.org/10.1016/j.tplants.2015.04.002
Hallmann J., Quadt-Hallmann A., Mahaffee W.F., Kloepper J.W. // Can. J. Microbiol. 1997. V. 43. № 10. P. 895‒914.https://doi.org/10.1139/m97-131
Sood G., Kaushal R., Sharma M. // Vegetos. 2020. V. 33. № 4. P. 782–792. https://doi.org/10.1007/s42535-020-00149-y
Van Loon L.C. // Eur. J. Plant Pathol. 2007. V. 119. P. 243–254. https://doi.org/10.1007/978-1-4020-6776-1_2
Akram W., Anjum T., Ali B., Ahmad A. // Int. J. Agric. Biol. 2013. V. 15. № 6. P. 1289–1294.
Maksimov I.V., Veselova S.V., Nuzhnaya T.V., Sarvarova E.R., Khairullin R.M. // Russ. J. Plant Physiol. 2015. V. 62. № 6. P. 715–726. https://doi.org/10.1134/S1021443715060114
Ma Y. Plant–microbe Interactions in Agro-ecological Perspectives / Ed. D. Singh, H. Singh, R. Prabha, Singapore: Springer, 2017. 657 p. https://doi.org/10.1007/978-981-10-6593-4_4
Dimkpa C., Weinand T., Asch F. // Plant Cell Environ. 2009. V. 32. № 12. P. 1682–1694. https://doi.org/10.1111/j.1365-3040.2009.02028.x
Abdel-Rahman S., Abdel-Kader A.A.S., Khalil S.E. // Nat. Sci. 2011. V. 9. P. 31–36.
Baez-Rogelio A., Morales-García Y.E., Quintero-Hernández V., Muñoz-Rojas J. // Microb. Biotechnol. 2016. V. 10. № 1. P. 19–21.https://doi.org/10.1111/1751-7915.12448
Barnawal D., Bharti N., Pandey S.S., Pandey A., Chanotiya C.S., Kalra A. // Physiol. Plant. 2017. V. 161. № 4. P. 502–514. https://doi.org/10.1111/ppl.12614
Numan M., Bashir S., Khan Y., Mumtaz R., Shinwari Z.K., Khan A. L., Khan A., AL-Harrasi A. // Microbiol. Res. 2018. V. 209. P. 21–32. https://doi.org/10.1016/j.micres.2018.02.003
Singh M., Tiwari N. // Comm. Integr. Biol. 2021. V. 14. № 1. P. 136–150.https://doi.org/10.1080/19420889.2021.1937839
Arzanesh M.H., Alikhani H.A., Khavazi K., Rahimian, H.A., Miransari M. // World J. Microbiol. Biotechnol. 2011. V. 27. № 2. P. 197–205. https://doi.org/10.1007/s11274-010-0444-1
Cherif H., Marasco R., Rolli E., Ferjani R., Fusi M., Soussi A. et al. // Env. Microbiol. Rep. 2015. V. 7. № 4. P. 668–678. https://doi.org/10.1111/1758-2229.12304
Amna S., Din Y., Sarfraz B., Xia Y., Kamran M.A., Javed M.T. et al. // Eco. Toxicol. Environ. Saf. 2019. V. 183. P. 109466. https://doi.org/10.1016/j.ecoenv.2019.109466
Kasim W.A., Osman M.E.H., Omar M.N., Salama S. // Bull. Natl. Res. Cent. 2021. V. 45. № 95. P. 1–14. https://doi.org/10.1186/s42269-021-00546-6
Rashid U., Yasmin H., Hassan M.N., Naz R., Nosheen A., Sajjad M. et al. // Plant. Cell. Rep. 2022. V. 41. P. 1–21. https://doi.org/10.1007/s00299-020-02640-x
Compant S., Samad A., Faist H., Sessitsch A. // J. Adv. Res. 2019. V. 19. P. 29–37. https://doi.org/10.1016/j.jare.2019.03.004
Rana K.L., Kour D., Kaur T., Sheikh I., Yadav A.N., Kumar V. et al. // Proc. Natl. Acad. Sci, India. Sect. B: Biol. Sci. 2020. V. 90. № 5. P. 969–979. https://doi.org/10.1007/s40011-020-01168-0
Kavamura V.N., Mendes R., Bargaz A., Mauchline T.H. // Comput. Struct. Biotechnol. J. 2021. V. 19. P. 1200–1213. https://doi.org/10.1016/j.csbj.2021.01.045
Pandey P.K., Singh M.C., Singh S.S., Singh A.K., Kumar M., Pathak M.M. et al. // Int. J. Curr. Microbiol. App. Sci. 2017. V. 6. № 2. P. 11–21. https://doi.org/10.20546/ijcmas.2017.602.002
Yang J., Kloepper J.W., Ryu C.M. // Trend. Plant. Sci. 2009. V. 14. № 1. P. 1–4. https://doi.org/10.1016/j.tplants.2008.10.004
Bokhari A., Essack M., Lafi F.F., Andres-Barrao C., Jalal R., Alamoudi S. et al. // Sci. Rep. 2019. V. 9. P. 18154.https://doi.org/10.1038/s41598-019-54685-y
Bukhat S., Imran A., Javaid S., Shahid M., Majeed A., Naqqash T. // Microbiol. Res. 2020. V. 238. P. 126486. https://doi.org/10.1016/j.micres.2020.126486
Lastochkina O.V., Baymiev An., Shayahmetova A., Garshina D., Koryakov I., Shpirnaya I. et al. // Plants. 2020. V. 9. № 1. P. 76. https://doi.org/10.3390/plants9010076
Васильева Е.Н., Ахтемова Г.А., Жуков В.А., Тихонович И.А. // Экол. генетика. 2019. V. 17. № 1. P. 19–32. https://doi.org/10.17816/ecogen17119-32
Žiarovská J., Medo J., Kyseľ M., Zamiešková L., Kačániová M. // Plants. 2020. V. 9. № 2. P. 266. https://doi.org/10.3390/plants9020266
Kazi N., Deaker R., Wilson N., Muhammad K., Trethowan R. // Field Crops Res. 2016. V. 196. P. 368–378. https://doi.org/10.1016/j.fcr.2016.07.012
Schlemper T.R., Dimitrov M.R., Gutierrez F.A.S., van Veen J.A., Silveira A.P., Kuramae E.E. // Peer J. 2018. V. 6. P. e5346. https://doi.org/10.7717/peerj.5346
Lastochkina O.V., Garshina D., Ivanov S., Yuldashev R., Khafizova R., Allagulova Ch. et al. // Plants. 2020a. V. 9. № 12. P. 1810. https://doi.org/10.3390/plants9121810
El-Megeed A., Fayrouz H., Mohiy M. // Egyptian J. Bot. 2022. V. 62. № 1. P. 275–290.
Ishak Z., Mohd Iswadi M.K., Russman Nizam A.H., Ahmad Kamil M. J., Ernie Eileen R.R., Wan Syaidatul A., Ainon H. // Malays. Cocoa J. 2016. V. 9. № 1. P. 127‒133.
Saikia J., Sarma R.K., Dhandia R., Yadav A., Bharali R., Gupta V.K., Saikia R. // Sci. Rep. 2018. V. 8. № 1. P. 3560. https://doi.org/10.1038/s41598-018-21921-w
Boleta E.H.M., Galindo F.S., Jalal A., Santini J.M.K., Rodrigues W.L., Lima B.H.D. et al. // Front. Sustain. Food Syst. 2020. V. 4. P. 607262. https://doi.org/10.3389/fsufs.2020.607262
Naqqash T., Fatima M., Rehman-ur-Saif., Bukhat S., Shahid M., Shabir C. et al. // J. Plant. Growth. Regul. 2021. P. 1–15. https://doi.org/10.1007/s00344-021-10519-8
Федоренко В.Ф., Завалина А.А., Милащенко Н.З. Научные основы производства высококачественного зерна пшеницы. М.: ФГБНУ Росинформагротех, 2018. 396 с. https://doi.org/10.25930/skc8-gc14
Di Benedetto N.A., Corbo M.R., Campaniello D., Cataldi M.P., Bevilacqua A., Sinigaglia M., Flagella Z. // AIMS Microbiol. 2017. V. 3. № 3. P. 413–434. https://doi.org/10.3934/microbiol.2017.3.413
Lastochkina O., Pusenkova L., Yuldashev R., Yuldashev R., Babaev M., Garipova S. et al. // Plant. Physiol. Biochem. 2017. V. 121. P. 80–88. https://doi.org/10.1016/j.plaphy.2017.10.020
Пищик В.Н., Воробьев Н.И., Моисеев К.Г., Свиридова О.В., Сурин В.Г. // Почвоведение. 2015. № 1. С. 87–94. https://doi.org/10.7868/S0032180X1501013X
Fukami J., Nogueira M.A., Araujo R.S., Hungria M. // AMB Express. 2016. V. 6. № 3. P. 3–16. https://doi.org/10.1186/s13568-015-0171-y
Fukami J., Ollero F.J., Megías M., Hungria M. //AMB Express 2017. V. 7. P. 153–163. https://doi.org/10.1186/s13568-017-0453-7
Galindo F.S., Teixeira Filho M.C.M., Buzetti S., Santin J.M.K., Alves C.J., Ludkiewicz M.G.Z. // Res. Agropec. Bras. 2017. V. 52. № 9. P. 794–805.
Galindo F.S., Teixeira Filho M.C.M., Buzetti S., Santini J.M., Montaniri R., Freitas L.A., Rodrigues W.L. // Commun. Soil Sci. Plant Anal. 2019. V. 50. P. 2429–2441. https://doi.org/10.1080/00103624.2019.1667369
Ardakani M.R., Mazaheri D., Mafakheri S., Moghaddam A. // Physiol. Mol. Biol. Plants. 2011. V. 17. № 2. P. 181–192. https://doi.org/10.1007/s12298-011-0065-7
Rodríguez H., Fraga R., Gonzalez T., Bashan Y. // Plant. Soil. 2006. V. 287. P. 15–21. https://doi.org/10.1007/s11104-006-9056-9
Karimzadeh J., Alikhani H.A., Etesami H., Pourbabaei A.A. // J. Plant. Growth. Regul. 2021. V. 40. № 1. P. 162–178. https://doi.org/10.1007/s00344-020-10087-3
Scanlan C.A., Bell R.W., Brennan R.F. Simulating wheat growth response to potassium availability under field conditions in sandy soils. II. Effect of subsurface potassium on grain yield response to potassium fertiliser // Field Crops Res. 2015. V. 178. P. 125–134. https://doi.org/10.1016/j.fcr.2015.03.019
Chandra D., Srivastava R., Gupta V.V.S.R., Franco C.M., Paasricha N., Saifi S.K., Sharma A.K. // Plant. Soil. 2019. V. 441. № 1–2. P. 261–281. https://doi.org/10.1007/s11104-019-04115-9
Złoch M., Thiem D., Gadzała-Kopciuch R., Hrynkiewicz K. // Chemosphere. 2016. V. 156. P. 312–325. https://doi.org/10.1016/j.chemosphere.2016.04.130
Sadeghi A., Karimi E., Dahaji P.A., Javid, M.G., Dalvand, Y., Askari H // World. J. Microbiol. Biotechnol. 2012. V. 28. № 4. P. 1503–1509. https://doi.org/10.1007/s11274-011-0952-7
Saha M., Sarkar S., Sarkar B., Sharma, B.K., Bhattacharjee S., Tribedi P. // Environ. Sci. Pollut. Res. 2016. V. 23. №. 5. P. 3984–3999. https://doi.org/10.1007/s11356-015-4294-0
Albelda-Berenguer M., Monachon M., Joseph E. // Adv. Appl. Microbiol. 2019. V. 106. P. 193–225. https://doi.org/10.1016/bs.aambs.2018.12.001
Шакирова Ф.М. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция. Уфа: Гилем, 2001. 160 с.
Sgroy V., Cassán F., Masciarelli O.F., Del Papa M.F., Lagares A., Luna V. // Appl. Microbiol. Biotechnol. 2009. V. 85. № 2. P. 371–381. https://doi.org/10.1007/s00253-009-2116-3
Кудоярова Г.Р., Курдиш И.К., Мелентьев А.И. // Изв. УфНЦ РАН. 2011. №. 3–4. С. 5–15.
Pankievicz V.C.S., do Amaral F.P., Santos K.F.D.N., Agtuca B., Xu Y., Schueller M. J., Ferrieri R.A. // Thy. Plant. J. 2015. V. 81. № 6. P. 907–919. https://doi.org/10.1111/tpj.12777
Wang C.J., Yang W., Wang C.J., Gu C., Niu D.D., Liu H.X., Guo J.H. // PLoS One. 2012. V. 7. № 12. P. e52565.https://doi.org/10.1371/journal.pone.0052565
Wang L., Ruan Y.L. // Front. Plant Sci. 2013. V. 4. P. 163. https://doi.org/10.3389/fpls.2013.00163
Poupin M.J., Greve M., Carmona V., Pinedo I. // Front. Plant Sci. 2016. V. 7. P. 492. https://doi.org/10.3389/fpls.2016.00492
Khan N., Ali S., Tariq H., Latif S., Yasmin H., Mehmood A., Shahid M. A. // Agronomy. 2020. V. 10. № 11. P. 1683. https://doi.org/10.3390/agronomy10111683
Egamberdieva D., Kucharova Z. // Biol. Fertil. Soils. 2009. V. 45. № 6. P. 563–571. https://doi.org/10.1007/s00374-009-0366-y
Creus C.M., Sueldo R.J., Barassi C.A. // Can. J. Bot. 2004. V. 82. № 2. P. 273–281. https://doi.org/10.1139/b03-119
El-Akhdar I.A., Elshikh M., Allam N.G., Kamal F., Abou-Shanab R., Staehelin C. // Environ. Biodivers. Soil Secur. 2019. V. 3. P. 15–17. https://doi.org/10.21608/jenvbs.2019.16428.1069
Ali S., Khan N. // Microbiol. Res. 2021. V. 249. P. 126771. https://doi.org/10.1016/j.micres.2021.126771
Glick B.R. // Scientifica. 2012. P. 963401. https://doi.org/10.6064/2012/963401
Мартыненко Е.В., Архипова Т.Н. // Агрохимия. 2010. № 8. С. 35–42.
Xu J., Li X., Luo L. // Appl. Environ. Microbiol. 2012. V. 78. № 22. P. 8056–8061. https://doi.org/10.1128/AEM.01276-12
Егоршина А.А., Хайруллин Р.М., Сахабутдинова А.Р., Лукьянцев М.А. // Физ. раст. 2012. Т. 59. №. 1. С. 148.
Tsukanova K.A., Meyer J.J.M., Bibikova T.N. // S. Afr. J. Bot. 2017. V. 113. P. 91–102. https://doi.org/10.1016/j.sajb.2017.07.007
Nett R.S., Montanares M., Marcassa A., Lu X., Nagel R., Charles T.C., Peters R.J. // Nat. Chem. Biol. 2017. V. 13. № 1. P. 69–74. https://doi.org/10.1038/nchembio.2232
Bastián F., Cohen A., Piccoli P., Luna V., Baraldi R., Bottini R. // Plant. Growth. Regul. 1998. V. 24. № 1. P. 7–11. https://doi.org/10.1023/A:1005964031159
Atzorn R., Crozier A., Wheeler C.T., Sandberg G. // Planta. 1988. V. 175. № 4. P. 532–538. https://doi.org/10.1007/BF00393076
Khan A.L., Waqas M., Kang S., Al-Harrasi A., Hussain J., Al-Rawahi A., Lee I.J. // J. Microbiol. 2014. V. 52. № 8. P. 689–695. https://doi.org/10.1007/s12275-014-4002-7
Huang G.T., Ma S.L., Bai L.P., Zhang L., Ma, H., Jia P., Guo Z.F. // Mol. Biol. Rep. 2012. V. 39. № 2. P. 969–987. https://doi.org/10.1007/s11033-011-0823-1
Cohen A.C., Travaglia C.N., Bottini R., Piccoli P.N. // Bot. 2009. V. 87. № 5. P. 455–462. https://doi.org/10.1139/B09-023
Cohen A.C., Bottini R., Pontin M., Berli F.J., Moreno D., Boccanlandro H., Piccoli P.N. // Physiol. Plant. 2015. V. 153. № 1. P. 79–90. https://doi.org/10.1111/ppl.12221
Bresson J., Varoquaux F., Bontpart T., Touraine B., Vile D. // New Phytol. 2013. V. 200. № 2. P. 558–569. https://doi.org/10.1111/nph.12383
Park J.W., Balaraju K., Kim J.W., Lee S.W., Park K. // Biol. Control. 2013. V. 65. № 2. P. 246–257. https://doi.org/10.1016/j.biocontrol.2013.02.002
Salomon M.V., Bottini R., de Souza F.G.A., Cohen A.C., Moreno D., Gil M., Piccoli P. // Physiol. Plant. 2014. V. 151. № 4. P. 359–374. https://doi.org/10.1111/ppl.12117
Shahzad R., Khan A.L., Saqib B., Waqas M., Kang S.M., Lee I.J. // Environ. Exp. Botany. 2017. V. 136. P. 68–77. https://doi.org/10.1016/j.envexpbot.2017.01.010
Li Y., Xu S., Gao J., Pan S., Wang G. // Plant Growth Regul. 2016. V. 78. P. 43–55. https://doi.org/10.1007/s10725-015-0073-7
Naing A.H., Maung T.T., Kim C.K. // Physiol. Plant. 2021. V. 173. № 4. P. 1992–2012. https://doi.org/10.1111/ppl.13545
Forchetti G., Masciarelli O., Alemano S., Alvarez D., Abdala G. // Appl. Microbiol. Biotechnol. 2007. V. 76. № 5. P. 1145–1152. https://doi.org/10.1007/s00253-007-1077-7
Chourdhary D., Johri B. // Microbiol. Res. 2009. V. 164. № 5. P. 493–513. https://doi.org/10.1016/j.micres.2008.08.007
García-Gutiérrez L., Zeriouh H., Romero D., Cubero J., de Vicente A., Pérez-García A. // Microb. Biotechnol. 2013. V. 6. № 3. P. 264–274. https://doi.org/10.1111/1751-7915.12028
Niu D.D., Liu H.X., Jiang C.H., Jiang C.H., Zhang W.Z., Wang Y.P., Guo J.H. // Mol. Plant Microb. Inter. 2011. V. 24 № 5. P. 533–542. https://doi.org/10.1094/MPMI-09-10-0213
Egamberdieva D., Wirth S.J., Alqarawi A.A., Abd Allah E.F., Hashem A. // FMC. 2017. V. 8. P. 2104. https://doi.org/10.3389/fmicb.2017.02104
Shakirova F.M., Sakhabutdinova A.R., Bezrukova M., Fatkhutdinova R.A., Fatkhutdinova D.R. // Plant. Sci. 2003. V. 164. P. 317–322. https://doi.org/10.1016/S0168-9452(02)00415-6
Singh U.P., Sarma B.K., Singh D.P. // Curr. Microbiol. 2003. V. 46. № 2. P. 131–140. https://doi.org/10.1007/s00284-002-3834-2
Vlot A.C., Dempsey D.A., Klessig D.F. // Annu. Rev. Phytopathol. 2009. V. 47. P. 177–206. https://doi.org/10.1146/annurev.phyto.050908.135202
Wu L., Huang Z., Li X., Ma L., Gu Q., Wu H., Gao X. // Front. Microbiol. 2018. V. 9. P. 847. https://doi.org/10.3389/fmicb.2018.00847
Panpatte D.G., Shukla Y.M., Shelat H.N., Vyas, R.V., Jhala Y.K. In: Microorganisms for Green Revolution / Ed. D.G. Panpatte, Y.K. Jhala, R.V. Vyas, H.N. Shelat. Singapore: Springer, 2017. 443 p. https://doi.org/10.1007/978-981-10-6241-4
Chiappero J., Cappellari L. del R., Alderete L.G.S., Palermo T.B., Banchio E. // Ind. Crop. Prod. 2019. V. 139. P. 111553. https://doi.org/10.1016/j.indcrop.2019.111553
Vaishnav A., Varma A., Tuteja N., Choudhary D.K. / Ed. D.K. Choudhary, A.K. Sharma, P. Agarwal, A. Varma, N. Tuteja. Singapore: Springer, 2017. 373 p. https://doi.org/10.1007/978-981-10-5553-9
ALKahtani M.D.F., Fouda A., Attia K.A. // Agronomy. 2020. V. 10. № 9. P. 1325. https://doi.org/10.3390/agronomy10091325
Park Y.S., Dutta S., An M., Raaijmakers J.M., Park K. // Biochem. Biophys. Res. Comm. 2015. V. 461. № 2. P. 361–365. https://doi.org/10.1016/j.bbrc.2015.04.039
Tahir H.A.S., Gu Q., Wu H., Raza W., Hanif A., Wu L., Gao X. // Front. Microbiol. 2017. V. 8. P. 171. https://doi.org/10.3389/fmicb.2017.00171
Lemfack M.C., Nickel J., Dunkel M., Preissner R., Piechulla B. // Nucleic Acids Res. 2014. V. 42. № 1. P. 744–748. https://doi.org/10.1093/nar/gkt1250
Bitas V., Kim H.S., Bennett J.W., Kang S. // Mol. Plant. Microbe. Interact. 2013. V. 26. № 8. P. 835–843. https://doi.org/10.1094/MPMI-10-12-0249-CR
Audrain B., Mohamed A.F., Ch.-M. Riu, J.-M. Ghigo // FEMS Microbiol. Rev. 2015. V. 39. № 2. P. 222–233. https://doi.org/10.1093/femsre/fuu013
Niinemets Ü. // Trends Plant Sci. 2010. V. 15. № 3. P. 145–153. https://doi.org/10.1016/j.tplants.2009.11.008
Timmusk S., El-Daim Abd I., Copolovici L., Copolovici L., Tanilas T., Kännaste A., Niinemets Ü. // PLoS One. 2014. V. 9. № 5. P. e96086.https://doi.org/10.1371/journal.pone.0096086
Cho S.M., Kang B.R., Han S.H., Anderson A.J., Park J.Y., Lee Y.H., Kim Y.C // APS Pub. 2008. V. 21. № 8. P. 1067–1075. https://doi.org/10.1094/MPMI-21-8-1067
Bhattacharyya D., Yu S.M., Lee Y.H. // Plant. Growth. Regul. 2015. V. 75. № 1. P. 297–306. https://doi.org/10.1007/s10725-014-9953-5
Bhattacharyya D., Lee Y.H. // J. Plant. Physiol. 2017. V. 214. P. 64–73. https://doi.org/10.1016/j.jplph.2017.04.002
Vurukonda S.S.K.P., Vardharajula S., Shrivastava M., SkZ A. // Microbiol. Res. 2016. V. 184. P. 13–24. https://doi.org/10.1016/j.micres.2015.12.003
Chen Y., Gozzi R., Yan F., Chai Y. // ASM J. 2015. V. 6. № 3. P. e00392. https://doi.org/10.1128/mBio.00392-15
Ryu C.M., Farag M.A., Hu C.H., Reddy M.S., Kloepper J.W., Paré P.W. // Plant Physiol. 2004. V. 134. № 3. P. 1017–1026. https://doi.org/10.1104/pp.103.026583
Raza W., Wang J., Wu Y., Ling N., Wei Z., Huang Q., Shen Q. // Appl. Microbiol. Biotechnol. 2016. V. 100. № 17. P. 7639–7650. https://doi.org/10.1007/s00253-016-7584-7
Vardharajula S., Zulfikar A.S., Grover M., Reddy G., Bandi V. // J. Plant. Interact. 2011. V. 6. № 1. P. 1–14. https://doi.org/10.1080/17429145.2010.535178
Dakora F.D., Matiru V.N., Kanu A.S. // Front. Plant Sci. 2015. V. 6. P. 700. https://doi.org/10.3389/fpls.2015.00700
Tanaka K., Cho S.H., Lee H., Pham A.Q., Batek J.M., Cui S., Stacey G. // J. Exp. Bot. 2015. V. 66. № 19. P. 5727–5738. https://doi.org/10.1093/jxb/erv260
Bramhachari P.V., Nagaraju G.P., Kariali E. In Role of Rhizospheric Microbes in Soil /Ed. V.S. Meena. Singapore: Springer, 2018. 400 p. https://doi.org/10.1007/978-981-10-8402-7
Talebi Atouei M., Pourbabaee A.A., Shorafa M. // Iranian J. Sci. Technol. Trans. A. 2019. V. 43. № 4. P. 2725–2733. https://doi.org/10.1007/s40995-019-00753-x
Alami Y., Achouak W., Marol C., Heulin T. // Appl. Environ. Microbiol. 2000. V. 66. № 8. P. 3393–3398. https://doi.org/10.1128/AEM.66.8.3393-3398.2000
Awasthi S., Srivastava P., Mishra P.K. // Agric. Res. Technol. 2017. V. 8. № 2. P. 8–10. https://doi.org/10.19080/ARTOAJ.2017.08.555731
Gontia-Mishra I., Sapre S., Sharma A., Tiwari S. // Plant. Biol. 2016. V. 18. № 6. P. 992–1000. https://doi.org/10.1111/plb.12505
Amellal N., Burtin G., Bartoli F., Heulin T. // Appl. Environ. Microbiol. 1998. V. 64. № 10. P. 3740–3747. https://doi.org/10.1128/AEM.64.10.3740-3747.1998
Subramanian S., Smith D.L. // Front. Plant. Sci. 2015. V. 6. P. 909. https://doi.org/10.3389/fpls.2015.00909
Глобальный климат и почвенный покров России: проявления засухи, меры предупреждения, борьбы, ликвидация последствий и адаптационные мероприятия (сельское и лесное хозяйство). / Ред. Р.С.-Х. Эдельгериев. М.: OOO “Изд. МБА”, 2021. 700 с.
Hunt E., Femia F., Werrell C., Christian J.I., Otkin J.A., Basara J., McGaughey K. // Weather. Clim. Extremes. 2021. V. 34. P. 100383. https://doi.org/10.1016/j.wace.2021.100383
Okuyama L.A., Federizzi L.C., Barbosa N.J.F // Ciênc. Rural. 2004. V. 34. № 6. P. 1701–1708. https://doi.org/10.1590/S0103-84782004000600006
Araus J.L., Slafer G.A., Royo C., Serret M.D. // Crit. Rev. Plant Sci. 2008. V. 27. № 6. P. 377–412. https://doi.org/10.1080/07352680802467736
Khan M.Y., Zahir Z.A., Asghar H.N., Waraich E.A. // Pak. J. Bot. 2017. V. 49. № 4. P. 1541–1551.
Çakmakçı R., Turan M., Kıtır N., Güneş, A., Nikerel E., Özdemir B.S., Mokhtari N.E.P. In: Wheat Improvement, Management and Utilization /Ed. R. Wanyera, J. Owuoche. London, UK: IntechOpen Limited, 2017. 394 p. https://doi.org/10.5772/63694
Chakraborty U., Chakraborty B.N., Chakraborty A.P., Dey P.L. // World J. Microbiol. Biotechnol. 2013. V. 29. № 5. P. 789–803. https://doi.org/10.1007/s11274-012-1234-8
Alvarez M.I., Sueldo R.J., Barassi C.A. // Cereal. Res. Commun. 1996. V. 24. № 1. P. 101–107.
Hussain M.B., Zahir Z.A., Asghar H.N., Asghar M. // Int. J. Agric. Biol. 2014. V. 16. P. 3‒13.
Chen C., Xin K., Liu H., Cheng J., Shen X., Wang Y., Zhang L. // Sci. Rep. 2017. V. 7. № 1. P. 41564. https://doi.org/10.1038/srep41564
Vacheron J., Desbrosses G., Bouffaud M.L., Touraine B., Moënne-Loccoz Y., Muller D., Prigent-Combaret C. // Front. Plant Sci. 2013. V. 4. P. 356. https://doi.org/10.3389/fpls.2013.00356
Ullah A., Nisar M., Ali H., Hazrat A., Hayat K., Keerio A.A., Yang X. // Appl. Microbiol. Biotechnol. 2019. V. 103. P. 7385‒7397. https://doi.org/10.1007/s00253-019-10045-4
Kasim W.A., Osman M.E., Omar M.N., El-Daim A., Islam A., Bejai S., Meijer J. // J. Plant. Growth. Regul. 2013. V. 32. P. 122–130.https://doi.org/10.1007/s00344-012-9283-7
El-Afry M.M. // Acta. Biol. Szeged. 2012. V. 56. № 2. P. 165–174.
Pereyra M.A., García P., Colabelli M.N., Barassi C.A., Creus C.M. // Appl. Soil. Eco. 2012. V. 53. P. 94–97. https://doi.org/10.1016/j.apsoil.2011.11.007
Furlan F., Saatkamp K., Volpiano C.G., de Assis Franco F., dos Santos M.F., Vendruscolo, E.C.G., da Costa A.C.T. // Sci. Agrar. 2017. V. 18. № 2. P. 104–113.
Yaghoubi Khanghahi M.Y., Leoni B., Crecchio C. // Acta. Physiol. Plant. 2021. V. 43. P. 123. https://doi.org/10.1007/s11738-021-03289-z
Naveed M., Hussain M.B., Zahir Z.A., Mitter B., Sessitsch A. // Plant Growth Regul. 2014. V. 73. № 2. P. 121–131. https://doi.org/10.1007/s10725-013-9874-8
Nemati A., Sedghi M. // J. Crop Prod. 2022. V. 13. № 4. P. 87–110. https://doi.org/10.22069/EJCP.2021.18408.2364
Maslennikova D., Lastochkina O. // Plants. 2021. V. 10. P. 2557. https://doi.org/10.3390/plants10122557
Мерзляк М.Н. // Соросовский Образ. Журн. 1999. Т. 9. С. 20–26.
Колупаев Ю.Е., Карпец Ю.В., Ястреб Т.О., Луговая А.А. // Вісн. Харків. нац. аграрy. ун-ту. Сер. Біологія. 2016. Т. 1. № 37. С. 42–62.
Kaushal M., Wani S.P. // Agriculture. Ecosyst. Env. 2016. V. 231. P. 68–78. https://doi.org/10.1016/j.agee.2016.06.031
Яруллина Д.Р., Асафова Е.В., Картунова Ю.Е., Зиятдинова Г.К., Ильинская О.Н. // Прикл. биохимия микробиология. 2014. Т. 50. № 2. С. 189–192. https://doi.org/10.7868/S0555109914020196
Ullah S., Bano A. // Can. J. Microbiol. 2015. V. 61. № 4. P. 307–313. https://doi.org/10.1139/cjm-2014-0668
Khalafallah A.A., Abo-Ghalia H.H. // J. Appl. Sci. Res. 2008. V. 4. № 5. P. 559–569.
Chaves M.M., Maroco J.P., Pereira J.S. // Funct. Plant Biol. 2003. V. 30. № 3. P. 239–264. https://doi.org/10.1071/FP02076
Чжоу К., Юй Б.Д. // Физиология растений. 2009. Т. 56. № 5. С. 751–758.
Sandhya V.D., Ali S., Grover M., Reddy G., Venkateswarlu B. // Plant. Growth. Regul. 2010. V. 62. № 1. P. 21–30.
Jogawat A. In: Molecular Plant Abiotic Stress: Biology and Biotechnology /Eds. A. Roychoudhury, D.K. Tripathi. Willy, 2019. P. 91‒97. https://doi.org/10.1002/9781119463665
Paul D., Nair S. // J. Basic. Microbiol. 2008. V. 48. № 5. P. 378–384. https://doi.org/10.1002/jobm.200700365
Ilyas N., Mumtaz K., Akhtar N., Yasmin H., Sayyed R.Z., Khan W., Ali Z. // Sustainability. 2020. V. 12. № 21. P. 8876. https://doi.org/10.3390/su12218876
Gusain Y.S., Singh U.S., Sharma A.K. // Afr. J. Biotechnol. 2015. V. 14. № 9. P. 764‒773. https://doi.org/10.5897/AJB2015.14405
Shintu P.V., Jayaram K.M. // Trop. Plant. Res. 2015. V. 2. P. 17–22.
Camaille M., Fabre N., Clément C., Ait Barka E. // Microorganisms. 2021. V. 9. № 4. P. 687. https://doi.org/10.3390/microorganisms9040687
Suárez R., Wong A., Ramírez M., Barraza A., Orozco M.D.C., Cevallos M.A., Iturriaga G. // Mol. Plant Microbe Interact. 2008. V. 21. № 7. P. 958–966. https://doi.org/10.1094/MPMI-21-7-0958
Forni C., Duca D., Glick B.R. // Plant Soil. 2017. V. 410. №. 1–2. P. 335–356. https://doi.org/10.1007/s11104-016-3007-x
Toju H., Peay K.G., Yamamichi M. // Nat. Plant. 2018. V. 4. P. 247–257. https://doi.org/10.1038/s41477-018-0139-4
Lahti L., Shetty S., Blake T., Salojarvi J. // Version. 2017. V. 1. № 5. P. 28.
Shade A., Stopnisek N. // Curr. Opin. Microbiol. 2019. V. 49. P. 50–58. https://doi.org/10.1016/j.mib.2019.09.008
Cernava T., Erlacher A., Soh J., Sensen C.W., Grube M., Berg G. // Microbiome. 2019. V. 7. P. 13. https://doi.org/10.1186/s40168-019-0624-7
Kavamura V.N., Robinson R.J., Hayat R., Clark I. M., Hughes D., Rossmann M., Auchline T.H. // Front. Microbiol. 2019. V. 10. P. 2625. https://doi.org/10.3389/fmicb.2019.02625
Simonin M., Dasilva C., Terzi V., Ngonkeu E. L., Diouf D., Kane A. et al. // FEMS Microbiol. Ecol. 2020. V. 96. № 6. https://doi.org/10.1093/femsec/fiaa067
Rossmann M., Pérez-Jaramillo J.E., Kavamura V.N., Chiaramonte J. B., Dumack K., Fiore-Donno A.M. et al. // FEMS Microbiol. Ecol. 2020. V. 96. № 4. https://doi.org/10.1093/femsec/fiaa032
Douglas A.J., Hug L.A., Katzenback B.A. // Microb. Ecol. 2020. V. 81. P. 78–92. https://doi.org/10.1007/s00248-020-01550-5
Risely A. // J. Anim. Ecol. 2020. V. 89. № 7. P. 1549–1558. https://doi.org/10.1111/1365-2656.13229
Schlatter D.C., Yin C., Hulbert S., Paulitz T. // Appl. Environ. Microbiol. 2019. V. 86. № 5. https://doi.org/10.1128/AEM.02135-19
Berg G., Rybakova D., Fischer D., Cernava T., Vergès M.C.C., Charles T. et al. // Microbiome. 2020. V. 8. № 1. P. 103. https://doi.org/10.1186/s40168-020-00875-0
Velázquez-Sepúlveda I., Orozco-Mosqueda M.C., Prieto-Barajas C.M., Santoyo G. // Phyton. Int. J. Exp. Bot. 2012. V. 81. P. 81–87.
Naz I., Mirza R.S., Bano A. // J. Anim. Plant Sci. 2014. V. 24. № 4. P. 1123–1134.
Kuźniar A., Włodarczyk K., Grządziel J., Woźniak M., Furtak K., Gałązka A., Wolińska A. // Int. J. Mol. Sci. 2020. V. 21. № 13. P. 4634. https://doi.org/10.3390/ijms21134634
Hone H., Mann R., Yang G., Kaur J., Tannenbaum I., Li T., Spangenberg G., Sawbridge T. // Sci Rep. 2021. V. 11. P. 11916. https://doi.org/10.1038/s41598-021-91351-8
Timmusk S., Paalme V., Pavlicek T., Bergquist J., Vangala A., Danilas T., Nevo E. // PloS One. 2011. V. 6. № 3. P. e17968. https://doi.org/10.1371/journal.pone.0017968
Safin R.I., Karimova L.Z., Nizamov R.M., Valiev A.R., Validov S.Z., Faizrakhmanov D.I. // Adv. Engin. Res. 2018. V. 151. P. 766–770. https://doi.org/10.2991/agrosmart-18.2018.143
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


