Прикладная биохимия и микробиология, 2022, T. 58, № 5, стр. 476-483
Галотолерантные бактерии рода Glutamicibacter – деструкторы терефталевой кислоты
О. В. Ястребова 1, *, А. А. Малышева 2, Е. Г. Плотникова 1, 2
1 Институт экологии и генетики микроорганизмов УрО РАН – филиал Пермского федерального исследовательского центра УрО РАН
614081 Пермь, Россия
2 Пермский государственный национальный исследовательский университет
614068 Пермь, Россия
* E-mail: olyastr@mail.ru
Поступила в редакцию 14.03.2022
После доработки 14.04.2022
Принята к публикации 26.04.2022
- EDN: PPREVJ
- DOI: 10.31857/S0555109922050166
Аннотация
Терефталевая кислота (ТФК), изомер орто-фталевой кислоты, широко используется в химической промышленности для получения искусственных волокон и пластмасс, в том числе полиэтилентерефталата, и является распространенным загрязнителем окружающей среды. Изучена способность двух штаммов Glutamicibacter spp. PB8-1 (=ВКМ Ac-2934D) и BO25 (=ВКМ Ac2935D), выделенных из района солеразработок (Пермский край, Россия), к росту на ТФК как единственном источнике углерода и энергии. Штаммы PB8-1 и BO25 способны утилизировать высокие концентрации ТФК (30 г/л), что для бактерий-деструкторов ТФК показано впервые. Штаммы PB8-1 и BO25 являются галотолерантными бактериями: растут в среде как без NaCl, так и при содержании NaCl до 90 г/л в богатой среде и до 60 г/л в минеральной среде с ТФК. Бактерии, способные к деструкции ТФК в условиях засоления, ранее описаны не были. Рост штамма ВО25 на ТФК сопровождался накоплением и последующим разложением протокатеховой кислоты (ПКК), что позволило предположить метаболизм ТФК через ПКК, описанный ранее для бактерий разных таксонов, в том числе актинобактерий. Таким образом, деструкторы ТФК Glutamicibacter spp. PB8-1 и BO25 являются перспективными для разработки методов биоремедиации засоленных почв и сточных вод, загрязненных ТФК.
Фталаты – соли и эфиры орто-фталевой кислоты, простейшей из двухосновных ароматических карбоновых кислот, которая является изомером терефталевой и изофталевой кислот. Фталаты широко применяются в промышленности в качестве пластификаторов при производстве пластмасс и большинства видов резины. Эфиры фталевой кислоты (дибутилфталат, диметилфталат, диэтилфталат) используются для пластификации поливинилхлорида (ПВХ), при синтезе полиэфирных волокон, полиэтилена, а также в производстве строительных и смазочных материалов, лаков, косметики [1–3]. Терефталевая кислота (ТФК) – изомер фталевой кислоты с пара-расположением карбоксильных групп, широко применяется для получения насыщенных полиэфиров, химических волокон, пластмасс, красителей. ТФК является основным исходным соединением для получения полиэтилентерефталата (ПЭТ), который составляет 90% от общего производимого количества насыщенных полиэфиров и используется в производстве искусственного волокна, пластиковых бутылок, пластмассы. Мировое годовое производство полиэтилентерефталата превысило 30 миллионов тонн, при этом потребность в ПЭТ постоянно растет [4]. Наряду с 2-этилгексанолом, ТФК является сырьем для производства диоктилтерефталата (ДОТФ) – ключевого компонента в производстве обоев, линолеума, напольных и кровельных материалов и другой продукции строительной отрасли [5].
В связи с широким применением в промышленном производстве, фталаты (в том числе, ТФК) являются повсеместными загрязнителями окружающей среды и обнаруживаются в настоящее время в различных экосистемах, в том числе в почве, морской воде, донных отложениях [6–8]. При производстве 1 т ТФК обычно образуется 3–10 т сточных вод, содержащих высокие концентрации этого соединения. В Китае производственные мощности по производству ТФК достигли 12 млн т/г, при этом объем сточных вод составлял около 30 миллионов т/г с концентрацией выбросов ТФК более 1000 мг/л [9, 10]. Известно, что терефталевая кислота оказывает неблагоприятное воздействие на клетки человека и животных, обладает гепатотоксичными и канцерогенными свойствами, в связи с чем, необходима утилизация этого широко распространенного поллютанта [6, 11].
К настоящему времени разработаны физические и химические методы разложения ТФК, однако данные методы являются сложными и дорогостоящими [12, 13]. Микробная деградация ТФК является альтернативным экологически безопасным и экономичным методом [10, 14]. Из литературы известна способность бактерий различных филогенетических групп к разложению ТФК. Так, изучена способность к росту и деструкции ТФК у грамотрицательных бактерий рода Comamonas, Pseudomonas [14, 15]. Среди грамположительных бактерий, утилизирующих ТФК, описаны несколько штаммов родов Rhodococcus, Arthrobacter [10, 16, 17]. В то же время, бактериальная деструкция ТФК изучена менее детально, чем биодеградация орто-фталевой кислоты [3, 18]. Известно, что разложение ТФК начинается с дигидроксилирования ароматического кольца с образованием цис-1,2-дигидрокси-1,2-дигидротерефталата, при трансформации которого образуется протокатеховая кислота (ПКК) – ключевой метаболит утилизации изомеров и сложных эфиров орто-фталевой кислоты [3, 15, 16]. К настоящему времени в литературе не найдено статей, посвященных деструкции ТФК актинобактериями рода Glutamicibacter.
Цель настоящей работы – характеристика двух бактерий рода Glutamicibacter, выделенных из района солеразработок, способных к деструкции терефталевой кислоты.
МЕТОДИКА
Объекты исследования. В работе использованы бактериальные штаммы BO25 и PB8-1 из коллекции лаборатории микробиологии техногенных экосистем “ИЭГМ УрО РАН”, которые были идентифицированы как представители рода Glutamicibacter [19].
Штаммы BO25 (=ВКМ Ас-2935D), PB8-1 (ВКМ Ac-2934D) выделены из образцов, отобранных на территории промышленных солеразработок (г. Березники, Россия). Штамм ВО25 выделен из образца техногенно-минеральных образований калийного производства БКПРУ‑1 методом прямого высева на агаризованную богатую среду Раймонда (БСР) [19] с добавлением 50 г/л NaCl. Штамм РВ8-1 выделен из образца ризосферной почвы, отобранного вблизи солеотвала БКПРУ-3 методом накопительного культивирования в минеральной среде Раймонда с орто-фталевой кислотой (1 г/л) в качестве субстрата и добавлением 30 г/л NaCl [19].
Среды и условия культивирования. Для выращивания бактерий использовали минеральную среду Раймонда (МСР) следующего состава (г/л): NH4NO3 – 2.0, MgSO4 · 7H2O – 0.2, K2HPO4 – 2.0, Na2HPO4 – 3.0, CaCl2 · 6H2O – 0.01, Na2CO3 – 0.1, 2 мл/л 1%-ного раствора MnSO4 ⋅ 2H2O и 1 мл/л 1%-ного раствора FeSO4 · 7H2O [20]. В качестве субстратов использовали ТФК, орто-фталевую кислоту (ОФК), дибутилфталат (ДБФ), диметилфталат (ДМФ), протокатеховую кислоту (ПКК), фенантрен, бифенил, салицилат, бензоат и нафталин в концентрации 1.0 г/л. Характеристики роста штаммов изучали в жидкой среде Раймонда с добавлением NaCl в концентрации 30–100 г/л. Для приготовления богатой среды Раймонда (БСР) в минеральную среду Раймонда добавляли 5 г/л триптона и 2.5 г/л дрожжевого экстракта в качестве субстратов. Культивирование микроорганизмов в жидких средах проводили при 28°С на термостатируемой качалке при 100 об./мин. Для получения агаризованных сред добавляли агар-агар (“Helicon”, Россия) в концентрации 15 г/л. Культивирование микроорганизмов осуществляли в термостате при 28°С.
Характеристики роста бактерий. Рост бактерий при разных концентрациях хлорида натрия изучали в периодической культуре в жидкой среде МСР с ТФК (1.0 г/л) в присутствии 30, 60, 70 г/л NaCl и без соли в среде. В качестве инокулята использовали культуры в экспоненциальной фазе роста, выращенные на МСР, без добавления NaCl, с ТФК в качестве субстрата. Рост бактерий при разных концентрациях ТФК оценивали в жидкой минеральной среде К1 [22], в которую вносили субстрат в концентрациях 1, 10, 20, 30, 40 г/л. В качестве инокулята использовали культуры в экспоненциальной фазе роста, выращенные на среде К1 с ТФК (1 г/л) в качестве субстрата. Культуры бактерий выращивали в колбах Эрленмейера объемом 250 мл (объем среды – 100 мл) при 28°С, с аэрацией на термокачалке при 100 об/мин. Оптическую плотность (ОП600) культуральной жидкости определяли на спектрофотометре UV Visible BioSpec-mini (“Shimadzu”, Япония) при длине волны 600 нм в кювете с длиной оптического пути 1 см. Расчет удельной скорости роста (μ, ч–1) проводили по стандартной формуле: μ = (lnB2 – ‒ lnB1)/(t2 – t1), где В1 и В2 – оптические плотности культуры в моменты времени t1 и t2, соответственно [21].
При оценке роста бактерий при разных рН использовали среду БСР с 30 г/л NaCl, штаммы культивировали на агаризованной среде при рН 5.0, 6.0, 7.0, 8.0, 9.0. Рост оценивали по наличию бактериальных колоний на седьмой день культивирования [21].
Потребление ТФК и определение ПКК. ТФК и ППК в среде для выращивания определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием хроматографа LC-20AD Prominance (“Shimadzu”, Япония) с колонкой (С-18 150 × 4.6 мм; “Shima-Aldrich”, США) и УФ-детектором SPD-20A (при 205 нм) в системе ацетонитрил–0.1%-ная H3PO4 (70 : 30). В качестве подвижной фазы использовали 80%-ный раствор ацетонитрила при скорости потока 1.0 мл/мин и температуре 40°С. Идентификацию проводили при сравнении времени выхода пиков экстрактов со стандартными растворами ТФК и ПКК в концентрациях 50 и 100 мг/л, время удерживания (tR) ТФК и ПКК составляло 5.1 мин и 4.8 мин, соответственно. Количественное содержание рассчитывали с помощью пакета программ “LCsolution” (“Shimadzu”, Япония). Расчет удельной скорости утилизации (μ, сут–1) проводили по стандартной формуле: μ = (lnС1 – lnC2)/(t2 – t1), где С1, С2 – концентрация субстрата в начальный и конечный момент времени t1 и t2, соответственно [21].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Общая характеристика штаммов. На основании морфо-физиологических и генетических (анализ гена 16S рРНК) характеристик штаммы BO25 и PB8-1 были идентифицированы как представители рода Glutamicibacter (семейство Micrococcaceae). Показано, что штамм BO25 филогенетически наиболее близок типовому штамму вида G. halophytocola, а штамм PB8-1 – типовому штамму вида G. arilaitensis [19].
Штаммы BO25 и PB8-1 были выделены из образцов шлама и ризосферной почвы, отобранных на территории добычи и переработки калийно-магниевых солей Верхнекамского месторождения (Россия). Ранее было показано, что образцы из района солеразработок характеризовались как повышенным содержанием соли, так и присутствием стойких органических загрязнителей, в том числе фталатов [23, 24]. Glutamicibacter spp. BO25, PB8-1 обладали способностью к росту на моно- и полиароматических углеводородах при культивировании в присутствии 30 г/л NaCl. Штамм BO25 показал умеренный рост на бензоате, ОФК, ДБФ, ДМФ, а также слабый рост на нафталине. Штамм PB8-1 способен к росту на бензоате, ОФК, ДБФ, нафталине и слабому росту на ДМФ (табл. 1). В литературе описаны штаммы рода Glutamicibacter, растущие на фталатах и моноароматических углеводородах в качестве субстратов. Так, штамм G. nicotianae ZM05 способен к утилизации ОФК и сложных эфиров фталевой кислоты: ДБФ, ДМФ, диэтилфталата (ДЭФ), ди-n-пропилфталата, а также ПКК [25]. Штамм G. nicotianae MSSRFPD35 способен к деструкции фенола и его производных, а также катехола [26].
Таблица 1.
Рост штаммов рода Glutamicibacter на моно(поли)ароматических соединениях*
| Штамм | Субстрат | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ОФК | ТФК | ДБФ | ДМФ | ПКК | Фен | Биф | Сал | Бен | Наф | |
| BO25 | ++ | ++ | ± | ± | ++ | ‒ | + | + | + | ± |
| PB8-1 | ++ | ++ | + | ± | ++ | ‒ | ‒ | + | + | + |
Примечание. “++” – ОП600 ≥ 0.5; “+” – ОП600 = 0.35–0.5; “±” – ОП600 = 0.2–0.35; “–” – отсутствие роста. *ОФК – орто-фталевая кислота, ТФК – терефталевая кислота, ДБФ – дибутилфталат, ДМФ – диметилфталат, ПКК – протокатеховая кислота, Фен – фенантрен, Биф – бифенил, Сал – салицилат, Бен – бензоат, Наф – нафталин.
Штаммы BO25 и PB8-1 хорошо росли при рН от 6.0 до 9.0 с оптимумом при 7.0. Аналогичные показатели рН были показаны ранее и для других видов рода Glutamicibacter [27].
Рост штаммов BO25 и PB8-1 в присутствии высоких концентраций соли. Установлено, что штаммы BO25 и PB8-1 способны к росту на агаризованной БСР как без добавления соли в среду культивирования, так и при содержании в среде до 90 г/л хлорида натрия. На агаризованной МСР с ТФК (1 г/л) в качестве единственного источника углерода и энергии штаммы росли при концентрации NaCl до 60 г/л в среде. Согласно полученным данным, штаммы BO25 и PB8-1 относятся к умеренно галотолерантным микроорганизмам по классификации Кашнера [28].
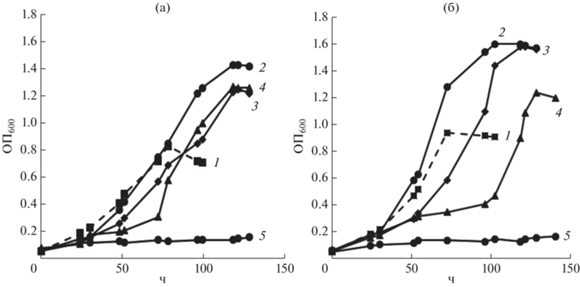
Изучено влияние различных концентраций NaCl на рост и потребление ТФК штаммами PB8-1 и BO25 в среде МСР с ТФК (1 г/л) в качестве субстрата (рис. 1, 2). Активный рост штаммов наблюдался в присутствии NaCl до 60 г/л в среде. Наибольшую плотность роста (ОП600) штаммов зафиксировали при культивировании без добавления NaCl. Высокие значения ОП600 и скорости роста культур наблюдали также в присутствии 30 г/л NaCl. Повышение концентрации NaCl в среде до 60 г/л NaCl приводило к увеличению лаг-фазы роста и к снижению максимальных значений ОП600 штаммов, однако удельная скорость роста снижалась незначительно (табл. 2). У штамма ВО25 наблюдали как увеличение лаг-фазы, так и снижение максимального значения ОП600, по сравнению со штаммом РВ8‑1. При содержании в среде 70 г/л NaCl рост штаммов на ТФК не наблюдали.
Рис. 1.
Рост штаммов РВ8-1 (а) и BO25 (б) на ТФК (1 г/л) при различных концентрациях NaCl (г/л): 1 – без NaCl; 2 – 30; 3 – 60; 4 – 70.
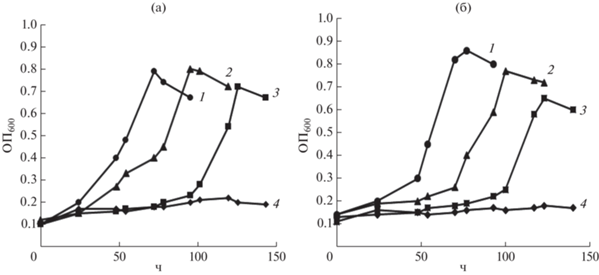
Рис. 2.
Утилизация ТФК (1 г/л) штаммами РВ8-1 (а) и BO25 (б) при различных концентрациях NaCl (г/л): 1 – без NaCl; 2 – 30; 3 – 60; 4 – 70.
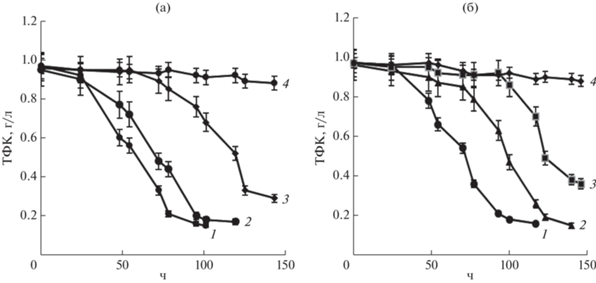
Таблица 2.
Параметры роста и утилизации ТФК при различных концентрациях хлорида натрия штаммами PB8-1, BO25 при выращивании в присутствие ТФК, ПКК
| Параметр | ТФК | ПКК | ||||||
|---|---|---|---|---|---|---|---|---|
| PB8-1 | BO25 | PB8-1 | BO25 | |||||
| без NaCl | 30 г/л | 60 г/л | без NaCl | 30 г/л | 60 г/л | без NaCl | ||
| Удельная скорость роста, ч–1 | 0.018 ± ± 0.002 | 0.020 ± ± 0.001 | 0.018 ± ± 0.003 | 0.021 ± ± 0.004 | 0.017 ± ± 0.003 | 0.016 ± ± 0.002 | 0.020 ± ± 0.002 | 0.030 ± ± 0.006 |
| Максимальное значение ОП600 | 0.79 | 0.80 | 0.72 | 0.78 | 0.77 | 0.65 | 0.73 | 0.91 |
| Лаг-фаза роста, ч | 24 | 24 | 78 | 24 | 70 | 93 | 24 | 24 |
| Утилизация ТФК, % | 84.5 ± 0.2 | 85.2 ± 0.4 | 69.7 ± 0.3 | 83.5 ± 0.3 | 84.3 ± 0.2 | 62.8 ± 0.3 | ‒ | ‒ |
| Удельная скорость потребления, сут-1 | 0.560 | 0.347 | 0.151 | 0.460 | 0.226 | 0.188 | ‒ | ‒ |
Отмечалась корреляция между показателями роста штаммов и снижением концентрации ТФК в среде культивирования. Показано, что деструкция терефталата штаммами РВ8-1 и ВО25 в среде без добавления соли и с добавлением 30 г/л NaCl была выше 84%. С повышением содержания NaCl в среде до 60 г/л отмечалось снижение уровня деструкции субстрата до 69.7 и 62.8% для штаммов РВ8-1 и ВО25 соответственно (табл. 2).
Известны бактерии рода Glutamicibacter, растущие на средах с высоким содержанием солей. Так, штаммы G. halophytocola KLBMP5180T и Glutamicibacter sp. YD01, как показано авторами, были способны к росту на богатой среде в присутствии до 130 и 100 г/л NaCl соответственно [27, 29]. Однако штаммы рода Glutamicibacter, способные к разложению фталатов, в частности ТФК, в условиях повышенного засоления, ранее описаны не были.
Рост штаммов BO25 и PB8-1 на средах с высокими концентрациями ТФК. Установлено, что штаммы РВ8-1 и ВО25 при культивировании в среде К1 [22], не содержащей NaCl, способны использовать ТФК в качестве единственного источника углерода и энергии в концентрации до 30 г/л (рис. 3). При концентрации ТФК 1 г/л максимальные значения ОП600 среды к 78-102 ч культивирования штаммов РВ8-1 и ВО25 составляли 0.8 и 0.94 соответственно. Увеличение концентрации ТФК в среде у обоих штаммов приводило к увеличению длительности лаг-фазы, накоплению биомассы и снижению удельной скорости роста (табл. 3). При этом максимальные значения ОП600 штаммов наблюдались при концентрации ТФК в среде культивирования 10 г/л и составляли 1.43 и 1.6 для штаммов РВ8-1 и ВО25 соответственно. При повышении концентрации ТФК в среде до 40 г/л роста исследуемых штаммов не наблюдали.
Таблица 3.
Параметры роста и утилицации ТФК (1, 10, 20, 30 г/л) штаммами PB8-1, BO25
| Показатель | PB8-1 | BO25 | ||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 10 | 20 | 30 | 1 | 10 | 20 | 30 | |
| Удельная скорость роста, ч-1 | 0.012 ± ± 0.003 | 0.017 ± ± 0.001 | 0.014 ± ± 0.002 | 0.020 ± ± 0.002 | 0.018 ± ± 0.003 | 0.030 ± ± 0.004 | 0.026 ± ± 0.003 | 0.028 ± ± 0.002 |
| Максимальное значение ОП600 | 0.83 | 1.43 | 1.25 | 1.27 | 0.94 | 1.60 | 1.58 | 1.24 |
| Лаг-фаза роста, ч | 24 | 30 | 48 | 72 | 30 | 30 | 51 | 102 |
| Утилизация ТФК, % | 79.0 ± 0.3 | 67.0 ± 0.4 | 32.6 ± 0.3 | 21.0 ± 0.2 | 87.5 ± 0.5 | 78.0 ± 0.3 | 38.0 ± 0.1 | 19.3 ± 0.2 |
| Удельная скорость утилиза-ции, сут-1 | 0.373 | 0.270 | 0.086 | 0.054 | 0.420 | 0.360 | 0.119 | 0.044 |
Наиболее высокий уровень утилизации ТФК отмечали при выращивании штамма PB8-1 в среде К1 при концентрации субстрата 1.0 г/л – 79% за 99 ч, а штамма ВО25 – 87.5% за 118 ч. Максимальная удельная скорость потребления ТФК у этих штаммов также наблюдалась при содержании ТФК в среде 1.0 г/л (табл. 3).
Как показано для представителей разных таксономических групп, терефталевая кислота в повышенных концентрациях может подавлять рост бактерий и способность к деструкции этого соединения. Так, концентрация ТФК 10 г/л и выше подавляла способность клеток штамма Arthrobacter sp. 0574 разлагать ТФК [10], а у бактерий рода Pseudomonas концентрация, которая превышала 1 г/л уже ингибировала рост [14]. Описан штамм Rhodococcus sp. N2, утилизирующий 10 г/л ТФК за 5 сут [30]. Исследуемые нами штаммы Glutamicibacter spp. РВ8-1 и ВО25 были способны к эффективному росту на более высоких концентрациях до 30 г/л ТФК. Таким образом, исследуемые штаммы не только способны выдерживать критически высокие концентрации ТФК, но и использовать это соединение в качестве источника углерода и энергии, что представляет несомненный интерес для дальнейшего изучения.
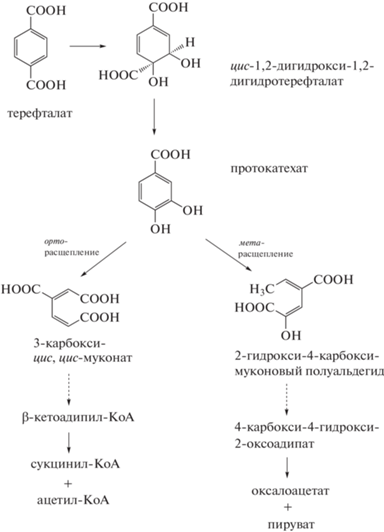
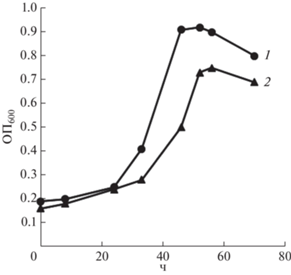
Разложение ТФК штаммами РВ8-1 и ВО25. Известно, что деструкция терефталевой кислоты аэробными бактериями осуществляется через стадию образования цис-1,2-дигидрокси-1,2-дигидротерефталата, который трансформируется до ПКК с последующим ее разложением до основных продуктов жизнедеятельности микробной клетки (рис. 4) [3, 16, 31]. Показана способность исследуемых штаммов BO25 и PB8-1 расти в МСР с 30 г/л NaCl на ПКК в качестве субстрата (рис. 5). Штамм ВО25 имел более высокие показатели максимального значения ОП600, удельной скорости роста на ПКК, чем штамм РВ8-1 (табл. 2). Анализ продуктов утилизации ТФК в культуральной среде при выращивании штамма ВО25 на данном субстрате методом ВЭЖХ показал присутствие ПКК в концентрации 0.3 и 0.1 г/л через 48 и 70 ч культивирования соответственно. На основании присутствия метаболита в среде с ТФК и способности исследуемых штаммов к росту на ПКК (рис. 5) можно предположить, что деструкция ТФК штамма Glutamicibacter sp. ВО25 осуществлялась по пути образования ПКК с последующим ее разложением (рис. 4). Известно, что утилизация ПКК актинобактериями идет преимущественно по орто-пути [32]. В то же время, имеются данные о возможности деградации ПКК у штаммов семейства Micrococcaciae (родов Arthrobacter, Pseudarthrobacter) по орто- и/или мета-пути [18, 33]. Исследование метаболического пути деструкции ТФК и ПКК штаммами Glutamicibacter spp. BO25 и РВ8-1 будет продолжено.
Таким образом, впервые охарактеризованы галотолерантные деструкторы ТФК рода Glutamicibacter. Штаммы BO25 и PB8-1 способны к росту и эффективной деструкции ТФК, в том числе при засолении среды (до 60 г/л NaCl) и высоких концентрациях этого соединения в среде культивирования (до 30 г/л). Подобные характеристики у бактериальных культур обнаружены впервые. Описанные бактериальные культуры являются перспективными для разработки эффективных биотехнологий очистки загрязненных/засоленных почв и промышленных стоков.
Список литературы
Jin D.-C., Liang R.-X., Dai Q.-Y., Zhang R.-Y., Wu X.-L., Chao W.-L. // J. Microbiol. Biotechnol. 2010. V. 20. № 10. P. 1440–1445.
Keyser P., Pujar B.G., Eaton R.W., Ribbons D.W. // Environ. Health Perspect. 1976. V. 18. P. 159.
Liang D.W., Zhang T., Fang H. // Appl. Microbiol. Biotechnol. 2008. V. 80. P. 183–198.
Delle Chiaie K.R., McMahon F.R., Williams E.J., Price M.J., Dove A.P. // Polym. Chem. 2020. V. 11. P. 1450–1453.
Медведев А.Н., Черезова Е.Н. // Вестник технологического университета. 2015. Т. 18. № 15. С. 44–46.
Przybylinka P.A., Wyszkowski E. // Ecol. Chem. Engin. 2016. V. 23(2). P. 347–356.
Staples C.A., Parkerton T.F., Peterson D.R. // Chemosphere. 2000. V. 40. P. 885–891.
Gao D., Wen Z. // Sci. Total Environ. 2016. V. 541. P. 986–1001.
Zhang X., Wan, Y., Cheng S., Sun S., Zhu C., Li W., Zhang X., Wang G., Lu J., Luo X. // J. Environ. Sci. (China). 2005. V. 17. № 5. P. 876–880.
Zhang Y.-M., Sun Y.-Q., Wang Z.-J., Zhang J. // South African J. Science. 2013. V. 109. № 7/8. Art. #0019.https://doi.org/10.1590/ sajs.2013/20120019
Zhang Z., Ma L., Zhang X.X., Li W., Zhang Y., Wu B., Yang L., Cheng S. // J. Hazard. Mater. 2010. V. 181. P. 1121–1126.
Park T., Lim J., Lee Y., Kim S. // J. Supercrit. Fluids. 2013. V. 26 P. 201–213.
Shafaei A., Nikazar M., Arami M. // Desalination. 2010. V. 252. P. 8–16.
Wang Z.J., Teng L.H., Zhang J.F. // Afr. J. Biotechnol. 2011. V. 10. №. 16. P. 3143–3148.
Kasai D., Kitajima M., Fukuda M., Masai E. // Appl. Environ. Microbiol. 2010. V. 76. № 18. P. 6047–6055.
Hara H., Eltis L.D., Davies J.E., Mohn W.W. // J. Bacteriol. 2007. V. 189. № 5. P. 1641–1647.
Choi K.Y., Kim D., Sul W.J., Chae J.C., Zylstra G.J., Kim Y.M., Kim E. // FEMS Microbiol. Letters. 2005. V. 252. P. 207–213.
Eaton R.W. // J. Bacteriol. 2001. V.183. № 12. P. 3689–3703.
Ястребова О.В., Плотникова Е.Г. // Вестник Пермского Университета. Серия Биология. 2020. № 4. С. 321–333.
Raymond R.L. // Developments in Industrial Microbiol. 1961. V. 2. №1. P. 23–32.
Нетрусов А.И. Практикум по микробиологии. М.: Академия, 2005. 608 с.
Зайцев Г.М., Карасевич Ю.Н. // Микробиология. 1981. Т. 50. С. 35–40.
Бачурин Б.А., Одинцова Т.А. Стойкие органические загрязнители в отходах горного производства. Современные экологические проблемы Севера. Апатиты: Изд-во НЦ РАН. 2006. Т. 2. С. 7–9.
Корсакова Е. С., Шестакова Е. А., Хайрулина Е. А., Назаров А. В. // Российский иммунологический журнал. 2015. Т. 9(18). № 2(1). С. 591–593.
Wang X., Shen S., Wu H., Wang H., Wang L. // Microorganisms. 2021. V. 30. № 9(7). P. 1417–1428.
Purushothaman D., Jegan S., Anu D.A., Prabavathy V.R. // Front. Microbiol. 2020. Article 1573. https://doi.org/10.3389/fmicb.2020.01573
Feng W.-W., Wang T.-T., Bai J.-L., Ding P., Xing K., Jiang J.-H., Peng X. Qin S. // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 1120–1125.
Kushner D.J. Life in High Salt and Solute Concentrations: Halophilic Bacteria, in Microbial Life in Extreme Environments / Ed. D.J. Kushner. London: Academic press, 1978. P. 317–368.
Ji J., Yuan D., Jin C., Wang G., Li X. // Acta Physiologiae Plantarum. 2020. V. 42. № 42.https://doi.org/10.1007/s11738-020-3034-3
Suwanawat N., Parakulsuksatid P., Nitayapat N., Sanpamongkolchai W. // Int. J. Environ. Science and Development. 2019. V. 10. № 1. P. 30–33.
Benjamin S., Pradeep S., Josh M.S., Kumar S., Masai E. // J. Hazardous Materials. 2015. V. 298. P. 58–72.
Bugg T.D., Ahmad M., Hardiman E.M., Singh R. // Curr. Opin. Biotechnol. 2011. V. 22. P. 394–400.
Tsagogiannis E., Vandera E., Primikyri A., Asimakoula S., Tzakos A.G., Gerothanassis I.P., Koukkou A.-I. // Int. J. Mol. Sci. 2021. V. 22. 9647. https://doi.org/10.3390/ijms22179647
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология