Прикладная биохимия и микробиология, 2022, T. 58, № 5, стр. 467-475
Роль биосинтеза кадаверина в адаптации Escherichia coli к действию пероксида водорода
А. В. Ахова 1, *, А. Г. Ткаченко 1
1 Институт экологии и генетики микроорганизмов УрО РАН – филиал
Пермского федерального исследовательского центра
614081 Пермь, Россия
* E-mail: akhovan@mail.ru
Поступила в редакцию 24.03.2022
После доработки 20.04.2022
Принята к публикации 26.04.2022
- EDN: FJKADY
- DOI: 10.31857/S0555109922050038
Аннотация
Исследована роль биосинтеза кадаверина в адаптации Escherichia coli к действию пероксида водорода. Показано дозозависимое увеличение уровня экспрессии генов ldcC и cadA, кодирующих ферменты синтеза кадаверина, в клетках, подвергнутых действию экзогенного пероксида водорода. Обнаружена обратная зависимость чувствительности бактерий от уровня внутриклеточного кадаверина в момент добавки пероксида водорода. Также установлено, что чувствительность бактерий к пероксиду водорода зависела от способности синтезировать кадаверин (наличия генов ldcC и cadA). В частности, скорость отмирания клеток, неспособных синтезировать кадаверин, была выше по сравнению с клетками способными к его синтезу. Чувствительность к пероксиду водорода увеличивалась в ряду изогенных штаммов с генотипом: дикий тип < ΔcadA < ΔldcC < ΔldcCΔcadA. Показана также роль накопления активных форм кислорода, в том числе пероксида водорода, в активации генов ldcC и cadA в клетках, подвергнутых воздействию антибиотика левофлоксацина.
Пероксид водорода традиционно используют в качестве биоцидного средства и применяют в медицине, пищевой индустрии и промышленном производстве для дезинфекции и стерилизации поверхностей и инструментов, помещений и готовой продукции, для обработки воды, в качестве антисептика и компонента лекарственных средств [1]. Для обработки применяют пероксид водорода в виде водного раствора или в более эффективной газообразной форме [2]. Одним из преимуществ Н2О2 по сравнению с другими дезинфектантами является его сравнительно быстрое разложение до нейтральных продуктов и низкие уровни остаточной концентрации. Н2О2 проявляет активность в отношении широкого спектра микроорганизмов, в том числе вирусов, бактерий, грибов, простейших, устойчивых покоящихся форм бактерий и простейших – эндоспор и цист соответственно, а также, возможно, прионов [3, 4].
Н2О2 относят к активным формам кислорода (АФК) и его биоцидное действие связано с окислением ключевых биологических макромолекул. Инициирование окисления пероксидом водорода органических соединений может происходить за счет непосредственного взаимодействия молекул, либо вследствие образования высокореактивных гидроксильных радикалов [5]. В частности, гидроксильные радикалы, способные вызывать окислительное повреждение ключевых биомолекул (нуклеиновых кислот, белков, липидов), образуются из пероксида водорода в присутствии ионов металлов с переменной валентностью (реакция Фентона).
В природных местах обитания микроорганизмы испытывают воздействие Н2О2 естественного происхождения. Пероксиды образуются в самой микробной клетке, в частности, в качестве побочного продукта метаболизма у аэробных организмов. Основной путь образования эндогенного Н2О2 связан с нейтрализацией посредством реакции дисмутации супероксидного аниона, который образуется за счет переноса электрона с компонентов дыхательной цепи непосредственно на кислород [6]. В отсутствии стресса сохраняется баланс между скоростью образования Н2О2 и его нейтрализацией, поэтому концентрация АФК поддерживается на постоянном, не наносящем ущерба уровне. В условиях воздействия естественных факторов стресса разной природы концентрация Н2О2 в клетке возрастает и наблюдается развитие окислительного стресса [7, 8]. Образование в клетках АФК, в том числе Н2О2, может быть вызвано воздействием редокс-циклирующих соединений, которые катализируют перенос электрона на кислород с образованием супероксидного аниона. Редокс-циклирующие соединения могут иметь искусственное происхождение или продуцироваться живыми организмами (растениями, бактериями) [9]. Увеличение концентрации Н2О2 в клетке до уровня способного вызвать повреждения может происходить за счет поступления его из окружающей среды. Н2О2 может образовываться в водной среде в результате физико-химических процессов, например, фотолиза воды. Кроме того, источником Н2О2 могут служить другие биологические объекты, например, лактобактерии и клетки иммунной системы макроорганизма [10].
Поскольку бактерии постоянно подвергаются воздействию Н2О2 в ходе эволюции у них сформировались механизмы защиты, позволяющие справляться с его повреждающим действием. Специальные ферменты (пероксидазы/каталазы), катализируют разложение Н2О2 до нейтральных продуктов [11]. Нейтрализовать АФК также способны малые антиоксидантные молекулы (глутатион, полиамины, витамины С и Е, каротиноиды), хотя следует отметить, что возможность синтеза витаминов в качестве защитного ответа на окислительный стресс у прокариот не показана. Важную роль в поддержании безопасного уровня свободных радикалов играет контроль количества ионов железа в клетке. Сохранять жизнеспособность в условиях окислительного стресса позволяют системы репарации макромолекул.
У Escherichia coli гены, кодирующие белки адаптации к пероксидному окислительному стрессу, объединены в регулон под контролем транскрипционного регулятора OxyR. Данный белок является непосредственным сенсором пероксида водорода, поскольку его переход в активную форму происходит в результате окисления сульфгидрильных групп имеющихся в его составе остатков цистеина (С199 и С208) с образованием дисульфидной связи за счет прямого контакта с Н2О2. Активация OxyR приводит к согласованной индукции экспрессии генов, кодирующих пероксидазы (katG, ahpCF), репрессор транспорта железа из среды (fur), компоненты системы восстановления глутатиона и других тиоловых соединений (gor, trxC, grxA), мини-ферритин dps и другие белки и функциональные РНК [12].
Ранее было показано, что в ответ на воздействие Н2О2 в клетках E. coli активируется синтез полиаминов (путресцина, спермидина и кадаверина) [13]. Если защитная функция путресцина и спермидина в условиях оксилительного стресса продемонстрирована [13, 14], то вклад кадаверина в адаптацию к действию пероксида водорода остается мало изученным.
Цель работы – исследование роли биосинтеза кадаверина в адаптации E. coli к пероксидному окислительному стрессу.
МЕТОДИКА
Материалы. Путресцин дигидрохлорид, кадаверин дигидрохлорид, спермидин тригидрохлорид, L-лизин моногидрохлорид, дансилхлорид, левофлоксацин, орто-нитрофенил-β-D-галактопиранозид – производства “Sigma” (США). Растворители, кислоты, пероксид водорода – призводства фирмы “Вектон” (Россия), додецилсульфат натрия – “Fluka” (США), полиамины содержали не ниже 98% основного компонента.
Объекты исследования. В качестве объектов исследования использованы штаммы Escherichia coli дикого типа (BW25141) и изогенные ему штаммы с делецией гена ldcC (BW25141ΔldcC) или гена cadA (BW25141ΔcadA), а также с делецией обоих генов, кодирующих лизиндекарбоксилазу (BW25141ΔldcCΔcadA) [15].
Для определения уровня экспрессии генов использованы штаммы E. coli, несущие транскрипционные генные слияния ldcC::lacZ (штамм SHT40, производный от штамма GC4468) или cadA::lacZ (штамм SHT45, производный от штамма GC4468) [15]. Штамм E. coli BGF931, несущий генное слияние katG::lacZ, предоставлен профессором Б. Демплом (Stony Brook University Medical School, США) [6].
Штаммы E. coli BW25141 и GC4468 получены из коллекции CGSC (Йельский университет, США).
Определение уровня экспрессии генов. Уровень экспрессии генов оценивали методом Миллера по активности β-галактозидазы в экстрактах клеток, несущих слияние промоторной части исследуемого гена со структурной частью гена lacZ и предварительно обработанных хлороформом и додецилсульфатом натрия [16].
Клетки культивировали в колбах Эрленмейера объемом 250 мл, содержащих 50 мл бульона LB (“VWR”, США), при 37°С без ротации в течение 16–18 ч. Полученные культуры разводили в свежей питательной среде до оптической плотности А600 = 0.1 и культивировали в описанных выше условиях. При оптической плотности культуры А600 = 0.3 вносили пероксид водорода/антибиотик. Добавку тиомочевины в культуру проводили за 10 мин до внесения пероксида водорода/антибиотика.
Определение оптической плотности культуры. Рост бактериальной культуры оценивали по изменению оптической плотности культуры при длине волны 600 нм (А600) с использованием сперктрофотометра UV-1280 (“Shimadzu”, Япония) и кюветы с длиной оптического пути 10 мм.
Определение минимальной подавляющей концентрации (МПК) пероксида водорода. МПК определяли методом двукратных серийных разведений пероксида водорода в лунках 96-луночных планшетов. Суспензию бактериальных клеток для анализа готовили, как описано в Руководстве по определению чувствительности микроорганизмов к антибиотикам [17] с некоторыми модификациями. Клетки предварительно культивировали в 5 мл среды М9 с добавкой 0.4% глюкозы, бульона LB или декарбоксилазного бульона при 37°С без перемешивания в течение 16–18 ч. В случае культивирования на М9 делали два пассажа культуры. Затем полученные культуры разводили до оптической плотности А625 = 0.09 и еще в 100 раз в среде соответствующего состава (указаны в табл. 1) и вносили 1 : 1 в лунки планшета, содержащие среду и пероксид водорода. Конечная концентрация бактерий в каждой лунке составляла примерно 5 × 105 КОЕ/мл. Далее планшеты инкубировали при 37°С в течение 18–20 ч. Минимальной подавляющей концентрацией считали наименьшую концентрацию, которая подавляла видимый рост бактерий.
Таблица 1.
Минимальная подавляющая концентрация пероксида водорода (мкг/мл)
| Генотип | Среда | |||||
|---|---|---|---|---|---|---|
| LB | ДК | ДК + 10 г/л лизина | М9 | М9 + 10 г/л лизина | М9 + 5/25/50 мМ кадаверина | |
| ldcC+cadA+ | 14.6 | 7.3 | 14.6 | 7.3 | 7.3 | 7.3/7.3/7.3 |
| ldcC-cadA- | 14.6 | 14.6 | 14.6 | 7.3 | 7.3 | 7.3/7.3/7.3 |
| ldcC+cadA- | 14.6 | 7.3 | 14.6 | 7.3 | 7.3 | 7.3/7.3/7.3 |
| ldcC-cadA+ | 14.6 | 14.6 | 14.6 | 7.3 | 7.3 | 7.3/7.3/7.3 |
Определение чувствительности бактериальных клеток к пероксиду водорода. Жизнеспособность бактериальных клеток оценивали по изменению количества колониеобразующих единиц (КОЕ) в культуре. Для определения количества КОЕ культуру клеток разводили в физрастворе и 10 мкл полученной суспензии наносили на поверхность агара LB (“Sigma”, США). Выживаемость рассчитывали в процентах от количества КОЕ в момент добавления пероксида водорода.
В серии экспериментов клетки культивировали в колбах Эрленмейера объемом 250 мл, содержащих 50 мл бульона LB, при 37°С без перемешивания (0 об./мин) или с перемешиванием (100 об./мин) в течение 16–18 ч. Полученные культуры разводили в свежей питательной среде до оптической плотности А600 = 0.1 и культивировали в описанных выше условиях. После достижения оптической плотности А600 = 0.3, 4.5 мл культуры переносили в пробирки с 0.5 мл раствора пероксида водорода и продолжали культивирование.
В другой серии экспериментов клетки культивировали в пробирках, содержащих 5 мл декарбоксилазного бульона Мёллера (бульон ДК) (“Sigma”, США) без добавок, с добавкой 10 г/л лизина гидрохлорида или 10 мМ кадаверина дигидрохлорида при 37°С без перемешивания в течение 16–18 ч. Затем клетки осаждали центрифугированием (16 000 g, 2 мин) и ресуспендировали в физрастворе, процедуру повторяли дважды. Отмытые сконцентрированные клетки переносили в пробирки со свежим ДК-бульоном для получения культур с примерно одинаковой плотностью (5.2 ± 2.4 × × 106 КОЕ/мл, среднее ± стандартное отклонение) и добавляли пероксид водорода (конечный объем культуры со всеми добавками составил 3 мл). В отмытых клетках до воздействия пероксида водорода определяли концентрацию внутриклеточных полиаминов.
Определение концентрации полиаминов в бактериальных клетках. 500 мкл суспензии клеток центрифугировали (16 000 g, 2 мин), полученный осадок заливали 100 мкл 0.4 M хлорной кислоты. На этом этапе пробы замораживали и хранили при –20°С. Размороженные пробы интенсивно встряхивали на шейкере в течение 40 мин, после чего обломки клеток осаждали центрифугированием при 16 000 g 5 мин. Надосадочную жидкость (клеточный экстракт) использовали для проведения реакции дансилирования. Клеточный экстракт, насыщенный раствор карбоната натрия и раствор дансилхлорида (2.7 мг/мл ацетона) в соотношении 1 : 1 : 2 помещали в плотно закрывающиеся микропробирки и инкубировали 2 ч при 37°С. Затем содержимое микропробирок выпаривали, осадок заливали 50 мкл бензола. Бензольный экстракт (10 мкл) наносили на поверхность пластин для ТСХ с силикагелевым покрытием Sorbfil ПТСХ-АФ-В (Россия). Разделение проводили в двух последовательных системах: 1 – бензол : триэтиламин 10 : 1, 2 – бензол : карбинол 10 : 0.45. Пластины фотографировали в ультрафиолетовом свете (340 нм) и измеряли интенсивность свечения пятен дансил-полиаминов на цифровом изображении. Идентификацию веществ и расчет концентрации полиаминов проводили методом внешнего стандарта. В качестве стандарта использовали растворы гидрохлоридов путресцина, кадаверина и спермидина, подвергнутые той же процедуре что и клеточные экстракты.
Статистическая обработка результатов. Обработка результатов проведена с использованием пакета программ Statistica 6.0 (“StatSoft Inc.”, США). Данные представлены как среднее и стандартная ошибка среднего, рассчитанные на основе результатов не менее трех отдельных экспериментов. Оценка статистической значимости различий средних сравниваемых групп произведена с использованием непарного t-критерия Стьюдента. Различия считали значимыми при p ≤ 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
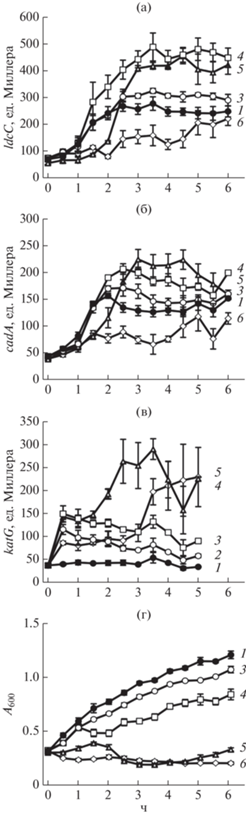
Влияние пероксида водорода на экспрессию генов ldcC и cadA. В ранних исследованиях показано, что в клетках E. coli, подвергнутых действию Н2О2, возрастала активность лизиндекарбоксилазы и, как следствие, наблюдалось накопление кадаверина [13]. Фермент, катализирующий синтез кадаверина – лизиндекарбоксилаза, у E. coli представлен двумя изоформами, которые кодируются генами ldcC и cadA [18]. С использованием метода генных слияний исследовали изменение уровня экспрессии этих генов в ответ на воздействие Н2О2 в концентрации 0.1–6.0 мМ. Добавка в среду Н2О2 в концентрации 0.5 мМ и выше вызывала повышение уровня экспрессии как гена ldcC, так и гена cadA (рис. 1а, 1б). Снижение экспрессии генов ниже уровня контроля в присутствии 6 мМ Н2О2 связано с гибелью бактериальных клеток. Для сравнения в тех же условиях исследовали влияние Н2О2 на экспрессию гена katG, кодирующего каталазу и входящего в OxyR-регулон защиты от пероксидного окислительного стресса (рис. 1в). Установлено, что для активации генов, кодирующих лизиндекарбоксилазы, требовались более высокие концентрации Н2О2, и индукция их экспрессии происходила позднее по сравнению с геном katG (1.5–2.0 и 0.5 ч соответственно). Можно предположить, что регуляция экспрессии генов, кодирующих ферменты синтеза кадаверина, в условиях воздействия пероксида водорода отличается от регуляции экспрессии генов, входящих в oxyR-регулон, и опосредована вторичными регуляторами. Тем не менее, увеличение концентрации Н2О2 можно рассматривать как сигнал для повышения экспрессии генов синтеза кадаверина.
Рис. 1.
Влияние пероксида водорода на экспрессию генов ldcC (а), cadA (б), katG (в) и оптическую плотность культуры E. coli (г): 1 – контроль без добавки Н2О2, 2 – 0.1, 3 – 0.5, 4 – 1.0, 5 – 3.0 и 6 – 6.0 мМ Н2О2.
Влияние экзогенного кадаверина на чувствительность бактериальных клеток к пероксиду водорода. Присутствие в среде кадаверина в концентрации 5–50 мМ не оказывало влияния на ингибирующее бактериальный рост действие Н2О2, как было установлено с применением метода двукратных серийных разведений (табл. 1).
Накопление кадаверина в клетках кадаверин-дефицитного штамма за счет экспорта из среды способствовало снижению чувствительности к пероксиду водорода (табл. 2, рис. 2г). В тоже время, более высокий уровень кадаверина в клетках штамма дикого типа, выращенных на среде с добавкой экзогенного кадаверина, обусловливал повышение их чувствительности к Н2О2 в сравнении с клетками, выращенными на среде, не содержащей кадаверин (табл. 2, рис. 2в). С чем связано повышение скорости отмирания клеток, выращенных в присутствии экзогенного кадаверина, на первых этапах воздействия Н2О2 не ясно. Поскольку сравниваемые штаммы, в целом, изогенны и отличались лишь наличием генов ldcC и cadA, возможно, что эффект экзогенного кадаверина обусловлен его влиянием на активность системы биосинтеза кадаверина.
Таблица 2.
Влияние состава среды культивирования на содержание полиаминов в клетках E. coli в зависимости от их способности синтезировать кадаверин*
| Среда | Генотип | Полиамины, нмоль/мг сухой биомассы | ||
|---|---|---|---|---|
| кадаверин | путресцин | спермидин | ||
| ДК | ldcC+cadA+ | 5.2 ± 0.5 | 7.7 ± 2.9 | 5.5 ± 1.5 |
| ldcC-cadA- | 1.4 ± 0.4** | 7.6 ± 2.1 | 4.6 ± 2.2 | |
| ДК + 10 г/л лизина | ldcC+cadA+ | 39.7 ± 3.7*** | 2.1 ± 0.2*** | 7.3 ± 3.9 |
| ldcC-cadA- | 1.8 ± 0.1** | 7.9 ± 4.2 | 5.2 ± 1.4 | |
| ДК + 10 мМ кадаверина | ldcC+cadA+ | 9.3 ± 1.3*** | 6.7 ± 1.1 | 4.5 ± 0.1 |
| ldcC-cadA- | 8.3 ± 1.3*** | 5.6 ± 2.2 | 3.6 ± 1.6 | |
Рис. 2.
Выживаемость (%) клеток E. coli штамма дикого типа BW25141 (а, в) и штамма BW25141ΔldcCΔcadA (б, г) при воздействии 3 (а, б) и 6 мМ (в, г) Н2О2 при культивировали в ДК-бульоне без добавок (1), с добавкой 10 г/л лизина (2) или 10 мМ кадаверина (3). Данные о внутриклеточной концентрации кадаверина в момент добавки Н2О2 представлены в табл. 2.
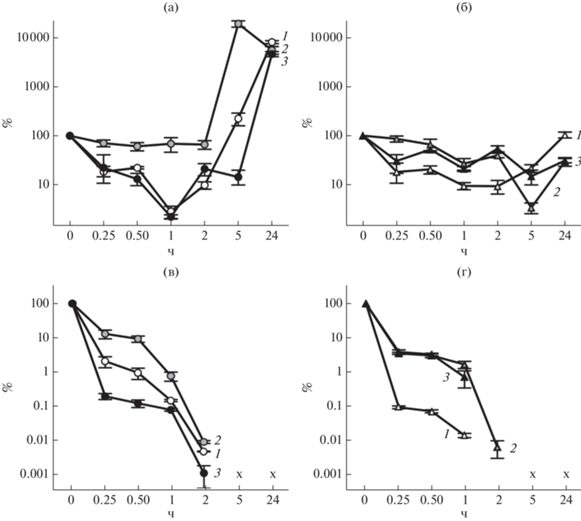
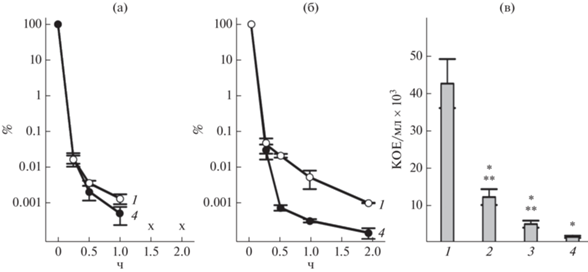
Вклад биосинтеза кадаверина в адаптацию бактериальных клеток к пероксидному окислительному стрессу. Для оценки вклада биосинтеза кадаверина в адаптацию бактерий к Н2О2 проведено сравнение выживаемости штамма дикого типа и штаммов с делецией генов ldcC и cadA. Разница в чувствительности к Н2О2 не была обнаружена при культивировании на полноценной среде в условиях микроаэрации (без перемешивания), тогда как в аэробных условиях скорость отмирания клеток способных к синтезу кадаверина была ниже по сравнению с бактериями, не способными синтезировать данный полиамин (рис. 3). Обе лизиндекарбоксилазы принимали участие в ответе на Н2О2, но больший вклад в выживаемость бактерий в данных условиях вносила лизиндекарбоксилаза LdcC (рис. 3в).
Рис. 3.
Выживаемость (%, а, б) и количество КОЕ в культуре E. coli (в) штаммов дикого типа BW25141 (1), BW25141ΔcadA (2), BW25141ΔldcC (3) и BW25141ΔldcCΔcadA (4) при воздействии 6 мМ Н2О2. Клетки культивировали в среде LB без перемешивания (а) и с перемешиванием (100 об./мин, б, в). Количество КОЕ (в) измеряли через 30 мин после воздействия Н2О2. (*Статистически значимые отличия от штамма дикого типа, **статистически значимые отличия от двойного нокаута, t-критерий, p ≤ 0.05).
На бульоне ДК, не содержащем лизин, орнитин, аргинин и глутамат, скорость отмирания культуры микроорганизмов, неспособных синтезировать кадаверин была выше по сравнению со штаммом дикого типа в условиях микроаэрации (рис. 2). Поскольку известно, что аминокислоты способны оказывать антиоксидантное действие [14, 19], отсутствие некоторых из них в составе среды позволило более ярко продемонстрировать эффект кадаверина, накопление которого в клетке наблюдалось и при культивировании в отсутствие экзогенного лизина (табл. 2).
Следует отметить, что клетки, выращенные в условиях низкой аэрации (без перемешивания) были более чувствительны к экзогенному Н2О2 по сравнению с клетками, культивируемыми в условиях более высокой аэрации (перемешивание со скоростью вращения 100 об./мин) (рис. 3а, 3б).
Выживаемость бактерий также зависела от количества кадаверина в клетках в момент добавки Н2О2. Для получения бактерий с разным уровнем внутриклеточного кадаверина их выращивали на среде ДК с добавкой и без добавки лизина. Внутриклеточная концентрация кадаверина уменьшалась в ряду – ldcC + cadA + (ДК + Лиз) > ldcC + cadA + + (ДК) > ldcC-cadA-(ДК) и была обратно пропорциональна скорости отмирания культуры (табл. 2, рис. 2в, 2г).
Лизин сам по себе оказывал защитное действие в условиях пероксидного окислительного стресса, поскольку его наличие в среде увеличивало выживаемость бактериальных клеток, лишенных генов синтеза кадаверина (рис. 3г). Аналогичный эффект лизина был обнаружен на эукариотных микроорганизмах Saccharomyces cerevisiae [20]. Клетки дрожжей, выращенные на среде с добавкой лизина и характеризующиеся повышенным внутриклеточным содержанием данной аминокислоты, были менее чувствительны к Н2О2 по сравнению с клетками, выращенными на среде без добавки лизина. Авторы статьи [20] исключили прямое антиоксидантное действие лизина (способность нейтрализовать Н2О2) и предположили, что основной механизм защитного действия экзогенного лизина связан с экономией восстановленного НАДФН, вследствие снижения его расхода на биосинтез лизина и перенаправления на другие нужды, в том числе для восстановления глутатиона и усиления антиоксидантной защиты. Возможно, наблюдаемое снижение чувствительности к пероксиду водорода клеток, выращиваемых в условиях интенсивной аэрации, по сравнению с клетками, выращиваемыми в условиях микроаэрации, обусловлено более высоким соотношением НАДФН/НАДФ [21].
Также в работе [20] был сделан вывод, что защитный эффект экзогенного лизина, скорее всего, не связан с накоплением в клетках дрожжей кадаверина, поскольку внесение в среду кадаверина не влияло на уровень чувствительности к пероксиду водорода. Как показали исследования, проведенные в настояшей работе, эффекты экзогенного и эндогенного кадаверина в условиях пероксидного окислительного стресса различны. Влияние уровня эндогенного кадаверина на устойчивость дрожжей к пероксиду водорода подробно не изучено, хотя показано, что клетки, обладающие активностью лизиндекарбоксилазы и практически ее лишенные, не отличались по уровню чувствительности. Такие эксперименты проведены в условиях культивирования в среде, не содержащей лизин. Возможно, при культивировании в среде, содержащей лизин, накапливались бы более значительные количества кадаверина, что позволило бы выявить его роль в адаптации к пероксидному стрессу у эукариотных микроорганизмов.
Роль эндогенного окислительного стресса в активации экспрессии генов ldcC и cadA в ответ на воздействие антибиотика. Известно, что воздействие антибиотиков сопровождается накоплением в бактериальных клетках АФК и активацией экспрессии генов антиоксидантной защиты, входящих в oxyR-регулон [22, 23]. Также показано, что в ответ на воздействие антибиотиков в клетках повышается уровень экспрессии генов, кодирующих ферменты синтеза кадаверина [15]. Можно предположить, что развитие эндогенного окислительного стресса, может быть сигналом для активации системы биосинтеза кадаверина в ответ на воздействие антибиотиков.
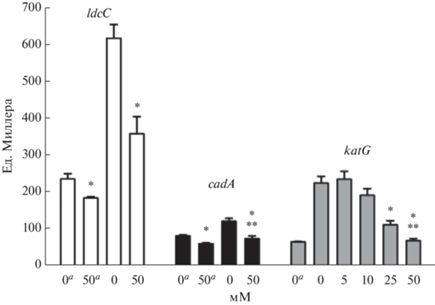
Для оценки вклада эндогенных АФК, в том числе Н2О2, в активацию генов ldcC и cadA был измерен уровень их экспрессии в клетках, подвергнутых действию фторхинолона левофлоксацина, в присутствии и в отсутствие антиоксиданта тиомочевины. Как было показано ранее, воздействие использованной в настоящей работе концентрации левофлоксацина вызывает повышение экспрессии гена katG [23]. Основное антиоксидантное действие тиомочевины связывают с нейтрализацией пероксида водорода и, как следствие, ингибированием реакции Фентона [24, 25]. Была подобрана концентрация тиомочевины, которая снижала до базового уровня экспрессию гена katG, индуцированную пероксидом водорода в концентрации, вызывавшей активацию генов синтеза кадаверина (рис. 4, рис. 1а, 1б). Добавка тиомочевины снижала как базовый уровень, так и индуцированный воздействием антибиотика уровень экспрессии генов, кодирующих ферменты синтеза кадаверина (рис. 4). В присутствии антиоксиданта индуцированный уровень экспрессии гена ldcC значительно снижался, а экспрессия гена cadA в клетках, подвергнутых воздействию антибиотика, возвращалась к базовому уровню. Следовательно, уровень экспрессии генов, кодирующих ферменты синтеза кадаверина, частично зависел от интенсивности эндогенного окислительного стресса.
Рис. 4.
Влияние тиомочевины на экспрессию генов ldcC и cadA в клетках E. coli, подвергнутых действию 0.1 мкг/мл левофлоксацина, экспрессию гена katG в клетках, подвергнутых действию 1 мМ пероксида водорода (а – без добавок контроль). Экспрессию измеряли через 3 ч после внесения антибиотика/Н2О2. (* Статистически значимые отличия от культуры без добавки тиомочевины, ** отсутствие статистически значимых отличий от культуры без добавки тиомочевины и антибиотика/Н2О2, t-критерий, p ≤ 0.05).
Таким образом, экзогенный пероксид водорода вызывал в клетках E. coli активацию генов, кодирующих ферменты синтеза кадаверина. Повышение внутриклеточного содержания АФК, в том числе пероксида водорода, за счет эндогенного образования, в частности, в результате воздействия фторхинолонового антибиотика, также являлось сигналом к повышению экспрессии генов ldcC и cadA. Накопление кадаверина в клетке являлось защитной реакцией на повышение концентрации Н2О2 и вносило вклад в адаптацию бактерий к пероксидному окислительному стрессу и, возможно, обусловливало преадаптацию к другим стрессирующим воздействиям. В целом, бактерии, неспособные синтезировать кадаверин в результате декарбоксилирования лизина, были более чувствительны к Н2О2 по сравнению с кадаверин-профицитными микроорганизмами. Жизнеспособность бактериальных клеток также напрямую зависела от уровня внутриклеточного кадаверина в момент начала воздействия пероксида водорода. Можно предположить, что защитное действие кадаверина может быть связано с прямым антиоксидантным действием, а также со стабилизацией и экранированием структур бактериальных клеток, таких как клеточная стенка и рибосомы [26–29]. Механизмы, лежащие в основе защитного действия кадаверина при адаптации к пероксидному окислительному стрессу, требуют дальнейшего изучения.
Авторы выражают искреннюю благодарность профессору Брюсу Демплу (Stony Brook University Medical School, Stony Brook, NY) за предоставленные штаммы E. coli.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации (АААА-А19-119112290009-1).
Авторы заявляют об отсутствии конфликта интересов. Исследования проведены без использования животных и без привлечения людей в качестве испытуемых.
Список литературы
Linley E., Denyer S.P., McDonnell G., Simons C., Maillard J.Y. // J. Antimicrob. Chemother. 2012. V. 67. № 7. P. 1589–1596.
McEvoy B., Rowan N.J. // J. Appl. Microbiol. 2019. V. 127. № 5. P. 1403–1420.
McDonnell G., Russell A.D. // Clin. Microbiol. Rev. 1999. V. 12. № 1. P. 147–179.
Fichet G., Antloga K., Comoy E., Deslys J.P., McDonnell G. // J. Hosp. Infect. 2007. V. 67. № 3. P. 278–286.
Kislenko V.N., Berlin A.A. // Russ. Chem. Rev. 1991. V. 60. № 5. P. 470–488.
González-Flecha B., Demple B. // J. Biol. Chem. 1995. V. 70. № 23. P. 13681–13687.
Mols M., Abee T. // Environ. Microbiol. 2011. V. 13. № 6. P. 1387–1394.
Akhova A.V., Sekatskaya P.A., Tkachenko, A.G. // Appl. Biochem. Microbiol. 2019. V. 55. P. 582–587.
Gu M., Imlay J.A. // Mol. Microbiol. 2011. V. 79. № 5. P. 1136–1150.
Imlay J.A. // Environ. Microbiol. 2019. V. 21. № 2. P. 521–530.
Хмелевцова Л.Е., Сазыкин И.С., Ажогина Т.Н., Сазыкина М.А. // Прикл. биохимия и микробиология. 2020. Т. 56. № 4. С. 327–335.
Sen A., Imlay J.A. // Front. Immunol. 2021. V. 12. 667343.
Tkachenko A.G., Nesterova L.Y. // Biochemistry (Mosc). 2003. V. 68. № 8. P. 850–856.
Chattopadhyay M.K., Tabor C.W., Tabor H. // Proc. Natl. Acad. Sci. USA. 2003. V. 100. № 5. P. 2261–2265.
Akhova A., Nesterova L., Shumkov M., Tkachenko A. // Res. Microbiol. 2021. V. 172. № 7–8. 103881.
Miller J.H. Experiments in Molecular Genetics. N.Y.: Cold Spring Harbor Laboratory, 1972. 466 p.
Performance Standards for Antimicrobial Susceptibility Testing; CLSI Document M100-S24. Wayne, PA: Clinical and Laboratory Standards Institute, Ed. 30. 2014. V. 40. № 1. 226 p.
Kikuchi Y., Kurahashi O., Nagano T., Kamio Y. // Biosci. Biotechnol. Biochem. 1998. V. 62. № 6. P. 1267–1270.
Wascher T.C., Posch K., Wallner S., Hermetter A., Kostner G.M., Graier W.F. // Biochem. Biophys. Res. Commun. 1997. V. 234. № 1. P. 35–38.
Olin-Sandoval V., Yu J.S.L., Miller-Fleming L., Alam M.T., Kamrad S., Correia-Melo C. et al. // Nature. 2019. V. 572. P. 249–253.
Godoy M.S., Nikel P.I., Cabrera Gomez J.G., Pettinari M.J. // Appl. Environ. Microbiol. 2015. V. 82. № 1. P. 244–254.
Kohanski M.A., Dwyer D.J., Hayete B., Lawrence C.A., Collins J.J. // Cell. 2007. V. 130. № 5. P. 797–810.
Akhova A.V., Tkachenko A.G. // FEMS Microbiol. Lett. 2014. V. 353. № 1. P. 69–76.
Randall L.O. // J. Biol. Chem. 1946. V. 164. P. 521–527.
Anbar M., Neta P. // Int. J. Appl. Radiat. Isot. 1967. V. 18. P. 493–523.
Gaboriau F., Vaultier M., Moulinoux J., Delcros J. // Redox Rep. 2005. V. 10. P. 9–18.
Spirin A., Gavrilova L. The ribosome. N.Y.: Springer-Verlag, 1969. 164 p.
Kojima S., Kaneko J., Abe N., Takatsuka Y., Kamio Y. // J. Bacteriol. 2011. V. 193. P. 2347–2350.
Akhova A.V., Tkachenko A.G. // Korean. J. Microbiol. 2020. V. 56. P. 103–110.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


