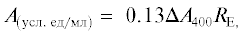Прикладная биохимия и микробиология, 2022, T. 58, № 5, стр. 484-499
Биодеструкция эфиров фталевой кислоты грибами белой гнили
О. С. Савинова 1, А. В. Шабаев 1, О. А. Глазунова 1, С. А. Еремин 1, 2, Т. В. Фёдорова 1, *
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Химический факультет, Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: fedorova_tv@mail.ru
Поступила в редакцию 25.11.2021
После доработки 10.12.2021
Принята к публикации 14.12.2021
- EDN: YIDDWF
- DOI: 10.31857/S0555109922050142
Аннотация
Изучена способность грибов белой гнили из разных экофизиологических групп (Trametes hirsuta – первичный дереворазрушающий сапротроф, Steccherinum ochraceum – вторичный дереворазрушающий сапротроф, Crucibulum laeve – подстилочный сапротроф, и Agrocybe praecox – гумусовый сапротроф) к деструкции эфиров фталевой кислоты (ЭФК). Показано, что диэтилгексилфталат (ДЭГФ), с более длинными и разветвленными углеводородными цепями, быстрее подвергался биодеструкции дереворазрушающими сапротрофами такими, как T. hirsuta и S. ochraceum, с эффективностью более 99%. Дибутилфталат (ДБФ), менее гидрофобный с более короткими углеводородными звеньями, наиболее эффективно трансформировался подстилочным сапротрофом C. laeve (до 96.5%). Диэтилфталат (ДЭФ) оказался наиболее токсичным для всех грибов. Из всех исследованных грибов T. hirsuta проявлял наибольшую устойчивость к повышенным концентрациям ДЭФ в среде. Показано, что грибы разрушают ЭФК с образование различных метаболитов в зависимости от состава мультиферментного комплекса гриба. Среди вторичных метаболитов обнаружен ионол – антиоксидант, образуемый грибами при внесении ЭФК в среду.
Проблема утилизации устойчивых токсичных органических загрязнителей в последнее время становится все более актуальной. К таким распространенным ксенобиотикам относятся эфиры фталевой кислоты (ЭФК, фталаты) – маслянистые жидкости без цвета и запаха, широко используемые для придания гибкости пластмассам, при изготовлении резины, полимеров, красок и топлива, в продуктах медицинского назначения, а также присутствующие в широком спектре продукции для личной гигиены [1]. ЭФК ковалентно не связаны с содержащей их продукцией, поэтому легко высвобождаются и попадают в различные биологические системы (реки, почву, воздух), оказывая серьезное негативное влияние не только на микробные сообщества почвы и круговорот питательных веществ [2, 3], но и нанося вред здоровью животных и человека, попадая в организм при вдыхании, перорально или трансдермальном всасывании [4–6]. ЭФК и их производные признаны потенциально опасными, так как оказывают негативное влияние на эндокринную систему млекопитающих, токсичны для печени и могут оказывать тератогенное и канцерогенное действие. Показано также негативное влияние ЭФК как на мужскую [1], так и на женскую [7] репродуктивную систему. ЭФК обнаруживаются и в пищевых продуктах, которые становятся источником попадания этих ксенобиотиков в организм человека [8, 9]. Все это свидетельствует о важности их удаления из окружающей среды.
Возможные пути разложения таких соединений в природе – гидролиз, фоторазложение и микробная деградация. Процесс гидролиза в основном происходит в водной среде, однако не всегда сопровождается полной деградацией ЭФК. Фоторазложение происходит очень медленно, а период полураспада составляет от нескольких лет до нескольких столетий. Таким образом, в настоящее время биодеструкция ЭФК с помощью ферментных систем микроорганизмов считается основным перспективным путем их деструкции в окружающей среде за относительно короткое время [10]. Так, были изучены и подробно описаны различные виды бактерий, способные к деструкции ЭФК [11–14]. Однако немногие способны к полной минерализации этих соединений и могут быть использованы в практических целях. Базидиальные грибы являются более перспективными объектами, благодаря их способности эффективно разрушать труднодеградируемые соединения [15]. При этом разработка стратегий, основанных на применении как самих грибных культур, так и синтезируемых ими ферментов, требует четкого понимания механизмов биодеградации каждого ксенобиотика. Известно, что способность к разложению ЭФК различная у разных штаммов грибов и зависит от синтезируемого ими комплекса ферментов и факторов окружающей среды. В литературе представлено значительное количество работ, которые показывают, что грибы, благодаря своим богатым и разнообразным мультиферментным комплексам, являются перспективными биодеструкторами различных поллютантов, в том числе ЭФК [15–18]. Таким образом, скрининг штаммов на способность к деградации ЭФК и изучение процесса их деградации является важным направлением современных исследований.
В качестве объектов для изучения деградации использованы диэтиловый эфир фталевой кислоты (ДЭФ, рис. 1а), дибутиловый эфир фталевой кислоты (ДБФ, рис. 1б) и диэтилгексилфталат (ДЭГФ, рис. 1в) – широко распространенные токсичные органические загрязнители, которые при попадании в организм человека могут нарушить работу эндокринной системы. Их относят к соединениям, нуждающимся в приоритетном контроле [19].
Цель работы – изучение биодеструкции ДЭФ, ДБФ и ДЭГФ грибами белой гнили из различных экофизиологических групп.
МЕТОДИКА
Реактивы. В работе были использованы следующие реактивы: диэтилфталат, дибутилфталат, диэтилгексилфталат фирмы “Sigma-Aldrich” (США). Другие материалы и растворители квалификации “х. ч.” и “ч. д. а.” были приобретены у российских производителей.
Культуры и условия культивирования. Штаммы базидиомицетов Trametes hirsuta LE-BIN 072, Steccherinum ochraceum LE-BIN 3174, Crucibulum laeve LE-BIN 1700 и Agrocybe praecox LE-BIN 2506 получены из Коллекции культур Ботанического института им. В.Л. Комарова (Санкт-Петербург, Россия).
Для оценки роста в присутствии ЭФК и определения общей оксидазной активности (ОА) грибы культивировали на твердой среде Мальтекс-агар, следующего состава (г/л): неохмеленный солодовый экстракт Maltax 10 (“OY Maltax AB”, Финляндия) – 50; агар-агар – 20, рН 6.0. В стерильную охлажденную до 40–50°С среду вносили ЭФК в концентрациях: 0.5, 1.0 и 1.5 г/л. Среды с внесенными ЭФК обрабатывали в ультразвуковой бане при 50°С в течение 5 мин. На подготовленные чашки Петри засевали мицелиальные блоки (d = 8 мм) грибов белой гнили и инкубировали в термостате при 25°С, измеряя в процессе роста диаметр мицелиального мата.
Инокулят грибов выращивали стационарно в 750 мл конических колбах с фарфоровыми бусами на глюкозо-пептонной (ГП) среде следующего состава (г/л): пептон – 3.0, глюкоза – 10, KH2PO4 – 0.6, K2HPO4 · 3H2O – 0.4, MgSO4 · 7H2O – 0.5, CaCl2–0.5, MnSO4 · 5H2O – 0.05, ZnSO4 – 0.001, FeSO4 – 0.0005, при 25°С 10–14 сут в зависимости от скорости роста гриба. Перед засевом инокулят измельчали бусами 20 мин при 180 об./мин до получения однородной суспензии, которую затем стерильно вносили в колбы для культивирования в объеме 10%.
Для изучения накопления биомассы и способности к биодеструкции ЭФК грибы выращивали глубинным способом на ГП среде на роторной качалке при 180 об./мин и 27°C. Выросшие грибные пеллеты отделяли фильтрованием и промывали 0.02%-ным стерильным водным раствором Твин 80, после чего 10 г грибной биомассы стерильно переносили в конические колбы на 250 мл со 100 мл жидкой минеральной среды следующего состава (г/л): KH2PO4 – 0.6, K2HPO4 – 0.4, MgSO4 ⋅ 7H2O – 0.5, CaCl2 – 0.05, MnSO4 – 0.05, ZnSO4 – 0.001, FeSO4 – 0.0005, NaNO3 – 3.0, глюкоза – 10.0, Твин 80 – 0.2. Перед внесением грибной биомассы в опытные колбы добавляли растворы ЭФК в концентрации 1.0 г/л, инкубировали на роторной качалке при 100 об./мин и 25°C. Образцы культуральной жидкости (КЖ) отбирали на 3, 6, 10 сут инкубации и хранили при –73°C до проведения анализа. Грибную биомассу отделяли фильтрованием и высушивали при температуре 100 ± ± 5°С до постоянной массы.
Скорость радиального роста (ur). Скорость радиального роста рассчитывали по графику зависимости диаметра колонии от времени роста с анализом линейной регрессии. Диаметр измеряли линейкой с первых суток инкубации до момента, когда гриб полностью покроет поверхность чашки Петри [20].
Общая эстеразная активность (ЭА). Оценку эстеразной активности в КЖ проводили при культивировании на жидкой минеральной среде с содержанием фталатов 1.0 г/л. Активность определяли спектрофотометрически на спектрофотометре PerkinElmer Lambda 35 (“PerkinElmer”, США), используя п-нитрофенил бутират в качестве субстрата. Реакцию проводили в натрий ацетатном буфере, рН 4.5 при 40°С в течение 10 мин. Реакцию останавливали натрий фосфатным буфером, рН 7.3, оптическую плотность определяли при длине волны λ = 400 нм. Расчет эстеразной активности проводили по формуле:
где RЕ – предварительное разбавление КЖ перед внесением в раствор субстрата;А400(S) – контроль, в котором вместо КЖ использовали воду; А400(Е) – контроль без внесения в реакционную смесь субстрата.
Определение общей оксидазной активности (ОА). ОА определяли в КЖ при выращивании грибов на жидкой минеральной среде с содержанием фталатов 1.0 г/л. Активность определяли спектрофотометрически на спектрофотометре PerkinElmer Lambda 35 при длине волны λ = 436 нм в 0.1 М натрий-ацетатном буфере, рН 4.5, как описано в работе [21] с использованием раствора 2,2'-азино-бис-(3-этилбензтиозолин-6-сульфокислоты) диаммониевой соли (АБТС) в качестве хромогенного субстрата. За 1 условную единицу активности принимали увеличение оптической плотности в 1 мл реакционной смеси за 1 мин.
Тонкослойная хроматография (ТСХ). Качественную оценку содержания ЭФК в КЖ грибов в процессе культивирования проводили методом ТСХ. Для этого 3 мл КЖ экстрагировали равным объемом дихлорметана (ДХМ), процедуру повторяли трижды. Полученный экстракт упаривали досуха и перерастворяли в 200 мкл ДХМ. По 10 мкл полученного экстракта наносили на пластину для аналитической хроматографии TLC Silica gel 60 F254 (“Merck”, Германия). В качестве контроля использовали растворы коммерческих ЭФК в ДХМ (по 10 мкг на точку). Элюцию проводили восходящим методом, используя в качестве подвижной фазы: 1) смесь ДХМ и гексана (2 : 1 об./об.) для предварительной оценки наличия ЭФК и продуктов деградации; 2) ДХМ для визуализации продуктов деградации, более полярных, чем исходные ЭФК. Визуализацию проводили в УФ-свете при длине волны 254 нм. Пластину обрабатывали 1%-ным раствором ванилина в 10%-ном водном растворе HClO4 и проявляли при температуре 100–110°С. Чувствительности метода ТСХ было достаточно для наблюдения за убыванием исходных ЭФК в процессе культивирования, а также визуализации в основном полярных продуктов биодеструкции.
Для разделения смеси полярных продуктов с целью их идентификации использовали препаративную ТСХ. Для этого сухой остаток, полученный после упаривания экстракта КЖ, растворяли в минимальном объеме ДХМ, наносили раствор на пластинки для ТСХ полосой на линии старта и хроматографировали восходящим методом в ДХМ. В УФ-свете пластинку делили на зоны по различным значениям Rf. Соединения элюировали отдельно из каждой зоны с использованием ДХМ. Элюаты упаривали досуха. Для контроля полученных элюатов проводили ТСХ. Идентификацию продуктов в образцах проводили с помощью ГХ-МС анализа.
Газовая хроматография с масс-спектрометрической детекцией (ГХ-МС). Оценку степени и скорости биодеструкции ЭФК в процессе культивирования грибов белой гнили проводили после анализа КЖ с использованием метода ГХ-МС. Для этого получали гексановые экстракты образцов КЖ (1 : 1 об./об.) и анализировали методом газо-жидкостной хроматографии в двух режимах: регистрация ионных масс в полном спектре (TIC, диапазон масс m/z 45–400) и регистрация по характерному для ЭФК основному иону (MIC, m/z = 149 – протонированный фталевый ангидрид).
Анализ проводили на газовом хроматографе GC-MS QP 2010 Ultra EI (“Shimadzu”, Япония), снабженном автоматическим устройством ввода пробы и квадрупольным масс-спектрометрическим детектором. Сбор данных и обработку хроматограмм проводили с помощью программного обеспечения LabSolutions GCMSsolution (“Shimadzu”, Япония). Использовали колонку MDN-5 30 м × 250 мкм × 0.25 мкм (“Supelco”, США), в качестве подвижной фаза – гелий, скорость потока элюента – 1 см3/мин, деление потока 1 : 5. Объем вводимой пробы 1 мкл, температура термостата 120°С, температура инжектора 200°С. Температурный градиент: 120°С выдержка 1 мин; с 120 до 280°С со скоростью 10°С/мин, изотерма 3 мин.
Все измерения проводили в 3 биологических повторностях. Результаты представлены в виде среднего значения ± стандартное отклонение. Статистическая обработка данных проводилась с использованием метода дисперсионного анализа. При обнаружении достоверного значения (р < 0.05) F-статистики, различия между индивидуальными средними были оценены с использованием теста множественного сравнения Тьюки (р ≤ 0.05).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Показано, что базидиальные грибы белой гнили могут использоваться для биоремедиации сточных вод и почв, загрязненных различными органическими соединениями. Благодаря своему уникальному комплексу секретируемых ферментов, они способны модифицировать даже такие труднодеградируемые полимеры, как лигнин, входящий в состав древесины. Известно, что такая высокая эффективность обусловлена существенными различиями в составе и композиции секретируемых мультиферментных комплексов (содержащих та-кие ферменты, как лакказа, лигнинпероксидаза, Mn-зависимая пероксидаза) у грибов из разных экофизиологических групп, участвующих на разных стадиях разложения древесины [22]. Этот факт позволил предположить, что такие различия могут обуславливать особенности деградации ЭФК разными представителями базидиомицетов. В настоящей работе был проведен сравнительный анализ способности грибов белой гнили – представителей различных экофизиологических групп, а именно: Trametes hirsuta (первичные дереворазрушающие сапротрофы), Steccherinum ochraceum (вторичные дереворазрушающие сапротрофы), Crucibulum laeve (подстилочные сапротрофы), Agrocybe praecox (гумусовые сапротрофы), к деструкции трех распространенных ЭФК.
Влияние ЭФК на рост грибов белой гнили. Хорошо известно, что начальная концентрация ЭФК может влиять на способность к их биодеградации различными организмами [18, 20]. Экстремальные концентрации загрязняющих веществ трудно поддаются деструкции большинством организмов. Для того, чтобы определить рабочий диапазон концентраций ЭФК, в данном исследовании была проведена предварительная оценка способности выбранных для исследования грибов к росту на агаризованных средах, содержащих разные концентрации фталатов. На рис. 2–4 приведены кривые роста грибных культур на среде с ДЭФ, ДБФ и ДЭГФ, в табл. 1 представлены скорости радиального роста грибов.
Рис. 2.
Кривые роста грибов на агаризованной среде с ДЭФ. а – T. hirsuta, б – S. ochraceum, в – C. laeve, г – A. praecox; 1 – контрольная среда без ЭФК, 2 – среда с 0.5 г/л ДЭФ, 3 – среда с 1 г/л ДЭФ, 4 – среда с 1.5 г/л ДЭФ.
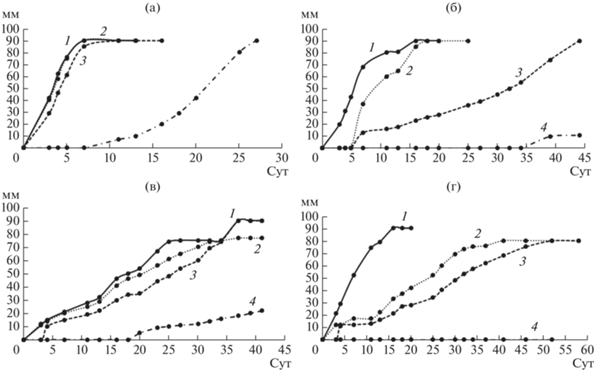
Рис. 3.
Кривые роста грибов на агаризованной среде с ДБФ. а – T. hirsuta, б – S. ochraceum, в – C. laeve, г – A. praecox; 1 – контрольная среда без ЭФК, 2 – среда с 0.5 г/л ДБФ, 3 – среда с 1 г/л ДБФ, 4 – среда с 1.5 г/л ДБФ.
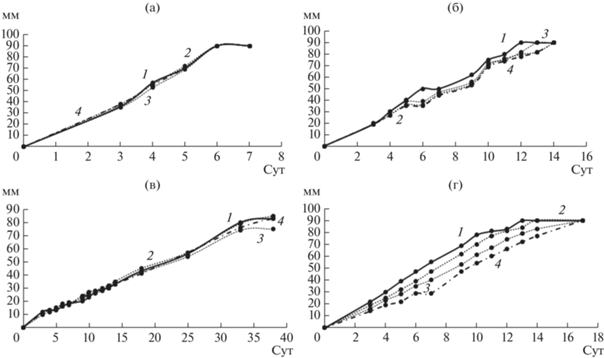
Рис. 4.
Кривые роста грибов на агаризованной среде с ДЭГФ. а – T. hirsuta, б – S. ochraceum, в – C. laeve, г – A. praecox; 1 – контрольная среда без ЭФК, 2 – среда с 0.5 г/л ДЭГФ, 3 – среда с 1 г/л ДЭГФ, 4 – среда с 1.5 г/л ДЭГФ.
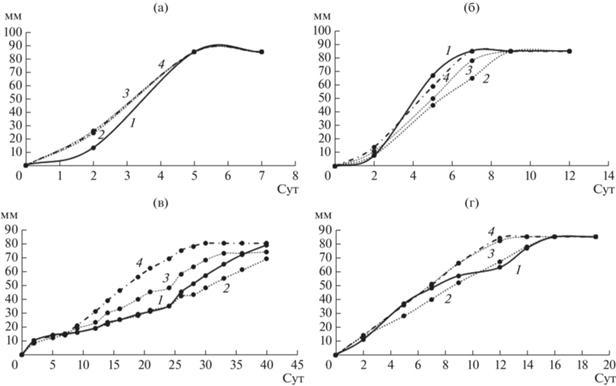
Таблица 1.
Скорость радиального роста штаммов, ur
| ЭФК | Концентрация, г/л | ur (мм/сут) | |||
|---|---|---|---|---|---|
| T. hirsuta | S. ochraceum | С. laeve | A. praecox | ||
| ДЭФ | 0 | 13.4 ± 0.6 | 6.6 ± 0.3 | 5.7 ± 0.2 | 2.4 ± 0.05 |
| 0.5 | 13.3 ± 0.6 | 6.2 ± 0.3 | 1.6 ± 0.05 | 2.1 ± 0.05 | |
| 1.0 | 12.4 ± 0.6 | 1.7 ± 0.08 | 1.2 ± 0.05 | 2.3 ± 0.05 | |
| 1.5 | 0.6 ± 0.03 | 0.1 ± 0.005 | Нет роста | 0.5 ± 0.01 | |
| ДБФ | 0 | 14.9 ± 0.7 | 7.4 ± 0.2 | 7.1 ± 0.3 | 2.2 ± 0.05 |
| 0.5 | 14.9 ± 0.7 | 6.7 ± 0.2 | 6.7 ± 0.3 | 2.2 ± 0.05 | |
| 1.0 | 14.8 ± 0.7 | 6.8 ± 0.2 | 5.8 ± 0.3 | 2.0 ± 0.05 | |
| 1.5 | 14.8 ± 0.7 | 6.5 ± 0.2 | 5.6 ± 0.2 | 2.1 ± 0.05 | |
| ДЭГФ | 0 | 17.6 ± 0.9 | 13.3 ± 0.7 | 4.7 ± 0.2 | 1.9 ± 0.05 |
| 0.5 | 17.3 ± 0.9 | 9.9 ± 0.5 | 5.2 ± 0.2 | 1.6 ± 0.05 | |
| 1.0 | 17.2 ± 0.9 | 10.4 ± 0.5 | 6.4 ± 0.3 | 2.0 ± 0.05 | |
| 1.5 | 17.2 ± 0.9 | 12.6 ± 0.6 | 6.4 ± 0.3 | 2.9 ± 0.05 | |
Эксперимент показал, что при увеличении концентрации ДЭФ в среде скорость роста всех штаммов замедлялась, причем на среде с концентрацией ДЭФ 1.5 г/л существенная задержка роста по сравнению с контролем наблюдалась у T. hirsuta, S. ochraceum и A. praecox (в 22, 66 и 5 раз соответственно), а гриб C. laeve не рос на среде с такой концентрацией ДЭФ. Следует отметить, что наиболее устойчивыми к присутствию ДЭФ в среде оказались T. hirsuta и A. praecox – их рост на контрольной среде и среде с 0.5 г/л ДЭФ не отличался, а на среде с ДЭФ в концентрации 1 г/л и выше рост гриба T. hirsuta замедлялся в большей степени, по сравнению с A. praecox. Все штаммы хорошо росли на среде с ДБФ. Наличие этого фталата в среде не оказывало влияния на рост T. hirsuta, на рост S. ochraceum и A. praecox влияние было незначительное, при этом рост C. laeve замедлялся при возрастании концентрации ДБФ в среде.
При выращивании грибов на среде с ДЭГФ наблюдали увеличение скорости роста T. hirsuta, по сравнению с контрольной средой, увеличение концентрации ДЭГФ в среде также ускоряло рост грибов A. praecox и C. leave, но замедляло рост S. ochraceum по сравнению с контролем. Увеличение скорости радиального роста на средах с добавлением ДЭГФ было ранее отмечено также для таких грибов белой гнили как Pleurotus pulmonarius, Pleurotus ostreatus и Lentinula edodes [18, 20], причем увеличение содержания ДЭГФ приводило к увеличению скорости роста. Авторы предположили, что грибы могут использовать фталаты в качестве источника углерода и энергии, так как наблюдалась четкая корреляция между диаметром гиф и концентрацией фталатов в среде.
Таким образом, для последующих экспериментов была выбрана концентрация ЭФК 1 г/л, которая, как было показано выше, не приводила к значительному ингибированию роста грибов.
На следующем этапе исследовали способность грибов к биодеструкции ДЭФ, ДБФ и ДЭГФ в жидких средах. При культивировании на минеральной среде с глюкозой и ЭФК в концентрации 1 г/л, наблюдали увеличение биомассы T. hirsuta как на контрольной среде, так на среде с ДЭГФ (рис. 5а), причем прирост биомассы продолжался вплоть до 10 сут культивирования. На среде с ДБФ биомасса увеличивалась к 6 сут, но далее не менялась. Биомасса S. ochraceum на среде с ДБФ и ДЭГФ увеличивалась к 3 сут на 8.1 и 22.6% соответственно, по сравнению с контрольной средой, но к 10 сут мицелий разрушался, причем более интенсивно в присутствии ДБФ (рис. 5б). Однако при культивировании как первичных, так и вторичных сапротрофов в присутствии ДЭФ количество биомассы оставалось на уровне исходного значения (рис. 5а, б), что согласуется с результатами по ингибированию роста этих грибов на агаризованных средах с ДЭФ (рис. 2а, б).
Рис. 5.
Диаграмма накопления биомассы (по сухому весу) при росте на среде с ЭФК (1 г/л). К – контрольная среда без ЭФК, 0 – исходная биомасса в расчете на сухой вес мицелия, 3 – биомасса на 3 сут, 6 – на 6 сут, 10 – на 10 сут культивирования. а – T. hirsuta, б – S. ochraceum, в – C. laeve, г – A. praecox.
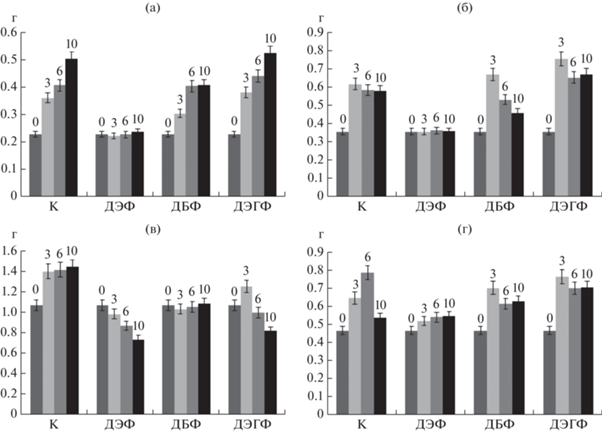
Наиболее чувствительным к присутствию ЭФК оказался подстилочный сапротроф C. laeve. Так, в присутствии ДБФ прирост биомассы не наблюдался, а в присутствии ДЭФ – мицелий гриба вовсе разрушался в ходе культивирования. На среде с ДЭГФ прирост биомассы наблюдался к 3 сут, далее биомасса резко уменьшалась (рис. 5в). Для гумусового сапротрофа A. praecox максимум биомассы на минеральных средах с ЭФК наблюдали на 3 сут культивирования, в отличие от контрольной среды (6 сут), но при этом он не превышал максимума биомассы в контроле (рис. 5г). На минеральной среде с ДЭФ был отмечен все же незначительный прирост биомассы A. praecox в ходе культивирования, которого не наблюдали у T. hirsuta и S. ochraceum.
Таким образом, в присутствии ЭФК, максимальный прирост биомассы грибов был отмечен на среде с ДЭГФ, однако только у S. ochraceum он был больше, чем на контрольной среде. В работе [23] показано, что биомасса Fusarium culmorum увеличивалась в присутствии ДБФ, по сравнению с контролем. Авторы предположили, что это связано с использованием фталата в качестве источника углерода, что, однако зависело от используемого организма и сложности структуры фталата.
Необходимо отметить существование различий в характере роста грибов на богатой среде Мальтекс-агар и жидкой минеральной среде. Так, в присутствии 1 г/л ДЭГФ скорость роста S. ochraceum на агаризованной среде замедлялась по сравнению с контролем, а в жидкой среде, наоборот, прирост биомассы был больше, по сравнению с контролем. У C. laeve на Мальтекс-агаре скорость роста увеличивалась, а на жидкой среде биомассы было значительно меньше, чем в контроле. Таким образом, характер роста S. ochraceum и C. laeve менялся в зависимости от состава среды культивирования. Для T. hirsuta и A. praecox такой зависимости не было выявлено. Скорость роста и накопление биомассы у T. hirsuta на обоих средах не отличалось от контроля, а у A. praecox скорость роста и прирост биомассы увеличивались в присутствии ДЭГФ.
Различия в характере роста грибных культур на разных средах в присутствии ЭФК могут быть связаны, в первую очередь, с синтезом ими специфического комплекса ферментов, который может сильно отличаться в зависимости от вида гриба и состава среды культивирования, а также, с различными путями деградации фталатов [20, 24–27].
Кроме того, в ходе жидкофазного культивирования грибов на средах с ЭФК наблюдали различия в изменении рН по сравнению с контрольной средой (рис. 6). Так, например, при культивировании S. ochraceum с ДЭФ к 10 сут рН резко снижался до 3.7 (по сравнению с исходным значением рН среды 4.9), в то время как на средах с другими ЭФК, а также контрольной, рН возрастал в процессе культивирования (рис. 6б). У грибов C. laeve и A. praecox также различалась динамика изменения рН на среде с ДЭФ, однако при этом показатель практически не менялся по сравнению с остальными вариантами эксперимента (рис. 6в, 6г). Для гриба T. hirsuta на всех средах сохранялась общая тенденция к снижению значения рН в процессе культивирования (рис. 6а), причем наиболее резкое падение происходило на 3 сут в присутствии ДЭФ.
Рис. 6.
Изменение рН при жидкофазном культивировании грибов T. hirsuta (а), S. ochraceum (б), C. leave (в), A. praecox (г): 1 – контрольная среда, 2 – ДЭФ, 3 – ДБФ, 4 – ДЭГФ.
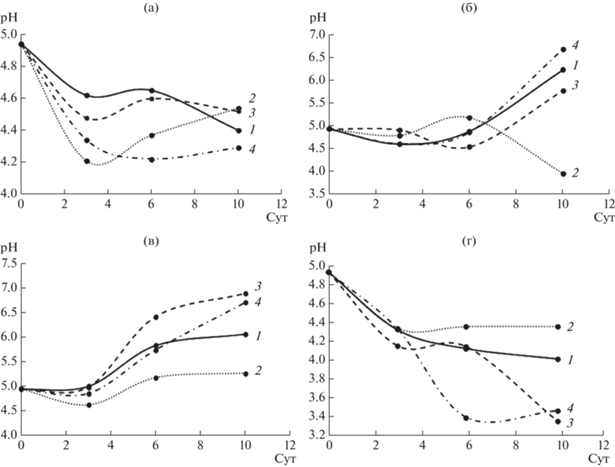
Закисление среды в процессе ферментативной деструкции ЭФК можно объяснить образованием продуктов гидролиза. Их присутствие тормозит деградацию ЭФК (эфиры гидролизуются в щелочной среде более интенсивно, чем в более кислой). Предыдущие исследования показали, что разложение ДЭФ и ДБФ зависит от значения pH. Так, скорость деградации ДЭГФ штаммом Pseudomonas sp. быстро увеличивалась, когда pH среды увеличивался до 8.5 [13], то же показано для ДБФ штаммом Agrobacterium sp. при увеличении рН с 5 до 8 [28].
Было показано, что T. hirsuta и A. praecox в динамике закисляли среду до 4.3–4.5 и 3.4–4.4 соответственно, что коррелировало с существенным падением у этих грибов ЭА к 10 сут культивирования. У S. ochraceum и C. laeve, напротив, наблюдалось защелачивание среды в ходе культивирования и соответствующее этому постепенное нарастание эстеразной активности. Однако, не смотря на различную динамику рН и ЭА, для всех 4 грибов на 10 сут степень деградации ДБФ и ДЭГФ составляла 86–99%. Вероятно, в процессах биодеструкции у разных грибов участвуют разные ферменты и механизмы. Так, например, при действии марганец пероксидаз, которые могут принимать участие в деградации ЭФК, отмечается образование свободных радикалов при низких рН, в то время как гидролитическое расщепление сложноэфирной связи между алкильными цепями и ароматическим кольцом ЭФК с образованием сложных моноэфиров, а затем и фталевой кислоты под действием эстераз эффективнее происходит в щелочных условиях.
Определение активности ферментов в КЖ грибов. Известно, что от метаболических особенностей штамма, субстрата и условий культивирования зависит уровень экспрессии ферментов. При выращивании гриба L. edodes авторы [20] показали увеличение активности внутри- и внеклеточных лакказ и эстераз на среде с ДЭГФ, причем активность лакказы была выше по сравнению с активностью эстеразы при всех концентрациях ДЭГФ. При этом, для других грибов, в частности P. ostreatus, выращенных в присутствии бутилбензилфталата, а также ДЭГФ, напротив, активность лакказы была ниже ЭА [24, 25]. Аналогичные результаты были получены для аскомицетов Fusarium culmorum и Trichoderma harzianum в присутствии ДЭГФ [16]. Таким образом, соотношение секретируемых ферментов может непосредственно влиять на эффективность деградации того или иного ЭФК. Поскольку ЭА и ОА играют важную роль в способности грибов к деструкции сложнодеградируемых соединений, была проведена их оценка при культивировании грибов на жидкой минеральной среде (рис. 7, 8 ).
Рис. 7.
Общая оксидазная активность КЖ грибов: 1 – контрольная среда, 2 – среда с ДЭФ, 3 – среда с ДБФ, 4 – среда с ДЭГФ; а – T. hirsuta, б – S. ochraceum, в – C. laeve, г – A. praecox.
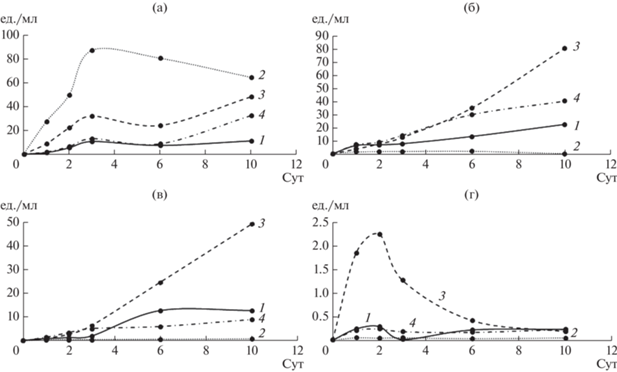
Показано, что у T. hirsuta максимальная ЭА достигалась в 1 сут в присутствии всех ЭФК, далее на 3 сут культивирования происходило увеличение ОА, особенно в присутствии ДЭФ. После 3 сут ОА T. hirsuta в присутствии ДБФ и ДЭГФ продолжала постепенно расти, а в среде с ДЭФ, наоборот, уменьшаться, что могло быть связано с токсичностью ДЭФ для гриба.
Для S. ochraceum пик ЭА достигался на 2–3 сут, при этом ОА возрастала плавно к 10 сут. Напротив, для C. leave и A. praecox пики ЭА и ОА совпадали и приходились на 10 и 2 сут соответственно. Наибольшая ЭА достигалась в присутствии ДБФ для грибов T. hirsuta, S. ochraceum и A. praecox, в то время как для C. leave – в присутствии ДЭГФ. При этом максимальные значения ЭА были получены для C. leave (0.16 усл. ед./мл) и A. praecox (0.09 усл. ед./мл) в присутствии ДЭГФ и ДБФ соответственно. Биосинтез ферментов может индуцироваться увеличением концентраций ЭФК в среде [18]. Показано, что присутствие ДБФ индуцирует ЭА у гриба Fusarium culmorum [27], что согласуется с результатами настоящей работы для всех грибов, кроме C. laeve. Однако для P. ostreatus также была показана индукция ЭА в присутствии ДЭГФ [25], что аналогично результату, полученному в настоящей работе для C. laeve.
В присутствии ДЭФ ОА уменьшалась у всех грибов, по сравнению с контролем, кроме T. hirsuta, в КЖ которого активность в присутствии ДЭФ наоборот, существенно увеличивалась. Это согласуется с данными по скорости роста T. hirsuta на среде с ДЭФ и с вышеописанными результатами по накоплению биомассы. Таким образом, гриб T. hirsuta – наиболее устойчив к присутствию ДЭФ по сравнению с остальными, вероятно, за счет более эффективного комплекса секретируемых оксидаз или других вспомогательных ферментов.
Рис. 8.
Общая эстеразная активность КЖ грибов: 1 – контрольная среда, 2 – среда с ДЭФ, 3 – среда с ДБФ, 4 – среда с ДЭГФ; а – T. hirsuta, б – S. ochraceum, в – C. laeve, г – A. praecox.
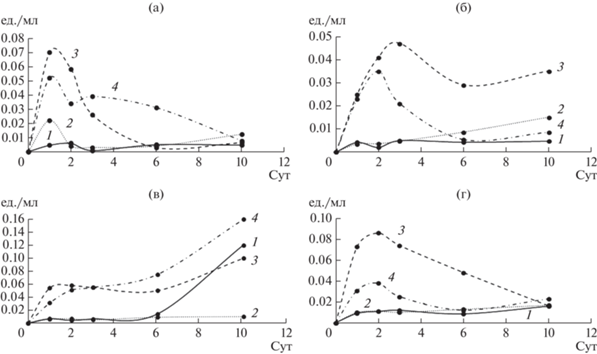
Известно, что на начальной стадии деградации ЭФК ключевыми ферментами являются эстеразы [29], осуществляющие гидролитическое расщепление сложноэфирной связи между алкильными цепями и ароматическим кольцом ЭФК с образованием сложных моноэфиров, а затем фталевой кислоты (ФК) и спиртов. Далее может происходить расщепление бензольного кольца ФК с образованием метаболитов, образующихся при разложении ФК и спиртов. Во вторую стадию могут быть вовлечены такие ферменты, как декарбоксилазы, оксигеназы и оксидазы/дегидрогеназы [26, 27, 30, 31].
Анализ продуктов деструкции ЭФК. Качественный анализ экстрактов КЖ штаммов грибов методом ТСХ показал, что скорость биоразложения ДЭФ у всех грибов была значительно ниже, по сравнению с другими ЭФК, что коррелирует со скоростью их роста на твердой агаризованной среде и накоплением биомассы на жидкой среде с ДЭФ. Существенного убывания ДЭФ во времени не было зафиксировано, продукты реакции не были визуализированы (результаты не представлены), вероятно по причине их крайне низкого содержания. Очевидно, что самым трудно деградируемым и токсичным для грибов белой гнили оказался ДЭФ, что подтверждается известными значениями токсичности использованных ЭФК: токсичность убывает в ряду ДЭФ > ДБФ > ДЭГФ [6]. Похожие результаты были получены в работе [15], в которой грибы белой гнили P. ostreatus и T. versicolor менее эффективно деградировали ДЭФ, по сравнению с диметилфталатом и бутилбензилфталатом. Результаты анализа экстрактов КЖ грибов с ДБФ и ДЭГФ методом ТСХ приведены на рис. 9 .
Рис. 9.
ТСХ экстрактов КЖ грибов T. hirsuta, S. ochraceum, C. leave и, A. praecox на 3, 6, и 10 сут культивирования на среде с ДБФ (а, б) и ДЭГФ (в, г): К- ДБФ коммерческий; а, в – визуализация в УФ-свете, б, г – проявление ванилином.

Показано, что у всех грибов в процессе культивирования с ДБФ и ДЭГФ менялось количественное соотношение продуктов реакции, а также их спектр. Поскольку, согласно результатам ТСХ, скорость деградации ЭФК убывала в порядке ДЭГФ > ДБФ > ДЭФ, и для ДЭФ скорость была очень низкая, а продукты не визуализировались, количественную оценку биодеструкции ЭФК с использованием метода ГХ-МС в дальнейшем проводили только для ДБФ и ДЭГФ. Результаты представлены в табл. 2.
Таблица 2.
Динамика биодеградации ДБФ и ДЭГ (1 г/л) грибами белой гнили
| Штамм | Деградация, % | |||||
|---|---|---|---|---|---|---|
| ДБФ | ДЭГФ | |||||
| 3 сут | 6 сут | 10 сут | 3 сут | 6 сут | 10 сут | |
| T. hirsuta 072 | 65.9 ± 2.0 | 78.3 ± 0.6 | 88.2 ± 1.2 | 39.2 ± 1.9 | 92.6 ± 0.2 | 99.2 ± 0.5 |
| S. ochraceum 3174 | 0.2 ± 0.05 | 57.7 ± 0.3 | 87.3 ± 0.2 | 45.0 ± 0.8 | 96.5 ± 0.4 | 99.7 ± 0.3 |
| C. laeve 1700 | 85.5 ± 1.5 | 94.9 ± 0.3 | 96.5 ± 0.5 | 52.3 ± 0.2 | 68.6 ± 2.0 | 88.7 ± 1.2 |
| A. praecox 6205 | 74.8 ± 0.8 | 85.5 ± 0.6 | 86.1 ± 1.0 | 12.6 ± 1.2 | 41.4 ± 0.5 | 99.0 ± 0.3 |
Полученные результаты показали высокую эффективность разложения ДЭФГ (более 98%) грибами T. hirsuta, S. ochraceum и A. praecox, а ДБФ (более 96%) – C. leave за 10 сут.
Несмотря на то, что в литературе описано снижение скорости биодеградации фталатов с увеличением длины алкильной цепи, а также зависимость от ее разветвленности [15, 19, 23, 32], в настоящей работе показано, что у гриба S. ochraceum скорость деградации ДЭГФ была существенно выше, чем ДБФ (табл. 2). Для остальных грибов скорость деградации ДБФ на 3 сут была выше, чем ДЭГФ, но все же к 10 сут для грибов T. hirsuta и A. praecox более высокая степень деградации была получена для ДЭГФ. Только результаты с C. leave согласовались c данными литературы. При этом увеличение концентрации ДБФ в среде в небольшой степени ингибировало рост C. leave (рис. 3в), в отличие от гриба P. ostreatus, рост которого не ингибировался повышением концентрации ДБФ в среде (до 1000 мг/л) [23].
Поскольку скорость биодеградации ДЭГФ была выше у дереворазрушающих сапротрофов, а ДБФ – у подстилочных сапротрофов (более 90% на 6 сут, табл. 2), по 1 представителю этих групп (T. hirsuta и C. leave) было выбрано с целью определения продуктов биодеградации ЭФК. Для накопления продуктов деградации ЭФК в количествах, необходимых для их идентификации, предварительно проводили разделение экстрактов методом препаративной ТСХ, после чего элюаты анализировали методом ГХ-МС. Для анализа в этом случае использовали экстракты КЖ C. leave на 3 сут для обоих субстратов, а T. hirsuta – на 3 сут с ДБФ и 6 сут с ДЭГФ (образцы, где продукты деградации ЭФК визуализировались методом ТСХ).
В результате ГХ-МС-анализа в контрольных образцах C. laeve (при отсутствии фталатов) был обнаружен более широкий спектр метаболитов (всего 24), по сравнению с контрольными образцами T. hirsuta (всего 13 и 19 на 3 и 6 сут соответственно), представленный в основном эфирами карбоновых кислот, а также спиртами и альдегидами (рис. 10 ).
Рис. 10.
Диаграмма Венна для метаболитов, обнаруженных в контрольных образцах КЖ C. leave и T. hirsuta методом ГХ-МС.
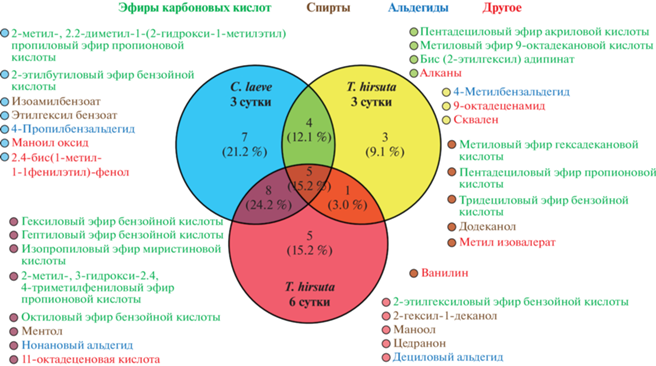
Следует отметить, что на 6 сут культивирования в КЖ T. hirsuta расширялся спектр синтезируемых грибом спиртов и эфиров бензойной кислоты. В присутствии фталатов образование большинства характерных для грибов метаболитов прекращалось: на 3 сут в образце КЖ C. laeve с ДБФ и ДЭГФ было обнаружено 7 и 11 соединений соответственно, а на 3 и 6 сут в образцах T. hirsuta с ДБФ и ДЭГФ – 5 и 3 соединения соответственно (табл. 3). Причем всего 3 соединения из контрольных образцов были идентифицированы в опытных образцах с фталатами, а именно: пентадециловый эфир акриловой кислоты, обнаруженный в контрольных образцах КЖ обоих грибов, идентифицирован в КЖ и C. laeve с ДЭГФ, и T. hirsuta с ДБФ и ДЭГФ; пентадециловый эфир пропионовой кислоты, найденный в контрольном образце T. hirsuta, также идентифицирован в КЖ T. hirsuta с ДБФ; 4-пропилбензальдегид, найденный в контрольном образце КЖ C. laeve – идентифицирован в КЖ C. laeve с обоими ЭФК. В присутствии ЭФК для C. laeve было характерно появление кетонов и отсутствующих в контрольных КЖ спиртов (табл. 3).
Таблица 3.
Метаболиты, идентифицированные в КЖ C. leave и T. hirsuta на средах с ЭФК методом ГХ-МС
| Метаболит | C. leave + + ДБФ (3 сут) |
C. leave + + ДЭГФ (3 сут) |
T. hirsuta +
+ ДБФ (3 сут) |
T. hirsuta + + ДЭГФ (6 сут) |
|---|---|---|---|---|
| Фталаты | ||||
Диэтилфталат (ДЭФ), C12H14O4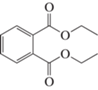 |
+ | + | + | + |
| Эфиры карбоновых кислот | ||||
| Тридецил акрилат, C16H30O2 | + | – | – | – |
| Спирты | ||||
| Гексадеканол, C16H33OH | – | + | – | – |
| Октадеканол, C18H38O | – | + | – | – |
| Кетоны | ||||
Бензил этил кетон, C10H12O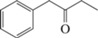 |
– | + | – | – |
1-Гидроксициклогексил фенил кетон, C13H16O2 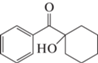 |
+ | + | – | – |
2-Гидрокси-изо-бутирофенон, C10H12O2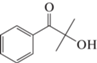 |
+ | + | – | – |
| Фенолы | ||||
2,4-Ди-трет-бутилфенол, C14H22O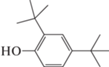 |
+ | – | – | – |
2,6-Дитретбутил-4-метилфенол (ионол), C15H24O 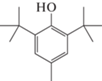 |
+ | – | + | + |
| Другие | ||||
| Сквален | – | + | – | – |
1-метокси-метилфлуорен, C15H14O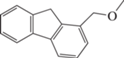 |
– | + | – | – |
| Неидентифицированное соединение с RT2126 | – | – | + | – |
В КЖ грибов T. hirsuta и C. leave обнаружен 2,6-дитретбутил-4-метилфенол (ионол), отсутствующий в контрольных образцах. Это соединение применяется в качестве антиоксиданта при производстве пищевых продуктов (пищевая добавка E321), а также является исходным соединением для синтеза различных пространственно затруднённых фенолов, многие из которых обладают биологической активностью [33]. Ионол часто встречается в качестве вторичного метаболита, продуцируемого различными группами организмов, в частности грибами, однако является аутотоксичным [34]. Имеющиеся на сегодняшний день данные не объясняют, почему организмы вырабатывает такой аутотоксичный метаболит. Вероятно, индукция биосинтеза ионола грибами является своеобразной защитной реакцией грибов от свободных радикалов, образующихся при ферментативном окислении в ходе деградации ЭФК. Однако, ввиду своей аутотоксичности, накопление этого соединения в ходе биотрансформации ДБФ может приводить к торможению роста гриба.
Кроме того, при культивировании грибов в присутствии ДБФ и ДЭГФ в КЖ грибов был обнаружен ДЭФ, из чего можно сделать вывод, что он являлся промежуточным продуктом биотрансформации этих ЭФК обоими грибами. В работе [23] при изучении пути деградации ДБФ дереворазрушающим грибом белой гнили P. ostreatus не было обнаружено ДЭФ в качестве промежуточного метаболита, однако при бактериальной трансформации этого фталата показана возможность его образования из ДБФ [32]. Вероятно, замедление роста грибных культур при выращивании на среде с ДБФ, может быть также связано с образованием в качестве промежуточного трудно деградируемого ДЭФ из-за его высокой токсичности, особенно в условиях высоких концентраций ЭФК.
В работе [35] в качестве основного метаболита при биодеструкции ДБФ бактериями Pseudomonas sp. и Comamonas sp. также был идентифицирован ДЭФ, который может быть получен путем реакции переэтерификации с участием липаз. Однако авторам, как и в настоящей работе, не удалось обнаружить такой основной метаболит деструкции ЭФК как фталевая кислота, предположительно, из-за короткого периода полураспада этого соединения.
Ранее показан возможный механизм деструкции ЭФК с помощью эстераз, приводящий к образованию 1,3-изо-бензофурандиона (ИБФ) при гидролизе сложного эфира с последующим спонтанным образованием оксомостика и дальнейшее превращение ИБФ в различные моноэфиры путем переэтерификации при наличии в среде спиртов [36]. Перечень возможных продуктов превращения ИБФ зависит от спектра синтезируемых грибами ферментов. Возможно, именно таким путем происходит образование ДЭФ при трансформации ДБФ и ДЭГФ. В КЖ гриба C. leave на 3 сут ЭА преобладала над ОА. Вероятно, идентифицированные в ней соединения, могут быть продуктами реакций переэтерификации моноэфиров, например 1-гидроксициклогексил фенил кетон. Поскольку одновременно с ЭА все же фиксируется и ОА, то параллельно могут проходить свободнорадикальные реакции с образованием целого спектра разнообразных соединений (подобно 2-гидрокси-изо-бутирофенону у C. leave), некоторые из которых трудно идентифицировать (вероятно, таким соединением может являться не идентифицированное соединение с RT2126, обнаруженное в КЖ T. hirsuta).
Таким образом, исследование показало, что грибы белой гнили являются перспективными биодеструкторами широко распространенных токсичных ЭФК, различающихся структурой и гидрофобностью. Полученные результаты подтвердили, что механизмы разрушения ЭФК различаются у грибов в зависимости от экофизиологической группы. Различия в путях деградации ЭФК грибами белой гнили могут быть связаны с секрецией уникальных ферментных комплексов, участвующих в процессах биодеструкции. Показано, что в процессе культивирования динамика ОА и ЭА T. hirsuta ближе к A. praecox, а S. ochraceum – к C. laeve. Очевидно, что присутствие ЭФК изменяло метаболический профиль гриба. Вероятно, вторичные ксилотрофы могут быть ближе по своему метаболизму к гумусовым и подстилочным грибам, в отличие от первичных ксилотрофов.
Полученные результаты могут быть использованы для дальнейших исследований, направленных на установление механизмов биоразложения ЭФК различными грибами, а также при отборе конкретных штаммов базидиальных грибов для использования с целью биоремедиации загрязненных фталатами сред.
Работа выполнена при финансовой поддержке Российского научного фонда, грант РНФ 21-14-00306.
Список литературы
Weaver J.A., Beverly B.E.J., Keshava N., Mudipalli A., Arzuaga X., Cai C. et al. // Environ. Int. J. 2020. V. 145. № 105848. https://doi.org/10.1016/j.envint.2020.105848
de Souza Machado A.A., Lau C.W., Kloas W., Bergmann J., Bachelier J.B., Faltin E., Becker R. et al. // Environ. Sci. Technol. 2019. V. 53. P. 6044–6052. https://doi.org/10.1021/acs.est.9b01339
Iqbal S., Xu J., Allen S.D., Khan S., Nadir S., Arif M.S., Yasmeen T. // Chemosphere. 2020. V. 260. № 127578. https://doi.org/10.1016/j.chemosphere.2020.127578
Wormuth M., Scheringer M., Vollenweider M., Hungerbuhler K. // Risk Analysis. 2006. V. 26. № 3. P. 803–324. https://doi.org/10.1111/j.1539-6924.2006.00770.x
Clark K.E., David R.M., Guinn R., Kramarz K.W., Lampi M.A., Staples C.A. // Hum. Ecol. Risk Assess. (HERA). 2011. V.17. P. 923–965. https://doi.org/10.1080/10807039.2011.588157
Шкаева И.Е., Солнцева С.А., Никулина О.С., Николаев А.И., Дулов С.А., Земляной А.В. // Toxicol. Rev. 2019. V. 159. № 6. P. 3–9.
Toft G., Jönsson B.A.G., Lindh C.H., Jensen T.K., Hjollund N.H., Vested A., Bonde J.P. // Environ Health Perspect. 2012. V. 120. № 3: 458–463. https://doi.org/10.1289/ehp.1103552
Kinnear E.J.C., Miller K.Y., Tong A.Z. // Food Additives & Contaminants: Part A. 2021. P. 1–12. https://doi.org/10.1080/19440049.2021.1940307
Edwards L., McCray N.L., VanNoy B.N., Yau A., Geller R.J., Adamkiewicz G., Zota A.R. // J. Expo. Sci. Environ. Epidemiol. 2021. https://doi.org/10.1038/s41370-021-00392-8
Ястребова О.В., Пьянкова А.А., Плотникова Е.Г. // Прикл. биохимия и микробиология. 2019. Т. 55. № 4. С. 378–385. https://doi.org/10.1134/S0555109919040159
Jin D., Baia Z., Chang D., Hoefelc D., Jin B., Wang P., Wei D., Zhuang G. //J. Hazard. Mater. 2012. V. 221–222. P. 80–85. https://doi.org/10.1016/j.jhazmat.2012.04.010
He Z., Niu C., Lu Z. // J. Hazard. Mater. 2014. V. 273. P. 104–109. https://doi.org/10.1016/j.jhazmat.2014.03.033
Tao Y., Li H., Gu J., Shi H., Han S., Jiao Y., et al. // Ecotoxicol. Environ. Saf. 2019. V. 173. P. 411–418. https://doi.org/10.1016/j.ecoenv.2019.02.055
Feng N., Feng Y., Liang Q., Chen X., Xiang L., Zhao H. et al. // Sci Total Environ. 2021. № 761:143208. https://doi.org/10.1016/j.scitotenv.2020.143208
Hwang S., Choi H.T., Song H. // J. Microbiol. Biotechnol. 2008. V. 18. № 4. P. 767–772
Aguilar-Alvarado Y., del Rosario Baez-Sanchez M., Martinez-Carrera D. C., Ahuactzin-Perez M., Cuamatzi-Mucoz M., Sanchez C. // Pol. J. Environ. Stud. 2015. V. 24. № 5. P. 1897–1902. https://doi.org/10.15244/pjoes/58808
Jegede D.O., Adewuyi G.O., Gbadamosi M.R., Oladoye P.O., Ogunneye A.L., Oyewola O.J. // Nigerian J. Chemical Research. 2019. V. 24. № 2. P. 77–89.
González-Márquez A., Ahuactzin-Pérez M., Sánchez C. // Bioresources. 2015. V. 10. № 4. https://doi.org/10.15376/biores.10.4.7898-7906
Chen Y., Zhang W., Chen J., Wang N., Chen C., Wang Y. et al. // J. Diabetes Res. 2021. Article ID 4027380. https://doi.org/10.1155/2021/4027380
Su’arez-Segundo J.L., Vazquez-Lopez D., Torres-Gar-cia J.L., Ahuactzin-Perez M., Montiel-Martinez N., Tlecuitl-Beristain S., Sanchez C. // Revista Mexicana de Ingenier’ıa Qu’ımica. 2013. V. 12. № 3. P. 499–504.
Savinova O.S., Moiseenko K.V., Vavilova E.A., Tyazhelova T.V., Vasina D.V. // Biochimie. 2017. V. 142. P. 183–190.
Moiseenko K.V., Glazunova O.A., Shakhova N.V., Savinova O.S., Vasina D.V., Tyazhelova T.V. et al. // Microorganisms. 2019. V. 7. P. 527. https://doi.org/10.3390/microorganisms7110527
Ahuactzin-Perez M., Tlecuitl-Beristain S., García-Davila J., Santacruz-Juarez E., Gonzalez-Perez M., Concepcion Gutierrez-Ruíz M., Sanchez C. // Fungal Biol. 2018. P. 1–7. https://doi.org/10.1016/j.funbio.2018.07.001
Hwang S., Kim H., Ka J., Song H. // J. Microbiol. Biotechnol. 2012. V. 22. № 2. P. 239–243. https://doi.org/10.4014/jmb.1107.07050
Cordoba-Sosa G., Gonzalez-Marquez A., Luis Torres J., Achuactzin-Perez M., Diaz-Godienez G., Diaz R., Sanchez C. // Proceedings of the 8th International Conference on Mushroom Biology and Mushroom Products (ICMBMP8). Ed. II. New Delhi: ICAR-DMR, SOLAN HP& WSMBMP, 2014. P. 231–237.
Gao D., Wen Z. // Sci. Total Environ. 2016. V. 541. P. 986–1001.
Ahuactzin-Perez M., Tlecuitl-Beristain S., García-Davila J., Santacruz-Juarez E., Gonzalez-Perez M., Concepcion Gutierrez-Ruíz M., Sanchez C. // 3 Biotech. 2018. V. 8. № 42. P. 1–10. https://doi.org/10.1007/s13205-017-1065-2
Wu X., Wang Y., Liang R., Dai Q., Jin D., Chao W. // Process Biochemistry. 2011. V. 46. P. 1090–1094. https://doi.org/10.1016/j.procbio.2011.01.031
Chang B., Yang C., Yang C. // Microorganisms. 2021. V. 9. P. 1989. https://doi.org/10.3390/microorganisms9091989
Tang Y., Zhang Y., Jiang L., Yang C., Rittmann B.E. // Biodegradation. 2017. https://doi.org/10.1007/s10532-017-9805-x
Ahmadi E., Yousefzadeh S., Ansari M., Reza Ghaffari H., Azari A., Miri M., et al. // Sci. Rep. 2017. 7:41020. https://doi.org/10.1038/srep41020
Liang D., Zhang T., Fang H.H.P., He J. // Appl. Microbiol. Biotechnol. 2008. V. 80. P. 183–198. https://doi.org/10.1007/s00253-008-1548-5
Zarudii F.S., Gil’mutdinov G.Z., Zarudii R.F., Myshkin M.A., Gershanov F.B., Novikov T.A. // Pharm. Chem. J. 2001. V. 35. P. 162–168. https://doi.org/10.1023/A:1010414130628
Zhao F., Wang P., Lucardi R.D., Su Z., Li S. // Toxins. 2020. V. 12. P. 35. https://doi.org/10.3390/toxins12010035
Kumar V., Sharma N., Maitra S.S. // Biotechnol Rep (Amst). 2017. P. 1–10. https://doi.org/10.1016/j.btre.2017.04.002
Chatterjee S., Karlovsky P. // Appl. Microbiol. Biotechnol. 2010. V. 87. P. 61–73. https://doi.org/10.1007/s00253-010-2570-y
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология