Прикладная биохимия и микробиология, 2022, T. 58, № 5, стр. 513-519
Фаговые антитела как биорецепторы для определения ампициллина
О. И. Гулий 1, *, А. К. М. Алсовэйди 2, А. С. Фомин 1, К. П. Габалов 1, С. А. Староверов 1, 3, О. А. Караваева 1
1 Институт биохимии и физиологии растений и микроорганизмов, ФИЦ
“Саратовский научный центр РАН” (ИБФРМ РАН)
410049 Саратов, Россия
2 Саратовский национальный исследовательский государственный университет
им. Н.Г. Чернышевского
410005 Саратов, Россия
3 Саратовский государственный аграрный университет им. Н.И. Вавилова
410012 Саратов, Россия
* E-mail: guliy_olga@mail.ru
Поступила в редакцию 27.02.2022
После доработки 15.04.2022
Принята к публикации 26.04.2022
- EDN: JVLFCS
- DOI: 10.31857/S0555109922050087
Аннотация
С применением овечьей дисплейной библиотеки фрагментов scFv (Griffin.1, UK) получены антитела, специфичные к ампициллину. Методом дот-иммуноанализа при биоспецифичном взаимодействии отобранных рекомбинантных антител в фаговом формате (фаговых антител) проведено определение ампициллина в водных растворах. Установлено, что фаговые антитела обладали специфичностью в отношении ампициллина и не взаимодействовали с другими антибиотиками тетрациклином и канамицином, а также с близкими по химической формуле веществами – L-фенилаланином, L-триптофаном и L-цистеином. Показано, что метод твердофазного иммуноанализа с визуальным учетом результатов, позволял определять минимальную концентрацию ампициллина в воде 1 мкг/мл. Фаговые антитела перспективны для использования в качестве чувствительного (распознающего) элемента сенсорных систем при определении ампициллина.
Антибактериальные препараты являются одной из наиболее широко используемых групп лекарственных средств на фармацевтическом рынке. Антибиотики используются в медицине, ветеринарии, пищевой промышленности при консервировании и транспортировке, а также для усиления роста животных при добавлении их в корм в субтерапевтических концентрациях [1]. В связи с этим актуальным является проблема контроля содержания антибиотиков в лекарственных формах, а также их определение в питьевой воде, сточных водах фармацевтических предприятий и других объектах [2].
Одной из важных составляющих при разработке диагностических аналитических систем анализа антибактериальных препаратов является подбор антибактериального биорецептора. В качестве биоселективного агента (элемента распознавания) преимущественно используют антитела, специфичные к определяемому антигену и современная иммунохимия предлагает широкий ассортимент качественных и количественных методов анализа антигена, различающихся по чувствительности и степени сложности [3]. Существует несколько технологий получения антител, но наиболее простым и доступным является метод отбора антител путем иммунизации животных изолированными препаратами антигена. Более сложным и, вместе с тем, позволяющим получить более надежные антитела методом (однажды полученные и охарактеризованные гибридомы представляют собой неограниченный источник моноклональных антител) является гибридомная технология [4]. Однако гибридомы, подобно большинству других клеточных культур животных, растут относительно медленно, не достигают высокой плотности и требуют сложных и дорогих сред, что создает определенные сложности для их применения в качестве аналитических реагентов. Для решения подобных задач в молекулярной биологии стали использоваться генно-инженерные технологии клонирования узнающих фрагментов – гипервариабельных участков иммуноглобулинов (фаговых антител), которые являются дешевыми и могут конкурировать по селективности с гибридомными технологиям. К такому методу относится технология фагового дисплея, в основе которой лежит экспонирование чужеродных пептидов или белков на поверхности фаговых частиц в составе одного из химерных белков оболочки. Данная технология была разработана Дж. Смитом [5], который доказал возможность экспрессии чужеродного белка на поверхности нитчатого бактериофага М13, осуществив встройку гена, кодирующего фрагмент эндонуклеазы рестрикции EcoRI, в единую рамку трансляции с минорным белком оболочки pIII нитчатого бактериофага [5, 6]. Данный метод не требует использования животных, длительных процедур иммунизации, дорогих сред и культур животных клеток.
Фаговые рекомбинантные антитела успешно зарекомендовали себя в качестве биорецепторов [7, 8]. Не менее востребованной окажется технология фагового дисплея для получения рекомбинантных антител, специфичных к низкомолекулярным антигенам, в том числе, антибиотикам. В частности, с применением этой технологии были получены и апробированы в различных методах иммуноанализа фаговые антитела к ивермектину [9], диминазину [10] ферритину [11] и силимарину [12]. В известной авторам литературе отсутствует информация о получении фаговых антител, специфичных к β-лактамным антибиотикам. На практике при выборе антибиотиков руководствуются принципом принадлежности антибактериального препарата к определенной группе, поэтому в качестве антигена использовали ампициллин (как представитель β-лактамных антибиотиков). β-лактамные антибиотики занимают 2 место по объему продаж среди всех антибиотиков в соответствии с данными на 2020 г. [1].
Цель работы – отработка технологии фагового дисплея для получения антител, специфичных к ампициллину, и демонстрация возможности их применения в качестве биорецептора методом дот-иммуноанализа.
МЕТОДИКА
Бактериальная культура и питательные среды. В работе были использованы бактерии Escherichia coli XL-1 Blue (IBPPM 632), полученные из коллекции ризосферных микроорганизмов ИБФРМ РАН (Россия) (http://collection.ibppm.ru). Культуру выращивали на среде 2хTY, следующего состава (г/100 мл воды): NaCl – 0.5; триптон (“Becton, Dickinson and Co.”, Франция) – 1.6; дрожжевой экстракт – 1.0, при 37°С и 160 об./мин.
В работе использовали следующие антибиотики: ампициллин, канамицин, тетрациклин (“Sigma”, США), и аминокислоты: L-фенилаланин, L-триптофан (“Fluka”, Швейцария), а также L-цистеин (“Merck”, Германия).
Аффинная селекция миниантител из фаговой библиотеки. В работе использовали хелперный бактериофаг М13К07 (“Stratagene”, Швеция), несущий ген устойчивости к канамицину.
Синтез белковых конъюгатов ампициллина проводили по методике, описанной в работе [13], ампициллин и 1-этил-3-(3-диметиламинопропил)-карбодиимид (по 83 мкмоль каждого) добавляли к 2 мл аликвот дистиллированной воды, содержащих растворенный белок (0.83 мкмоль бычьего сывороточного альбумина (БСА). Реакционную смесь инкубировали при комнатной температуре при непрерывном перемешивании в течение 2 ч, затем инкубировали при 4°С в течение 14 ч, рН поддерживали на уровне 5.0. Полученные конъюгаты диализовали против дистиллированной воды и лиофилизировали.
Для селекции фагов, несущих антитела к конъюгатам ампициллина с БСА, в качестве твердой фазы для закрепления антигена использовали планшет для иммуноферментного анализа (ИФА).
В лунку вносили 200 мкл антигена и инкубировали в течение ночи при 4°С, затем блокировали незанятое антигеном пространство на стенках планшета 2%-ным раствором сухого обезжиренного молока в течение 1 ч, после чего вносили 200 мкл рекомбинаторной фаговой библиотеки (с концентрацией 1012 фагмид/мл), как описано в работе [14] и затем инкубировали в течение ночи при 4°С. Элюцию фаговых частиц проводили триэтиламином. Элюированные фаговые частицы использовали для инфицирования клеток E. coli штамма XL-1. Методика получения фаговых антител подробно описана в работах [15]. Фаговые частицы осаждали центрифугированием 10 мин при 8000 g, осадок ресуспендировали в 1/10 от исходного объема культуры буфера ТЕ pH 7.5 (5 мл). Полученный препарат осветляли центрифугированием в тех же условиях, после чего фаговые частицы снова осаждали добавлением 1/5 объема раствора ПЭГ6000/NaCl (1.0 мл) с последующим центрифугированием. Осадок растворяли в 1 мл буферного раствора ТЕ.
Концентрацию фаговых частиц определяли спектрофотометрически, как описано в работе [16], используя для расчетов следующее соотношение: A269 – А320 ~ 2 × 1014 фаговых частиц/мл, где А320 – оптическая плотность суспензии фагов при длине волны электромагнитного излучения 320 нм, А269 – оптическая плотность суспензии при длине волны 269 нм. Измерения проводили на спектрофотометре UV-VIS Specord BS 250 (“Analytik Jena”, Германия) в Центре коллективного пользования научным оборудованием в области физико-химической биологии и нанобиотехнологии “Симбиоз” ИБФРМ РАН.
Полученный препарат фаговых частиц использовали для проведения последующих раундов селекции, осуществляемых в аналогичных условиях. Специфичность полученных препаратов фаговых антител определяли методом дот-иммуноанализа. Титр сыворотки определяли с помощью ИФА по общепринятой методике [17]. Титр фаговых антител составил 1 : 1200.
Приготовление наночастиц золота. Наночастицы золота (НЗ) со средним диаметром частиц (15 нм) получали, используя реакцию восстановления золотохлористоводородной кислоты (“Aldrich”, США) цитратом натрия (“Fluka”, Швейцария) по методу, описанному в работе [18]. Подготовленные наночастицы контролировали по фотометрической калибровке, а также с помощью трансмиссионной электронной микроскопии и регистрации динамического рассеяния света, как описано в работе [19] в Центре коллективного пользования научным оборудованием в области физико-химической биологии и нанобиотехнологии “Симбиоз” ИБФРМ РАН.
Фотометрическую оценку НЗ проводили на спектрофотометре UV-vis Specord BS 250 при длине волны 520 нм (A520).
Трансмиссионную электронную микроскопию осуществляли с помощью электронного микроскопа Libra 120 (“Carl Zeiss AG, Oberkochen”, Германия).
Динамическое рассеяние света исследовали на приборе Malvern Zetasizer Nano Nanoparticle Characterization System (“Malvern Instruments”, Великобритания) с He-Ne лазером (длина волны 633 нм, мощность 4 мВт). Измерения проводили под фиксированным углом 173° при 25°С. Значения гидродинамического радиуса, полученные при регистрации динамического рассеяния света, составили 15.2 ± 1.4 нм для нативных золотых частиц.
Процедуру получения конъюгатов наночастиц золота с фаговыми антителами проводили согласно методике [20].
Дот-иммуноанализ. Для дот-иммуноанализа использовали мембрану “Western S” (“Sigma-Aldrich”, США), которую предварительно погружали в раствор метанола на 30 с. Ампициллин в концентрациях 1.0, 4.0, 6.0, 12, 25, 50 и 100 мкг/мл наносили на мембрану “Western S”, а затем проводили блокировку мембраны с нанесенным на нее антигеном в течение 1 ч 2%-ным сухим молоком, разведенным в фосфатном буферном растворе (рН 7.0). Мембрану погружали в раствор специфических фагмид, разведенных до концентрации 1 × 1013 фагмид/мл 10 мМ фосфатного буфера, и проводили инкубацию в течение ночи при 4°С. Затем мембрану отмывали от неспецифически связавшихся фаговых антител в фосфатном буферном растворе и погружали в конъюгат коллоидного золота (КЗ) с кроличьими антифаговыми антителами (А520 = 0.5), при 25°С на ночь.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работе проводили отработку технологии получения фаговых антител, специфичных в отношении ампициллина. В 1999 г. в ИБФРМ РАН в ходе выполнения совместного научного проекта с Университетом г. Абердина (Великобритания) был передан фаговый дисплей антител овцы, протоколы и методические рекомендации по применению данной технологии [14]. Основой метода является создание комбинаторной библиотеки, в которой вариабельные участки легких и тяжелых цепей иммуноглобулинов соединены случайным образом и представлены на поверхности нитевидного бактериофага (М13К07). Каждый бактериофаг экспрессирует антитела единственной специфичности. Фаги, несущие антигенсвязывающие фрагменты антител (scFv, Fab) нужной специфичности, могут быть отобраны на иммобилизованном антигене.
Для получения фаговых антител, специфичных к ампициллину, оптимальным носителем выбрана мембрана “Western S”. Установлено, что количество антигена, используемого для иммобилизации, должно быть не менее ×1012 бактериофагов/мл. Подобран элюент – 100 мМ раствор триэтиламина, для его нейтрализации выбран 1.0 М Трис-НСl, рН 7.4. Для повышения чувствительности фаговых антител рекомендовано проводить не менее 4 раундов селекции. Контроль специфичности антител рекомендовано проводить методом дот-иммуноанализа, титр антител определять методом ИФА. Измерение проводили на микропланшетном спектрофотометре АИФ-Ц-01С (ЗАО “Илип”, РФ) при длине волны 490 нм. Титр полученных фаговых антител составил 1 : 1200.
С использованием отработанной методики было проведено 4 раунда селекции фаговых антител к ампициллину. Для увеличения их специфичности с каждым раундом вдвое уменьшалась концентрации антигена, как описано в [21]. Начальная концентрация антигена составляла 100 мг/мл. Концентрация фаговых частиц, определенная спектрофотометрическим методом с использованием формулы: A269 – А320, составила ~1.2 × 1013 вирионов/мл.
Специфичность фаговых антител определяли методом дот-иммуноанализа. Метод дот-иммуноанализа является, в основном, качественным или полуколичественным методом, тем не менее, его использование может оказывать большую помощь при предварительном тестировании. Суть метода заключается в визуализации специфического взаимодействия адсорбированного на мембране антигена и меченых (коллоидными или молекулярными метками) антител. В работе использовали стратегию вторичного мечения, аналогично, как описано [11], то есть сначала проводили биоспецифическую реакцию ампициллин/фаговые антитела, а затем визуализировали ее с помощью меченых наночастицами поликлональных кроличьих антифаговых антител. Были проведены с первого по четвертый раунды селекции фаговых антител, специфичных к ампициллину. Только после четвертого раунда селекции методом дот-иммуноанализа показано, что фаговые антитела обладали специфичностью к ампициллину (рис. 1б). После первого раунда селекции такой четкой картины не наблюдалось (рис. 1а), также, как и после второго и третьего раунда. Поэтому сделан вывод, что для повышения чувствительности фаговых антител рекомендуется проводить не менее 4 раундов селекции. Необходимо было определить минимальную концентрацию антигена, детектируемую визуально с помощью фаговых антител методом дот-иммуноанализа. Для этого использовали фаговые антитела, специфичные к ампициллину, полученные после 4 раунда селекции, и ампициллин в концентрациях 1.0, 4.0, 6.0, 12, 25, 50 и 100 мкг/мл. В качестве метки использовали 15 нм конъюгаты коллоидного золота с кроличьими антифаговыми антителами (200 мкл конъюгата на 1 мл фосфатного буферного раствора при визуальном контроле (около 20 мин).
Рис. 1.
Дот-иммуноанализ фаговых антител, специфичных к ампициллину, полученных с использованием фаговой библиотеки после (а) первого раунда и (б) обогащенной библиотеки после 4 раунда селекции: 1 – 100; 2 – 50; 3 – 25; 4 – 12; 5 – 6.0; 6 – 4.0; 7 – 1.0 мкг/мл ампициллина.

Из данных, представленных на рис. 2 видно, что конъюгат связывался с комплексом антиген-антитело, что можно было визуально наблюдать в виде серии розовых пятен. Следовательно, полученные в работе фаговые антитела способны детектировать ампициллин с помощью метода дот-иммуноанализа при минимальной определяемой концентрации 1 мкг/мл (различимое связывание метки, отличное от фонового уровня).
Рис. 2.
Дот-иммуноанализ фаговых антител, специфичных к ампициллину, полученных с использованием овечьей фаговой библиотеки (Griffin.1, Англия) после 4 раунда селекции, при детекции ампициллина в концентрации: 1 – 1.0; 2 – 4.0; 3 – 6.0; 4 – 12; 5 – 25; 6 – 50; 7 – 100 мкг/мл.

На следующем этапе проводили анализ специфичности взаимодействия полученных фаговых антител в отношении представителей других групп антибиотиков. Для этого использовали антибактериальные препараты, которые, в соответствии с данными 2020 г., активно используются во всем мире [1]: тетрациклин (занимает 1 место по объему продаж) и канамицин (как представитель аминогликозидных антибиотиков, объем продаж которого составляет 6.2% от общего объема продаж всех антибактериальных препаратов).
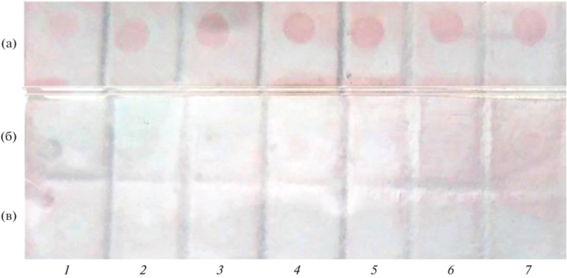
Условия проведения анализа для всех антибиотиков были аналогичны тем, как и при использовании ампициллина. Установлено, что конъюгат связывался с комплексом ампициллин (антиген) – специфичные фаговые антитела, что можно визуально наблюдать в виде серии розовых пятен (рис. 3). Из представленных данных видно, что фаговые антитела, специфичны только к ампициллину и не взаимодействуют с тетрациклином и канамицином.
Рис. 3.
Определение специфичности фаговых антител в отношении ампициллина (а), тетрациклина (б, мкг/мл), канамицина (в) методом дот-иммуноанализа при их концентрации: 1 – 1.0; 2 – 4.0; 3 – 6.0; 4 – 12; 5 – 25; 6 – 50; 7 – 100 мкг/мл.
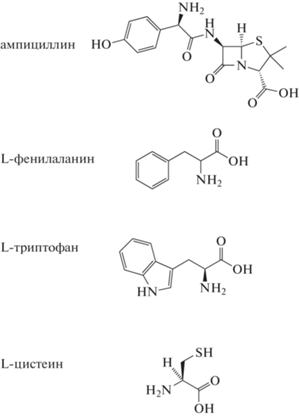
При разработке биорецептора для определения антигена одним из важных моментов является анализ возможности неспецифичного взаимодействия с другими аналитами, близкими по химическому строению. Поскольку химическая формула ампициллина, L-фенилаланина и L-триптофана содержат ароматическое кольцо и группу NH2 (рис. 4), были проведены контрольные исследования по исключению возможности неспецифичного взаимодействия полученных фаговых антител с L-фенилаланином и L-триптофаном. Дополнительно проводили исследования, исключающие неспецифичное взаимодействие фаговых антител в отношении L-цистеина, который также в своем составе содержит группу NH2 (рис. 4).
Из результатов, представленных на рис. 5, видно, что фаговые антитела, специфичные в отношении ампициллина, не взаимодействуют L-фенилаланином, L-триптофаном и L-цистеином.
Рис. 5.
Анализ взаимодействия фаговых антител, специфичных в отношении ампициллина, с L-фенилаланином (б), L-триптофаном (а) и L-цистеином (в) методом дот-иммуноанализа при их концентрации: 1 – 1.0; 2 – 4.0; 3 – 6.0; 4 – 12; 5 – 25; 6 – 50; 7 – 100; 8 – 1000 мкг/мл; 9 – с ампициллином (100 мкг/мл): контроль.

Как показало исследование, технология фагового дисплея является перспективным инструментом для получения антител, специфичных к ампициллину. Полученные фаговые антитела обладают достаточно высокой специфичностью по отношению к ампициллину и не взаимодействуют с другими антибиотиками: тетрациклином и канамицином, а также аминокислотами: L-фенилаланином, L-триптофаном и L-цистеином. Рекомендовано проводить не менее 4 раундов биопэннинга для получения фаговых антител, специфичных к ампициллину. Фаговые антитела, специфичные к ампициллину, в дальнейшем могут быть использованы для детекции ампициллина в водных растворах методом дот-иммуноанализа, при этом нижний предел детекции составлял 1 мкг/мл. На данном этапе показана возможность получения фаговых антител, специфичных к ампициллину, и продемонстрирована принципиальная возможность их применения для иммунодетекции ампициллина. В дальнейшем такие фаговые антитела могут быть использованы в качестве чувствительного (распознающего) элемента сенсорных систем при определении ампициллина в водных растворах.
Исследование выполнено при финансовой поддержке гранта Российского научного фонда № 22-24-00417, https://rscf.ru/project/22-24-00417/.
Список литературы
European Medicines Agency, European Surveillance of Veterinary Antimicrobial Consumption, 2021. ‘Sales of Veterinary Antimicrobial Agents in 31 European Countries in 2019 and 2020’. (EMA/58183/2021).
Ierapetritou M., Muzzio F., Reklaitis G. // AIChE J. 2016. V. 62. P. 1846–1862. https://doi.org/10.1002/aic.15210
Sharma S., Byrne H., O’Kennedy R.J. // Essays Biochem. 2016. V. 60. № 1. P. 9–18. https://doi.org/10.1042/EBC20150002
Kohler G., Milstein C. // Nature. 1975. V. 256. P. 495–497.
Smith G.P., Petrenko V.A. // Chem. Rev. 1997. V. 97. P. 391–41. https://doi.org/10.1021/cr960065d
McCafferty J., Griffiths A.D., Winter G., Chiswell D.J. // Nature. 1990. V. 348. P. 552–554. https://doi.org/10.1038/348552a0
Ye J., Guo J., Li T., Tian J., Yu M., Wang X., Majeed U., Song W., Xiao J., Luo Y., Yue T. // Compr Rev Food Sci Food Saf. 2022. V. 21. № 2. P. 1843–1867. https://doi.org/10.1111/1541-4337.12908
Zhao F., Shi R., Liu R., Tian Y., Yang Z. // Food Chemistry. 2021. V. 339. 128084. https://doi.org/10.1016/j.foodchem.2020.128084
Пристенский Д.В., Староверов С.А., Ермилов Д.Н., Щеголев С.Ю., Дыкман Л.А. // Биомедицинская химия. 2007. Т. 53. № 1. С. 57–64. Pristensky D.V., Staroverov S.A., Ermilov D.N., Shchyogolev S.Y., Dykman L.A. // Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry. 2007. V. 1. № 3. P. 249–253.
Staroverov S.A., Sidorkin V.A., Fomin A.S., Shchyogolev S.Y., Dykman L.A. // J. Vet. Sci. 2011. V. 12. № 4. P. 303–307.
Staroverov S.A., Volkov A.A., Fomin A.S., Laskavuy V.N., Mezhennyy P.V., Kozlov S.V., Larionov S.V., Fedorov M.V., Dykman L.A., Guliy O.I. // J Immunoassay Immunochem. 2015. V. 36. № 1. P. 100–110.
Staroverov S.A., Kozlov S.V., Fomin A.S., Gabalov K.P., Khanadeev V.A., Soldatov D.A., Domnitsky I.Y., Dykman L.A., Akchurin S.V., Guliy O.I. // ADMET & DMPK. 2021. V. 9. № 4. P. 255–266.
Самсонова Ж.В., Щелокова О.С., Иванова Н.Л., Рубцова М.Ю., Егоров А.М. // Прикл. биохимия и микробиология. 2005. Т. 41. № 6. С. 668–675. doi 10.1007/s10438-005-0107-4. Samsonova Z.V., Shchelokova O.S., Ivanova N.L., Rubtsova M.Y., Egorov A.M. // Appl. Biochem. Microbiol. 2005. V. 41. P. 589–595.
Charlton K.A., Moyle S., Porter A.J., Harris W.J. // The J. Immunology. 2000. V. 164. P. 6221–6229. https://doi.org/10.1016/S0956-5663(01)00192-0
Guliy O.I., Velichko N.S., Fedonenko Yu.P., Bunin V.D. // Talanta. 2019. V. 202. P. 362–368. https://doi.org/10.1016/j.talanta.2019.04.086
Smith G.P., Scott J.K. // Methods in Enzymology. 1993. V. 217. P. 228–257. https://doi.org/10.1016/0076-6879(93)17065-D
Beatty J.D., Beatty B.G., Vlahos W.G. // J. Immunological Methods. 1987. V. 100. P. 173–179. https://doi.org/10.1016/0022-1759(87)90187-6
Frens G. // Nature Phys. Sci. 1973. V. 241. P. 20–22.
Guliy O.I., Zaitsev B.D., Burygin G.L., Karavaeva O.A., Fomin A.S., Staroverov S.A., Borodina I.A. // Ultrasound in Medicine & Biology. 2020. V. 46. №. 7. P. 1727–1737. https://doi.org/10.1016/j.ultrasmedbio.2020.03.014
De Mey J., Moeremans M. In: Koehler J.K., (Ed.), Advanced Techniques in Biological Electron Microscopy III. Berlin: Springer-Verlag, 1986.
Griep R.A., Twisk van C., Beckhoven van J.R., Wolf van der J.M., Schots A. // Phytopathology. 1998. V. 88. P. 795–803. https://doi.org/10.1094/PHYTO.1998.88.8.795
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология