Прикладная биохимия и микробиология, 2022, T. 58, № 5, стр. 520-534
Лактобациллы: правовое регулирование и перспективы создания препаратов нового поколения
Р. А. Юнес 1, *, Е. У. Полуэктова 1, Т. В. Белкина 1, В. Н. Даниленко 1
1 Институт общей генетики им. Н.И. Вавилова РАН
Москва, Россия
* E-mail: romanyunes@gmail.com
Поступила в редакцию 15.11.2021
После доработки 20.04.2022
Принята к публикации 26.04.2022
- EDN: LWZGVX
- DOI: 10.31857/S0555109922050178
Аннотация
Индустрия пробиотиков в мире в последние годы претерпевает серьезные изменения. Меняются подходы поиска и создания пробиотиков, а также парадигмы использования в пищевой промышленности, медицине и фармацевтике. Катализатором послужила нарастающая популярность и доступность омиксных технологий, в частности метагеномных исследований микробиома человека и животных. Однако эффективность, безопасность и быстрота внедрения лекарственных препаратов на основе пробиотических штаммов в значительной степени зависят от уровня правового и технического регулирования в данной области. В обзоре обсуждаются правовые аспекты регулирования в России, Евросоюзе и США и преимущества и недостатки пробиотиков и постбиотиков. Сегодня формируется консенсус, что постбиотики имеют ряд преимуществ по сравнению с классическими живыми пробиотическими культурами. Также в обзоре уделяется внимание семейству лактобацилл, включающему самое большое количество изученных пробиотических штаммов, и по-прежнему занимающему среди пробиотиков лидирующее положение. В законодательном плане Россия нередко выдвигает опережающие предложения, это касается принятия федерального закона № 492-ФЗ о биологической безопасности, давшего определение понятию микробиоты человека и животных и сформулировавшего законодательные указания по ее сохранению. Новое направление “нутригеномика микробиома” направлено на решение этой задачи.
Бактерии, относящиеся к пробиотическим, издавна используются людьми как компоненты пищи, а с начала 20 в. – и как аналоги лекарственных средств. Их принципиальное отличие от собственно лекарств в том, что они оказывают благоприятный эффект на макроорганизм в целом, однако механизм и мишени их действия не известны. Пробиотики предназначены в основном для здоровых людей и используются как профилактическое средство. В последние годы интерес к пробиотикам постоянно растет, расширяется круг используемых микроорганизмов [1–5].
Омиксные технологии сделали возможным изучение как микробиоты в целом, так и отдельных бактерий на уровне их геномов. Было идентифицировано огромное число видов микроорганизмов, прежде всего бактерий, обитающих на поверхности и в организме человека, что заставило и фарминдустрию обратить внимание на потенциал использования препаратов на основе живых пробиотических организмов для лечения различных заболеваний [8–14]. Исследования последних лет демонстрируют огромный потенциал пробиотиков. Они способны влиять на различные процессы в организме человека, в том числе повышать чувствительность к инсулину, улучшать память и когнитивные свойства, снижать проявление признаков тревожности и депрессии, снижать проявление аллергических реакций. Следует подчеркнуть, что проявление пробиотических свойств бактериями – явление штаммоспецифическое, что требует детального исследования свойств не только видов, но и конкретных штаммов.
Однако использование препаратов на основе пробиотических микроорганизмов в медицине затруднено в связи со сложностями их стандартизации и разработки соответствующих протоколов, позволяющих гарантировать сохранение полезных свойств микроорганизмами в процессе производства. Проблему осложняет и большое количество терминов (“эубиотики”, “пребиотики”, “пробиотики” “синбиотики”, “парабиотики”, “постбиотики”) и их произвольное использование. Тем не менее, такие препараты были названы “живыми биотерапевтическими препаратами” (англ. Live Biotherapeutic Products – LBPs) или “фармабиотиками” и были сформулированы руководства по их созданию Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в США и Европейским директоратом по качеству лекарственных средств и здравоохранению (EDQM) [6, 7]. Постепенно формируется консенсус, что гораздо перспективнее вкладываться не в пробиотики на основе живых культур бактерий, а в постбиотики (инактивированные микробные клетки или их метаболиты), которые легче поддаются контролю и стандартизации.
Согласно государственному реестру лекарственных средств, в РФ зарегистрирован ряд препаратов, нормализующих микробиоту. Большая часть препаратов содержит бифидобактерии и лактобактерии [8]. В РФ зарегистрированные лекарственные препараты, нормализующие микробиоту, применяются преимущественно после курсов антибиотикотерапии, при аллергических заболеваниях, респираторных инфекциях и расстройствах желудочно-кищечного тракта. В данном обзоре рассматриваются вопросы правого регулирования пробиотиков, постбиотиков и фармабиотиков в России и за рубежом. Уделяется особое внимание лактобациллам как наиболее часто используемым в качестве пробиотиков бактериям.
ПРОБИОТИКИ: ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ БАДОВ И ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ В РОССИИ И ЗА РУБЕЖОМ
Термин “пробиотик” был впервые использован в 1954 г. Фердинандом Вегином [9]. В настоящее время международная научная ассоциация пробиотиков и пребиотиков (the International Scientific Association for Probiotic and Prebiotic, ISAPP) определяет пробиотики как живые организмы, которые, при приеме в достаточном количестве, приносят пользу для здоровья хозяина [10].
Пробиотики могут использоваться как БАДы, как компоненты функциональных пищевых продуктов и как лекарственные средства, называемые “фармабиотиками” или “LBP”. Термин “фармабиотики” впервые был использован в 2002 г. Колином Хиллом во время его работы по изучению пробиотиков под руководством Фергуса Шанахана [11]. Как БАДы и лекарственные средства пробиотики используются для профилактики и лечения заболеваний ЖКТ (синдром раздраженного кишечника, желудочно-кишечные расстройства, элиминация хеликобактера, воспалительные заболевания кишечника), аллергических заболеваний, ожирения, диабета 2 типа, неалкогольной жировой болезни печени, побочных эффектов рака, заболеваний нервной системы, для модуляции иммунной системы. Пробиотики способствуют поддержанию нормального состава микробиоты, укреплению кишечного барьера, подавляют рост патогенных бактерий, стимулируют пролиферацию и активность компонентов врожденного и адаптивного иммунитета и синтез ферментов организма хозяина, участвующих в защите от стресса [12–15].
Пробиотики действуют на макроорганизм посредством как интактных клеток, так и клеточных компонентов и отдельных метаболитов. Мишени их действия различны, они включают бактерии микробиоты, клеточные рецепторы (в том числе Toll-подобные рецепторы), компоненты систем сигнальной трансдукции, клетки кишечного эпителия и энтеральной нервной системы [16]. Было выдвинуто предположение, что пробиотики могут влиять на различные биохимические и сигнальные пути через эпигенетические модификации, такие как метилирование ДНК, фосфорилирование, биотинилирование, ацетилирование гистонов и РНК-интерференцию [17]. Данные механизмы вовлечены в осуществление эпигенетического контроля ответов клетки-хозяина, таким образом регулируя различные биохимические процессы, такие как иммуномодуляция, конкурентное исключение и барьерная функция эпителиальных клеток. Кроме того, эти биохимические модификации могут способствовать предотвращению различных заболеваний, таких как рак, аутоиммунные расстройства, и других.
Эффективность пробиотиков определяется не видом используемых бактерий, а конкретным штаммом, а также конкретным заболеванием, для профилактики и лечения которого используется данный пробиотик [18]. Для максимальной эффективности штаммы пробиотиков должны быть отобраны в том же географическом регионе, в котором предполагается их применение.
Широко используемые термины “пребиотик” и “синбиотик” были введены позже, в 1995 г. [19]. В настоящее время ISAPP определяет пребиотики как неживые пищевые ингредиенты, которые поддерживают здоровье хозяина за счет модуляции микробиоты [20]. Термин синбиотик обозначает смесь, содержащую живые микроорганизмы и субстрат(ы), селективно используемые микроорганизмами, которая благотворно влияет на организм хозяина [21]. Пребиотики могут быть использованы как альтернатива пробиотикам или совместно с ними, для усиления эффекта их действия в составе синбиотиков. Используется также термин “аутопробиотики”, их получают культивированием in vitro штаммов индивидуальной микробиоты человека с последующем использованием в качестве персонифицированных лекарств или пищевых продуктов [22].
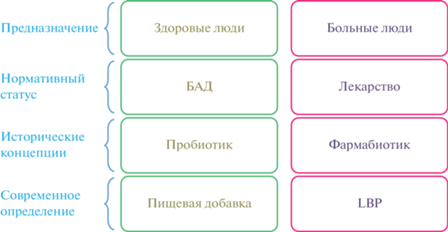
Статус пробиотиков за рубежом. В США пробиотики могут получить статус биологически активной добавки (БАД), пищевого ингредиента или живого биологически активного продукта (LBP), являющегося лекарственным средством, в зависимости от того, предназначены они для использования здоровыми или больными людьми, соответственно (рис. 1).
Большинство пробиотиков, используемых в США как пищевой ингредиент, не проходили процесс утверждения перед выходом на рынок, так как они попадают под программу GRAS (Generally Regarded as Safe) и признаются полностью безвредными для здоровья человека. Статус GRAS получают автоматически вещества, применявшиеся исторически в составе пищевой продукции на момент до 1 января 1958 г. Международная молочная федерация (IDF) составила список организмов с задокументированной историей безопасного использования в пищевых продуктах в своем бюллетене № 377 “Инвентаризация микроорганизмов с задокументированной историей использования в пищевых продуктах” [23].
Что касается регистрации пищевых добавок в США, согласно закону о пищевых добавках (DSHEA), пищевые добавки, применяемые до 15 октября 1994 г., автоматически разрешены к производству. Совет по вопросам ответственного питания (CRN) составил список разрешенных добавок до 15 октября 1994 г. Однако в списке, к сожалению, указаны только виды пробиотиков без указания названий штаммов. Штаммы, выделенные позднее 15 октября 1994 г., нужно регистрировать как новый диетический ингредиент (NDI) [24]. Регистрация пробиотиков в США регулируется федеральным законом о продуктах питания, лекарствах и косметике (сокращенно FFDCA, FDCA или FD&C) [25].
EFSA одобрила список видов бактерий, используемых в составе пищевой продукции, для которых действует принцип квалицифированной презумпции безопасности (Qualified Presumpiton of Safety – QPS) [26, 27]. Данное решение основано на исследованиях, показывающих, что безопасность штаммов, входящих в состав пищи, в первую очередь определяется их видовой принадлежностью.
Стоит отметить, что в большинстве стан ЕС, согласно регламенту № 1924/2006, запрещено наносить на этикете слово “пробиотик” в целях защиты прав потребителя. Причиной тому является то, что применение названия “пробиотик” на этикете сообщает потребителю о наличии в составе продукта полезных свойств для его организма, которые далеко не всегда доказаны. Из 400 заявок о регистрации полезных свойств пробиотиков поданных в EFSA, лишь одна была поддержана. Согласно статье 13.1, йогурты, содержащие не менее 108 колоний-образующих единиц видов L. delbrueckii subsp. bulgaricus и Streptococcus thermophilus, можно рекламировать как средство для улучшения усвоения лактозы [28].
Регистрация пробиотиков в качестве LBP за рубежом. В 2010 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) стало первым компетентным органом, предложившим рассмотреть статус лекарственных препаратов, содержащих живые микроорганизмы, применяемые для профилактики или лечения болезней у людей. В 2016 году FDA опубликовало руководство по созданию LBP. Согласно FDA, препарат можно отнести к категории LBP, если он содержит живые организмы, применим для профилактики и лечения конкретного заболевания или расстройства у людей и не является вакциной [29].
В 2019 г. Европейский директорат по качеству лекарственных средств и здравоохранению (EDQM) опубликовал монографию, посвященную LBP, тем самым официально признав их в качестве новой категории лекарственных средств для применения на Европейском рынке [6]. Подача заявок на регистрацию препаратов в качестве LBP часто обсуждается с компетентными органами, такими как EDQM и FDA, для уточнения всех требуемых исследований для конкретного препарата. Все требования к разработке и использованию препаратов на основании живых культур были подробно изложены в статье, посвященной препарату на основе штамма Christensenella minuta DSM 33407 для лечения ожирения и метаболического синдрома [30].
Национальный институт исследования здоровья США (NIH) сегодня разрешает применение LBP для лечения заболеваний желудочно-кишечных, аллергических, стоматологических, связанных с осью кишечник-мозг и других (см. табл. 1) [31].
Таблица 1.
Список медицинских областей применения LBP согласно Национальному институту здоровья США (NIH) [31]
| Желудочно-кишечные заболевания | Антибиотик-ассоциированная диарея,
инфекция Clostridioides difficile, запор, диарея, вызванная противораковой терапией, двертикулярная болезнь, воспалительное заболевание кишечника, синдром раздраженного кишечника, диарея путешественника |
|---|---|
| Детские заболевания | Детские колики, некротический энтероколит, сепсис новорожденных |
| Стоматологические заболевания | Зубной кариес, заболевания десен |
| Аллергические заболевания | Аллергический ринит, астма, атопический дерматит, профилактика аллергии |
| Ось кишечник-мозг и связанные с ней заболевания | Тревожность и стресс, когнитивные функции, депрессия, расстройство аутистического
спектра, шизофрения болезнь Паркинсона, болезнь Альцгеймера |
| Другие заболевания | Воспаление сальных желез, печеночная энцефалопатия, инфекции верхних дыхательных путей, инфекции мочеиспускательного канала, заболевания половых путей |
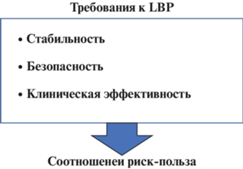
Если вкратце, для регистрации нового препарата LBP требуется продемонстрировать положительный баланс пользы и риска (рис. 2). Доказательство положительного баланса пользы и риска должно быть получено на основе проведения надежных и подтвержденных доклинических и клинических исследований. Соотношение польза/риск – это краеугольный камень заявки на регистрацию препарата [32]. Клинические испытания – это исследования, проводимые на людях и направленные на оценку безопасности и эффективности медицинских, хирургических или поведенческих вмешательств. Это основая и общепринятая методика, с помощью которой исследователи выясняют, является ли новое лечение в виде нового лекарства, диеты или медицинского устройства безопасным и эффективным для людей. Клинические испытания подразделяются на четыре этапа. Конечная цель клинических испытаний является протестировать новый вид лечения, найти подходящую дозировку и выявить побочные эффекты. Если в ходе первых трех фаз клинических испытаний выявляется, что лекарство или другое вмешательство безопасно и эффективно, оно может быть одобрено для постмаркетинговой IV фазы. Как правило, проведение первых трех фаз достаточно для вывода препарата/методики лечения на рынок.
На сегодняшний день зарегистрированных LBP на территории США нет. Первым таким препаратом может стать SER-109 на основе спор бактерий типа Фирмикуты (лат. Firmicutes) для лечения антибиотико-ассоциированной диареи, вызванной C. difficile [33]. Есть ряд других препаратов LBP на разных стадиях клинических исследований (табл. 2) [34].
Таблица 2.
Список LBP, которые проходят сегодня клинические исследования
| Препарат | Мишень | Фаза исследования | Описание препарата |
|---|---|---|---|
| SER-109 | Инфекция Clostridium difficile | III | SER-109 представляет собой совокупность спор бактерий, полученную из донорского стула от здоровых, проверенных доноров |
| VE303 | Инфекция Clostridium difficile | II | VE303 представляет собой живой биотерапевтический продукт, содержащий 8 штаммов комменсальных бактерий человека, полу-ченных в соответствии с требованиями GMP |
| Blautix (MRx1234) | Синдром раздраженного кишечника | а II | Лиофилизированный продукт запатентованного штамма бактерии Blautia hydrogenotrophica |
| LACTIN-V | Бактериальный вагиноз | II | LACTIN-V представляет собой живой биотерапевтический продукт для интравагинального введения, состоящий из штамма Lactobacillus crispatus CTV-05 |
| Xla1 | Ожирение и метаболический синдром | I | Xla1 представляет собой LBP, содержащий штамм бактерий Christensenella minuta |
Что касается регистрации LBP на территории Европейского Союза (ЕС), в соответствии с директивой N 2001/83/ЕС Европейского парламента и Совета ЕС “О Кодексе Сообщества о лекарственных средствах для использования человеком” любой продукт, предназначенный для профилактики или лечения заболеваний, определяется как лекарственный продукт и соответственно требуется получить разрешение на продажу от компетентных органов до его коммерциализации. Однако, даже если нормативно-правовая база в области фармацевтики будет налажена на уровне ЕС, получение разрешений на продажу лекарственных средств для LBP остается очень сложной задачей. По сравнению с другими лекарственными средствами, находящимися в продаже в настоящее время на рынке, оценка безопасности LBP представляет собой реальную проблему из-за их специфики, свойственной живым организмам и сложного механизма действия. Например, сами LBP не должны попасть в кровоток как большинство лекарственных средств, нацеленных на отдаленные органы, ткани или рецепторы, а скорее оказывать свое действие посредством прямого взаимодействия с микробиотой хозяина, что косвенно приводит к отдаленным биологическим эффектам в его организме.
Для оценки безопасности LBPv недостаточно сослаться на историческое безопасное использование некого штамма в составе пищевой продукции. В ЕС послепродажный надзор, как правило, не требуется для пищевых продуктов и пищевых добавок. Соответственно, о возможных побочных эффектах у больных людей может не сообщаться. Кроме того, в отчете 2011 г. Агентства США по исследованиям и качеству в области здравоохранения авторы заключили, что, хотя существующие клинические испытания для пробиотиков пока не выявляют повышенного риска, современная литература не может с уверенностью ответить на вопросы о безопасности интервенционных исследований. Дело в том, что в случае лекарственных средств, данные о безопасности и токсикологии являются обязательными, что нельзя сказать о пищевых добавках.
EMA до сих пор не разработало требования к регистрации LBP, поскольку EMA до сих пор не занималась живыми микроорганизмами и трудностями, связанными с их стандартизацией. Среди требований, которые возможно будут введены для LBP, может быть подсчет с помощью проточной цитометрии живых, мертвых и активных бактерий. Такой стандарт уже был разработан и сертифицирован ISO, а также включен в Европейскую фармакопею. Поэтому есть надежда, что в ближайшие годы EMA продолжит разработку, оценку и улучшение существующих процедур согласования требований к LBP. В отсутствии такого формального регулирования можно ожидать появления национальных инициатив по использованию термина “пробиотик”. Согласно ISAPP, на этикетке пробиотического продукта должны быть указаны род, вид и обозначение штамма для всех штаммов, содержащихся в продукте; ингредиенты/аллергены; эффект/рекомендуемое использование; суточная доза; информация о хранении; срок хранений; название компании/контактная информация [35].
Статус пробиотиков на территории РФ. Пробиотики регулируются разными законодательными актами РФ в зависимости от того, будут ли они зарегистрированы как биологически активные пищевые добавки (БАД) или как лекарственное средство (ЛС). При этом важно понимать, что только ЛС может быть выписано врачом в качестве фармакологического лечения. Пробиотики – БАДы могут быть применены для профилактики заболеваний, принимать их как лекарство запрещено ФЗ РФ “о надзоре за БАД” от 10.07.2009. Существует и третья группа препаратов, содержащих пробиотики, это продукты функционального питания, имеющие в своем составе живые пробиотические бактерии.
Регистрация пробиотиков в качества БАДов в России. Согласно Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзору) биологически активные добавки к пище (БАДы) – это природные и (или) идентичные природным биологически активные вещества, а также пробиотические микроорганизмы, предназначенные для употребления одновременно с пищей или введения в состав пищевой продукции [36]. Для того, чтобы зарегистрировать пробиотик в качестве БАДа на территории РФ, требуется провести испытание препарата, пройти экспертизу документации и оформить свидетельство о государственной регистрации. Стадия испытания направлена в первую очередь на доказательство безопасности препарата и на подтверждение соответствия заявленным в документации его свойствам. Пробиотики – БАДы регулируются также гигиеническими требованиями безопасности пищевой продукции, сформулированными в техническом регламенте Таможенного союза “О безопасности пищевой продукции” [37], что является необходимым условием для продажи продукта на территории РФ. Существуют микробиологические стандарты, которым должны соответствовать БАДы для обеспечения безопасности продукта. Данные стандарты подробно описаны в Единых санитарно-эпидемиологических и гигиенических требованиях к товарам, подлежащим санитарно-эпидемиологическому надзору под контролем Роспотребнадзора [37]. Конечным этапом является государственная регистрация БАДа, что подразумевает внесение препарата в единый Реестр свидетельств о государственной регистрации. Данный реестр контролируется Роспотребнадзором. Пребиотики могут быть зарегистрированы только в качестве БАДов.
Регистрация пробиотиков в качества ЛС в России. Для регистрации пробиотика в качестве ЛС необходимо, чтобы препарат соответствовал требованиям Федерального закона Российской Федерации N 61-ФЗ “Об обращении лекарственных средств” [38]. Оборот таких препаратов регулируется приказом Министерства здравоохранения Российской Федерации от 11.07.2017 г. № 403н “Об утверждении правил отпуска лекарственных препаратов для медицинского применения, в том числе иммунобиологических лекарственных препаратов, аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность” [39].
Сегодня ЛС на основе пробиотиков признаются как иммуннобиологические препараты. Как правило, они содержат живые полезные микроорганизмы, для которых должна быть доказана их активность, например, антагонистическая активность в отношении патогенных и условно-патогенных бактерий. Подобные препараты должны соответствовать фармакопейным требованиям к производству стандартного препарата и требованиям к качеству ЛС для определенной лекарственной формы [40]. При этом существует несколько фармакотерапевтических групп для ЛС на основе пробиотиков; препарат может быть отнесен к пробиотикам, эубиотикам, противодиарейным средствам или к медицинским иммунобиологическим препаратам и классифицируется в соответствии с анатомотерапевтической химической классификацией (АТХК). ЛС на основе пробиотиков могут иметь следующие коды: сахаромицеты Boulardii (A07FA02), противодиарейные микроорганизмы (A07FA), лактобациллы (G01AX14), микроорганизмы, продуцирующие молочную кислоту (A07FA01), микроорганизмы, продуцирующие молочную кислоту в комбинации с другими препаратами (A07FA51). При этом нужно отметить, что понятие “эубиотик”, которым обозначают препарат, содержащий один или несколько штаммов пробиотиков, считается устаревшим [40].
С точки зрения правого регулирования, пробиотики в РФ в основном используются для лечения заболеваний гастроэнтерологического профиля и не могут быть зарегистрированы в качестве ЛС, предназначенных для лечения большинства заболеваний, упомянутых в табл. 1 и признанных NIH [41]. Что касается уровня доказательности, учитывая, что БАДы и ЛС могут быть зарегистрированы без указания штамма, не существует гарантии, что штамм, входящий в состав препарата, будет всегда проявлять заявленные производителем свойства. Очевидно, необходимо более строгое правое регулирование пробиотиков как ЛС и БАДов. Результаты анализа правого регулирования пробиотиков просуммированы в табл. 3.
Таблица 3.
Анализа правового регулирования пробиотиков в РФ, ЕС и США
| Показатель | РФ | ЕС | США | |||
|---|---|---|---|---|---|---|
| БАД | ЛС | БАД | ЛС | БАД | ЛС | |
| Регулирующий орган | Роспотребнадзор | Минздрав | EFSA | EMA | FDA | FDA |
| Требуется идентификация штамма, входящего в состав препарата | Нет | Нет | Нет | Да | Нет | Да |
| Документы, регулирующие требования к регистрации | Гигиенические требования безопасности пищевой продукции, сформулированные в техническом
регламенте Таможенного союза “О безопасности пищевой продукции” (TP ТС 021/2011) [35] |
Требования Федерального закона Российской Федерации N 61-ФЗ “Об обращении лекарственных
средств”, Общая фармакопейная статья ОФС.1.7.1.0008.15 [38] |
Регламент Европейского Парламента и Совета Европейского Союза 1924/2006 от 20 декабря 2006 г. о заявлениях о пищевой ценности и полезности для здоровья (NHCR) [27] | 3053E Общая монография о живых биотерапевтических продуктах (2019 г.) Директива N 2001/83/ЕС [6] |
Федеральный закон США о продуктах питания, лекарствах и косметике (сокращенно FFDCA,
FDCA или FD&C) [25] |
FDA. Ранние клинические испытания живых биотерапевтических продуктов: информация
о химическом составе, производстве и контроле (2012, 2016) [7, 28] |
| Требования к безопасности | Единые санитарно-эпидемиологические и гигиенические требованиями к товарам, подлежащим санитарно- эпидемиологическому надзору [35] |
Общая фармакопейная статья ОФС.1.7.1.0008.15 [38] | Квалицифированная презумпция безопасности (QPS) [25, 26] | Руководство по лекарственным препаратам на основе клеток человека (EMA, 2008 г.) [35] | GRAS или DSHEA [23] | FDA. Ранние клинические испытания живых биотерапевтических продуктов, информация о
химическом составе, производстве и контроле (2012, 2016) [7, 28] |
Также стоит упомянуть о категории функциональных пищевых продуктов, которые содержат пребиотики, пробиотики и другие активные ингредиенты и предназначены для потребления здоровой категорией людей и направлены на предотвращение заболеваний и поддержание здорового состояния организма человека. Общие требования к пробиотикам – БАДам, ЛС, функциональным пищевым продуктам – сформулированы Федеральным законом о “Биологической безопасности в Российской Федерации” [42]. Закон был принят Государственной Думой 24.12.2020 и одобрен Советом Федерации 25.12.2020; он направлен на защиту населения от воздействия опасных биологических факторов и охрану окружающей среды, на предотвращение биологических угроз и мониторинг рисков. Формулировка закона предполагает его комплексность. Здесь мы сосредоточимся на положениях, касающихся микробиоты человека. В статье 1 дается следующее определение микробиоты: “совокупность сообществ микроорганизмов (симбиотических, условно-патогенных и (или) патогенных), населяющих различные участки живых организмов с однородными условиями существования”. В статье 8 уточняется, что к биологическим угрозам относится “нарушение нормальной микробиоты человека, сельскохозяйственных животных и растений, приводящее к возникновению и распространению связанных с этим заболеваний”. Далее в статье 9 говорится, что “сохранение и восстановление нормальной микробиоты человека, сельскохозяйственных животных, а также редких и исчезающих видов животных и растений” относится к комплексу мер, направленных на защиту населения. Также в статье 10 упоминается “создание и производство пищевых продуктов, кормов и кормовых добавок для животных, нормализующих микробиоту” как одна из мер, направленных на борьбу с распространением инфекционных и паразитарных болезней “в целях профилактики и лечения болезней, связанных с нарушениями нормальной микробиоты человека, сельскохозяйственных животных и растений, осуществляются меры по сохранению или восстановлению нормальной микробиоты”. В пункте 7 статьи 10 настоящего закона утверждается, что для сохранения биологического разнообразия микробиоты человека, необходимо: 1) обеспечение проведения научных исследований для понимания роли микробиоты в здоровье человека; 2) разработка подходов для диагностики, профилактики и лечения заболеваний, связанных с нарушением микробиоты; 3) использование потенциала микробиоты человека, животных и растений для разработки новых средств и биологических технологий, в том числе персонифицированных продуктов питания и лекарственных препаратов. Принятие федерального закона № 492-ФЗ “О биологической безопасности в Российской Федерации” подчеркивает важность изучения микробиоты человека и поддержания ее стабильности и позволяет надеяться, что исследования в данной области будут расширены.
ПОСТБИОТИКИ И ПАРАБИОТИКИ
Пробиотики являются живыми культурами, поэтому в отдельных случаях – у иммуноослабленных больных, у детей – могут вызывать воспалительные патологические процессы. При использовании клеток живых микроорганизмов практически невозможно установить точный суммарный механизм действия различных компонентов бактерий и невозможно точно предсказать ответ макроорганизма. Кроме того, стандартизация живых культур достаточно сложна. Эти факты привели к идее использования постбиотиков – убитых бактерий или отдельных их метаболитов [43]. Международная научная ассоциация пробиотиков и пребиотиков (ISAPP) определила постбиотик как “препарат неживых микроорганизмов и/или их компонентов, приносящих пользу здоровью хозяина” [44].
Однако это определение не устроило многих исследователей, т.к. оно относится и к убитым бактериальным клеткам, представляющим собой конгломерат различных структур и метаболитов, и к отдельным соединениям. Было предложено термин “постбиотик” использовать для обозначения инактивированных бактериальных клеток и их компонентов, а для обозначения отдельных соединений пробиотических бактерий использовать термин “парабиотик” [45].
Постбиотики – это инактивированные микробные клетки с метаболитами или без них или клеточные компоненты (пептидогликаны, тейхоевые кислоты, поверхностные белки, внеклеточные везикулы и т.д.) с доказанной пользой для здоровья организма хозяина и безопасностью. Инактивация живых бактерий может быть достигнута различными методами: термической обработкой, обработкой химическими веществами (например, формалином), гамма- или ультрафиолетовым облучением, обработкой ультразвуком. Термическая обработка остается самым популярным методом, она включает широкий диапазон комбинаций времени и температуры для обеспечения полного подавления жизнеспособности бактерий в суспензии. Инактивация также может быть достигнута путем сочетания процесса тиндализации и замораживания клеток [46]. Инъекции, очищенные микробные метаболиты и вакцины выходят за рамки понятия постбиотиков.
Важно отметить, что постбиотики, несмотря на их нежизнеспособность, являются перспективной альтернативой пробиотикам и обладают рядом фармацевтических преимуществ [47]. Инактивированные нагреванием пробиотики доказали свою способность противодействовать адгезии различных энтеропатогенов на экспериментальной модели клеток Caco-2 [48]. Эти данные позволяют предположить, что постбиотики могут быть применены для борьбы с диарейными и пищевыми патогенами. Кроме того, инактивированные нагреванием штаммы лактобацилл и бесклеточная культуральная жидкость продемонстрировали иммуномодулирующее, антиоксидантное (способность нейтрализовать свободные радикалы) и противовоспалительное действие в экспериментальных моделях [49–53].
Парабиотики имеют преимущества перед постбиотиками: их химическая структура легко поддается идентификации, соответственно можно получить продукт с высокой степенью очистки. Также легче определить дозировку и срок хранения и стандартизировать производственный процесс. Симбиотические (пробиотические) штаммы микробов производят различные биоактивные молекулы, которые являются кандидатами для создания парабиотиков. К ним относятся ферменты, органические кислоты, гликопротеины, пептиды (образующиеся при гидролизе белков пищи и собственно бактериальных белков), метаболиты триптофана и желчных кислот, полиамины, секретируемые белки, экзополисахариды, аминокислоты (в том числе гамма-аминомасляная кислота), короткоцепочечные жирные кислоты, полифосфаты, витамины, антиоксиданты, бактериоцины токоферолы, каротиноиды и многие другие [54–60]. Примеры коммерческих препаратов постбиотиков и парабиотиков приведены в табл. 4.
Таблица 4.
Препараты постбиотиков и парабиотиков
| Препарат | Состав | Статус препарата |
|---|---|---|
| Хилак форте | Водный субстрат продуктов обмена веществ Escherichia coli, Enterococcus faecalis, Lactobacillus rhamnosus, Lactobacillus helveticus | Лекарственное средство |
| Закофальк | Инулин, масляная кислота | БАД |
| Бактистатин | Биологически активные метаболиты бесклеточной культуральной жидкости бактерий Bacillus subtilis | БАД |
| Актофлор-С | Комплекс аминокислот и органических кислот – аналогов метаболитов пробиотических бактерий. | БАД |
| Про-симбиофлор | Автолизат из клеток E. coli и E. faecalis |
Лекарственное средство |
| Хелинорм | Инактивированные бактерии Lactobacillus reuteri | БАД |
Постбиотки и парабиотики принципиально не отличаются по своему механизму действия от живых пробиотиков. Они модулируют кишечный микробиом, иммунную систему, нервную систему а также укрепляют кишечный барьер и модулируют метаболизм. В отличие от живых пробиотиков у них отсутствуют риск бактериальной транслокации из просвета кишечника в кровь в случае пациентов с хроническими заболеваниями и ослабленным иммунитетом; возможность приобретения и передачи генов устойчивости к антибиотикам; риск потери жизнеспособности из-за лизиса клеток [61].
На сегодняшний день не существует нормативной базы в мире конкретно ни для постбиотиков в качестве БАДов и содержащих их пищевых продуктов, ни для постбиотиков в качестве лекарств. Соответственно постбиотики регулируются как любые другие вещества, в зависимости от их сферы применения. Если речь идет о пищевом продукте, то необходимы соответствующие испытания безопасности. Если речь идет о лекарстве, необходимы клинические испытания и доказательство специфической активности. Однако однозначно, что постбиотики легче регистрировать, чем LBP. В России понятие постбиотик попадает под определение “пробиотик”; пробиотик, зарегистрированный в качестве ЛС, идентифицируется как “иммунобиологический лекарственный препарат, который содержит живые или инактивированные апатогенные микроорганизмы, обладающие антагонистической активностью в отношении патогенных и условно-патогенных бактерий” [40].
Учитывая сложности создания лекарств на основе живых организмов, переход к пребиотикам, постбиотикам, парабиотикам является реальной и неизбежной перспективой [62, 63].
ПРОБИОТИКИ НА ОСНОВЕ ЛАКТОБАЦИЛЛ
Лактобациллы издавна используются для получения ферментированных продуктов (ФП), по некоторым оценкам с седьмого века до нашей эры, т.е. с того времени, когда происходила экспансия оседлого образа жизни и аграрной культуры [64]. ФП привлекали наших предков как способ консервации продуктов, а иногда и ликвидации их токсичности [65, 66]. Сегодня в разных странах имеется большое разнообразие ФП, начиная от кимчи родом из Кореи, квашеной капусты из центральной Европы, чатни из Индии, натто из Японии, разных местных видов кисломолочных продуктов и т.д. Лактобациллы расцениваются как полезная пищевая добавка со времен описания болгарской палочки доктором Стаменом Григоровым [67] и исследований ее значения для здоровья и продолжительности жизни человека российским ученым И. Мечниковым [68].
В настоящее время лактобациллы широко используются для создания пробиотиков [69, 70]. Открытия последних двух десятилетий в области микробиома человека позволили перейти к более глубокому и целенаправленному изучению лактобацилл как пробиотиков, что заставило и фарминдустрию обратить внимание на потенциал использования препаратов на основе живых пробиотических организмов для лечения различных заболеваний [71–77]. Омиксные технологии сделали возможным изучение как микробиоты в целом, так и отдельных бактерий на уровне их геномов. C помощью секвенирования ДНК можно определить наличие генов лекарственной устойчивости и патогенности у микробов, а также отобрать для дальнейшего исследования штаммы с полезными генами [78, 79].
Подавляющее большинство пробиотиков содержит штаммы лактобацилл. Это объясняется рядом фактов. Лактобациллы являются постоянными компонентами микробиоты человека и проявляют свойства, полезные и важные для макроорганизма [80]. Лактобациллы входят в состав многих пищевых продуктов и издавна используются для получения ферментированных продуктов [81]. 36 видов лактобацилл признаны безопасными по версии EFSA (European Food Safety Authority) и 12 видов признаны GRAS (Generally Recognised as Safe) по версии FDA, что означает, что они могут быть использованы в качестве пищевых и кормовых добавок. Кроме того, лактобациллы составляют 43% от общего числа бактериальных видов с доказанными полезными свойствами [82].
Пробиотики на основе лактобацилл оказывают противовоспалительный, иммуномодулирующий, антиоксидантный эффекты, способствуют поддержанию здоровья зубов и периодонта, снижают уровень холестерина, используются в борьбе с ожирением, раком (антипролиферативный и проапоптозный эффекты), диареей, психическими и нейродегенеративными заболеваниями [70, 77]. Большое количество штаммов лактобацилл прошли четвертую фазу клинических испытаний. В табл. 5 приведены примеры таких штаммов.
Таблица 5.
Примеры живых штаммов лактобацилл, которые прошли Фазу 4 клинических исследований
| Препарат | Тестируемое заболевание/исследуемая микробиота | Место проведения исследования |
|---|---|---|
| Lactobacillus reuteri DSM 17938 | Антибиотикоассоцииро- ванная диарея |
Стамбул, Турция |
| Lactobacillus rhamnosus GG | Инфекционное заболевание пищеварительного тракта | Сент-Луис, Миссури, США |
| Lactobacillus acidophilus Rossel-52 and Lactobacillus rhamnosus Rosell-11 | Гриппоподобное заболевание | Джакарта, Индонезия |
| Lactobacillus reuteri DSM 17938 | Антибиотикоассоциированная диарея | Варшава, Польша |
| Lactobacillus plantarum 299v | Синдром раздраженного кишечника | Восточный Кейп, Южная Африка |
| Lactobacillus paracasei subspecies paracasei F19 | Желудочно-кишечные симптомы | Неаполь, Италия |
| Lactobacillus casei rhamnosus Lcr35 | Запор | Варшава, Польша |
| Lactobacillus reuteri DSM 17938 | Функциональный запор | Кастеллана-Гротте, Бари, Италия |
| Lactobacillus rhamnosus GG | Микробиота кишечника, микробиота кожи, гуморальные иммунные реакции, атопический дерматит | Турку, Финляндия |
| Lactobacillus casei Shirota | Инфекции дыхательных путей | Антверпен, Бельгия |
Лактобациллы входят в состав препаратов, зарегистрированных и как БАДы, и как лекарственные средства. Примеры препаратов приведены в табл. 6. Видовые названия лактобацилл приведены так, как они были использованы авторами цитированных статей и в названиях БАДов и ЛС – по старой номенклатуре. В 2020 г. род лактобацилл был разделен на 23 рода, при этом изменились родовые названия, но остались неизменными видовые [83].
Таблица 6.
Препараты на основе лактобацилл
| Название | Состав препарата | Статус препарата |
|---|---|---|
| Отечественные препараты | ||
| Аципол | Lactobacillus acidophilus | Лекарственное средство |
| Ацилакт | L. acidophilus | Лекарственное средство |
| Лактобактерин | L. acidophilus | Лекарственное средство |
| Флорин форте | Bifidobacterium bifidum и Lactobacillus | Лекарственное средство |
| Нормофлорин Д | Lactobacillus casei, B. bifidum, Bifidobacterium longum | БАД |
| Гепафор | B. bifidum, Lactobacillus fermentum | Лекарственное средство |
| Импортные препараты | ||
| Линекс | Bifidobacterium infantis, L. acidophilius, Enterococcus faecium | Лекарственное средство |
| Линекс форте | L. acidophilus, Bifidobacterium animalis subsp. lactis | Лекарственное средство |
| Максилак | L. helveticus, L. rhamnosus, L. casei, Lactobacillus plantarum, B. longum, Bifidobacterium breve, B. bifidum, Lactococcus lactis, Streptococcus thermophilus, олигофруктоза | БАД |
| Бак-Сет Форте | L. casei, L. plantarum, L.rhamnosus, B. bifidum, B.breve, B. longum, L. acidophilus, L. lactis, S. thermophiles, B. infantis, Lactobacillus delbrueckii ssp. bulgaricus, L. helveticus, Lactobacillus salivarius, L.fermentum | БАД |
| Нормобакт | L. rhamnosus и фруктоолигосахариды | БАД |
| РиоФлора Иммуно | Bifidobacterium, Lactobacillus, L. lactis, S. thermophilus | БАД |
| Флувир | L. plantarum, L. rhamnosus, B. lactis, фруктоолигосахариды. | БАД |
***
Сегодня мы хорошо понимаем пагубное влияние антибиотиков на состояние микробиоты человека и его здоровье. В течение последнего десятилетия мировая научная общественность искала и разрабатывала альтернативные подходы и антибактериальные препараты, способные заменить антибиотики [84–86]. Классические пробиотики были в их числе. Исследования последних лет показывают, что потребление пробиотиков и постбиотиков приводит к значительному изменению композиции кишечной микробиоты на уровне видов, родов, и более крупных таксономических единиц и ее метаболической активности [87]. Однако мы зачастую ничего или очень мало знаем о способности конкретного штамма продуцировать те или иные вещества, имеющие антиоксидантную или иммуномодуллирующую активность, и механизм их действия на организм хозяина. Для большинства применяемых в качестве пробиотиков бактерий отсутствуют данные о наличии в их геномах генов лекарственной устойчивости или патогенности, об их конкретном влиянии на структуру (колонизацию) микробиоты здорового человека.
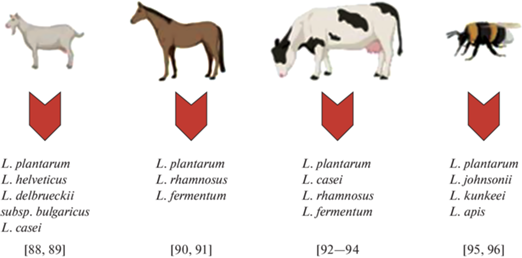
По сравнению с пробиотиками более безопасные и эффективные препараты – это постбиотики и парабиотики, бактериальные метаболиты и компоненты бактериальных клеток. Если для создания живых бактерий-пробиотиков используются штаммы, источником происхождения которых является именно человеческий организм или традиционные продукты питания (в связи с их потенциальной безопасностью для людей) [66], то при использовании постбиотиков и парабиотиков круг используемых бактерий может быть расширен. Учитывая пользу для здоровья человека ферментированных молочных продуктов козьего, коровьего, лошадиного и пчелиного происхождения, данные животные являются перспективными для поиска уникальных штаммов, обладающих антиоксидантной и нейромодулирующей активностью для последующего использования в качестве постбиотиков и парабиотиков для фармсубстанций и функциональных продуктов питания (рис. 3).
Рис. 3.
Нетрадиционные и перспективные источники выделения штаммов лактобацилл для последующего использования в качестве постбиотиков и ингредиентов для фармсубстанций и функциональных продуктов питания.
Пандемия COVID-19 и ее последствия, коснувшись сотен миллионов людей, требуют скорейших мер по реабилитации переболевшего населения. Современные препараты на основе лактобацилл с антиоксидантными и иммуномодулирующими свойствами, в том числе в качестве ингредиентов функциональных продуктов питания, крайне необходимы в этой реабилитации.
Для работы в этом направлении в России по инициативе ИОГен РАН создан междисциплинарный консорциум “Нутригеномика микробиома”. Нутригеномика – это наука, изучающая влияние биологически активных пищевых добавок на экспрессию генов человека и его здоровье, которая возникла 15–20 лет тому назад. Интенсивное исследование микробиома человека и его роли в утилизации продуктов питания сегодня позволяет обосновать понятие нутригеномика микробиома [95].
Целью консорциума является с помощью таких подходов как метагеномика, сравнительная геномика, транскриптомика, протеомика, биоинформатика и других, начать разработку фармакологических ингредиентов, полезных для конкретных групп людей, а также технологий, обеспечивающих их создание. Предпосылками для создания и последующего развития направления “Нутригеномика микробиома” послужили следующие результаты:
– конкретизированы биологически активные компоненты микробиоты человека как объекты исследования для создания персонализированных продуктов: пребиотики, постбиотики, аутобиотики и другие;
– продемонстрирована значительная роль постбиотиков, пребиотиков и аутобиотиков в коррекции композиции микробиоты кишечника;
– обозначены функциональные свойства компонентов микробиоты: иммуномодулирующие, антиоксидантные, нейромодулирующие;
– выявлены глобальные регуляторные гены и каскадные регуляторные системы организма человека, реагирующие на иммуномодулирующую, нейромодулирующую и антиоксидантную активность конкретных бактериальных продуктов;
– установлена сигнатура кишечной микробиоты человека при некоторых заболеваниях [78, 97].
Сегодня требуется объединить усилия участников консорцирума для проведения детальных исследований в рамках конкретных задач и перевода их в плоскость практического применения.
Постковидный синдром затронул сотни миллионов людей во всем мире. Сегодня четко установлено, что у многих переболевших происходят изменения композиции микробиома кишечника [дисбиоз], коррелирущие с различными неврологическими, кардиологическими и иммунологическими заболеваниями [98–100]. Выясняется, что классические пробиотики (БАДы) являются малоэффективными в коррекции. Ставится задача разработки фармабиотиков с селективными свойствами, способных лечить конкретные постковидные проявления. Микробиота кишечника становится не виртуальным, а конкретным органом, требующим детального изучения на основе доказательной медицины.
Список литературы
Danilenko V., Devyatkin A., Marsova M., Shibilova M., Ilyasov R., Shmyrev V. // J. Inflammation Research. 2021. V. 14. P. 6349.
O’Toole P.W., Marchesi J.R., Hill C. // Nature microbiology. 2017. V. 2. № 5. P. 1–6.
Cordaillat-Simmons M., Rouanet A., Pot B. // Experimental & Molecular Medicine. 2020. V. 52. № 9. P. 1397–1406.
Patterson E., Cryan J.F., Fitzgerald G.F., Ross R.P., Dinan T.G., Stanton C. // Proceedings of the Nutrition Society. 2014. V. 73. № 4. P. 477–489.
Hill C. // Human Vaccines. 2008. V. 4. № 4. P. 271–274.
EDQM (European Pharmacopoeia). 3053E General monograph on Live Biotherapeutic Products published (EDQM, 2019).
FDA. Early Clinical Trials with Live Biotherapeutic Products: Chemistry, Manufacturing, and Control Information (FDA, 2012).
https://minzdrav.gov.ru/opendata/7707778246-grls.
Vergin F. // Hipokrates. 1954. V. 25. P. 116–119.
Hill C., Guarner F., Reid G., Gibson G.R., Merenstein D.J., Pot B. et al. // Nat. Rev. Gastroenterol. Hepatol. 2014. V. 11. № 8. P. 506–514.
Hill C. // Bioeng. Bugs. 2010. V. 1. P. 79–84.
Oleskin A.V., Shenderov B.A. // Probiotics Antimicrob. Proteins. 2019. V. 11. № 4. P. 1071–1085.
Yan F., Polk D.B. // Front. Immunol. 2020. V. 11. 1428.
Stavropoulou E., Bezirtzoglou E. // Front. Immunol. 2020. V. 11. 2192.
Markowiak P., Śliżewska K. // Nutrients. 2017. V. 9. № 9. 1021.
Plaza-Diaz J., Ruiz-Ojeda F.J., Gil-Campos M., Gil A. // Adv. Nutr. 2019. V. 10. Suppl. 1. S49–S66.
Bhat M.I., Kumari A., Kapila S., Kapil, R. // Annals of Microbiology. 2019. V. 69. № 6. P. 603–612.
McFarland L.V., Evans C.T., Goldstein E.J.C. // Front. Med. 2018. V. 5. 124.
Gibson G.R., Roberfroid M.B. // J. Nutr. 1995. V. 125. P. 1401–1412.
Gibson G.R., Hutkins R., Sanders M.E., Prescott S.L., Reimer R.A., Salminen S.J. et al. // Nat. Rev. Gastroenterol. Hepatol. 2017. V. 14 P. 491–502.
Swanson K.S., Glenn R.G., Robert H., Raylene A.R., Gregor R., Kristin V., Karen P.S. // Nat. Rev. Gastroenterol. Hepatol. 2020. V. 17. № 11. P. 687–701.
Suvorov A., Karaseva A., Kotyleva M., Kondratenko Y., Lavrenova N., Korobeynikov A. et al. // Front Microbiol. 2018. V. 9. 1869.
Mogensen, G. // Bulletin of the International Dairy Federation. 2002. V. 377. P. 1–10.
Dickinson A. // Fitoterapia. 2011. V. 82. № 1. P. 5–10.
Gilsenan M.B. // Trends in Food Science & Technology. 2011. V. 22. № 10. P. 536–542.
Ricci A., Allende A., Bolton D., Chemaly M., Davies R., Fernández Escámez P.S. et al. // EFSA J. 2018. V. 16. № 7. P. e05315.
Koutsoumanis K., Allende A., Álvarez-Ordóñez A., Bolton D., Bover-Cid S., Chemaly M., Davies R., Hilbert F., Lindqvist R., Nauta M. // EFSA J. V. 17. № 1. P. e05555.
Gilsenan M.B. // Trends in Food Science & Technology. 2011. V. 22. № 10. P. 536–542.
FDA. Early Clinical Trials with Live Biotherapeutic Products: Chemistry, Manufacturing, and Control Information (FDA, 2016).
Paquet J.C., Claus S.P., Cordaillat-Simmons M., Mazier W., Rawadi G., Rinaldi L. et al. // Frontiers in Medicine. 2021. P. 1289. https://doi.org/10.3389/fmed.2021.716266
NCCIH. Probiotics: What You Need To Know. https://nccih.nih.gov/health/ probiotics/introduction.htm (NCCIH, 2011).
FDA. Benefit-Risk Assessment in Drug Regulatory Decision-Making (FDA, 2018).
Feuerstadt P., Louie T.J., Lashner B., Wang E.E., Diao L., Bryant J.A. et al. // New England Journal of Medicine. 2022. V. 386. № 3. P. 220–229.
https://www.clinicaltrials.gov/.
Committee for Medicinal Product for Human use (CHMP). Guideline on Human Cell-Based Medicinal Products–EMEA/CHMP/410869/2006 (2008).
Роспотребнадзор. Что нужно знать о биологически активных добавках к пище https://www.rospotrebnadzor.ru/about/info/news/news_details.php?ELEMENT_ID=11900.
Технический регламент Таможенного союза “О безопасности пищевой продукции” от 9 декабря 2011 года N 880 (ТР ТС 021/2011).
http://www.kremlin.ru/acts/bank/30941.
https://minzdrav.orb.ru/documents/active/7066/
https://pharmacopoeia.ru/ofs-1-7-1-0008-15-probiotiki/.
Ивашкин В.Т., Маев И.В., Абдулганиева Д.И., Алексеенко С.А., Ивашкина Н.Ю., Корочанская Н.В. и др. // Российский журн. гастроэнтерологии, гепатологии, колопроктологии. 2020. Т. 30. № 2. С. 76–89.
http://www.kremlin.ru/acts/bank/46353
Shenderov B.A. // Microb. Ecol. Health. Dis. 2013. V. 24. № 1. 20399.
Salminen S., Collado M.C., Endo A., Hill C., Lebee S., Quigley E.M. et al. // Nat. Rev. Gastroenterol. Hepatol. 2021. V. 18. Suppl. 1. P. 1–19.
Aguilar-Toalá J.E., Arioli S., Behare P., Belzer C., Berni Canani R., Chatel J.M. et al. // Nat. Rev. Gastroenterol. Hepatol. 2021. https://doi.org/10.1038/s41575-021-00521-6
Taverniti V., Guglielmetti S. // Genes Nutr. 2011. V. 6. № 3. P. 261–74.
Caimari A., del Bas J.M., Boqué N., Crescenti A., Puiggròs F., Chenoll E., Martorell P., Ramón D., Genovés S., Arola L. // J. Funct. Foods. 2017. V. 38(A). P. 251–263.
Singh T.P., Kaur G., Kapila S., Malik R.K. // Front. Microbiol. 2017. V. 8. P. 486.
Jang H.J., Song M.W., Lee N.K., Paik H.D. // J. Food Sci. Technol. 2018. V. 55. № 8. P. 3174–80.
Marsova M., Abilev S., Poluektova E., Danilenko V. // World. J. Microbiol. Biotechnol. 2018. V. 34. № 2. P. 27.
Rocha-Ramírez L.M., Hernández-Ochoa B., Gómez-Manzo S., Marcial-Quino J., Cárdenas-Rodríguez N., Centeno-Leija S., García-Garibay M. // Microorganisms. 2020. V. 8. № 1. P. 79.
Zendeboodi F., Khorshidian N., Mortazavian A.M., da Cruz A.G. // Curr. Opin. Food Sci. 2020. V. 32. P. 103–123.
Warda A.K., de Almeida Bettio P.H., Hueston C.M., Di Benedetto G., Clooney A.G., Hill C. // Front. Microbiol. 2020. V. 11. P. 69.
Singh A., Vishwakarma V., Singhal, B. // Advances in Bioscience and Biotechnology. 2018. V. 9. № 04. P. 147.
Teame T., Wang A., Xie M., Zhang Z., Yang Y., Ding Q., Gao C., Olsen R.E., Ran C., Zhou Z. // Front. Nutr. 2020. V. 7. P. 570344.
Ghosh S., Whitley C.S., Haribabu B., Jala V.R. // Cellular and Molecular Gastroenterology and Hepatology. 2021. V. 11. № 5. P. 1463–1482.
Novik G., Savich V. // Microbes Infect. 2020. V. 22. № 1. P. 8–18.
Averina O.V., Zorkina Y.A., Yunes R.A., Kovtun A.S., Ushakova V.M., Morozova A.Y., Kostyuk G.P., Danilenko V.N., Chekhonin V.P. // Int. J. Mol. Sci. 2020B. V. 21. № 23. P. 9234.
Averina O.V., Poluektova E.U., Marsova M.V., Danilenko V.N. // Biomedicines. 2021. V. 9. P. 1340.
Rani A., Saini K.C., Bast F., Mehariya S., Bhatia S.K., Lavecchia R., Zuorro A. // Molecules. 2021. V. 26. № 4. P. 1142.
Piqué N., Berlanga M., Miñana-Galbis D. // Int. J. Mol. Sci. 2019. V. 20. № 10. P. 2534.
Tsai Y.L., Lin T.L., Chang C.J., Wu T.R., Lai W.F., Lu C.C., Lai H.C. // J. Biomed. Sci. 2019. V. 26 № 1. P. 3. https://doi.org/10.1186/s12929-018-0493-631
Vallianou N., Stratigou T., Christodoulatos G.S., Tsigalou C., Dalamaga M. // Curr. Obes. Rep. 2020. V. 9. P. 179–192.
McGovern P.E., Zhang J., Tang J., Zhang Z., Hall G.R., Moreau R.A., Nuñez A., Butrym E.D., Richards M.P., Wang C.S., Cheng G. // Proc. Natl. Acad. Sci. USA. 2004. V. 101. № 51. P. 17593–17598.
Sokari T.G., Karibo P.S. // Food Addit. Contam. 1992. V. 9. № 4. P. 379–384.
Peivasteh-Roudsari L., Pirhadi M., Karami H., Tajdar-Oranj B., Molaee-Aghaee E., Sadighara P. // J. Food Safe & Hyg. 2019. V. 5. № 1. P. 1–9.
Fisberg M., Machado R. // Nutrition reviews. 2015. V. 73. P. 4–7. https://doi.org/10.1093/nutrit/nuv020
Mackowiak P.A. // Frontiers in Public Health. 2013. V. 1. P. 52.
Arshad F.A., Mehmood R., Hussain S., Khan M.A., Khan M.S. // Br. J. Res. 2018. V. 5. № 3. P. 43. https://doi.org/10.21767/2394-3718.100043
Zhang Z., Lv J., Pan L., Zhang Y. // Appl. Microbiol. Biotechnol. 2018. V. 102. № 19. P. 8135–8143.
Chervinets Y., Chervinets V., Shenderov B., Belyaeva E., Troshin A., Lebedev S., Danilenko V. // Probiotics Antimicrob. Proteins. 2018. V. 10. № 1. P. 22–33.
Lee E.S., Song E.J., Nam Y.D., Lee S.Y. // J. Microbiol. 2018. V. 56. № 11. P. 773–782.
Kim S.K., Guevarra R.B., Kim Y.T., Kwon J., Kim H., Cho J.H., Kim H.B., Lee J.H. // J. Microbiol. Biotechnol. 2019. V. 29. № 9. P. 1335–1340.
Marsova M.V., Odorskaya M.V., Novichkova M., Polyakova V., Abilev S.K., Kalinina E., Shtil A., Poluektova E.U., Danilenko V.N. // Microorganisms. 2020. V. 8. № 6. P. 876.
Yunes R.A., Poluektova E.U., Vasileva E.V., Odorskaya M.V., Marsova M.V., Kovalev G.I., Danilenko V.N. // Probiotics Antimicrob. Proteins. 2020. V. 12. № 3. P. 973–979.
Nezametdinova V.Z., Yunes R.A., Dukhinova M.S., Alekseeva M.G., Danilenko V.N. // Int. J. Mol. Sci. 2021. V. 22. № 17. P. 9219.
Poluektova E.U., Yunes R.A., Danilenko V.N. // Nutrients. 2021. V. 13. № 5. P. 1591. doi.org/https://doi.org/10.3390/nu13051591
Averina O.V., Kovtun A.S., Polyakova S.I., Savilova A.M., Rebrikov D.V., Danilenko V.N. // J. Med. Microbiol. 2020A. V. 69. № 4. P. 558–571.
Kovtun A.S., Averina O.V., Alekseeva M.G., Danilenko V.N. // Microb. Drug Resist. 2020. V. 26. № 11. P. 1307–1320.
George F., Daniel C., Thomas M., Singer E., Guilbaud A., Tessier F.J. et al. // Front. Microbiol. 2018. V. 9. P. 2899.
Bernardeau M., Guguen M., Vernoux J.P. // FEMS Microbiol. Rev. 2006. V. 30. № 4. P. 487–513.
Salvetti E., O’Toole P.W. // Trends Food Sci. Technol. 2017. V. 66. P. 187–194.
Zheng J., Wittouck S., Salvetti E., Franz C.M., Harris H., Mattarelli P.,et al. // Int. J. Syst. Evol. Microbiol. 2020. V. 70. № 4. P 2782–2858.
Kamaruzzaman N.F., Tan L.P., Hamdan R.H., Cho-ong S.S., Wong W.K., Gibson A.J., Chivu A., Pina M.D. // Int. J. Mol. Sci. 2019. V. 20. № 11. P. 2747.
Vivas R., Barbosa A.A., Dolabela S.S., Jain S. // Microb. Drug Resist. 2019. V. 25. № 6. P. 890–908.
Wieërs G., Belkhir L., Enaud R., Leclercq S., Philippart de Foy J.M. et al. // Front. Cell. Infect. Microbiol. 2020. V. 9. P. 454. doi.org/https://doi.org/10.3389/fcimb.2019.00454
Valles-Colomer M., Falony G., Darzi Y., Tigchelaar E.F., Wang J., Tito R.Y. et al. // Nat. Microbiol. 2019. V. 4. № 4. P. 623–632.
Barua R., Al Masud H.A., Mahmud N., Hakim M.A. // IOSR J. Pharm. Biol. Sci. 2015. V. 10. № 4. P. 9–15.
Mulyawati A.I., Jatmiko Y.D., Mustafa I., Ardyati T. // InIOP Conference Series: Earth and Environmental Science. 2019. V. 230. № 1. P. 012104.
Kusdianawati, Mustopa A.Z., Fatimah, Budiarto B.R. // Biodiversitas. 2020. V. 21. P. 3225–3233.
Wang D., Liu W., Ren Y., De L., Zhang D., Yang Y., Bao Q., Zhang H., Menghe B. // Korean J. for Food Science of Animal Resources. 2016. V. 36. № 4. P. 499.
Alnakip M.E., Mohamed A.S., Kamal R.M., Elbadry S. // Japanese J. Veterinary Research. 2016. V. 64. P. 23–30.
Azhari A.A. // Int. J. Dairy Sci. 2011. V. 6. № 1. P. 66–71.
Audisio M.C., Torres M.J., Sabaté D.C., Ibarguren C., Apella M.C. // Microbiol. Research. 2011. V. 166. № 1. P. 1–13.
Parichehreh S., Tahmasbi G., Sarafrazi A., Imani S., Tajabadi N. // Apidologie. 2018. V. 49. № 3. P. 430–438.
Dhar D., Mohanty A. // Virus research. 2020. V. 285. P. 198018. https://doi.org/10.1016/j.virusres.2020.198018
Badis A., Guetarni D., Moussa-Boudjemaa B., Henni D.E., Tornadijo M.E., Kihal M. // Food Microbiol. 2004. V. 21. № 3. P. 343–349.
Zuo T., Zhang F., Lui G.C., Yeoh Y.K., Li A.Y., Zhan H., Wan Y., Chung A.C., Cheung C.P., Chen N., Lai C.K. // Gastroenterology. 2020. V. 159. № 3. P. 944–955.
Aktas B., Aslim B. // Turkish J. Biology. 2021. V. 45. № 4. P. 390–403.
Jabczyk M., Nowak J., Hudzik B., Zubelewicz–Szkodzińska B. // J. Clinical Medicine. 2021. V. 10. № 19. P. 4537.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология