Прикладная биохимия и микробиология, 2022, T. 58, № 5, стр. 507-512
Способ получения нанокомпозитов серебро-сукцинил хитозан и их антимикробная активность
В. А. Александрова 1, *, А. М. Футорянская 1, **, В. С. Садыкова 2
1 Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Россия
2 Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе
119021 Москва, Россия
* E-mail: alexandrova@ips.ac.ru
** E-mail: futoraynskaya@ips.ac.ru
Поступила в редакцию 26.03.2022
После доработки 05.04.2022
Принята к публикации 26.04.2022
- EDN: GTENMZ
- DOI: 10.31857/S055510992205004X
Аннотация
Для формирования наночастиц серебра методом восстановления из ионов металла в присутствии восстановителя D-глюкозы при комнатной температуре в качестве полимерной матрицы было использовано водорастворимое производное хитозана – сукцинил хитозан. Синтез наночастиц серебра можно также осуществлять без восстановителя при термической активации системы с использованием щелочи (NaOH) в качестве ускорителя процесса. О наличии наночастиц серебра в полученных коллоидных растворах судили по появлению полосы поглощения в спектрах электронного плазмонного резонанса (ƛmax = 417 нм). Показано, что использование дополнительного компонента – полиэтиленоксида в макромолекулярной системе позволило получить наночастицы серебра малого размера (1–3 нм). Результаты исследований антимикробной активности в опытах in vitro полученных коллоидных растворов, содержащих наночастицы серебра, подтвердили, что уменьшение размеров наночастиц серебра приводило к расширению спектра антибактериальной активности в отношении штаммов грамположительных и грамотрицательных бактерий (Bacillissubtilis ATCC 6633, Staphylococcus aureus 209P, Escherichia coli ATCC 25922) и к проявлению выраженного антифунгального действия по отношению к Aspergillus niger INA 00760.
В последнее время значительно возрос интерес исследователей к зеленой химии. В соответствии с основными положениями этого научного направления методы синтеза выбираются так, чтобы как исходные, так и синтезированные вещества были безвредными для человека и окружающей среды [1]. Методы химического восстановления ионов металлов в растворе полимера часто используются для создания нанокомпозитов [2–4]. С учетом требований, которые предъявляются к зеленой химии, выбор сукцинил хитозана в качестве полимерной матрицы для создания нанокомпозитов, является обоснованным.
Водорастворимое производное хитозана – сукцинил хитозан является нетоксичным, биодеградируемым полимером, для которого характерна антиоксидантная, иммуностимулирующая и др. активности [5, 6]. Важно отметить, что сукцинил хитозан безопасен при внутривенном введении, что позволяет использовать этот полимер в системах доставки противоопухолевых препаратов [7, 8].
При химическом восстановлении ионов серебра, обычно в качестве восстановителей используют такие вещества, как боргидрид натрия, амины, гидразин, формальдегид и др., не относящиеся к числу безопасных для здоровья человека и для окружающей среды. Наночастицы серебра можно получать с использованием экстрактов различных растений. Однако, получаемые при этом коллоидные растворы представляют собой сложную смесь различных веществ, что затрудняет идентификацию компонентов реакционной системы [9, 10].
Наночастицы металлов можно получать с использованием методов радиационно-химического и фотохимического восстановления, а также при воздействии микроволнового облучения [11–13]. Для проведения таких исследований необходимы дорогостоящие установки и специально оборудованные помещения.
С учетом вышеизложенного исследовали возможность разработки простого экологичного способа синтеза наночастиц серебра в матрице сукцинил хитозана при комнатной температуре или при термической активации системы, как в присутствии восстановителя, так и без него.
Цель работы – получение и изучение антимикробной активности композитов на основе сукцинил хитозана и наночастиц серебра.
МЕТОДИКА
Материалы. В качестве полимерной матрицы-стабилизатора в работе использовали сукцинил хитозан (СХТЗ) производства ООО “Биопрогресс” (Россия). Молекулярная масса (ММ) хитозана, из которого был получен СХТЗ – 200 кДА, степень дезацетилирования – 85%. Для проведения реакции в гомогенных условиях в качестве растворителя использовали воду (бидистиллят, 18МОМ × см–1), азотнокислое серебро (AgNO3), щелочь (NаOH) и D-глюкозу (марки х. ч.), полиэтиленоксид (ПЭО) с молекулярной массой 7 × 105 ЗХК “Экотек” (Россия).
Синтез наночастиц серебра в матрице сукцинил хитозана. При комнатной температуре. СХТЗ растворяли в бидистиллированной воде при комнатной температуре и перемешивании на магнитной мешалке. К 5 мл раствора полимера (0.25% по массе) при перемешивании добавляли водный раствор AgNO3, с таким расчетом, чтобы его концентрация в растворе полимера составляла 0.0018 М. Затем в реакционную смесь добавляли восстановитель (D-глюкозу) в соотношении AgNO3 : D-глюкоза, равном 1 : 5 (моль/моль). В полученную реакционную смесь по каплям добавляли 0.1 М NаOH (20–100 мкл). В ходе эксперимента из реакционной смеси отбирали пробы для определения оптической плотности коллоидного раствора (ƛmax = 417 нм) при различной концентрации щелочи.
При термической активации системы. СХТЗ растворяли в бидистиллированной воде при комнатной температуре и перемешивании на магнитной мешалке. К 2.5 мл раствора СХТЗ (1% по массе) при перемешивании добавляли 2.5 мл водорастворимого ПЭО (10% от массы СХТЗ). В полученную реакционную смесь добавляли 60 мкл 0.1 М раствор NаOH, а затем водный раствор AgNO3, с таким расчётом, чтобы его концентрация в реакционной смеси составляла 0.0018М. После тщательного перемешивания реакционную смесь нагревали до 70°С в течение 3 ч. Синтез проводили в токе аргона. При проведении эксперимента наблюдали изменение окраски рабочего раствора от бледно-желтого до коричневого.
УФ-спектроскопия. Спектры полученных растворов регистрировали на УФ-спектрофотометре “SPECORD M–40” (“Carl Zeiss”, Германия) в кварцевой кювете с длинной оптического пути 1 мм при 25°С, в качестве раствора сравнения использовали бидистилированную воду.
Просвечивающая электронная микроскопия (ПЭМ). Размеры наночастиц серебра в коллоидном растворе на основе СХТЗ изучали при помощи просвечивающей электронной микроскопии (ПЭМ) “LEO 912 AB Omega” (“Leo Electron Microscopy”, Великобритания).
Микробные штаммы, питательные среды, условия культивирования. Антимикробную активность растворов наночастиц оценивали методом диффузии в агар по диамеру зоны отсутсвия роста тест-культур. Антибактериальную активность оценивали с помощью тест-штаммов: грамотрицательные бактерии Escherichia coli ATCC 25922, грамположительные бактерии Bacillus subtilis АТСС 6633, и Staphylococcus aureus 209P. Для оценки фунгицидной активности использовали плесневый гриб Aspergillus niger INA 00760.
Тест-культуру B. subtilis АТСС 6633 выращивали на среде Гаузе № 2 следующего состава (г/л): триптон – 2.5 (или бульон Хоттингера – 30 мл), пептон – 5, хлорид натрия – 5, глюкоза – 10; S. aureus 209P выращивали на среде МПА (“ЗАО НИЦФ”, Россия), а E. coli ATCC 25922 на среде LB (триптон-соевый агар). Культуру A. niger INA 00760 выращивали на среде Чапека. Предварительно культуры бактерий выращивали в течение суток в пробирках на скошенном питательном агаре, после чего клетки суспендировали в физиологическом растворе до мутности 0.5 по стандарту McFarland (1.5 × 108 КОЕ/мл) и использовали в течение 15 мин. Культуру гриба выращивали в течение 5 сут. Все тест-культуры получены из коллекции культур НИИ по изысканию новых антибиотиков им. Г.Ф. Гаузе (Россия). В качестве контроля использовали стандартные диски с амфотерицином В для грибов (40 мкг, “НИИ Пастера”, Россия) и амоксиклавом (амоксициллин/клавулоновая кислота) для бактерий (20/10 мкг, “НИИ Пастера”, Россия).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЯ
Одним из условий зеленой химии является синтез веществ из возобновляемых в природе источников сырья. Известно, что для синтеза полимеров ряда хитина и хитозана используют природный полисахарид – хитин, который широко распространен в природе и, в частности, содержится в панцире и клешнях крабов, креветок, насекомых и др. организмов.
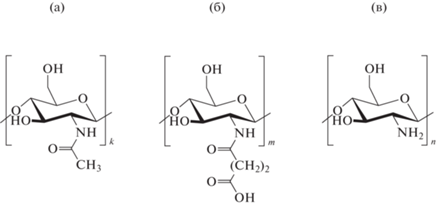
С целью разработки простого и экологичного способа синтеза наночастиц серебра (НЧAg) в настоящей работе в качестве матрицы был использован СХТЗ, который получают путем взаимодействия хитозана с янтарным ангидридом. Структура элементарных звеньев полимера приведена на рис. 1, где k-N-ацетилглюкозамин. Этот полимер является полиэлектролитом, в структуре которого присутствуют как карбоксильные –COOH группы (m), так и первичные аминогруппы -NH2 (n). При этом мольное соотношении этих групп составляло: k-0.15, m-0.75 и n-0.1.
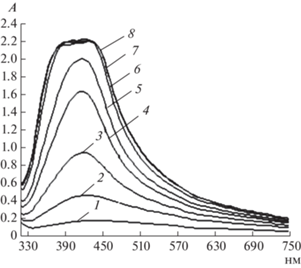
Для синтеза НЧAg из ионов Ag+ в матрице СХТЗ была исследована возможность проведения процесса при комнатной температуре с использованием в качестве восстановителя D-глюкозы. При этом для ускорения процесса восстановления ионов Ag+ в НЧAg использовали водный раствор NaOH. Анализ полученных результатов (рис. 2) показал, что постепенное увеличение количества NaOH в реакционной среде приводило к росту оптической плотности образующихся при этом НЧAg (кривые 1–5, рис. 2). О наличии НЧAg в системе судили по появлению полосы поглощения (ƛmax = 420 нм) в УФ-спектрах коллоидных растворов. Дальнейшее увеличение количества ускорителя (NaOH) выше 60 мкл в реакционной смеси было нецелесообразно, поскольку приводило к образованию более крупных НЧAg. Подтверждением этого служит отсутствие четко выраженного максимума полосы поглощения характерной для НЧAg (кривые 6–8, рис. 2). Отметим также, что при этом не происходило дальнейшее увеличение оптической плотности синтезированных НЧAg. В результате проведенных исследований было установлено оптимальное соотношение AgNO3 и восстановителя-D-глюкозы, которое составляло 1 : 5 (моль/моль). Известно, что при проведении реакции химического восстановления ионов Ag+ в НЧAg обычно используется большой избыток восстановителя [14, 15]. Таким образом, использование ускорителя процесса восстановления ионов серебра позволило значительно снизить необходимый избыток восстановителя в реакционной среде. В результате проведенных предварительных исследований также была определена оптимальная концентрация раствора NaOH – 0.1 М, которая позволяла регулировать процесс образования НЧAg при восстановлении ионов Ag+ в растворе СХТЗ.
Рис. 2.
Спектры оптического поглащения растворов НЧAg в матрице СХТЗ с различным содержанием NaOH в системе: 1 – 20, 2 – 30, 3 – 40, 4 – 50, 5 – 60, 6 – 80, 7 – 90, 8 – 100 мкл. Соотношение Ag : D-глюкозы в реакционной смеси 1 : 5 моль/моль.
Вопросу стабилизации НЧAg в растворе полимера уделяется особое внимание, поскольку эти частицы легко подвергаются окислению и склонны к агрегации. Для снижения вероятности ассоциирования образующихся НЧAg помимо основного полимера СХТЗ был введен дополнительный компонент – полиэтиленоксид (ПЭО). Известно, что ПЭО относится к числу нетоксичных полимеров, что дает возможность его использования в фармацевтике в качестве связующего компонента при приготовлении лекарственных препаратов.
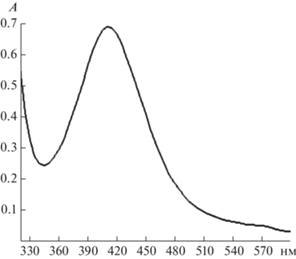
Синтез НЧAg также можно проводить без восстановителя при термической активации системы. При этом в качестве ускорителя восстановления ионов Ag+ также использовали NaOH. Представленные на рис. 3 результаты подтвердили, что полученный при восстановлении ионов Ag+ в матрице СХТЗ с добавлением ПЭО коллоидный раствор, содержал НЧAg (полоса поглощения при ƛmax = 417 нм).
Рис. 3.
Спектр оптического поглощения коллоидного раствора с НЧAg в матрице СХТЗ (разбавление 1 : 4).
Оценку формы и размера синтезированных НЧAg проводили с использованием метода просвечивающей электронной микроскопии (ПЭМ). Из представленных на рис. 4 данных можно заключить, что синтезированные НЧAg имели сферическую форму. Введение дополнительного компонента ПЭО в количестве 10% от массы основного полимера приводило к образованию НЧAg размером 1–6 нм (рис. 4а, система: СХТЗ-ПЭО1-НЧAg). Увеличение содержания ПЭО до 20% приводило к образованию более мелких частиц 1–3 нм (рис. 4б, система: СХТЗ-ПЭО2-НЧAg). О стабильности НЧAg, синтезированных в матрице СХТЗ, судили по отсутствию уменьшения оптической плотности НЧAg в УФ-спектрах полученных коллоидных растворов после их выдержки в темноте при комнатной температуре в течение 6 месяцев.
Рис. 4.
Электронная микрофотография и дифракционная картина пленки (на врезке): а – СХТЗ-ПЭО1-НЧAg (10% ПЭО); б – СХТЗ-ПЭО2-НЧAg (20% ПЭО).

В настоящее время проблема разработки новых подходов к созданию нетоксичных биодеградируемых композитных материалов и расширение спектра их биологической активности является актуальной. Условия синтеза наночастиц серебра в полимерной матрице оказывают существенное влияние на размер частиц. Известно, что размер НЧAg являются важной характеристикой, определяющей их бактерицидную активность. Ранее при исследовании биологической активности НЧAg, синтезированных из ионов Ag+ в растворе СХТЗ при воздействии микроволнового облучения, авторами было показано, что такие частицы (размер 9–34 нм) проявляют выраженную антибактериальную активность по отношению к штаммам грамположительных бактерий (B. subtilis ATCC 6633, B. coagulans 429) [16]. Исследована возможность уменьшения размеров НЧAg, образующихся в матрице СХТЗ, путем введения в систему дополнительного компонента ПЭО, препятствующего ассоциации образующихся НЧAg. Результаты ПЭМ (рис. 4) подтвердили, что введение ПЭО в систему позволило снизить размер образующихся НЧAg (1–3 нм).
Исследование антимикробной активности коллоидных растворов НЧAg, полученных в матрице СХТЗ с добавлением ПЭО показало, что уменьшение размера НЧAg в системе приводило к расширению спектра антибактериальной активности системы в отношении штаммов грамположительных и грамотрицательных бактерий, а также к появлению выраженного антифунгального действия нанокомпозитных систем в отношении A. niger INA 00760 (табл. 1).
Таблица 1.
Антимикробная активность растворов СХТЗ-ПЭО-НЧAg в отношении условно патогенных бактерий и грибов (зона угнетения роста, мм)
| Вещества | Зона, мм | |||
|---|---|---|---|---|
| B. subtilis ATCC 6633 |
S. aureus 209P | E. coli ATCC 25922 | A. niger INA 00760 | |
| СХТЗ-ПЭО1-НЧ Ag, 88 мкг/мл | 12 | нет | 13 | 13 |
| Контроль, СХТЗ-ПЭО1 | нет | нет | нет | нет |
| СХТЗ-ПЭО2-НЧ Ag, 84 мкг/мл | 11 | 12 | 12 | 12 |
| Контроль СХТЗ-ПЭО2 | нет | нет | нет | нет |
| Амоксиклав/клавулоновая кислота, 20/10 мкг | 31 | 27 | 23 | – |
| Амфотерицин, 40 мкг | – | – | – | 12 |
Таким образом, в результате проведенных исследований разработан зеленый синтез наночастиц серебра из ионов в матрице нетоксичного биодеградируемого сукцинил хитозана. Синтез НЧAg можно осуществлять при комнатной температуре с использованием в качестве восстановителя D-глюкозы и ускорителя процесса NaOH. Помимо этого синтез НЧAg в матрице СХТЗ можно проводить без восстановителя при термической активации системы. Показано, что применение дополнительного компонента ПЭО в системе позволило получить НЧAg малого размера 1–3 нм.
Исследование антимикробной активности в опытах in vitro полученных коллоидных растворов, содержащих НЧAg, показало, что уменьшение размеров НЧAg приводило к расширению спектра антибактериальной активности (B. subtilis ATCC 6633, S. aureus 209P, E. coli ATCC 25922), по сравнению с более крупными частицами исследованными ранее [16], и к проявлению антифунгального действия по отношению к A. niger INA 00760.
Полученные нанокомпозиты, стабилизированные сукцинил хитозаном, могут найти применение при разработке биодеградируемых пленочных покрытий для лечения открытых ран и ожогов, а также при создании антибактериальных препаратов (аэрозоли, мази, жидкие пластыри и другие материалы).
В связи с сильно возросшей в последнее время резистентностью различных микроорганизмов к антибиотикам возникает необходимость разработки альтернативных подходов к получению антимикробных и противовирусных средств с иным механизмом действия на основе экологически безопасных веществ.
Работа выполнена в рамках Госзадания ИНХС РАН.
Список литературы
Anastas P.T., Warner J.C. Green Chemistry: Theory and Practice, Oxford, N.Y.: Oxford University Press, 1998, 148 p.
Gurusamy V., Krishnamoorthy R., Gopal B., Veeraravagan V., Neelamegam P. // Inorg. Nano-Metal Chem. 2017. V. 47. № 5. P. 761–767.
Dong X., Ji X., Jing J., Li M., Li J., Yang W. //J. Phys. Chem. C. 2010. V. 114. № 5. P. 2070–2074.
Wojtysiak S., Kudelski A. //Colloids Surfaces A: Physicochem. Eng. Asp. 2012. V. 410. P. 45–51.
Skorik Y.A., Kritchenkov A.S., Moskalenko Y.E., Go-lyshev A.A., Raik S.V., Whaley A.K., Vasina L.V., Sonin D.L. // Carbonhydr. Polymers. 2017. V. 166. P. 166–172.
Колесов С.В., Бадыкова Л.А., Мударисова Р.Х. // Хим. физика. 2020. Т. 39. № 11. С. 73–79.
Kato Y., Onishi H., Machida Y. //Biomaterials. 2000. V. 21. № 15. P. 1579–1585.
Panevin A.A., Golyshev A.A., Skorik Y.A., Zhuravskii S.G., Sonin D.L. // Pharm. Chem. J. 2017. V. 50. № 11. P. 711–714.
Yaqub A., Malkani N., Shabbir A., Ditta S.A., Tanvir F., Ali S. et al.//Curr. Microbiol. Springer US. 2020. V. 77. № 9. P. 2287–2299.
La Spina R., Mehn D., Fumagalli F., Holland M., Reniero F., Rossi F., Gilliland D. // Nanomaterials. 2020. V. 10. № 10. P. 2031.https://doi.org/10.3390/nano10102031
Barrera N., Guerrero L., Debut A., Santa-Cruz P. // PLoS One. 2018. V. 13. № 7. P. 1–18.
Milad Torabfam, Hoda Jafarizadeh-Malmiri // Green Process Synthesis. 2018. № 7. P. 530–537.
Torabfam M., Jafarizadeh-Malmiri H. //Green Process. Synth. 2018. № 7. P. 530.https://doi.org/10.1515/gps-2017-0139
Вишнякова Е.А., Сайкова С.В., Жарков С.М., Лихацкий М.Н., Михлин Ю.Л. // Журн. Сибирского федерального ун-та. Сер. Химия. 2009. Т. 2. № 1. С. 48–55.
Помогайло А.Д., Джардималиева Г.И. Металлополимерные гибридные нанокомпозиты. М.: Наука, 2015. 494 с.
Александрова В.А., Футорянская А.М., Садыкова В.С. // Прикл. биохимия и микробиология. 2020. Т. 56. № 5. С. 497–502.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология