Прикладная биохимия и микробиология, 2022, T. 58, № 5, стр. 459-466
Влияние нитроксила на клетки Escherichia coli, выращенные в условиях карбонильного стресса
Э. И. Насыбуллина 1, И. С. Пугаченко 1, О. В. Космачевская 1, А.Ф. Топунов 1, *
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: aftopunov@yandex.ru
Поступила в редакцию 01.04.2022
После доработки 22.04.2022
Принята к публикации 26.04.2022
- EDN: IHQTWM
- DOI: 10.31857/S0555109922050117
Аннотация
Карбонильный стресс – повышение концентрации моносахаридов и активных дикарбонильных соединений (глиоксаля и метилглиоксаля, MG), которое приводит к увеличению скорости образования конечных продуктов гликирования (КПГ). MG, добавленный в культуру Escherichia coli, тормозил рост бактерий, при этом возрастало количество флуоресцирующих КПГ, связанных с белками. Действие нитроксила (HNO) на клетки зависело от степени аэрации бактериальной культуры. Нитроксил снижал токсическое действие MG на бактериальную культуру, что выражалось в увеличении жизнеспособности клеток, оцениваемой по МТТ-тесту, и снижению автофлуоресценции связанных с белками продуктов неферментативного гликирования. В условиях пониженной аэрации цитопротекторное действие донора нитроксила – кислоты Пилоти, было более выражено. Цитопротекторный эффект HNO в условиях карбонильного стресса может быть связан с его антиоксидантным и антигликирующим действием. Результаты исследования важны для понимания механизмов защитного и регуляторного действия НNO в клетках.
Понятие “карбонильный стресс” в биологическую науку ввел Бейнс в 1991 г. [1]. Оно аналогично понятию “окислительного стресса”. Под карбонильным стрессом понимают повышение концентрации сахаров (глюкозы, дезоксиглюкозы, фруктозы, рибозы и триозофосфатов) и активных карбонильных соединений (АКС), которое приводит к увеличению скорости образования конечных продуктов гликирования (КПГ).
В биологических образцах идентифицировано более 20 активных альдегидов и кетонов, основными из которых являются глиоксаль, метилглиоксаль (MG), 3-деоксиглюкозон и малоновый диальдегид. Наибольшей гликирующей активностью обладают α,β-дикарбонильные соединения – глиоксаль и MG. Особого внимания заслуживает метилглиоксаль, для которого также используют такие названия, как: 2-оксопропаналь, пировиноградный альдегид, пирувальдегид. Токсичное действие MG обусловлено его способностью вступать в реакции с амино- и SH-группами аминокислотных остатков белков, формируя ковалентно связанные КПГ (AGEs, Advanced Glycation End products): карбоксиэтиллизин (CEL, Nε(carboxyethyl)lysine), карбоксиметиллизин (CML, Nε(carboxymethyl)lysine), имидазолоны, аргпиримидины и кросс-сшитые димеры лизина с MG (MOLD, methylglyoxal-derived lysine dimers) [2, 3]. Такие модификации изменяют структуру, заряд и конформацию белка, вследствие чего нарушается функция белка и его способность к протеолитической деградации. Отметим также, что наряду с термином “карбонильный стресс” в литературе используется и термин “дикарбонильный стресс”, подчеркивающий тот факт, что некоторые АКС, например, тот же MG, содержат две карбонильные группы [4].
Карбонильному стрессу подвержены и бактериальные клетки в условиях резкого перехода на субстраты с высокой концентрацией углеводов или в стационарной фазе [5]. Избыточное образование активных форм кислорода (АФК) может быть еще одним механизмом развития карбонильного стресса в прокариотической клетке. Впервые неферментативное гликирование белков в бактериях было показано в работах Мироновой с соавт. [6, 7]. Гликировался γ-интерферон человека, экспрессируемый в клетках Escherichia coli. Пеппер с соавт. [8] обнаружили увеличение количества гликированных белков при выращивании E. coli в стационарной фазе и при добавлении глюкозы в среду LB. В работе [9] удалось выделить неферментативно гликированный легоглобин (гемоглобин бобовых растений) из клеток E. coli, содержащих плазмиду с геном этого белка. И в работах группы Мироновой [6, 7], и в ранее опубликованной работе авторов [9] неферментативному гликированию подвергались рекомбинантные белки, которые экспрессируются в большом количестве и накапливаются внутри клетки.
Карбонильный стресс тесно связан с окислительным [10–12]. При взаимодействии аминокислот с MG образуются свободнорадикальные интермедиаты: катион-радикал основания Шиффа и анион-радикал MG (семидион) [11]. При наличии кислорода в среде анион-радикал MG может восстанавливать кислород до супероксид-аниона $\left( {{\text{O}}_{2}^{{\centerdot \, - }}} \right)$ [11]. Образуемый в аэробной среде ${\text{O}}_{2}^{{\centerdot \, - }}$ инициирует цепные реакции перекисного окисления липидов (ПОЛ), в результате которых образуются новые АКС [11, 13, 14]. Таким образом, карбонильный стресс способствует развитию окислительного стресса и, наоборот, окислительный стресс усиливает карбонильный.
В настоящее время ведется поиск новых препаратов, которые могли бы ингибировать реакции неферментативного гликирования. Считается, что основными механизмами ингибирования гликирования могут быть удаление карбонильных и радикальных соединений, которые увеличивают образование КПГ, а также хелатирование ионов металлов, таких, как железо и медь.
В различных экспериментальных системах in vitro и in vivo было показано, что оксид азота (NO) и его доноры ингибируют образование КПГ и, тем самым, минимизируют негативные последствия их образования [12, 15–18]. Антигликирующее действие NO во многом обусловлено его антиоксидантными и антирадикальными свойствами [19, 20]. Еще более сильным антиоксидантном является нитроксил (НNO) – продукт одноэлектронного восстановления и протонирования NO. Этот метаболит NO может влиять на реакции неферментативного гликирования биомолекул, выступая в роли антигликирующего вещества.
Цель работы – выяснение, может ли нитроксил оказывать защитное действие на клетки E. coli, культивируемые в условиях, моделирующих карбонильный стресс.
МЕТОДИКА
В работе были использованы следующие реактивы: цитохром с из сердца лошади, метилглиоксаль, HEPES, МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиум бромид) – “Sigma-Aldrich” (США); среда LB – “AppliChem” (Германия); соль Ангели (Angeli’s salt, триоксодинитрат натрия), кислота Пилоти (Piloty’s acid, N-гидроксибензолсульфонамид) – “Cayman Europa” (Эстония).
Определение антигликирующей активности нитроксила. Антигликирующую активность нитроксила изучали в реакции с MG. Реакционная смесь содержала 0.6 мМ цитохрома с в 50 мМ К-фосфатном буфере (pH 7.4), 55 мМ MG. В качестве донора нитроксила использовали соль Ангели в концентрациях 2, 4, 6, 8, 10 мМ. В качестве стандартного антигликирующего соединения (положительный контроль) использовали аминогуанидин. Оценивали способность различных концентраций антигликирующих веществ подавлять развитие флуоресценции, обусловленной образованием КПГ в ходе инкубации цитохрома с MG. Реакционную смесь инкубировали в течение 24 ч при 37°С. За накоплением КПГ следили по изменению флуоресценции при λвозб = 320 нм, λисп = = 440 нм. Перед измерением образцы белка диализовали против 50 мМ К-фосфатного буфера (pH 7.4). Измерение проводили на спектрофлуориметре Shimadzu RF-5302 PC (“Shimadzu”, Япония) в 0.5 мл микрокювете при средней скорости сканирования, высокой чувствительности (по маркировке прибора), ширине щели возбуждающего света 5 нм и испускаемого света 10 нм.
Выращивание клеток E. coli. В работе были использованы клетки Escherichia coli штамм TB-1. Клеточную суспензию (1 мл), хранившуюся в растворе глицерина при температуре –70°С, высевали в жидкую среду LB и культивировали в течение 15 ч при 37°С на термошейкере фирмы “Биоком” (Россия) с частотой 200 об./мин до оптической плотности 0.096 ед. при 600 нм (OD600). Полученную культуру использовали для заcева серии колб объемом 350 и 150 мл с 60 мл жидкой среды LB, коэффициент заполнения колбы 0.17 и 0.43 соответственно до OD600 = 0.02–0.03. В начале логарифмической фазы роста (OD600 = = 0.12–0.15), через 2 ч после начала культивирования вносили раствор MG (до концентрации 3 мМ) и/или кислоту Пилоти (до концентрации 1 мМ), длительно высвобождающую HNO. Концентрацию клеток в культуре измеряли через каждые 2 ч по величине OD600 в 0.1 см кювете на спектрофотометре Carу 300 (“VarianBio”, США). Через 8 ч (середина логарифмической фазы роста) отбирали пробы культуры для оценки жизнеспособности клеток. Через 24 ч (стационарная фаза) отбирали клетки для получения белкового экстракта для оценки флуоресцирующих продуктов неферментативного гликирования.
Получение белкового экстракта из клеток E. coli. Белковый экстракт получали из 24-часовой культуры клеток. Бактериальную суспензию (1 мл) отмывали от компонентов питательной среды трехкратным центрифугированием (10 000 g, 5 мин) в 0.1 М К-фосфатном буфере (pH 7.4) и нормировали до OD600 = 0.24. К отмытой суспензии клеток добавляли лизоцим (20 мкг/мл) и инкубировали в течение 1 ч при 37°С. Затем клетки разрушали ультразвуком (три цикла по 1 мин) на ультразвуковом дезинтеграторе Soniprep 150 (“MSE”, Великобритания) при мощности 3 кГц, охлаждая образцы между циклами. Суспензию разрушенных клеток центрифугировали в течение 20 мин при 15 000 g для получения фракции растворимых белков.
Измерение флуоресценции растворимых белков. В супернатанте, полученном, как описано выше, регистрировали автофлуоресценцию при λвозб = = 325 нм и λисп = 490 нм. Измерения проводили на спектрофлуориметре Shimadzu RF-5302 PC в микрокювете на 0.5 мл при низкой скорости сканирования, высокой чувствительности (по маркировке прибора), ширине щели возбуждающего и испускающего света 5 нм.
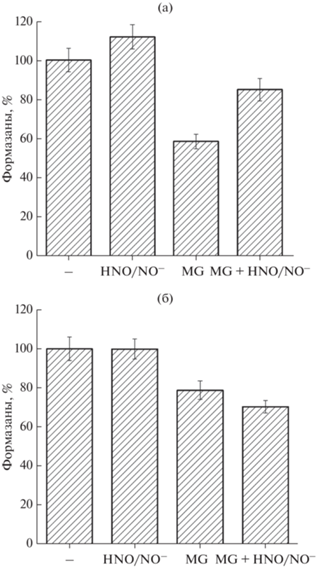
Определение жизнеспособности клеток E. coli. Жизнеспособность клеток оценивали по скорости восстановления МТТ в нерастворимый формазан. К 100 мкл культуры клеток (8 ч роста) в 400 мкл среды LB добавляли 100 мкл МТТ (5 мг/мл) и инкубировали при 37°С в течение часа. Образовавшиеся кристаллы формазана отделяли центрифугированием при 13 000 g в течение 5 мин и растворяли в 0.5 мл изопропанола. Количество формазанов определяли спектрофотометрически, используя коэффициент миллимолярной экстинкции ε560 = 7.2 мМ–1 см–1. Перед регистрацией образцы разбавляли в 10 раз в изопропаноле. Спектрофотометрические измерения проводили на спектрофотометре Carу 300 в кювете с длиной оптического пути 1 см.
Статистический анализ. Все результаты представляли в виде средних значений 4–6 измерений ± ± стандартное отклонение. Статистическую обработку результатов выполняли с помощью Microsoft Excel.
РЕЗУЛЬТАТЫ
Антигликирующее действие нитроксила в реакции цитохрома с с метилглиоксалем. Поскольку в литературе отсутствуют данные о влиянии нитроксила на процессы неферментативного гликирования и модификацию белков метилглиоксалем, было исследовано антигликирующее действие нитроксила в экспериментальной системе, моделирующей карбонильный стресс.
В качестве объекта использовали цитохром с – модельный гемовый белок, поскольку белки этого класса содержатся и в прокариотах. Антигликирующую активность оценивали в реакции с MG. MG был выбран в качестве гликирующего агента, поскольку это наиболее активное дикарбонильное соединение, образующееся во всех живых организмах, в том числе и в бактериях [5]. В качестве донора нитроксила использовали соль Ангели [21], которая в настоящее время является одним из наиболее часто используемых доноров HNO/NO–, особенно в фармакологических исследованиях. Соль Ангели высвобождает нитроксил, спонтанно разлагаясь в диапазоне pH 4–8. Антигликирующую активность нитроксила сравнивали с аминогуанидином.
Поскольку некоторые КПГ (пентозидин, гидроимидазолон) активно флуоресцируют, это свойство использовали для регистрации их накопления в реакционной среде. На рис. 1 представлены кривые, отражающие уровень КПГ, образованных в реакции MG с цитохромом с через 24 ч. В присутствии донора нитроксила (соли Ангели) образование КПГ замедлялось. Соль Ангели показала значения концентрации полумаксимального ингибирования IC50 = 1.7 мМ. Антигликирующая активность аминогуанидина в данной реакционной системе оказалась ниже, чем у донора HNO/NO–. Это объясняется принципиально разными механизмами действия данных соединений на реакции неферментативного гликирования. Аминогуанидин является хорошей ловушкой MG, образуя нереакционноспособные аддукты. Действие нитроксила, вероятно, связано с его способностью снижать уровень свободнорадикальных интермедиатов реакции неферментативного гликирования, поскольку в данной системе он может выступать в качестве восстановителя свободных радикалов.
Рис. 1.
Влияние различных концентраций антигликирующих веществ на флуоресценцию конечных продуктов гликирования (КПГ, %), образованных в реакции цитохрома с с MG: 1 – донор нитроксила (соль Ангели), 2 – аминогуанидин.
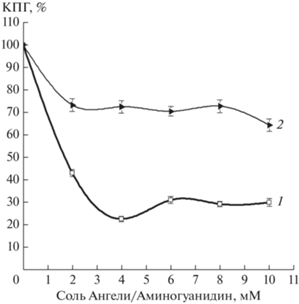
В литературе имеются данные о взаимодействии NO с продуктами неферментативного гликирования [15, 16]. В то же время в работе [16] показано, что различные доноры NO ингибировали образование пентозидинов. Это обусловлено способностью NO перехватывать свободные радикалы, возникающие в реакциях неферментативного гликирования (анион-радикал MG, катион радикал диалкилимина, основания Шиффа, супероксидный анион-радикал), которые формируются в ходе реакций аминокислот или белков с MG [11, 14].
Влияние нитроксила и метилглиоксаля на рост клеток E. coli. Учитывая, что в экспериментах in vitro нитроксил проявил себя как антигликирующий агент, было проверено его влияние на клетки E. coli, выращенные в присутствии MG. В качестве донора HNO/NO– использовали кислоту Пилоти, которая медленно (kmax ~ 10–3–10–4 с–1 при 25°C) выделяет HNO [21]. MG (конечная концентрация 3 мМ) и кислоту Пилоти (конечная концентрация 1 мМ) вносили в среду культивирования в начале логарифмической фазы роста. Предварительно было показано, что кислота Пилоти в концентрации 1 мМ не ингибирует рост бактерий.
Поскольку биологический эффект нитроксила зависит от концентрации кислорода [22], в эксперименте использовали два типа культур: растущие в условиях нормальной аэрации (коэффициент заполнения колбы 0.17) и растущие в условиях с пониженной аэрацией (коэффициент заполнения колбы 0.43). Известно, что снижение содержания кислорода в среде культивирования способствует развитию карбонильного стресса в клетках бактерий из-за активации гликолиза [5].
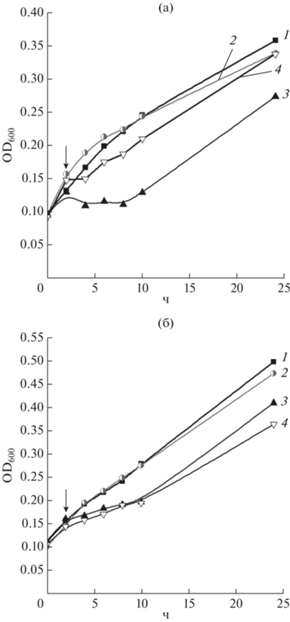
Добавление MG приводило к полному подавлению роста бактерий, выращенных при сниженном уровне аэрации, в период с 2 до 10 ч (рис. 2а), в то время как в хорошо аэрируемых культурах происходило лишь замедление роста (рис. 2б). Также различалось и влияние кислоты Пилоти на эти культуры. В первом случае HNO/NO– оказывал цитопротекторное действие (рис. 2а), во втором случае эффект был незначительным (рис. 2б).
Рис. 2.
Влияние MG и донора нитроксила (кислота Пилоти) на рост клеток E. coli в условиях пониженной (а) и нормальной аэрации (б): 1 – без добавок, 2 – кислота Пилоти, 3 – MG, 4 – MG и кислота Пилоти. Стрелками отмечено добавление MG и/или кислоты Пилоти.
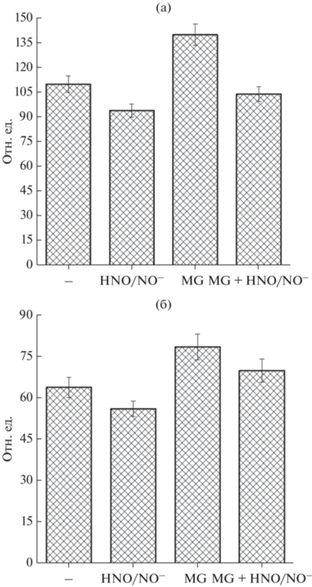
Флуоресценция растворимой фракции белков клеток E. coli. В клетках E. coli помимо добавленного MG, в процессе культивирования образуются собственные активные карбонильные соединения, участвующие в реакциях неферментативного гликирования клеточных белков. Особенно активно эти процессы протекают в культурах, находящихся в стационарной фазе [8, 9]. Поэтому было изучено влияние нитроксила на накопление связанных с белками КПГ через 24 ч культивирования, когда клетки находятся в стационарной фазе. Образование КПГ оценивали по их флуоресценции.
В слабо аэрируемых культурах уровень КПГ практически в 2 раза превышал их уровень в нормально аэрируемых культурах (рис. 3). Это объясняется активацией гликолиза и связанной с этим повышенной продукцией MG. Добавка MG к обоим типам культур усиливала образование КПГ ~ на 25%, в то время как добавка нитроксила – снижала ~ на 15%. Антигликирующее действие нитроксила на клетки E. coli было более выражено в присутствии MG. В слабоаэрируемых культурах нитроксил снижал содержание КПГ до уровня контрольного варианта (без добавок) (рис. 3a).
Рис. 3.
Флуоресценция (отн. ед.) растворимой фракции белков клеточного экстракта E. coli, выращенной в условиях пониженной аэрации (а) и нормальной аэрации (б).
Жизнеспособность клеток E. coli. Цитотоксическое и цитопротекторное действие MG и HNO/NO– на бактерии оценивали по восстановлению МТТ цитоплазматическими дегидрогеназами до нерастворимого формазана, количество которого коррелировало с метаболической активностью клеток и способностью к делению (МТТ-тест). Показатели МТТ-теста у слабо аэрируемых культур E. coli были на 20% ниже, чем у нормально аэрируемых (рис. 4). При действии MG количество формазанов в обоих типах культур было ниже, чем в контрольном варианте: на 40% в слабо аэрируемых и на 20% в нормально аэрируемых. Нитроксил оказывал цитопротекторное действие только на бактериальные культуры, выращенные в условиях пониженной аэрации (рис. 4). Эти результаты подтверждаются также кривыми роста бактерий на рис. 2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Карбонильный стресс у прокариотов протекает отлично от эукариотов. Подробно особенности карбонильного стресса у бактерий описаны в обзоре [16]. Основные факторы, способствующие его развитию у прокариотов – интенсивный метаболизм углеводных субстратов и избыточное образование АФК (окислительный стресс). Большие количества АФК часто образуются в стационарной фазе роста, когда бактерии испытывают дефицит питательных веществ и переходят в состояние с пониженной метаболической активностью, образуя так называемые переживающие формы – некультивируемые, но жизнеспособные (VBNC – Viable But Non-Culturable) [23]. Неспособность таких клеток к делению в сочетании с замедленным метаболизмом и окислительным стрессом благоприятствует накоплению гликированных аддуктов [8].
В бактериях помимо ферментативного пути генерации MG, его источником может быть неферментативная деградация триозофосфатов (дигидроксиацетон фосфата и глицеральдегид-3-фосфата) [5]. При длительной стационарной фазе неферментативный путь образования MG может превалировать над ферментативным. Если в активно делящихся клетках в экспоненциальной фазе происходит “разбавление” концентрации гликированных белков в последующих поколениях клеток, то клетки в стационарной фазе являются своего рода аккумуляторами повреждений, вызванных MG и другими АКС.
Показано, что в некультивируемых клетках E. coli повреждена ферментативная антиоксидантная система, поэтому такие клетки характеризуются высоким уровнем окислительно модифицированных белков и других биомолекул [24], низким уровнем экспрессии универсального стрессового белка A (UspA) [25] и повышенным уровнем экспрессии стрессовых регулонов: Rpos, SoxRS, RpoH, RpoE, CpxR [23]. Это объясняет 3-4-кратное повышение уровня неферментативно гликированных белков и нуклеиновых кислот в VBNC культуре E. coli по сравнению с клетками экспоненциальной фазы [8, 9].
Карбонильный стресс тесно связан не только с АФК, но и с активными метаболитами NO (нитрозативный стресс). В бактериях может работать несколько путей образования NO и НNO/NO–: первый – восстановление нитратов до аммиака через нитрит и второй – окисление аммиака до нитрита через гидроксиламин. В анаэробных условиях гидроксиламиноксидоредуктаза (КФ 1.7.3.4) окисляет NH2OH до NO2– через промежуточные продукты – HNO и NO, диссоциирующие от фермента. Если второй путь присущ почвенным денитрифицирующим бактериям [26], то первый характерен и для кишечной микрофлоры, включая E. coli [27, 28]. Еще один путь генерации NO – неферментативное восстановление нитритов при подкислении среды, например, при продукции молочной кислоты, а E. coli может превращать нитрит в NO и при нейтральном рН за счет работы различных нитритредуктаз [28, 29]. E. coli может также использовать нитрат в качестве конечного акцептора электронов при недостатке кислорода в среде [28].
У денитрификаторов и некоторых патогенов описаны редуктазы NO, катализирующие образование HNO, быстро превращающегося в N2O [30]. Такой же процесс возможен и при восстановлении NO бактериальным флавогемоглобином (Hmp) [31], причем синтез самого Hmp при аноксии запускается через нитрозилирование кластеров 4Fe-4S в транскрипционном регуляторе FNR. Нитроксил может образовываться при перекисном окислении азотсодержащих субстратов (гидроксиламина, гидроксимочевины, гидроксамовых кислот), катализируемом гемовыми белками [32], в ходе неферментативных реакций NO с тиолами [33] и за счет распада динитрозильных комплексов железа (ДНКЖ) – физиологических доноров NO [34, 35].
Нитроксил – короткоживущее соединение, которое сложно детектировать в организмах. В бактериях обнаружены метаболиты различной структуры, к которым присоединена нитроксильная группа. Многие такие метаболиты существуют как нитроксильные радикалы. Например, у Micrococcus luteus идентифицированы гидроксиламинные соединения (лизодектоза и аммонигенин), переходящие в долгоживущие нитроксильные радикалы [36]. В биологических системах нитроксильный анион может функционировать и как антиоксидант, и как прооксидант. При повышении концентрации кислорода происходит инверсия антиоксидантных свойств нитроксила в прооксидантные, а в гипоксических условиях значительно снижается токсичность этого соединения [22, 37, 38].
Имеются многочисленные сведения об антиоксидантном и антирадикальном действии нитроксила. Так, в условиях окислительного стресса HNO/NO– повышает выживаемость дрожжевых клеток, дефицитных по коэнзиму Q, и ингибирует перекисное окисление липидов (ПОЛ) [39], что, по-видимому, обусловлено восстановлением липидных свободных радикалов. Доноры нитроксила – соль Ангели и кислота Пилоти количественно ингибируют ПОЛ в гомогенезированном препарате сердечной мышцы крыс [40]. Нитроксил может снижать продукцию супероксида как за счет ингибирования НАДН-оксидазы [41], так и за счет ингибирования активности I и II комплексов дыхательной цепи митохондрий [42]. Антиоксидантное действие нитроксила может быть связано и с образованием ДНКЖ [34, 35], поскольку нитрозильные комплексы гемового и негемового железа являются эффективными антиоксидантами [19, 20].
Прооксидантное действие HNO/NO– прежде всего определяется его реакцией с кислородом, в которой образуется пероксинитрит (ONOO–) – сильный окислитель, вызывающий необратимую модификацию белков, мутации и разрыв ДНК [22, 37, 38, 43]. В отличие от реакции NO с супероксидом, эта реакция не контролируется супероксиддисмутазой (КФ 1.15.1.1). Автоокисление HNO обычно происходит в клеточных мембранах, где концентрация антиоксидантов низка. К тому же NO−, восстанавливая ионы металлов переменной валентности, катализирует образование гидроксильного радикала в реакции Фентона. Это объясняет отсутствие положительного эффекта нитроксила на хорошо аэрируемую бактериальную культуру. В этом случае повышение концентрации кислорода в культуральной среде способствует как образованию пероксинитрита, так и появлению супероксида в реакциях неферментативного гликирования. Нитроксил способен подавлять дыхание, ингибируя цитохромы за счет модификации специфических остатков цистеина [27, 42] и образования железонитрозильных комплексов с гемом в реакции восстановительного нитрозилирования [43]. Также нельзя исключить ингибирующее действие HNO на ключевой фермент гликолиза – 1,3-дифосфоглицератдегидрогеназу (КФ 1.1.1.95) [44]. Причем токсичность HNO выше для микроорганизмов, у которых существенный вклад в получение энергии вносит гликолиз [45].
Цитопротекторное действие нитроксила на бактерии при пониженной аэрации можно объяснить проявлением его антиоксидантных и антигликирующих свойств. Помимо непосредственного антиоксидантного или прооксидантного действия, HNO/NO– может влиять на метаболизм клетки за счет модификации железо-гемовых белков, а также белков, содержащих реакционноспособные тиолы и Fe-S-кластеры [27, 46]. Эти белки выполняют сигнальную и регуляторную функцию, что приводит к изменению экспрессии генов и синтезу защитных ферментов. Причем HNO, в отличие от NO, может непосредственно взаимодействовать с тиолами, тиолсодержащими белками и окисленным гемовым железом. Влияние нитроксила на метаболизм может быть также связано с NO, который образуется либо в результате окисления HNO двухэлектронными окислителями, (например, ФАД), либо при восстановительном нитрозилировании гемопротеидов HNO.
Таким образом, нитроксил защищал слабо аэрируемые клетки E. coli от карбонильного стресса, индуцированного MG. Этот цитопротекторный эффект может быть обусловлен снижением уровня ассоциированных с белками свободных радикалов и продуктов неферментативного гликирования, возникающих при взаимодействии аминокислотных остатков с MG. Нитроксил также может выполнять сигнально-регуляторную функцию в клетке. Полученные результаты могут быть полезны при разработке новых фармакологических препаратов на основе доноров нитроксила.
Список литературы
Baynes J.W. // Diabetes. 1991. V. 40. № 4. P. 405–412.
Rabbani N., Thornalley P.J. // Ann. N.Y. Acad. Sci. 2008. V. 1126. P. 124–127.
Rabbani N., Thornalley P.J. // Amino Acids. 2012. V. 42. № 4. P. 1087–1096.
Thornalley P.J. // Ann. N.Y. Acad. Sci. 2005. V. 1043. № 2. P. 111–117.
Kosmachevskaya O.V., Shumaev K.B., Topunov A.F. // Biochemistry (Moscow). 2015. V. 80. № 13. P. 1655–1671.
Mironova R., Niwa T., Hayashi H., Dimitrova R., Ivanov I. // Mol. Microbiol. 2001. V. 39. № 4. P. 1061–1068.
Mironova R., Niwa T., Dimitrova R., Boyanov M., Ivanov I. // J. Biol. Chem. 2003. V. 278. № 51. P. 51068–51074.
Pepper E.D., Farrell M.J., Nord G., Finkel S.E. // Appl. Environ. Microbiol. 2010. V. 76. № 24. P. 7925–7930.
Kosmachevskaya O.B., Topunov A.F. // Appl. Biochem. Microbiol. 2010. V. 46. № 3. P. 297–302.
Rosca M.G., Mustad T.G., Kinter M.T., Ozdemir A.M., Kern T.S., Szweda L.I., Brownlee M., Monnier V.M., Weiss M.F. // Am. J. Physiol. Renal. 2005. V. 289. P. 420–430.
Shumaev K.B., Gubkina S.A., Kumskova E.M., Shepel’kova G.S., Ruuge E.K., Lankin V.Z. // Biochemistry (Moscow). 2009. V. 74. № 4. P. 568–574.
Kosmachevskaya O.V., Shumaev K.B., Nasybullina E.I., Topunov A.F. // Clin. Chem. Lab. Med. 2014. V. 52. № 1. P. 161–168.
Yim H.S., Kang S.O., Hah Y.C., Chock P.B., Yim M.B. // J. Biol. Chem. 1995. V. 270. № 47. P. 28228–28233.
Lee C., Yim M.B., Chock P.B., Yim H.S., Kang S.O. // J. Biol. Chem. 1998. V. 273. № 39. P. 25272–25278.
Bucala R., Cerami A., Tracey K.J. // J. Clin. Invest. 1991. V. 87. P. 432–438.
Asahi K., Ichimori K., Nakazawa H., Izuhara Y., Inagi R., Watanabe T., Miyata T., Kurokawa K. // Kidney International. 2000. V. 58. № 4. P. 1780–1787.
Kosmachevskaya O.V., Shumaev K.B., Nasybullina E.I., Gubkina S.A., Topunov A.F. // Hemoglobin. 2013. V. 37. № 3. P. 205–218.
Насыбуллина Э.И., Космачевская О.В., Топунов А.Ф. // Труды Карельского научного центра РАН. 2018. № 4. С. 93–104.
Shumaev K.B., Gorudko I.V., Kosmachevskaya O.V., Grigoryeva D.V., Panasenko O.M., Vanin A.F. et al. // Oxid. Med. Cell. Longev. 2019. V. 2019. e2798154. https://doi.org/10.1155/2019/2798154
Shumaev K.B., Kosmachevskaya O.V., Grachev D.I., Timoshin A.A., Topunov A.F., Lankin V.Z., Ruuge E.K. // Biochemistry (Moscow), Supplement Series B: Biomedical Chemistry. 2021. V. 15. № 4. P. 313–319.
DuMond J.F., King S.B. // Antioxid. Redox Signal. 2011. V. 14. № 9. P. 1637–1648.
Shoman M.E., Aly O.M. // Oxid. Med. Cell. Longev. 2016. V. 2016. e4867124. https://doi.org/10.1155/2016/4867124
Desnues B., Cuny C., Grégori G.J., Dukan S. // EMBO Reports. 2003. V. 4. № 4. P. 400–404.
Dukan S., Nyström T. // Genes Dev. 1998. V. 12. P. 3431–3441.
Nyström T., Neidhardt F.C. // Mol. Microbiol. 1994. V. 11. № 3. P. 537–544.
Caranto J.D., Lancaster K.M. // Proc. Natl. Acad. Sci. USA. 2017. V. 114. № 31. P. 8217–8222.
Sobko T., Reinders C.I., Jansson E., Norin E., Midtvedt T., Lundberg J.O. // Nitric Oxide. 2005. V. 13. № 4. P. 272–278.
Tiso M., Schechter A.N. // PLoS One. 2015. V. 10. № 3. e0119712. https://doi.org/10.1371/journal.pone.0119712
Cole J. // FEMS Microbiol. Lett. 1996. V. 136. № 1. P. 1–11.
Hendriks J., Oubrie A., Castresana J., Urbani A., Gemeinhardt S., Saraste M. // Biochim. Biophys. Acta. 2000. V. 1459. № 2–3. P. 266–273.
Hausladen A., Gow A., Stamler J.S. // Proc. Natl. Acad. Sci. USA. 2001. V. 98. № 18. P. 10108–10112.
Reisz J.A., Bechtold E., King S.B. // Dalton Trans. 2010. V. 39. P. 5203–5212.
Suarez S.A., Muñoz M., Alvarez L., Venâncio M.F., Rocha W.R., Bikiel D.E., Marti M.A., Doctorovich F. // J. Am. Chem. Soc. 2017. V. 139. № 41. P. 14483–14487.
Liu T., Zhang M., Terry M.H., Schroeder H., Wilson S.M., Power G.G. et al. // Mol. Pharmacol. 2018. V. 93. № 5. P. 427–437.
Shumaev K.B., Kosmachevskaya O.V., Nasybullina E.I., Gromov S.V., Novikov A.A., Topunov A.F. // J. Biol. Inorg. Chem. 2017. V. 22. № 1. P. 153–160.
Арцатбанов В.Ю., Галон И.А., Гончаренко А.В., Островский Д.Н. // Микробиология. 2009. Т. 78. № 5. С. 605–611.
Smulik R., Dębski D., Zielonka J., Michałowski B., Adamus J., Marcinek A., Kalyanaraman B., Sikora A. // J. Biol. Chem. 2014. V. 289. № 51. P. 35570–35581.
Bryukov M., Kachanov A., Timonnen R., Seetula J., Vandoren J., Sarkisov O. // Chemical Physics Letters. 1993. V. 208. № 5–6. P. 392–398.
Lopez B.E., Shinyashiki M., Han T.H., Fukuto J.M. // Free Radic. Biol. Med. 2007. V. 42. P. 482–491.
Гудков Л.Л., Шумаев К.Б., Каленникова Е.И., Ванин А.Ф., Рууге Э.К. // Биофизика. 2007. Т. 52. № 3. С. 503–508.
Lin E.Q., Irvine J.C., Cao A.H., Alexander A.E., Love J.E., Patel R., McMullen J.R., Kaye D.M., Kemp-Harper B.K., Ritchie R.H. // PloS One. 2012. V. 7. № 4. e34892. https://doi.org/10.1371/journal.pone.0034892
Shiva S., Crawford J.H., Ramachandran A., Ceaser E.K., Hillson T., Brookes P.S., Patel R.P., Darley-Usmar V.M. // Biochem. J. 2004. V. 379. № 2. P. 359–366.
Doctorovich F., Bikiel D.E., Pellegrino J., Suárez S.A., Martí M.A. // Acc. Chem. Res. 2014. V. 47. № 10. P. 2907–2916.
Lopez B.E., Wink D.A., Fukuto J.M. // Arch. Biochem. Biophys. 2007. V. 465. № 2. 430–436.
Lopez B.E., Rodriguez C.E., Pribadi M., Cook N.M., Shinyashiki M., Fukuto J.M. // Arch. Biochem. Biophys. 2005. V. 442. № 1. P. 140–148.
Bianco C.L., Toscano J.P., Bartberger M.D., Fukuto J.M. // Arch. Biochem. Biophys. 2017. V. 617. P. 129–136.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология